Способ защиты от-пцр от контаминации продуктами амплификации на основе разрушающего действия урацил-днк-гликозилазы
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и может быть использовано для детекции биологических объектов. Предложенный способ защиты ОТ-ПЦР от контаминации продуктами амплификации предусматривает добавление урацил-ДНК-гликозилазы в смесь для обратной транскриптазной реакции и проведение обратной транскриптазной и полимеразной цепной реакции в одном реакционном объеме. Применение изобретения обеспечивает защиту ОТ-ПЦР от контаминации продуктами амплификации с повышенной эффективностью. 1 ил., 1 табл.
Реферат
Изобретение относится к области биохимии, в частности к молекулярно-генетическим методам детекции биологических объектов.
Контаминация - попадание из внешней среды в реакционную смесь специфических и неспецифических молекул ДНК, способных служить мишенями в реакции амплификации и давать ложноположительные или ложноотрицательные результаты [1, 2, 3].
Такими мишенями могут быть продукты реакции, попадающие во внешнюю среду на этапе детекции из пробирок, в которых успешно прошла амплификация, либо специфическая ДНК из образцов на этапе пробоподготовки [1, 2, 3].
Урацил-ДНК-гликозилазный метод защиты ОТ-ПЦР от контаминации продуктами амплификации является действенным инструментом, позволяющим значительно снизить риск ложноположительных реакций [1]. Оптимизированные методики с использованием Tth-полимеразы нашли достойное применение в решении данной проблемы. Температурный режим элонгации Tth ДНК полимеразы (60-72°С) позволяет использовать урацил-ДНК-гликозилазный метод защиты от контаминации в варианте «I пробирка, 1 этап» [1].
Использование же M-MuLV обратной транскриптазы совместно с урацил-ДНК-гликозилазой (из Е. coli) [4, 5] в варианте «1 пробирка, 1 этап» невозможна по причине одинаковой рабочей температуры ферментов (37°С).
Цель изобретения - разработка эффективной методики защиты ОТ-ПЦР от контаминации продуктами амплификации на основе урацил-ДНК-гликозилазного метода защиты.
Нами разработан способ защиты ОТ-ПЦР от контаминации продуктами амплификации на основе разрушающего действия урацил-ДНК-гликозилазы (из Е. coli) [4, 5] на урацил-содержащую ДНК в варианте «1 пробирка, 2 этапа» при использовании M-MuLV обратной транскриптазы и Taq ДНК полимеразы путем комбинированного использования dTTP/dUTP.
Принцип способа заключается в том, что на 1 этапе M-MuLV обратная транскриптаза катализирует матричный синтез ДНК на матрице РНК с исключением использования урацил-содержащих ампликонов в качестве матрицы из-за их гидролиза урацил-ДНК-гликозилазой (из Е. coli) при температуре 37°С. В качестве строительных блоков используются dATP, dTTP, dGTP, dCTP. На 2 этапе добавляется в реакционную смесь Taq ДНК полимераза и смесь из дезоксинуклеозидтрифосфатов (dATP, dUTP, dGTP, dCTP) с заменой dTTP на dUTP в пропорциональной концентрации с общим содержанием во время проведения ПЦР 5 дезоксинуклеозидтрифосфатов -dATP, dTTP, dUTP, dGTP и dCTP, что обеспечивает выход урацил-содержащей ДНК (Схема).
Ближайшим аналогом заявленного способа можно считать способ защиты ОТ-ПЦР, катализируемой обратной транскриптазой M-MuLV и ДНК-полимеразой, от контаминации продуктами амплификации, раскрытый в Instruction manual, DyNAmoТМ Capillary SYBR® Green 2-Step qRT-PCR Kit (Distributed by New England Biolabs, Version 1.2, March 2005, www. finnzymes.com) (далее D1). Указанный способ (D1), как и заявленное изобретение, предусматривает:
1) проведение обратной транскриптазной реакции с использованием в качестве дезоксинуклеозидтрифосфатов dATP, dTTP, dGTP и dCTP;
2) обработку реакционной смеси урацил-ДНК-гликозилазой, высвобождающей свободный урацил из урацил-содержащей ДНК при 37°С, перед проведением ПЦР;
3) проведение ПЦР с использованием в качестве
дезоксинуклеозидтрифосфатов dATP, dTTP, dUTP, dGTP и dCTP.
Заявленный способ отличает от указанного предложения (D1) то, что ПЦР и обратнотранскриптазную реакцию проводят в одном реакционном объеме, причем урацил-ДНК-гликозилазу добавляют в реакционную смесь для обратной транскриптазной реакции.
Условия проведения реакции
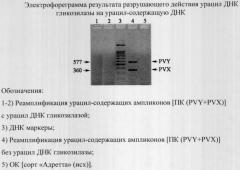
Для теоретического обоснования разработанного способа нами были проведены практические исследования, направленные на доказательство эффективности выбранного подхода, для чего проводили мультиплексную ОТ-ПЦР для одновременного выявления возбудителей вирусных болезней картофеля в варианте «1 пробирка, 2 этапа» с использованием в качестве ПКО (положительный контрольный образец) положительную на PVY (Potato vims Y)+PVX (Potato vims X) амплифицированную ОТ-ПЦР-пробу в разведении 1:10000 в смеси с ОКО (отрицательный контрольный образец) по протоколу, представленному в таблице.
ОТ-ПЦР проводили на амплификаторе «Терцик» (Россия).
Детекцию результатов проводили методом горизонтального электрофореза в 2% агарозном геле в трис-боратном буфере (ТВЕ), рН 8,0, содержащим этидий бромид в концентрации 0,5 мкг/мл, с визуализацией УФ-светом (λ=310 нм).
Размеры амплифицированных фрагментов ДНК в нуклеотидных парах (н.п.) оценивали по подвижности в 2% агарозном геле по сравнению со стандартным маркером размерами 100-1500 н.п.(«СибЭнзим», Новосибирск) (чертеж).
| Таблица"Одна пробирка, два этапа" Обратнотранскриптазная реакция | ||||
| Реактивы | Исходная концентрация | Рабочая концентрация | 1 проба | 10 проб |
| dH2O | 9,45 мкл | 94,5 мкл | ||
| Смесь из dATP, dTTP, dGTP, dCTP | 2 мМ каждого из dNTP | 0,3 мМ | 2,25 мкл | 22,5 мкл |
| Буфер ОТ | 10× | 1× | 1,5 мкл | 15,0 мкл |
| M-MuLV Обратная транскриптаза | 5 ед | 0,5 ед | 0,1 мкл | 1,0 мкл |
| Урацил-ДНК-гликозилаза (из E. Coli) | 5 ед | 0,5 ед | 0,1 мкл | 1,0 мкл |
| PPVYCP6P cgtccaaaatgagaatgcc | 50 мкМ | 0,5 мкМ | 0,15 мкл | 1,5 мкл |
| PPVYCP6M tcttgtgtactgatgccac | 50 мкМ | 0,5 мкМ | 0,15 мкл | 1,5 мкл |
| PPVXv1 gacactatggcacaggctgcttgg | 50 мкМ | 0,5 мкМ | 0,15 мкл | 1,5 мкл |
| PPVXc2 ttgggcagcattcatttcagcttc | 50 мкМ | 0,5 мкМ | 0,15 мкл | 1,5 мкл |
| Проба | 1,0 мкл | |||
| Всего | 15,0 мкл | |||
| 37°С - 45 мин. | ||||
| Добавить равный объем (15 мкл) ПЦР смеси ПЦР | ||||
| Реактивы | Исходная концентрация | Рабочая концентрация | 1 проба | 10 проб |
| dH2O | 11,05 мкл | 110,5 мкл | ||
| Смесь из dATP, dUTP, dGTP, dCTP | 2 мМ каждого из dNTP | 0,3 мМ | 2,25 мкл | 22,5 мкл |
| Буфер Taq ДНК полимераза | 10× | 1× | 1,5 мкл | 15,0 мкл |
| Taq ДНК полимераза | 5 ед | 1 ед | 0,2 мкл | 2,0 мкл |
| Всего | 15,0 мкл |
| Режим амплификации: 37°С-15 мин. 94°С-4 мин. 94°С - 1 мин, 60°С - 1 мин, 72°С - 1 мин.=40 циклов. 72°С-10 мин. |
Заключение
По результатам практических исследований, направленных на теоретическое обоснование разработанного способа защиты ОТ-ПЦР от контаминации продуктами амплификации на основе разрушающего действия урацил-ДНК-гликозилазы (из E. Coli), нами получен обеспечиваемый заявленным способом технический результат, выраженный в демонстрации предотвращения возможности реамплификации урацил-содержащих ампликонов (чертеж) при использовании заявленного протокола ОТ-ПЦР в варианте «1 пробирка 2 этапа» (таблица) ввиду того, что урацил-содержащая ДНК (контаминант) теряет роль мишени из-за выщепления из нее свободного урацила ферментом урацил-ДНК-гликозилазой (из E. coli) в процессе реакции (Схема).
Источники информации
1. http://www.roche-applied-science.com.
2. Higuchi, R. and Kwok, S. (1989) Nature 339, 237-238.
3. Tomilin, N.V. and Aprelikova, O.N. (1989) Intl. Rev. Cytol. 114, 125-179. 3. Sobek, H. et al. (1996) FEBS Lett. 388, 1^t.
5. Longo, M.C., Beringer, M.S., and Hartle, J.L. (1990) Gene 93. 125-128.
Способ защиты от контаминации обратной транскриптазной полимеразной цепной реакции (ОТ-ПЦР), катализируемой обратной транскриптазой M-MuLV и ДНК-полимеразой, предусматривающий проведение обратной транскриптазной реакции с использованием в качестве дезоксинуклеозидтрифосфатов dATP, dTTP, dGTP и dCTP, обработку реакционной смеси перед проведением ПЦР урацил-ДНК-гликозилазой, высвобождающей свободный урацил из урацил-содержащей ДНК при 37°С, и проведение ПЦР с использованием в качестве дезоксинуклеозидтрифосфатов dATP, dTTP, dUTP, dGTP и dCTP, отличающийся тем, что обратную транскриптазную реакцию и полимеразную цепную реакцию проводят в одном реакционном объеме, а обработку реакционной смеси урацил-ДНК-гликозилазой проводят на стадии реакции обратной транскрипции, причем указанный фермент добавляют в смесь для обратной транскриптазной реакции.