Способ моделирования и исследования последствий геморрагического инсульта
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к неврологии, и может быть использовано для моделирования и исследования последствий геморрагического инсульта. Для этого подготавливают переживающие срезы, фиксируют исходные параметры, вызванные биоэлектрической активностью клеток. Затем апплицируют аутокровь на переживающие срезы нервных клеток мозга на 25-40 мин и регистрируют при этом биоэлектрическую активность клеток. Отмывают срезы и вновь оценивают биоэлектрическую активность. Сопоставляя параметры клеток с аппликацией с их исходными параметрами, определяют степень их повреждения. Сопоставляя параметры отмытых клеток с исходными, определяют возможность их восстановления. Способ позволяет создать условия для исследования молекулярно-клеточных механизмов повреждения мозговой ткани при поиске эффективных протективных препаратов для защиты нервных клеток, подвергшихся воздействию кровоизлияния. 3 ил.
Реферат
Изобретение относится к медицине.
Известны способы моделирования геморрагического инсульта путем ультразвукового воздействия, введения аутологичной крови или ее отдельных компонентов, а также бактериальной коллагеназы в различные структуры мозга целого животного под давлением.
Аналогом предлагаемого способа является способ моделирования геморрагического инсульта in vivo путем введения 1,2-1,5 мл аутокрови животного, смешанной с 0,2 мл гепарина, под давлением 120-150 мл рт.ст. во внутреннюю капсулу одного из полушарий мозга через иглу, вживленную в мозг по стереотаксическим координатам.
Имеющиеся заявки относятся к созданию моделей ишемического инсульта только на целом организме (Авт. свид. №1767518 А1, 1990). Способ моделирования по Авт. свид. №1767518 А1, 1990 г. (Макаренко и др.) принят в качестве прототипа. Согласно этому свидетельству, где моделирование геморрагического инсульта in vivo осуществляют вживляя в мозг целого животного по стереотаксическим координатам билатерально полые иглы, в них вводят изогнутые мандрены и несколькими вращательными движениями мандрена разрушают ткань мозга и проходящие в ней сосуды. Затем в образовавшиеся области механической деструкции и микроизлияний крови вводят 0,2-0,3 мл аутокрови животного, а спустя 2-3 мин в эти же области дополнительно вводят еще раз 0,1-0,2 мл аутокрови.
Однако известные к настоящему времени способы моделирования инсульта, в том числе и способ, описанный в прототипе, имеют следующие недостатки: высокая летальность животных (80% и выше) в ранние сроки из-за проникновения значительного количества крови в мозговые желудочки, что вызывает повреждения, зачастую необратимые, структур мозга, находящихся дистально от места введения аутокрови. Кроме того, в мозге нарастает компрессия за счет введения аутокрови под давлением. Это приводит к сдавливанию и повреждению кровеносных сосудов, питающих другие структуры мозга, т.е. картина геморрагического инсульта усложняется процессами ишемического поражения структур мозга. Вызванные компрессионные процессы индуцируют нарушение нормального функционирования мозга не только в области инъекции крови, но и в других непредсказуемых структурах мозга, в которых могут возникать ишемические, травматические, эпилептические, эксайтотоксические процессы.
Неопределенность локализации пораженных структур мозга при моделировании геморрагического инсульта, возникающая вследствие присоединения общемозговых симптомов (глутаматэксайтотоксические, ишемические и др.) в результате ретроградных проникновений избытка крови вдоль инъекционной иглы под мозговые оболочки, является совершенно неприемлемой для проведения длительных экспериментальных исследований.
Недостатком прототипа является и то, что к геморрагическому инсульту добавляется превалирующий травматический компонент, и это затрудняет поиск эффективных и надежных протективных антигеморрагических препаратов.
Недостатком всех используемых в настоящее время способов моделирования геморрагического инсульта является непредсказуемость локализации первичных и вторичных повреждений мозговых структур целого организма, что заставляет многократно проводить повторные исследования для получения однотипного повреждения. Кроме того, недостатком моделей геморрагического инсульта in vivo является затрудненность исследования тонких механизмов, протекающих в мозге при инсульте. Это, в свою очередь, препятствует поиску эффективных и надежных фармакологических препаратов, защищающих нервные клетки от разрушающего действия крови при геморрагическом инсульте. Кроме того, серьезным недостатком этого метода является гепаринизация крови.
Целью настоящего изобретения является моделирование геморрагического инсульта in vitro, что дает многократное повышение надежности при воспроизведении модели геморрагического инсульта, а также создание условий для исследования молекулярно-клеточных механизмов повреждения мозговой ткани при поиске эффективных протективных препаратов для защиты нервных клеток, подвергшихся воздействию кровоизлияния.
Сущность предложенного способа моделирования геморрагического инсульта, включающего воздействие аутокровью на нервные клетки мозга, заключается в том, что аутокровь апплицируют на переживающие срезы нервных клеток мозга в течение 25-40 мин, затем отмывают срезы. Регистрируют исходные параметры вызванной биоэлектрической активности клеток в заданных структурах, в процессе аппликации и после отмывания. Сопоставляя параметры активности клеток с аппликацией с их исходными параметрами определяют степень их повреждения. Сопоставляя параметры активности отмытых клеток с их исходными, определяют возможность их восстановления.
Феноменологически эту модель следует рассматривать как аналог субдурального геморрагического инсульта, возникающего в целом организме согласно классификации сосудистых поражений головного мозга (Виленский, 1995), т.е. развитие патологических процессов в функционировании нервных клеток при действии крови под субарахноидальной оболочкой мозга. Однако опустив стеклянную пипетку, через которую поступает аутокровь в глубь переживающего среза, можно получить аналог внутримозгового, внутрикортикального инсульта.
Предложенный способ моделирования поясняется чертежами, где:
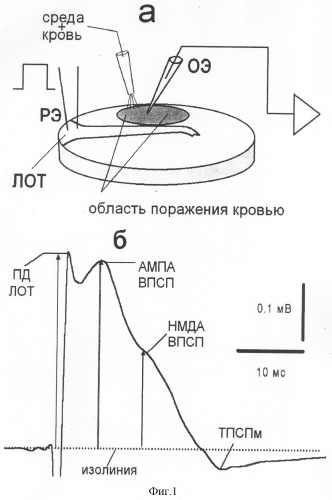
Фиг.1. Схема переживающего среза обонятельной коры мозга крыс (а) и фокальный потенциал, регистрируемый в нем (б).
а: РЭ - раздражающий электрод; ОЭ - отводящий электрод; ЛОТ - латеральный обонятельный тракт.
б: компоненты фокального потенциала: ПД ЛОТ - потенциал действия латерального обонятельного тракта; АМПА, НМДА ВПСП - глутаматергические возбуждающие постсинаптические потенциалы; ТПСПм - медленный тормозный постсинаптический потенциал.
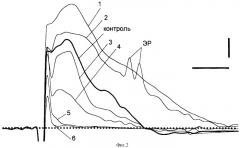
Фиг.2. Изменения фокальных потенциалов под действием аутокрови (концентрация 1-5 мл).
Цифры: 1, 2, 3, 4, 5, 6 - 5, 10, 20, 30, 40 и 30 мин отмыва соответственно. Горизонтальная пунктирная линия - изолиния. ЭР - эпилептиформные разряды. Калибровка: 0,1 мВ, 10 мс.
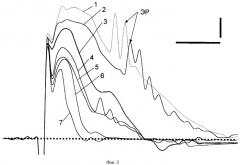
Фиг.3. Изменения фокальных потенциалов под действием аутокрови в меньшей концентрации - 0, 5 мл.
Цифры: 1, 2, 3, 4, 5, 6, 7 - 5, 10, контроль, 20, 30, 40, отмыв 30 мин соответственно. Остальные обозначения как на фиг.1.
Способ осуществляют следующим образом. Подготовленные переживающие срезы заданных структур мозга (фиг.1, а) помещают в специальную камеру для регистрации вызванной биоэлектрической активности и фиксируют исходные параметры (фиг.1, б). Затем апплицируют на срез аутокровь, взятую из общей сонной артерии в объеме 0,5-5 мл на 25-40 мин и регистрируют при этом биоэлектрическую активность клеток. После чего отмывают срез от крови и регистрируют снова биоэлектрическую активность мозга.
Сопоставляя параметры биоэлектрической активности клеток среза в процессе аппликации и после отмывания, определяют степень их поражения. Сопоставляя параметры активности отмытых клеток с их исходными параметрами, определяют возможность восстановления этих клеток.
Аппликация аутокрови на переживающие срезы сопровождается прогрессивной редукцией механизмов электрогенеза клетками и синаптических глутаматергических и ГАМК-эргических процессов. Процесс начинается спустя 3-5 мин и развивается довольно быстро в течение 25-40 мин. В конце указанного срока наступают необратимые нарушения нормальной деятельности сначала тормозных (ГАМК-эргических), а затем постсинаптических глутаматергических механизмов функционирования структур обонятельной коры. Обратимость повреждения мозговых структур проверяют при устранении аутокрови из перфузионной среды после отмывания (фиг.2).
Во всех протестированных по предлагаемому методу срезах получали стабильные результаты, что свидетельствует о высоком 100% уровне надежности данной модели геморрагического инсульта. Кроме того, проведенные исследования позволяют выявить последовательный каскад нарушений основных мозговых процессов при геморрагическом инсульте. Так, наиболее уязвимым механизмом при действии крови являются тормозные (ГАМК-эргические) процессы. В последующем при продолжающемся действии крови ингибируется функционирование таких глутаматергических механизмов как НМДА-связанные процессы. Эти механизмы ответственны за развитие серьезных невропатологий, таких как ишемические/аноксические и травматические повреждения мозга, эпилепсия, болезнь Альцгеймера, амиотрофический склероз (фиг.2, 3).
В отставленный период времени происходит нарушение АМПА-связанных процессов. Еще в более поздний период времени развивается нарушение механизмов проведения возбуждения по проводящим волокнам ЛОТ (фиг.2, 3).
Способ моделирования инсульта осуществляют следующим образом. Подготовленные переживающие срезы заданных структур мозга (фиг.1, а) помещают в камеру специальной конструкции. Регистрируют исходную вызванную биоэлектрическую активность клеток (фиг.1, б). Апплицируют на переживающий срез 0,5-5 мл аутокрови животного на 25-40 мин, продолжая регистрировать вызванную биоэлектрическую активность клеток. Затем срезы отмывают, и продолжают регистрировать параметры активностей клеток. Затем сопоставляют исходные параметры биоэлектрической активности с их параметрами при аппликации аутокрови и определяют степень их повреждения. При сопоставлении исходных параметров биоэлектрической активности с параметрами после отмывания определяют возможность восстановления клеток.
Пример 1.
На предварительно приготовленном переживающем срезе обонятельной коры мозга крыс линии Вистар стеклянным микроэлектродом (сопротивление электрода = 5 мОм) были зарегистрированы фокальные потенциалы (ФП), параметры которых являлись исходными. Затем срез перфузировали средой с кровью (1-5 мл) в течение 25-40 мин. Электрические импульсы прямоугольной формы от стимулятора ЭСУ-1 подавали через биполярные раздражающие электроды на ЛОТ среза. Через 5 мин после начала перфузии средой с кровью регистрировали увеличение, по сравнению с исходными, амплитуд ПД ЛОТ, АМПА и НМДА ВПСП. ТПСПм был заблокирован (фиг.2, 1). Эти изменения амплитуд ФП свидетельствуют о потенциации возбуждающих и блокаде тормозных процессов, вызываемых кровью. На 10-й мин было зарегистрировано снижение величины потенциации, отсутствовал ТПСПм, а на нисходящей фазе НМДА ВПСП появились спонтанные эпилептиформные разряды, что свидетельствует о возникновении эпилептического состояния в нервных клетках, подвергнутых действию аутокрови (фиг.2, 2). На 20-30-й мин наблюдалось снижение ПД ЛОТ, АМПА и НМДА ВПСП (фиг. 2, 3, 4). К 40-й мин была зарегистрирована блокада механизмов электрогенеза АМПА и НМДА ВПСП. Примерно вдвое снизилась амплитуда ПД ЛОТ, ТПСПм были ингибированы. В этот период времени ЭР были апериодичными и редкими (фиг.2, 5). После этого было сделано тестирование на обратимость эффектов, вызываемых аутокровью на срез после отмывания. Восстановление параметров отдельных компонентов ФП до исходных не происходило, что свидетельствует о необратимости негативного воздействия целой аутокрови на нервные клетки и синаптическую передачу (фиг. 2, 6).
Таким образом, полученные данные свидетельствуют о том, что действие аутокрови на нервные клетки, синаптическую передачу и проводящие волокна оказывает негативное и необратимое воздействие. При действии аутокрови в кортикальных структурах развивается последовательный каскад событий, приводящих к нарушению их нормального функционирования. Необратимость воздействия аутокрови на нервные клетки свидетельствует о том, что механизмы, ответственные за генерацию отдельных компонентов их функционирования, нарушены необратимо. Эти данные можно расценить как клинический коррелят обширного кровоизлияния, возникающего при геморрагическом инсульте.
Пример 2.
На предварительно приготовленном переживающем срезе обонятельной коры мозга крыс было испытано действие аутокрови в меньшей концентрации, чем то, что описано в примере 1, а именно 0,5 мл. Это было сделано с целью испытать другую концентрацию аутокрови, поскольку большая концентрация (1-5 мл) вызывала необратимое нарушение нормального функционирования отдельных механизмов электрогенеза нервных клеток.
Через 5 мин происходило увеличение амплитуд АМПА и НМДА ВПСП примерно на 30% и 80% соответственно, а также возрастание амплитуды ПД ЛОТ по сравнению с контролем (фиг. 3, 1). Тормозный потенциал ТПСПм исчезал. На нисходящей фазе НМДА ВПСП возникали ЭР. Все эти модификации компонентов ФП указывают на повышение уровня возбудимости в нервных клетках и развитие потенциации под действием аутокрови. На 10-й мин потенциация сохранилась, но ее амплитудные характеристики уменьшились. Однако апериодические ЭР сохранились (фиг.3, 2). При продолжающемся воздействии аутокрови (25-40 мин) происходило уменьшение, по сравнению с исходными, амплитуд АМПА и НМДА ВПСП, но полной блокады механизмов их генерации не наблюдалось (фиг.3, 4-6). ЭР возникали, но были редкими и регистрировались с частотой 1/15 мин. После отмывания восстановление исходных параметров ФП не происходило, более того, наблюдалось даже снижение амплитуд АМПА и НМДА ВПСП по сравнению с 40-й мин действия аутокрови (фиг.3, 7).
Данные результаты указывают на то, что снижение концентрации аутокрови, воздействующей на нервные клетки, не приводит к необратимым и полностью разрушающим действиям аутокрови на нервные структуры. Это может быть рассмотрено как коррелят клинического микроинсульта.
Таким образом, предлагаемый способ отличается от прототипа in vivo по следующим характеристикам: 1. Позволяет достичь 100% уровня повторяемости, тогда как в прототипе она снижена до 60-80% за счет летальных исходов экспериментальных животных. 2. Величина поражения мозга от действия аутокрови стандартна, в прототипе - неконтролируема и варьирует от одного животного к другому. 3. Отсутствует травматический (механический, компрессионный) компонент воздействия на клетки мозга, в прототипе он является значительным или даже доминирующим. 4. Позволяет выявить последовательность нарушений нормального функционирования базисных механизмов нервной ткани при геморрагическом инсульте, в прототипе это чрезвычайно затруднено. 5. Позволяет упростить и увеличить надежность подбора высокоэффективных фармакологических препаратов для защиты нервных клеток от разрушающего действия аутокрови, в прототипе такой подбор осложняется опосредованными действиями препаратов на другие мозговые структуры, а также воздействием наркоза, что является необходимым условием проведения экспериментов in vivo.
Цитируемая литература.
1. Виленский Б.С. Инсульт // СПб. 1995.
2. Макаренко А.Н., Косицын Н.С., Карпенко С.В., Мишина В.А. Способ моделирования геморрагического инсульта // Авт. свид. №1767518 А1 от 03.11.1990 г. G09В 23/28.
3. Макаренко А.Н., Косицын Н.С., Пасикова Н.В., Свинов М.М. Метод моделирования локального кровоизлияния в различных структурах головного мозга у экспериментальных животных // Журнал высшей нервной деятельности. 2002. Т.52. №6. С.765-768.
4. Мокрушин А.А., Мусящикова С.С. Анализ формирования вызванных потенциалов в нейронах обонятельной коры мозга крыс // Известия АН СССР; Сер. биол. №4, 1989, С.556-565.
5. Мокрушин А.А. Участие эндогенных пептидов в развитии и долговременной посттетанической потенциации // Известия РАН. Сер. биол. №1, 2002, С.74-87.
6. Мокрушин А.А., Павлинова Л.И., Гужова И.В., Маргулис Б.А. Эффекты экзогенного белка теплового шока (HSP70) на глутаматергическую синаптическую передачу в обонятельной коре мозга крыс in vitro // ДАН, 2004, Т. 395, №4, С.551-553.
7. Del Bigio M.R., Yan H.J., Buist R., Peeling J. Experimental intracerebral hemorrhage in rats. Magnetic resonance imaging and histopathologicai correlates // Stroke. 1996. 27(12): 2312-2319.
8. Del Bigio M.R., Yan H.J., Xue M.J. Intracerebral infusion of a second-generation ciliary neurotrophic factor reduces neuronal loss in rat striatum following experimental intracerebral hemorrhage // J Neurol Sci. 2001. 192(1-2): 53-59.
9. Felberg R.A., Grotta J.C., Shirzadi A.L, Strong R., Narayana P., Hill-Felberg S.J., Aronowski J. Cell death in experimental intracerebral hemorrhage: the "black hole" model of hemorrhagic damage //Ann Neurot. 2002. 51(4): 517-524.
10. Gong С., Boulis N., Qian J., Turner D.E., Hoff J.T., Keep R.F. Intracerebral hemorrhage-induced neuronal death // Neurosurgery. 2001. 48(4): 875-882.
11. Kitaoka Т., Hua Y., Xi G., Hoff J.T., Keep R.F. Delayed argatroban treatment reduces edema in a rat model of intracerebral hemorrhage // Stroke. 2002 33(12): 3012-3018.
12. Lowe D.A., Bayer A.G. Behavioural deficits following subdural haematoma: a rat model for functional recovery after brain injury // Neuronal Plasticity: The Key to Stroke Recovery, 2000, P.78.
13. Matz P.G., Fujimura M., Chan P.H. Subarachnoid hemolysate produces DNA fragmentation in a pattern similar to apoptosis in mouse brain // Brain Res. 2000. 858(2): 312-319.
14. Mayne M., Ni W., Yan H.J., Xue M., Johnston J.B., Del Bigio M.R., Peeling J., Power C. Antisense oligodeoxynucleotide inhibition of tumor necrosis factor-alpha expression is neuroprotective after intracerebral hemorrhage // Stroke. 2001. 32(1): 240-248.
15. Power С., Henry S., Del Bigio M.R., Larsen P.H., Corbett D., Imai Y., Yong V.W., Peeling J. Intracerebral hemorrhage induces macrophage activation and matrix metalloproteinases //Ann Neurol. 2003. 53(6): 731-742.
16. Tomita H., Ito U., Ohno K., Hirakawa K. Chronological changes in brain edema induced by experimental intracerebral hematoma in cats // Acta Neurochir. Suppl. (Wien). 1994. 60: 558-560.
17. Xi G., Hua Y., Bhasin R.R., Ennis S.R., Keep R.F., Hoff J.T. Mechanisms of edema formation after intracerebral hemorrhage: effects of extravasated red blood cells on blood flow and blood-brain barrier integrity // Stroke. 2001. 32(12): 2932-2938.
18. Xiao L., Li X.Q., Zhang H.X. Effects of nao-yi-an granule on the intercellular expression of IL-6 in the experimental intracerebral hemorrhagic brain of rats // Hunan Yi Ke Da Xue Xue Bao. 2002. 27(2): 123-126.
19. Xue M., Del Bigio M.R. // Intracortical hemorrhage injury in rats: relationship between blood fractions and brain cell death // Stroke. 2000. 31(7): 1721-1727.
Способ моделирования и исследования последствий геморрагического инсульта путем воздействия аутокровью на нервные клетки мозга, отличающийся тем, что подготавливают переживающие срезы, фиксируют исходные параметры, вызванные биоэлектрической активностью клеток, апплицируют аутокровь на переживающие срезы нервных клеток мозга на 25-40 мин и регистрируют при этом биоэлектрическую активность клеток, отмывают срезы и вновь оценивают биоэлектрическую активность, сопоставляя параметры клеток с аппликацией с их исходными параметрами определяют степень их повреждения, а сопоставляя параметры отмытых клеток с исходными определяют возможность их восстановления.