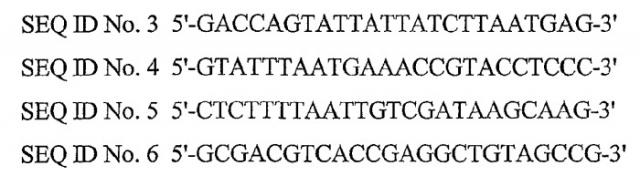Кольцевая молекула днк, характеризующаяся зависимой от условий точкой начала репликации, способ их получения и их применение в генной терапии
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой прокариотическую рекомбинантную клетку хозяина, содержащую гетерологичный белок инициации репликации, который активирует зависимую от условий точку начала репликации, и внехромосомную молекулу ДНК, содержащую гетерологичный терапевтический ген и зависимую от условий точку начала репликации. Также изобретение относится к способу продуцирования плазмиды, содержащей гетерологичный терапевтический ген и зависимую от условий точку начала репликации. А также к самой плазмиде, представляющей собой суицидный вектор для переноса генов, содержащей гетерологичный терапевтический ген и зависимую от условий точку начала репликации. Данное изобретение позволяет избежать неконтролируемой гиперэкспрессии терапевтического гена и генов устойчивости. 3 н. и 41 з.п. ф-лы, 33 ил., 10 табл.
Реферат
Настоящее изобретение относится к новой молекуле ДНК с зависимой от условий репликацией, которая может использоваться в генной терапии или для продукции рекомбинантных белков. Новые молекулы ДНК согласно изобретению здесь и далее обозначены pCOR™.
Генная терапия состоит в коррекции дефицита или аномалии путем введения в пораженный орган или клетку генетической информации. Данная информация может вводиться in vitro в клетку, выделенную из органа и затем снова вводимую в организм, или in vivo непосредственно в ткань-мишень. Как молекула с большой молекулярной массой и отрицательным зарядом, ДНК с трудом преодолевает фосфолипидные клеточные мембраны. Различные векторы, таким образом, используют для обеспечения переноса генов: вирусные векторы, с одной стороны, и природные или синтетические химические и/или биохимические векторы, с другой стороны.
Вирусные векторы (ретровирусы, аденовирусы, аденоассоциированные вирусы и т.д.) очень эффективны, в частности, в пересечении мембран, но связаны с некоторым риском, таким как патогенность, рекомбинация, репликация и иммуногенность.
Химические и/или биохимические векторы позволяют обойти указанный риск (см. обзоры, Behr, 1993, Cotton and Wagner 1993). Они представляют собой, например, катионы (фосфат кальция, DEAE-декстран и т.д.), которые действуют путем образования преципитатов с ДНК, способных "фагоцитироваться" клетками. Они также могут быть липосомами, в которые встроена ДНК и которые сливаются с плазматической мембраной. Синтетические векторы для переноса генов в основном представляют собой липиды или катионные полимеры, которые образуют комплекс с ДНК и формируют вместе с ней частицу, несущую положительные катионные заряды. Для иллюстрации векторов данного типа следует упомянуть, в частности, диоктадециламидоглицилспермин (DOGS, Transfectam™) или N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмоний (DOTMA, Lipofectin™).
Однако применение химических и/или биохимических векторов или голой ДНК предполагает возможность продукции больших количеств ДНК фармакологической чистоты. Причина этого в том, что в способах генной терапии медицинский продукт состоит из ДНК самой по себе, и существенно, чтобы имелась возможность производства в подходящих количествах ДНК, характеризующихся свойствами, которые могут использоваться для лечебных применений у человека.
В случае невирусной векторологии используемые векторы представляют собой плазмиды бактериального происхождения. Плазмиды, в основном используемые в генной терапии, несут (i) точку начала репликации, (ii) маркерный ген, такой как ген устойчивости к антибиотику (канамицину, ампициллину и т.д.), (iii) один или более трансгенов с последовательностями, необходимыми для их экспрессии (энхансер(ы), промотор(ы), последовательности полиаденилирования и пр.). Однако доступная в настоящее время технология не является полностью удовлетворительной.
С другой стороны, остается риск распространения по организму. Так, бактерия, которая присутствует в организме, может с низкой вероятностью получить данную плазмиду. Имеется большая вероятность данного происшествия, если используется лечение путем генной терапии in vivo, при которой ДНК может распространяться по организму пациента и может контактировать с бактериями, которые инфицируют данного пациента, или с бактериями симбиотической флоры. Если бактерия, получающая плазмиду, представляет собой энтеробактерию, такую как E. coli, данная плазмида может реплицироваться. Затем это событие приводит к распространению терапевтического гена. Поскольку терапевтические гены, используемые в лечении путем генной терапии, могут кодировать, например, лимфокин, фактор роста, антионкоген или белок, функция которого дефектна в организме хозяина, и они дают возможность коррекции генного дефекта, распространение некоторых из этих генов может оказывать непредсказуемое и тревожное действие (например, если патогенная бактерия приобрела ген человеческого фактора роста).
С другой стороны, плазмиды, в общем используемые в невирусной генной терапии, также обеспечивают маркер устойчивости к антибиотику (ампициллину, канамицину и т.д.). Бактерия, несущая такую плазмиду, имеет неоспоримое селективное преимущество, поскольку любое лечение антибиотиками, в котором используются антибиотики того же семейства, что и тот, что служит для селекции путем плазмидного гена устойчивости, будет приводить к селекции указанной плазмиды. В данном отношении ампициллин относится к a-лактамам, представляющим семейство антибиотиков, которое наиболее часто применяется в мире. Применение в бактериях маркеров селекции, которые не представляют собой гены устойчивости к антибиотикам, является особенно предпочтительным. Оно позволит избежать селекции бактерий, которые могут получить плазмиду, несущую такой маркер.
Так, особенно важно постараться как можно сильнее ограничить пределы распространения терапевтических генов и генов устойчивости.
Конкретно, предметом настоящего изобретения является представление новых молекул ДНК, которые могут использоваться в генной терапии или для продукции рекомбинантных белков in vitro и которые реплицируются только в клетках, которые могут дополнить некоторые функции данных невирусных векторов.
Изобретение также относится к особенно эффективному способу получения данных молекул ДНК.
Заявленные здесь молекулы ДНК имеют преимущества, позволяющие избежать риск, ассоциированный с распространением плазмиды, такой как (1) репликация и распространение, что может привести к неконтролируемой гиперэкспрессии терапевтического гена, (2) распространение и экспрессия генов устойчивости. Генетическая информация, содержащаяся в молекулах ДНК согласно изобретению, эффективно включает в себя терапевтический(-ие) ген(-ы) и сигналы регуляции его (их) экспрессии, функциональную, зависимую от условий точку начала репликации, которая сильно ограничивает спектр клеток хозяина для плазмиды, маркер селекции сниженного размера, который предпочтительно отличается от гена, который придает устойчивость к антибиотикам, и, где это подходит, фрагмент ДНК, который обеспечивает разрешение мультимеров плазмиды. Вероятность того, что данные молекулы (и, таким образом, генетическая информация, которую они содержат) будут перенесены в микроорганизм и там будут стабильно поддерживаться, очень ограничена.
Наконец, векторы согласно изобретению, также называемые миниплазмидами за счет их кольцевой структуры, сниженного размера и сверхспиральной формы, имеют следующие дополнительные преимущества: за счет их размера, который снижен по сравнению с обычно применяемыми происходящими от ColE1 плазмидами, молекулы ДНК согласно изобретению потенциально характеризуются лучшей биодоступностью in vivo, и данные молекулы ДНК, или pCOR, остаются в стабильной внехромосомной форме прокариотических или эукариотических клетках хозяина, которые не содержат инициирующего белка. В частности, они имеют улучшенные способности проникновения в клетки и распространения в них. Так, допускается, что коэффициент диффузии в тканях обратно пропорционален молекулярной массе (Jain, 1987). Сходным образом, в клетке молекулы с высокой молекулярной массой характеризуются меньшей проницаемостью через плазматическую мембрану. Кроме того, в плане проникновения плазмиды в ядро, что существенно для ее экспрессии, высокая молекулярная масса также является недостатком, причем ядерные поры устанавливают предел размеров для диффузии в ядро (Landford et al, 1986). Снижение размера нетерапевтических частей молекулы ДНК (точки начала репликации и гена селекции, в частности) согласно изобретению также дает возможность для снижения размера молекул ДНК. Часть, которая обеспечивает репликацию и селекцию плазмиды в бактерии (1 т.п.н.), снижена в 3 раза, составляя, например, 3 т.п.н. для части вектора, включающей в себя точку начала репликации и маркерный ген устойчивости. Данное снижение (i) молекулярной массы и (ii) отрицательного заряда обеспечивает улучшенную биодоступность и диффузию молекул согласно изобретению в отношении тканей, клеток и ядер.
Более конкретно, настоящее изобретение относится к кольцевой молекуле ДНК, которая может использоваться в генной терапии, причем данная молекула содержит по меньшей мере одну интересующую последовательность нуклеиновой кислоты и характеризуется тем, что область, которая обеспечивает ее репликацию, содержит точку начала репликации, функциональность которой в клетке хозяина требует наличия по меньшей мере одного конкретного белка, который является чужеродным по отношению к указанной клетке хозяина.
Данная молекула ДНК может быть в одно- или двухцепочечной форме и предпочтительно обладает сверхспиральной формой.
Для целей настоящего изобретения используемые клетки хозяина могут быть различного происхождения. Они могут быть эукариотическими или прокариотическими клетками. Согласно предпочтительному осуществлению настоящего изобретения они являются прокариотическими клетками.
Репликация бактериальных плазмид обычно требует присутствия по меньшей мере одного белка, который кодируется клеткой хозяина, типа РНК-полимеразы, РНКазы, ДНК-полимеразы и т.д. По уже объясненным выше причинам, с данным типом репликации невозможно полностью преодолеть любой вероятный риск распространения в подвергающемся лечению организме. Предпочтительно, функциональность точки начала репликации молекулы ДНК согласно изобретению требует наличия конкретного белка, который является чужеродным для клетки хозяина. Значение данной характеристики состоит в сужении спектра хозяев для заявленной плазмиды до конкретных штаммов, которые экспрессируют инициаторный белок. Молекула ДНК, разработанная в контексте настоящего изобретения, таким образом, предпочтительно обладает так называемой зависимой от условий точкой начала репликации.
Зависимая от условий точка начала репликации, используемая согласно изобретению, может происходить из плазмид или бактериофагов, которые характеризуются следующими характеристиками: они содержат в своей точке репликации последовательности повтора, или итероны, и они кодируют по меньшей мере один инициирующий репликацию белок (Rep), который является специфическим для них. Для примера могут быть указаны зависимые от условий системы репликации следующих плазмид и бактериофагов:
| плазмида или бактериофаг | специфический инициаторный белок |
| RK2 (Stalker et al., 1981) | TrfA |
| R1 (Ryder et al., 1981) | RepA |
| pSC101 (Vocke and Bastia, 1983) | RepA |
| F (Murotsu et al., 1981) | белок E |
| RtsI (Itoh et al., 1982, 1987) | RepA |
| RSF1010 (Miao et al., 1995) | RepC |
| P1 (Abeles et al., 1984) | RepA |
| P4 (Flensburg and Calendar, 1987) | альфа-белок |
| лямбда (Moore et al., 1981) | белок О |
| фи-82 (Moore et al., 1981) | белок О из фи-82 |
| фи-80 | белок О из фи-80 |
Согласно предпочтительному осуществлению изобретения точка начала репликации, используемая в заявленных молекулах ДНК, происходит из природной плазмиды E. coli, обозначенной как R6K.
Функции репликации R6K сгруппированы во фрагменте ДНК размером 5,5 т.п.н. (фигура 1), содержащем 3 точки начала репликации a, Я и (и a обеспечивают 90% репликации) и оперон, кодирующий инициаторный белок репликации П и белок Bis. Минимальное количество генетической информации, требуемое для поддержания данной плазмиды в числе копий, характерном для нее (15 копий на геном), содержится в двух элементах: 400 п.н. ori и ген pir, продукт которого есть инициаторный белок П.
Ori может разделяться на две функциональные части: коровая часть и активаторный элемент (фигура 1). Коровая часть, существенная для репликации, содержит итероны (7 прямых повторов по 22 п.н.), с которой связывается белок П, представленный в SEQ ID No.1, и фланкирующие сегменты, которые являются мишенями для белков хозяина (IHF, DnaA).
Согласно предпочтительному способу изобретения точка начала репликации заявленного вектора состоит полностью или частично из данной точки начала репликации плазмиды R6K и, более предпочтительно, полностью или частично из SEQ ID No. 1 или одного из ее производных.
Точка начала репликации, описанная выше, которая характеризуется преимуществом очень ограниченного размера, функциональна исключительно в присутствии специфического инициаторного белка, белка Pi, продуцированного геном pir (SEQ ID No. 2). Поскольку данный белок может действовать в транс-положении, возможно физически отделить ori гамма от гена pir, который может вводиться в геном клетки, выбранной в качестве специфического хозяина для данных плазмид. Мутации в П могут изменять его ингибиторные функции (Inuzuka and Wada, 1985) и приводить к снижению числа копий производных R6K, вплоть до количества, более чем в 10 раз превышающего изначальное число копий. Данные замены могут иметь место внутри домена из 40 аминокислот, который поэтому оказывается ответственным за контроль числа копий плазмиды, обеспечиваемый П (фигура 2), или в других областях белка П.
Согласно предпочтительному осуществлению настоящего изобретения белок П, экспрессируемый в клетке хозяина, является результатом экспрессии гена, представленного в SEQ ID No. 2 или одного из его производных, определяемых выше, и, более конкретно, гена pir 116, который содержит мутацию по сравнению с геном pir. Данная мутация соответствует замене пролина на лейцин в положении 106 от стартового кодона. В данном контексте число копий производных R6K составляет примерно 250 на геном.
Для целей настоящего изобретения термин "производное" означает любую последовательность, которая отличается от рассматриваемой последовательности, полученной путем одной или нескольких модификаций генетической и/или химической природы, а также любую последовательность, которая гибридизуется с данными последовательностями или их фрагментами и продукт которых обладает активностью, обозначенной в отношении инициирующего репликацию белка П. Термин "модификаций генетической и/или химической природы" можно понимать как обозначение любой мутации, замены, делеции, добавления и/или модификации одного или нескольких остатков. Термин "производное" также включает в себя последовательности, гомологичные в отношении рассматриваемой последовательности, происходящие из других клеточных источников и, в частности, клеток человеческого происхождения, или из других организмов, и обладающие активностью того же типа. Такие гомологичные последовательности могут быть получены путем экспериментов по гибридизации. Гибридизации могут проводиться, начиная с библиотек нуклеиновых кислот, с использованием природной последовательности или ее фрагмента в качестве зонда, при общепринятых условиях жесткости (Maniatis et al., cf. General techniques of molecular biology), или, предпочтительно, при условиях высокой жесткости.
Кроме зависимой от условий точки начала репликации, определяемой выше, заявленные молекулы ДНК содержат область, включающую в себя один (или несколько) ген (-ов), что дает возможность обеспечения селекции молекулы ДНК в выбранном хозяине.
Это может быть общепринятый маркер типа гена, который придает устойчивость к антибиотику, такому как канамицин, ампициллин, хлорамфеникол, стрептомицин, спектиномицин, ливидомицин или подобные им.
Однако согласно предпочтительному осуществлению изобретения данная область отличается от гена, который придает устойчивость к антибиотику. Это, таким образом, может быть ген, существенный для жизнеспособности рассматриваемого хозяина при определенных условиях культивирования. Это, например, может быть
- ген, кодирующий супрессорную тРНК природного или синтетического происхождения. Это, более предпочтительно, тРНК амбер-кодона (TAG);
- ген, продукт которого необходим для метаболизма клетки в определенных условиях культивирования, а именно, ген, участвующий в биосинтезе метаболита (аминокислоты, витамина и т.д.), или ген катаболизма, который дает возможность для ассимиляции вещества, присутствующего в культуральной среде (конкретного источника азота или углерода) и т.д.
Согласно предпочтительному способу изобретения данная область содержит экспрессирующую кассету гена, кодирующего супрессорную тРНК для конкретных кодонов. Этот последний может быть выбран, в частности, из кодирующих аминокислоты фенилаланин, цистеин, пролин, аланин и гистидин. Более конкретно, это супрессорная тРНК для амбер-кодонов (TAG).
В данном конкретном случае система, используемая для селекции в клетках хозяина молекул ДНК согласно изобретению, включает в себя два элемента: 1) ген на молекуле ДНК, кодирующий супрессорную транспортную ДНК для амбер-кодона (TAG), которая составляет маркер селекции, известный как ген (sup), и 2) конкретный хозяин, один из генов которого, который является существенным при определенных условиях культивирования, содержит амбер-кодон TAG. Данная клетка может расти в условиях культивирования, при которых существенен продукт гена, содержащего кодон TAG, только если плазмида, обеспечивающая экспрессию sup, присутствует в клетке. Условия культивирования, таким образом, обеспечивают пресс селекции молекулы ДНК. Используемые гены sup могут быть природного происхождения (Glass et al., 1982) или могут происходить из синтетической конструкции (Normanly et al., 1986, Kleina et al., 1990).
Такая система предоставляет большую гибкость, поскольку в зависимости от гена, содержащего амбер-мутацию, возможно определить различные селективные среды. В бактерии Lactococcus lactis амбер-кодон, например, расположен в гене биосинтеза пурина. Это обеспечивает селекцию плазмиды, несущей ген, кодирующий супрессорную тРНК, когда бактерии размножаются в молоке. Такой маркер имеет преимущество малого размера и не содержит "чужеродных" последовательностей, происходящих из фагов или транспозонов.
Согласно предпочтительному осуществлению изобретения молекула ДНК также включает в себя фрагмент ДНК, мишень для сайт-специфических рекомбиназ, что обеспечивает разрешение плазмидных мультимеров.
Таким образом, такой фрагмент, введенный в молекулу ДНК, которая является кольцевой и точка начала репликации которой, например, представляет собой, например, ori гамма, обеспечивает разрешение мультимеров такой плазмиды. Такие мультимеры наблюдаются, в частности, когда молекулу ДНК получают в штамме, несущем мутантный аллель pir, такой как pir116, что дает возможность увеличения числа копий производных R6K.
Рекомбинация может достигаться посредством различных систем, которые вызывают сайт-специфическую рекомбинацию между последовательностями. Более предпочтительно, сайт-специфическая рекомбинация согласно изобретению достигается средствами специфических последовательностей внутримолекулярной рекомбинации, способных рекомбинировать друг с другом в присутствии специфических белков, в общем называемых рекомбиназами. В данном конкретном случае имеют место рекомбиназы XerC и XerD. По этой причине молекулы ДНК согласно изобретению в общем также включают в себя последовательность, которая обеспечивает данную сайт-специфическую рекомбинацию. Система специфической рекомбинации, присутствующая в генетических конструкциях согласно изобретению (рекомбиназы и участки специфического распознавания), могут быть разного происхождения. В частности, используемые специфические последовательности и рекомбиназы могут принадлежать различным структурным классам, и в частности, к семейству резолвазы транспозона Tn3 или семейству интегразы бактериофага лямбда. Из рекомбиназ, принадлежащих семейству транспозона Tn3, могут быть упомянуты, в частности, резолваза транспозона Tn3 или транспозонов Tn21 и Tn522 (Stark et al., 1992); инвертаза Gin бактериофага мю или, альтернативно, плазмидные резолвазы, такие как из par-фрагмента RP4 (Abert et al., Mol. Microbiol. 12 (1994) 131). Из рекомбиназ, принадлежащих семейству интегразы бактериофага, могут быть упомянуты, в частности, интеграза фагов лямбда (Landy et al., Science 197 (1977) 1147), P22 и Ф80 (Leong et al., J. Biol. Chem. 260 (1985) 4468), HP1 Haemophilus influenzae (Hauser et al., J. Biol. Chem. 267 (1992) 6859), интеграза Cre фага P1, интеграза плазмиды pSAM2 (EP 350 341) или, альтернативно, рекомбиназа FLP плазмиды 2μ и рекомбиназы XerC и XerD из E. coli.
Предпочтительно молекулы ДНК, которые относятся к настоящему изобретению, содержат фрагмент cer из природной плазмиды E. coli ColEl. Используемый фрагмент cer представлен 382 п.н. HpaII из ColEl, который, как было показано, обеспечивает в цис-положении разрешение мультимеров плазмид (Summers et al., 1984; Leung et al., 1985). Также возможно применение фрагмента HpaII-TaqI меньшего размера (280 п.н.) или меньшего фрагмента (примерно 220 п.н.), содержащегося во фрагменте Hpall, причем эти фрагменты обладают одинаковыми свойствами (Summers and Sherratt, 1988). Данное разрешение происходит путем специфической внутримолекулярной рекомбинации, в которой используются четыре белка, кодируемых в геноме E. coli: ArgR, PepA, XerC и XerD (Stirling et al., 1988, 1989; Colloms et al., 1990, Blakely et al., 1993). Было обнаружено, что вставка фрагмента cer из природной плазмиды E. coli ColEl позволяет получить высокую степень разрешения мультимеров плазмид, с получением, таким образом, большой доли мономеров воспроизводимым образом. Это особенно неожиданно, поскольку было показано, что вставка участка cer в мини-кольцо, которое содержит точку начала репликации ColEl из pBluescript SK+, не приводит к эффективному разрешению мультимеров (Kreiss et al., Appl. Microbiol. Biotechnol, 49: 560-567 (1998)), и, таким образом, эффективное разрешение в цис-положении плазмид является непредсказуемым и, как представляется, зависит от конформации плазмиды. В случае плазмиды pCOR эффективное разрешение в цис-положении достигается, когда cer присутствует на pCOR, что приводит к получению непредсказуемо высокого количества мономеров pCOR воспроизводимым образом.
В этой связи особенно предпочтительно использовать весь cer-фрагмент ColEl или его часть, или одно из его производных, как это определено выше.
Согласно некоторому варианту осуществления, молекулы ДНК согласно изобретению могут также содержать последовательность, способную специфически взаимодействовать с лигандом. Предпочтительно, это последовательность, способная образовывать путем гибридизации тройную спираль со специфическими олигонуклеотидами. Данная последовательность, таким образом, дает возможность для очистки молекул согласно изобретению путем селективной гибридизации с комплементарным олигонуклеотидом, иммобилизованным на подложке (см. заявку WO 96/18744 и WO 02/07727). Данная последовательность может присутствовать в природе в точке начала репликации плазмиды, как описано в опубликованной заявке на выдачу патента США 2003/186268, принадлежащей настоящему заявителю, или присутствовать в природе в трансгене, как описано в WO 02/07727, и, альтернативно, может располагаться в любом участке в молекуле ДНК согласно изобретению при обеспечении того, что она не будет влиять на функциональность интересующего гена и точки начала репликации. Образование тройной спирали путем гибридизации, таким образом, происходит между олигонуклеотидом и специфической комплементарной последовательностью, присутствующей в ДНК. В этой связи, для получения лучших выходов и большей избирательности олигонуклеотид и специфичная последовательность, которые являются полностью комплементарными, используют в способе согласно изобретению. Это может быть, в частности, олигонуклеотид поли(CTT) и специфичная последовательность поли(GAA). Например, олигонуклеотиды, содержащие повторяемые мотивы, такие как CTT, способны образовывать тройную спираль с конкретной последовательностью, содержащей комплементарные единицы (GAA). Интересующая последовательность может, в частности, представлять собой область, содержащую 7, 14 или 17 единиц GAA, и в олигонуклеотидах - соответствующие количества повторов CTT. В данном случае олигонуклеотид связывается в антипараллельной ориентации с полипуриновой цепью. Данные тройные спирали стабильны только в присутствии Mg2+ (Vasquez et al., Biochemistry, 34: 7243-7251 (1995); Beal and Dervan, Science, 251: 1360-1363 (1991)).
Как указывалось выше, специфичная последовательность может представлять собой последовательность, присутствующую в природе в pCOR, или может представлять собой синтетическую последовательность, искусственно введенную в последнюю. Особенно предпочтительно применение олигонуклеотида, способного образовывать тройную спираль с последовательностью, присутствующей в природе в pCOR, например, в точке начала репликации плазмиды или в маркерном гене. Синтез олигонуклеотидов, способных образовывать тройные спирали с данными природными областями гомопуринов-гомопиримидинов, является особенно предпочтительным, поскольку он может применяться на немодифицированных плазмидах pCOR. Особенно предпочтительные последовательности-мишени, которые могут образовывать тройные структуры с конкретными олигонуклеотидами, идентифицированы в точках начала репликации ColEl и pCOR. Происходящие от ColEl плазмиды содержат 12-членную гомопуриновую последовательность (5'-AGAAAAAAAGGA-3') (SEQ ID NO: 33), картированную выше транскрипта РНК-II, участвующего в репликации плазмиды (Lacatena et al., Nature, 294: 623 (1981)). Данная последовательность образует стабильную тройную структуру с комплементарным 12-членным олигонуклеотидом 5'-TCTTTTTTTCCT-3' (SEQ ID NO: 34). Остов pCOR содержит гомопуриновую полосу из 14 неповторяемых оснований (5'-AAGAAAAAAAAGAA-3') (SEQ ID NO:35), расположенных в A+T-богатом сегменте репликона точки начала репликации pCOR (Levchenko et al., Nucleic Acids Res., 24: 1936 (1996)). Данная последовательность образует стабильную тройную структуру с 14-членным комплементарным олигонуклеотидом 5'-TTCTTTTTTTTCTT-3' (SEQ ID NO: 36). Соответствующие олигонуклеотиды 5'-TCTTTTTTTCCT-3' (SEQ ID NO: 37) и 5'-TTCTTTTTTTTCTT-3' (SEQ ID NO: 38) эффективно и специфически направленно действуют на соответствующие им комплементарные последовательности, расположенные в пределах точки начала репликации ori ColEl или pCOR (ori ). Также применение олигонуклеотида, способного образовывать тройную спираль с последовательностью, присутствующей в точке начала репликации, или маркерного гена является особенно предпочтительным, поскольку это дает возможность с использованием того же олигонуклеотида очищать любую ДНК, содержащую указанную точку начала репликации указанного маркерного гена. Следовательно, не является необходимым модифицировать плазмиду или двухцепочечную ДНК с введением в нее искусственной специфической последовательности.
Хотя предпочтительны полностью комплементарные последовательности, следует понимать, однако, что могут допускаться некоторые несовпадения между последовательностью олигонуклеотида и последовательностью, представленной в ДНК, при обеспечении того, что они не приведут к очень большой потере сродства. Может указываться последовательность 5'-AAAAAAGGGAATAAGGG-3' (SEQ ID NO: 39), присутствующая в гене β-лактамазы E. coli. В данном случае тимин, прерывающий полипуриновую последовательность, может распознаваться гуанином третьей цепи с образованием, таким образом, триплета G*TA, который стабилен при фланкировании двумя триплетами T*AT (Kiessling et al., Biochemistry, 31: 2829-2834 (1992)).
Согласно конкретному осуществлению, используемые олигонуклеотиды могут содержать последовательность (CCT)n, последовательность (CT)n или последовательность (CTT)n, в которых n представляет собой целое число от 1 до 15 включительно. Особенно предпочтительным является применение последовательностей типа (CT)n или (CTT)n. В олигонуклеотидах также могут сочетаться единицы (CCT), (CT) или (CTT).
Используемые олигонуклеотиды могут быть природными (состоящими из немодифицированных природных оснований) или химически модифицированными. В частности, олигонуклеотид может предпочтительно иметь конкретные химические модификации, обеспечивающие повышение его устойчивости или защиты от нуклеаз, или его сродства в отношении специфической последовательности.
В качестве репрезентативной молекулы ДНК согласно изобретению наиболее конкретно может быть заявлена плазмида pXL2774 и ее производные. Для целей изобретения термин "производное", как он понимается, относится к любой конструкции, происходящей от pXL2774 и содержащей один или несколько интересующих генов, отличных от гена люциферазы. Также следует указать на плазмиды pXL3029, pXL3030 и плазмиду pXL3179 или NV1FGF, содержащие экспрессирующие кассеты терапевтического гена. В наиболее предпочтительном осуществлении изобретение относится к pCOR, содержащей ген FGFa или FGF-1, как описано в патенте США 4686113, принадлежащем настоящему заявителю, которая обозначена pXL3179 или NV1FGF.
Настоящее изобретение также относится к разработке способа конструирования специфической клетки хозяина, которая особенно эффективна для продукции данных терапевтических молекул ДНК.
Другой предмет настоящего изобретения относится к способу продукции кольцевой молекулы ДНК, характеризующемуся тем, что культивируется клетка хозяина, содержащая по меньшей мере одну молекулу ДНК, определяемую выше, и белок, который может экспрессироваться in situ или не экспрессируется, причем данный белок обуславливает функциональность точки начала репликации указанной молекулы ДНК, которая является специфической и которая является чужеродной для указанной клетки хозяина, в условиях, которые обеспечивают селекцию клетки хозяина, трансформированного указанными молекулами ДНК.
Более предпочтительно, белок, который обуславливает функциональность точки начала репликации молекулы ДНК, экспрессируется in situ из соответствующего гена. Ген, кодирующий белок инициации репликации, может находиться во вспомогательном репликоне, который совместим с производными используемой общепринятой точки начала репликации или который может вводиться в геном клетки-хозяина путем рекомбинации посредством транспозона, бактериофага или любого другого вектора. В конкретном случае, в котором ген, экспрессирующий белок, помещается во вспомогательный репликон, последний также содержит промоторную область для функциональной транскрипции в клетке, а также область, которая локализована на 3'-конце и которая определяет сигнал терминации транскрипции. В отношении промоторной области это может быть промоторная область, которая в природе ответственна за экспрессию рассматриваемого гена, когда последний способен функционировать в данной клетке. Она также может быть случаем областей отличного происхождения (ответственной за экспрессию других белков) или даже синтетического происхождения. В частности, она может являться случаем промоторных последовательностей прокариотических генов или генов бактериофагов. Например, она может являться случаем промоторных последовательностей, полученных из клеточного генома.
В качестве генов, кодирующих белок инициации репликации, могут применяться гены дикого типа или мутированные аллели, которые дают возможность получения повышенного числа копий плазмид (или производных), специфических для инициаторного белка, которые обуславливают функциональность точки начала репликации, используемой в молекуле ДНК.
Такие мутанты описаны, в частности, для плазмид R6K (Inuzuka and Wada, 1985; Greener et al., (1990), Rtsl (Terawaki and Itoh, 1985, Terawaki et al., 1990; Zeng et al., 1990), F (Seelke et al., 1982; Helsberg et al., 1985; Kawasaki et al., 1991), RK2 (Durland et al., 1990; Haugan et al., 1992, 1995), pSC101 (Xia et al., 1991; Goebel et al., 1991; Fang et al., 1993).
В конкретном случае, в котором используемая молекула ДНК обладает точкой начала репликации, происходящей из плазмиды R6K, инициаторный белок представляет собой производное белка П той же самой плазмиды. Особенно предпочтительной является экспрессия мутантной формы данного белка, которая способна существенно увеличивать число начальных копий. Для того, чтобы сделать это, ген, встроенный в клетку хозяина, предпочтительно, представлен частью или целой последовательностью, указанной в SEQ ID No. 2, или одним из его производных, а более предпочтительно - геном pir116.
Ассоциированная мутация соответствует замене пролина лейцином. Согласно конкретному осуществлению изобретения данный ген pir116 непосредственно встраивается в геном клетки хозяина.
Предпочтительно один из генов специфической клетки хозяина, который является необходимым при выбранных условиях культивирования, содержит специфический кодон, который может распознаваться в молекуле ДНК выбранной супрессорной тРНК. Согласно предпочтительному способу изобретения он представляет собой амбер-кодон TAG. В данном конкретном случае клетка может выращиваться в условиях культивирования, когда необходим продукт гена, содержащего кодон TAG, только если в клетке хозяина присутствует плазмида, обеспечивающая экспрессию sup. Условия культивирования, таким образом, оказывают на молекулу ДНК давление селекции.
Предпочтительно ген, содержащий амбер-кодон, представляет собой ген, участвующий в биосинтезе аминокислоты аргинина. Данный ген argE кодирует N-ацетилорнитиназу (Meinnel et al., 1992) и в данном случае содержит кодон TAG, соответствующий точечной мутации Gln-53 (CAG) TAG; затем давление селекции плазмиды, несущей ген sup, предоставляется в минимальной среде M9 (Maniatis et al., 1989). Однако данный ген также может представлять собой, например, ген биосинтеза витамина или основания нуклеиновой кислоты, или, альтернативно, ген, который обеспечивает использование конкретного источника азота или углерода, или любой другой ген, функциональность которого необходима для жизнеспособности клеток в выбранных условиях культивирования.
Клетка хозяина предпочтительно выбрана из штаммов E. coli, а более предпочтительно, представлена штаммом E.coli XAC-1.
Согласно конкретному осуществлению изобретения клетка хозяина, используемая в заявленном способе, представляет собой клетку E. coli штамма XAC-1, содержащую ген pir116 в ее геноме и трансформированную плазмидой pXL2774 или одной из ее производных.
Согласно предпочтительному варианту изобретения клетка хозяина, используемая в заявленном способе, представляет собой прокариотическую клетку, в которой инактивирован ген endA1 или гомологичный ему ген. Ген endA кодирует эндонуклеазу I E. coli. Данный фермент периплазмы характеризуется неспецифической активностью по расщеплению двухцепочечной ДНК (Lehman, I. R., G. G. Roussos and E. A. Pratt (1962) J. Biol. Chem. 237: 819-828; Wright M. (1971) J. Bacteriol. 107: 87-94). Исследование, проведенное на различных штаммах Escherichia coli (дикого типа или endA), показало, что деградация плазмидной ДНК, инкубируемой в экстрактах данных бактериальных штаммов, имела место в штаммах endA+, но не в мутантах endA.(Wnendt S. (1994) BioTechniques 17: 270-272). Качество плазмидной ДНК, выделенной из штаммов endA+ или из мутантов endA, исследовано компанией Promega с использованием их системы очистки (Shoenfeld, T., J. Mendez, D. Storts, E. Portman, B. Patterson, J.Frederiksen and C. Smith. 1995. Effects of bacterial strains carrying the endA1 genotype on DNA quality isolated with Wizard plasmid purification systems. Promega notes 53). Заключение, полученное исследователями, было следующим: качество ДНК, полученной из мутантов endA, в целом выше, чем качество ДНК, полученной из тестируемых штаммов endA+.
Качество препаратов плазмидной ДНК, таким образом, подвергается воздействию любой контаминации данной эндонуклеазой (относительно долговременная деградация ДНК).
Делеция или мутация гена endA может рассматриваться без проблем, поскольку мутанты, более не имеющие данной эндонуклеазной активности, в целом остаются подобными бактериям дикого типа (Durwald, H. and H. Hoffmann-Berling (1968) J. Mol. Biol. 34: 331-346).
Ген endA1 может инактивироваться мутацией, общей или частичной делецией, разрушением и т.д. Инактивация гена endA штамма E. coli, выбранного для продукции плазмид pCOR, может, более конкретно, достигаться путем переноса посредством бактериофага P1, делеции::TcR, описанной Черепановым и Вакернагелем (Cherepanov, P. P. and W. Wackernagel. 1995. Gene disruption in Escherichia coli: TcR and KmR cassettes with the option of Flp-catalyzed excision of the antibiotic-resistance determinant. Gene 158: 9-14) или путем обмена аллеля дикого типа, представленного в геноме интересующей бактерии, на мутированный или подвергнутый делеции аллель endA путем гомологичной рекомбинации. Применение данного типа штаммов в контексте настоящего изобретения дает возможность для улучшения качества продуцированной ДНК.
Изобретение также относится к любой рекомбинантной клетке, содержащей определенную выше молекулу ДНК. Она может быть клеткой различного происхождения, эукариотического, прокариотического типа и т.д.
Согласно другому осуществлению изобретения клетка хозяина E. coli XAC-1, используемая в заявленном способе, обозначена TEX1 и содержит ген traD или гомологичный ему ген, инактивированный для предотвращения переноса F'. traD представляет собой 5'-ко