Состав для стабилизации липидов
Иллюстрации
Показать всеИзобретение относится к масложировой промышленности, а именно к способам защиты липидов, масел и жиров от окисления. Состав включает в себя α-токоферол и синергист антиоксиданта. При этом в качестве синергиста антиоксиданта используют амид 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты. Заявленный состав добавляют в количестве 0,04-0,28% от массы липидов. При этом все компоненты взяты при определенном соотношении. Изобретение позволяет снизить скорость процесса окисления липидов в 2-5 раз, а также снизить уровень гидропероксидов, образующихся в процессе окисления липидов на 72,2%. 3 табл.
Реферат
Изобретение относится к области пищевой технологии, а именно к способам защиты липидов, масел, жиров от окисления и окислительной деструкции, и может быть использовано в пищевой, косметической и химико-фармацевтической промышленности для получения стабильных липидосодержащих пищевых добавок (нутрицевтиков), лечебно-косметических средств и лекарственных препаратов.
Для торможения процессов окисления применяют антиоксиданты (ингибиторы окисления), которые находят все более широкое применение для предотвращения окислительных превращений липидов и содержащих их препаратов in vitro, а также in vivo в комплексной терапии широкого круга заболеваний (Герчук М.П. Антиокислители в пищевой промышленности // Журн. Всесоюз. хим. общества им. Д.И.Менделеева. - 1960. - N.4. - С.395-402; Авакумов В.М., Ковлер М.А., Кругликова-Львова Р.П. Лекарственные средства метаболической терапии на основе витаминов и ферментов (Обзор) // Вопросы мед. химии. - 1992. - Т.38. - N.4. - С.14-21; Дурнев А.Д., Середенин С.В. Антиоксиданты как средства защиты генетического аппарата // Хим.-фарм. журн. - 1990. - N.2. - С.92-100). Таким образом, антиоксиданты, присутствующие в лекарственном или косметическом препарате, являются не только действующим началом этих средств, но могут значительно тормозить их окисление в процессе длительного хранения, способствуя сохранению в нативном состоянии легкоокисляемых биологически активных компонентов.
Рекомендуемые курсы назначения нутрицевтиков, пероральных лекарственных средств, липидных препаратов с антиоксидантами достаточно продолжительны (до 30 дней), что определяет особую тщательность в подборе ингибиторов окисления (Дегтярев И.А., Заиков Г.Е. Ионол. Распределение в организме и биологическое действие // Хим.-фарм. журн. - 1985. - N10. - С.1160-1168; Ленинжер А. Основы биохимии. - М. - Мир. - 1985. - Т.1. - С.385/.
Во всем мире ведется целенаправленный скрининг (отбор) полифункциональных стабилизаторов, лекарств антиоксидантного действия, синергических смесей. Использование синергических смесей позволяет получать высокоэффективные композиции и при этом снижать количество антиоксиданта.
Известен состав для стабилизации липидов, включающий следующие компоненты, масса в %:
| α-токоферол (или α-токоферола ацетат) | - 2,4-80,0 |
| бензафлавин | - 2,3-76,9 |
| лецитин | - 8,3-93,8, |
добавляемых в количестве 0,4-5,2% от массы липидов (Патент 2077558 RU, МПК6 С11В 5/00, опубликованный 20.07.1996 г).
Указанный состав тормозит процесс окисления липидов за счет антиоксидантного действия ингибиторов природного происхождения α-токоферола (6-гидрокси-2,5,7,8-тетраметил-2-фитил-хромана, витамина Е), бензафлавина (аналога витамина В2) и лецитина (яичного фосфатидилхолина). В составе указанной композиции бензафлавин и лецитин проявляют по отношению к α-токоферолу или α-токоферола ацетату синергическое действие. Однако практическое применение указанной синергической смеси затруднено в силу многокомпонентности ее состава, отсутствия промышленного производства бензафлавина, дороговизны препаратов, получаемых в экспериментальном производстве.
В связи с этим целесообразен поиск высокоэффективных синергических смесей, способных значительно тормозить окисление жиров, масел, липидов, применяемых в качестве основ фармпрепаратов, пищевых добавок, разнообразной косметической продукции, но более простых по составу и доступных для практического применения.
Задачей заявляемого изобретения является расширение ассортимента эффективных смесей природных и синтетических антиоксидантов, экономия использования дорогостоящих соединений, достижение ингибирующего эффекта меньшим количеством антиоксиданта.
Техническим результатом изобретения является упрощение состава и повышение его ингибирующего эффекта при наименьших концентрациях антиоксидантов.
Указанный технический результат достигается тем, что в составе для стабилизации липидов, включающем α-токоферол и синергист антиоксиданта, особенностью является то, что в качестве синергиста антиоксиданта использован амид 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты при следующих соотношениях компонентов в смеси, масса в %:
| α-токоферол | 29,4-93,8, |
| амид 1-(N-4′-гидроксифенилпропил- | |
| -3,3′,5′-три-трет-бутил)-5-этил | |
| салициловой кислоты | 6,2-70,6, |
добавляемых в количестве 0,04-0,28% от массы липидов.
Отличие заявляемого состава от известного состоит в том, что вместо бензафлавина и лецитина используют амид 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты. Предлагаемое соединение амид 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты было синтезировано в Новосибирском Институте органической химии им. Н.Н.Ворожцова СО РАН с целью расширения ассортимента нетоксичных биологически активных ингибиторов окисления. Соединения не обладают местным и общетоксическим действием, не оказывают влияния на эмбриогенез и развитие потомства.
Предлагаемое соединение амид 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты проявляет активность в реакции с пероксильными радикалами и обладает дополнительно способностью непосредственно взаимодействовать с гидропероксидами, разрушая их без образования свободных радикалов, что не наблюдается в присутствии α-токоферола. Разрушение гидропероксидов под влиянием изучаемого соединения, в свою очередь, является причиной выигрыша в периодах индукции и обеспечения высокой эффективности соединения по сравнению с прототипом.
Дополнительно, производное салициловой кислоты является УФ-стабилизатором (адсорбером). В медицинской практике УФ-адсорберы используются для защиты кожи, особенно внутренних ее слоев. Для этой цели требуется адсорбер, поглощающий УФ-облучение в области 300-350 нм, поскольку считается, что облучение в этой области способно проникать глубоко в ткани организма (Орлова С.В. Энциклопедия биологически активных добавок к пище. М. - 1998. - Т.2. - С.147-148). При этом известно, что облучение УФ-светом эффективно инициирует окислительные превращения. Таким образом, наличие антиоксиданта здесь также необходимо. Предлагаемое производное салициловой кислоты содержит в своей структуре одновременно фрагмент адсорбера и фрагмент антиоксиданта, в качестве последнего может выступать фрагмент пространственно затрудненного фенола. Минимальная токсичность и высокие антиоксидантные и светостабилизирующие свойства позволяют широко использовать изучаемое производное салициловой кислоты в косметической и химико-фармацевтической промышленности для получения стабильных липидосодержащих лечебно-косметических средств и лекарственных препаратов.
Для предлагаемого синтетического антиоксиданта имеет место положительная корреляционная связь между концентрацией и величиной ингибирующего эффекта, что не наблюдается для α-токоферола, указанная зависимость имеет экстремальный характер и при высоких концентрациях антиоксидантное действие α-токоферола сменяется на проантиоксидантное.
Эффективность стабилизаторов оценивалась несколькими независимыми методами (Сторожок Н.М. Межмолекулярные взаимодействия компонентов природных липидов в процессе окисления. Дис. ... д-ра хим. наук. М.: Институт биохимической физики им. Н.М.Эмануэля РАН, 1996. С.360. Цепалов В.Ф., Харитонова А.А., Гладышев Г.П. и др. Определение констант скорости и коэффициентов ингибирования фенолов-антиоксидантов с помощью модельной цепной реакции // Кинетика и катализ. - 1977. - Т.18.- вып.5. - С.1261-1267):
- изучалась кинетика поглощения кислорода при инициированном окислении липидных субстратов различного происхождения в присутствии предлагаемого состава и прототипа;
- тестировалась кинетика накопления первичных продуктов окисления - гидропероксидов методом йодометрического титрования (ПЧ) при аутоокислении липидов при повышенных температурах (60±0,2°С).
Изучение кинетики поглощения кислорода проводилось манометрическим методом в установках типа Варбурга при инициированном окислении липидов в присутствии инициатора азобисизобутиронитрила (АИБН) в концентрации 3 мМ при температуре 60±0,5°С. Контролем служили образцы липидов без добавок антиоксидантов.
В качестве субстратов окисления использовали природные липиды (сиговых рыб) и метиловый эфир олеиновой кислоты (метилолеат). Опытная серия рыбных липидов была наработана на Салехардском рыбоконсервном заводе по методу (Сторожок Н.М., Кутузова И.В. Состав для стабилизации липидов. Патент 2077552, RU, опубл. в БИ №11. - 1997 г.). Изучение жирно-кислотного состава липидов позволило установить присутствие значительного количества полиненасыщенных жирных кислот (до 37%), в том числе пента- и гексаенов до 12% и 2% соответственно (Ушкалова В.Н., Артамонова Н.А., Сторожок Н.М., Горяев М.И. Жирнокислотный состав общих и нейтральных липидов сиговых Обского бассейна. // Химия природ, соединен. - 1981. - №5. - С.555-558).
Эффективность индивидуальных компонентов и их комбинаций исследовалась в широком диапазоне концентраций и соотношений компонентов:
| α-токоферол | 0,10-8,0 мМ, |
| амид 1-(N-4′-гидроксифенилпропил- | |
| -3,3′,5′-три-трет-бутил)-5-этил | |
| салициловой кислоты | 0,05-1,50 мМ, |
добавляемых в количестве 0,02-1,29% от массы липидов.
В присутствии определенной добавки ингибиторов окисления α-токоферола, амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты, смеси α-токоферола и амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты, а также прототипа записывалась кинетика окисления с использованием вышеописанных методов. На основании полученных данных строились кинетические кривые поглощения кислорода (О2, мм3) либо накопления пероксидов (г I2/100 г липида).
Из кинетических кривых определялись периоды индукции (τ), за которые принимали:
- время (в мин), за которое процесс инициированного окисления липидов достигал максимальной скорости (τинд);
- время (в часах) накопления пероксидов, количественно соответствующих значению ПЧ 0,1% I2.
Эффективность совместного ингибирующего действия смеси количественно характеризовали абсолютным значением разности (Δτ) периодов индукции окисления метилолеата (МО) в присутствии композиции антиоксидантов (АО) (τΣ) и простой суммы индивидуальных компонентов (Στi) (аддитивное действие) (Δτ=ΔΣ-Στ;), либо выражали в относительных единицах - (Δτ/Στi)Ч100%. Выполнение неравенства τΣ>Στi - свидетельствовало о проявлении синергизма в совместном действии компонентов, а τΣ<Στi - об эффекте антагонизма.
Критерием антиоксидантного действия служили начальная (Wo2нач×10-7, М×с-1) и максимальная (Wo2max×10-7, М×с-1) скорости процесса окисления в присутствии и в отсутствие антиоксиданта. Эффективность стабилизации окисления определяли также по величине Wo2max(MO)/Wo2max(MO+АО), количественно характеризующей степень уменьшения скорости поглощения кислорода в присутствии метилолеата (МО) и метилолеата с добавками антиоксидантов (МО+АО).
Было установлено, что зависимость изменения периодов индукции для индивидуального α-токоферола носит экстремальный характер. Диапазон эффективных концентраций расположен в области (0,25-8,00) мМ, что соответствует (0,03-1,08)% от массы липидов, максимум указанной зависимости определялся при концентрации 2,5 мМ (0,34% от массы липидов). Зависимости изменения величины периодов индукции от концентрации амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты в системе окисления носили линейный характер, указанное соединение в смеси с α-токоферолом проявляло синергическое действие, превосходящее по своему ингибирующему действию прототип.
Изучение ингибирующего действия смесей α-токоферола с амидом 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты с постоянными концентрациями α-токоферола показало, что зависимость периодов индукции от концентрации амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты также носит экстремальный характер с максимумом в области 4×10-4 моль/л (0,05% от массы липидов). Диапазон эффективных концентраций соответствовал (1,0-6,0)×10-4 моль/л, что составляет (0,01-0,08)% от массы липидов. Диапазон эффективных концентраций смесей α-токоферола с амидом 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты с постоянными концентрациями амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты соответствовал (2,5-15,0)×10-4 моль/л, что составляет (0,03-0,20)% от массы липидов.
В связи с этим с целью отбора наиболее эффективных синергических смесей более подробно изучались двухкомпонентные составы, включающие α-токоферол и амид 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты, при этом концентрации каждого из компонентов смеси выбирались из указанной области наибольшей эффективности смесей.
Диапазоны изменения концентрации каждого из компонентов, составляющих в целом наиболее высокоэффективные смеси, представлены следующими значениями, масса в %:
| α-токоферол | 29,4-93,8 |
| амид 1-(N-4′-гидроксифенилпропил- | |
| -3,3′,5′-три-трет-бутил)-5-этил | |
| салициловой кислоты | 6,2-70,6, |
добавляемых в количестве 0,04-0,28% от массы липидов.
Сущность изобретения иллюстрируется следующими примерами:
ПРИМЕР 1
Берут 10 г (точная навеска) эфиров ненасыщенных высших жирных кислот, например метилолеата или метиллинолеата, и добавляют 0,0044 г (0,04%) смеси α-токоферола с амид 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты. Стабилизирующая комбинация содержит 0,0034 г α-токоферола, 0,0010 г амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты, что составляет соответственно 0,03% и 0,01% от массы липидов. При этом соотношение компонентов стабилизирующей смеси следующее, масса в %:
| α-токоферол | 71,4 |
| амид 1-(N-4′-гидроксифенилпропил- | |
| -3,3′,5′-три-трет-бутил)-5-этил | |
| салициловой кислоты | 28,6 |
ПРИМЕР 2
Берут 10 г (точная навеска) эфиров ненасыщенных высших жирных кислот, например метилолеата или метиллинолеата, и добавляют 0,0064 г (0,06%) смеси α-токоферола с амидом 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты. Стабилизирующая комбинация содержит 0,0034 г α-токоферола, 0,0030 г амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты, что составляет соответственно 0,03% и 0,03% от массы липидов. При этом соотношение компонентов стабилизирующей смеси следующее, масса в %:
| α-токоферол | 55,6 |
| амид 1-(N-4′-гидроксифенилпропил- | |
| -3,3′,5′-три-трет-бутил)-5-этил | |
| салициловой кислоты | 44,4 |
ПРИМЕР 3
Берут 10 г (точная навеска) эфиров ненасыщенных высших жирных кислот, например метилолеата или метиллинолеата, и добавляют 0,0078 г (0,08%) смеси α-токоферола с амидом 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты. Стабилизирующая комбинация содержит 0,0068 г α-токоферола, 0,0010 г амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты, что составляет соответственно 0,07% и 0,01% от массы липидов. При этом соотношение компонентов стабилизирующей смеси следующее, масса в %:
| α-токоферол | 83,3 |
| амид 1-(N-4′-гидроксифенилпропил- | |
| -3,3′,5′-три-трет-бутил)-5-этил | |
| салициловой кислоты | 16,7 |
ПРИМЕР 4
Берут 10 г (точная навеска) эфиров ненасыщенных высших жирных кислот, например метилолеата или метиллинолеата, и добавляют 0,0110 г (0,11%) смеси α-токоферола с амидом 1-(N-4′-гидроксифенилпропил--3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты. Стабилизирующая комбинация содержит 0,0100 г α-токоферола, 0,0010 г амида 1-(N-4′-гидроксифенилпропил--3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты, что составляет соответственно 0,10% и 0,01% от массы липидов. При этом соотношение компонентов стабилизирующей смеси следующее, масса в %:
| α-токоферол | 88,2 |
| амид 1-(N-4′-гидроксифенилпропил- | |
| -3,3′,5′-три-трет-бутил)-5-этил | |
| салициловой кислоты | 11,8 |
ПРИМЕР 5
Берут 10 г (точная навеска) эфиров ненасыщенных высших жирных кислот, например метилолеата или метиллинолеата, и добавляют 0,0150 г (0,15%) смеси α-токоферола с амидом 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты. Стабилизирующая комбинация содержит 0,0140 г α-токоферола, 0,0010 г амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты, что составляет соответственно 0,14% и 0,01% от массы липидов. При этом соотношение компонентов стабилизирующей смеси следующее, масса в %:
| α-токоферол | 90,9 |
| амид 1-(N-4′-гидроксифенилпропил- | |
| -3,3′,5′-три-трет-бутил)-5-этил | |
| салициловой кислоты | 9,1 |
ПРИМЕР 6
Берут 10 г (точная навеска) эфиров ненасыщенных высших жирных кислот, например метилолеата или метиллинолеата, и добавляют 0,0170 г (0,17%) смеси α-токоферола с амидом 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты. Стабилизирующая комбинация содержит 0,0140 г α-токоферола, 0,0030 г амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты, что составляет соответственно 0,14% и 0,03% от массы липидов. При этом соотношение компонентов стабилизирующей смеси следующее, масса в %:
| α-токоферол | 83,3 |
| амид 1-(N-4′-гидроксифенилпропил- | |
| -3,3′,5′-три-трет-бутил)-5-этил | |
| салициловой кислоты | 16,7 |
Эффективность ингибирующего действия смесей указанных выше веществ оценивали на основании данных кинетики поглощения кислорода, получаемых с использованием манометрического метода, подробно изложенного в описании изобретения.
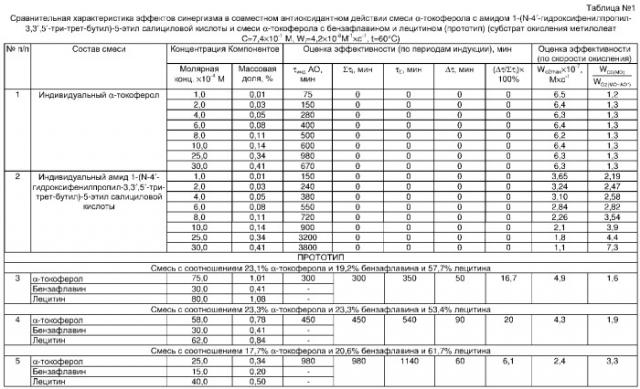
Полученные результаты приведены в табл.1. Из данных табл.1 видно, что все рекомендуемые сочетания ингибиторов окисления превосходят по величине эффективности прототип. Наибольшую эффективность по сравнению с прототипом проявляет смесь (пример 6), включающая 83,3% α-токоферола и 16,7% амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты, добавляемая в концентрации 0,14% и 0,03% соответственно от массы липидов, максимально достигаемый ингибирующий эффект составляет 1370 мин, соотношение компонентов смеси 5:1, при этом эффект синергизма составляет 66,3%.
Было установлено, что эффективность синергизма при совместном использовании α-токоферола и амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты в разных субстратах составляет от (20-75)%, тогда как для прототипа эффективность смесей изменялась в пределах (16-20)% (табл.1).
Из сравнения ингибирующего действия исследуемых смесей видно, что абсолютная величина периодов индукции смеси, включающей 83,3% α-токоферола и 16,7% амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты, добавляемых в количестве 0,14% и 0,03% от массы липидов соответственно, выше при окислении метилолеата (1370 мин), чем при окислении рыбных липидов (280 мин). Однако сравнение для указанной смеси величин Δτ/Στi, в %, полученных при окислении разных субстратов показывает, что этот показатель выше при ингибировании рыбных липидов нежели метилолеата (соответственно 63,1% и 75,0%). Эти данные объясняются более высокой степенью не насыщенности входящих в состав рыбных липидов высших жирных кислот (Ушкалова В.Н., Артамонова Н.А., Сторожок Н.М., Горяев М.И. Жирнокислотный состав общих и нейтральных липидов сиговых Обского бассейна // Химия природ. соединен. - 1981. - №5. - С.555-558), следовательно, и более высокой их окисляемостью. Введение рекомендуемой концентрации исследуемых соединений воссоздает антиоксидантную систему и обеспечивает эффективную защиту липидов от окисления. Более высокая ингибирующая способность указанной выше смеси по сравнению с прототипом была доказана несколькими независимыми методами (приведенными выше) (табл.1, 2, 3).
Установлен наиболее эффективный диапазон концентраций антиоксидантов, масса в %:
| α-токоферол | 29,4-93,8 |
| амид 1-(N-4′-гидроксифенилпропил- | |
| -3,3′,5′-три-трет-бутил)-5-этил | |
| салициловой кислоты | 6,2-70,6 |
добавляемых в количестве 0,04-0,28% от массы липидов.
При изучении кинетики накопления гидропероксидов было показано, что в опытах с концентрацией 83,3% α-токоферола и 16,7% амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты в концентрации 0,14% и 0,03% от массы липидов соответственно, процент разрушения гидропероксидов составляет 72,2%, что не наблюдается в присутствии прототипа (табл.3).
Причинно-следственная связь между существенными признаками изобретения и достижением технического результата следующая. Полученные впервые эффекты ингибирования синергической смесью α-токоферола и амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты могут быть объяснены исходя из представлений о механизме антиоксидантного действия. Установлено, что оба компонента смеси воздействуют на сложный многостадийный процесс окисления по различным механизмам.
Так, в соответствии с литературными данными, α-токоферол проявляет чрезвычайно высокую активность только в реакции с пероксильными радикалами (RO2•), ведущими процесс окисления. Константа скорости реакции а-токоферола с RO2• (реакции 7 согласно классической схемы) составляет 3,60×106 М-1×с-1 (Сторожок Н.М., Храпова Н.Г., Бурлакова Е.Б. Исследование межмолекулярных взаимодействий компонентов природных липидов в процессе окисления // Химическая кинетика. - 1995. - т.14. - №11. - С.29-46. Бурлакова Е.Б., Крашаков С.А., Храпова Н.Г. Роль токоферола в пероксидном окислении липидов биомембран // Биологические мембраны. - 1998. - т.15. - №2. - С.137-168).
Таким образом, соединение амид 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты проявляет активность в реакции с пероксильными радикалами с константой скорости реакции К7=0,85×10 М-1×с-1, снижает скорость процесса окисления липидов в смеси с α-токоферолом в 2-5 раз, а также дополнительно снижает уровень гидропероксидов, образующихся в процессе окисления липидов, на 72,2% (табл.3). Разрушение гидропероксидов под влиянием смеси заявляемого соединения, в свою очередь, является причиной выигрыша в периодах индукции и обеспечения высокой эффективности.
Предлагаемый состав, включающий α-токоферол и амид 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты, достигает эффекта ингибирования окисления липидов при низких концентрациях компонентов смеси по сравнению с прототипом. Сочетание в одной композиции ингибиторов, действующих на разные элементарные реакции сложного окислительного процесса, а также присутствие эффекта синергизма антиоксидантов, позволяет увеличить ингибирующую способность смеси и эффективно тормозить окисление полиненасыщенных субстратов.
| Таблица 3 | ||||||
| Величины начальной, максимальной скоростей поглощения кислорода при инициированном окислении метилолеата (МО), разрушения гидропероксидов при аутоокислении линолевой кислоты (ЛК) (Cсубстрата=7,4×10-1 M) в присутствии смеси антиоксидантов (АО) и прототипа t=60°С, р≤0,05 | ||||||
| № п/п | Состав | Инициированное окисление, Wi=4,2×10-8 M-1 Ч c-1 | Аутоокисление ЛК | Процент разрушения ROOH за 7 часов | ||
| Wo2нач×10-7 М-1с | Wo2max×10-7 M-1с | Wнакопления ROOH.× 10-4 г 12/100 г лип.* × с-1 | Wразрушения ROOH×10-4 г 12/100 г лип.* × с-1 | |||
| 1 | МО (контроль) | 1,9 | 8,0 | 5,5 | - | - |
| 2 | МО + Смесь с соотношением 83,3% α-токоферола (1,0 мМ)и 16,7% амида 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты (0,2 мМ) | 0,5 | 2,4 | - | 3,5 | 72,2 |
| 3 | МО + Смесь с соотношением 17,7% α-токоферола (2,5 мМ) и 20,6% бензафлавина (1,5 мМ) и 61,7% лецитина (4,0 мМ) | 0,7 | 2,4 | - | - | - |
| * - липиды |
Состав для стабилизации липидов, включающий α-токоферол и синергист антиоксиданта, отличающийся тем, что в качестве синергиста антиоксиданта использован амид 1-(N-4′-гидроксифенилпропил-3,3′,5′-три-трет-бутил)-5-этил салициловой кислоты при следующих соотношениях компонентов в смеси, мас.%:
| α-токоферол | 29,4-93,8 |
| амид 1-(N-4′-гидроксифенилпропил- | |
| 3,3′,5′-три-трет-бутил)-5-этил | |
| салициловой кислоты | 6,2-70,6 |
добавляемых в количестве 0,04-0,28% от массы липидов.