Уменьшение объема ткани
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к пульмонологии, и может быть использовано при заболеваниях легких, требующих уменьшения объема поврежденной ткани легкого или герметизации его в случае спонтанного пневмоторакса. Для этого через бронхоскоп, подведенный к участку-мишени, по катетеру вводят определенный материал. Количество и природа материала должны быть достаточными для стимуляции адгезии между одной спавшейся частью участка-мишени легкого и другой и фиброза участка-мишени легкого или вокруг участка-мишени легкого, в котором произошел коллапс. Данный материал на основе фармацевтических композиций содержит в своем составе полипептидный фактор роста, компонент внеклеточного матрикса, вазоактивное вещество, про-апоптотический агент. При этом композиции дополнительно включают фибриноген или мономер фибрина, или активатор фибриногена. Изобретение позволяет достичь направленной стимуляции адгезии участка-мишени, фиброза самого участка-мишени или вокруг участка, в котором возник коллапс, что обеспечивает повышение эффективности лечения таких заболеваний легких. 8 н. и 62 з.п. ф-лы, 14 ил., 4 табл.
Реферат
Предпосылки изобретения
Областью данного изобретения являются репарация и уменьшение объема ткани, например, репарация и уменьшение объема легких.
Конечная стадия эмфиземы может лечиться хирургией для уменьшения объема ткани (LVRS) (см., например. Cooper et al., J. Thorac. Cardiovasc. Surg. 109:106-116, 1995). Хотя кажется противоречащим здравому смыслу, что дыхательная функция могла бы быть улучшена удалением части легкого, иссечение перерастянувшейся ткани (что наблюдается в пациентах с гетерогенной эмфиземой) позволяет соседним участкам легкого, которые являются более нормальными, расширяться (увеличиваться в размерах). В свою очередь, это расширение делает возможными улучшенную эластическую тягу и улучшенный газообмен легкого. Даже пациенты с гомогенной эмфиземой легкого получают пользу от LVRS, поскольку резекция отклоняющегося от нормы легкого приводит к общему уменьшению в объемах легких, увеличению давлений эластической тяги и смещению к норме кривой статической эластичности (ткани без нагрузки) (Hoppin, Am. J. Resp.Crit. Care Med. 155:520-525, 1997).
Хотя многие пациенты, которые были подвергнуты LVRS, испытывают значительное улучшение (Cooper et al., J. Thorac. Cardiovasc. Surg. 112:1319-1329, 1996), они подвергаются значительному риску. LVRS проводят хирургическим удалением части больного легкого, доступ к которому осуществлялся введением торакоскопа через грудную стенку или посредством более радикального разреза вдоль грудины (Katloff et al., Chest 110:1399-1406, 1996). Таким образом, получение доступа к легкому является травматическим, и последующие процедуры, которые могут включать в себя использование сшивающего аппарата (ушивателя) хрупкой ткани легкого, могут вызывать серьезные послеоперационные осложнения.
Сущность изобретения
Данное изобретение описывает устройства, композиции и способы для репарации ткани и для достижения нехирургического уменьшения объема ткани (например, легкого). В одном аспекте, эти способы проводят на ткани легкого с использованием бронхоскопа. Этот способ полностью исключает необходимость хирургического вмешательства, так как он делает возможной выполнение процедуры уменьшения ткани через трахею и более мелкие дыхательные пути пациента. В этом подходе бронхоскопическое уменьшение объема легкого (BLVR) выполняют спадением (коллапсом) участка легкого, плотным прикреплением одной части спавшегося участка с другой и стимуляцией фиброза в прикрепленной ткани. Композицией, используемой для достижения коллапса легкого, может быть, но необязательно, та же самая композиция, которую используют для образования адгезий (слипаний) в этой ткани. Предпочтительные варианты могут включать в себя один или более следующих признаков.
Имеются многочисленные пути для индуцирования коллапса легкого. Например, материал, который увеличивает поверхностное натяжение жидкостей, выстилающих альвеолы (т.е. материал, который может действовать как антисурфактант), может быть введен через бронхоскоп (предпочтительно через катетер, находящийся внутри бронхоскопа). Этот материал может включать в себя фибриноген, фибрин или их биологически активные фрагменты. Коллапс легкого может быть также индуцирован блокированием потока воздуха в участок или из участка легкого, который намечен для коллапса. Это достигается введением баллонного катетера через бронхоскоп и раздуванием этого баллона таким образом, что он закупоривает бронх или бронхиолу, в которые он был помещен. Перед индуцированием коллапса легкого легкое может быть наполнено кислородом, так чтобы сохранившийся газ мог быть абсорбирован в кровь.
Подобным образом, имеются многочисленные способы для стимуляции адгезий между одной частью спавшегося легкого и другой. Если в качестве антисурфактанта выбран фибриноген, адгезию активируют подверганием фибриногена действию активатора фибриногена, такого как тромбин, который расщепляет фибриноген и полимеризует образующийся фибрин. Другие вещества, в том числе агонисты рецептора тромбина и батроксобин, могут быть также использованы для активации фибриногена. Если в качестве антисурфактанта выбран фибрин, нет необходимости введения дополнительного вещества или соединения; фибрин может полимеризоваться спонтанно, прикрепляя посредством этого одну часть спавшейся ткани к другой.
Фиброз активируется обеспечением одного или более полипептидных факторов роста вместе с одним или более антисурфактантами или активаторными веществами, описанными выше. Факторы роста могут быть выбраны из семейства факторов роста фибробластов (FGF) или могут быть полипептидами, подобными трансформирующему фактору роста бета (TGFβ).
Композиции, описанные выше, могут также содержать один или более антибиотиков для содействия профилактике инфекции. Альтернативно или в дополнение, могут быть использованы другие пути для введения антибиотика (например, они могут вводиться перорально или внутримышечно).
Другие аспекты данного изобретения включают в себя композиции, описанные выше, для стимуляции коллапса и/или адгезии, а также устройства для введения композиции в тело. Например, в одном аспекте, данное изобретение описывает физиологически приемлемые композиции, которые включают в себя полипептидный фактор роста или его биологически активный фрагмент (например, тромбоцитарный фактор роста, фибробластный фактор роста (FGF) или полипептид, подобный трансформирующему фактору роста бета) и фибриноген или мономер фибрина (например, мономер фибрина I, мономер фибрина II, мономер фибрина des BB, или их любую смесь или комбинацию) или активатор фибриногена (например, тромбин). Фибриноген, мономеры фибрина и активаторы фибриногена, применимые в BLVR, могут быть биологически активными мутантами (например, фрагментами) этих полипептидов.
В другом аспекте данное изобретение описывает устройства для проведения нехирургического уменьшения объема легкого. Например, данное изобретение описывает устройство, которое включает в себя бронхоскоп, имеющий рабочий канал, и катетер, который может быть вставлен в этот рабочий канал. Катетер может содержать множественные просветы и может включать в себя раздуваемый баллон. Другое устройство для выполнения уменьшения объема легкого включает в себя катетер, имеющий множество просветов (например, два или более), и контейнер для материала, имеющий множество камер (например, две или более), причем камеры контейнера могут соединяться с просветами этого катетера. Эти устройства могут также включать в себя инъектор для облегчения перемещения материала из контейнера в катетер.
BLVR имеет несколько преимуществ над стандартным хирургическим уменьшением объема легкого (LVRS). BLVR должно снижать болезненность и смертность, которые, как известно, связаны с LVRS (Swanson et al., J. Am. Coil. Surg. 185:25-32, 1997). Предсердные аритмии и пролонгированные утечки воздуха, которые являются наиболее часто сообщаемыми осложнениями LVRS, являются менее вероятно встречающимися в случае BLVR, поскольку BLVR не требует использования сшивающего устройства (ушивателя) хрупкой легочной ткани или хирургических манипуляций, которые раздражают перикард. BLVR может быть также значительно менее дорогостоящим, чем LVRS, которая в настоящее время стоит между приблизительно 18000 и 26000 долларов США для одного применения. Экономия могла бы быть значительной, поскольку известно, что эмфизема поражает два - шесть миллионов пациентов только в Америке. Кроме того, некоторые пациенты, которые не могли бы быть кандидатами для LVRS (например, вследствие их преклонного возраста), могут подвергаться BLVR. Кроме того, в случае необходимости, BLVR предоставляет пациентам возможность подвергаться более, чем одной процедуре уменьшения объема легкого. Хотя повторяемое хирургическое вмешательство не является обязательным предметом выбора (вследствие плевральных спаек, которые образуются после первоначальной процедуры), подобные недостатки не должны существовать для пациентов, которые были подвергнуты BLVR.
Другие признаки и преимущества данного изобретения будут очевидными из следующего подробного описания и из формулы изобретения.
Краткое описание чертежей
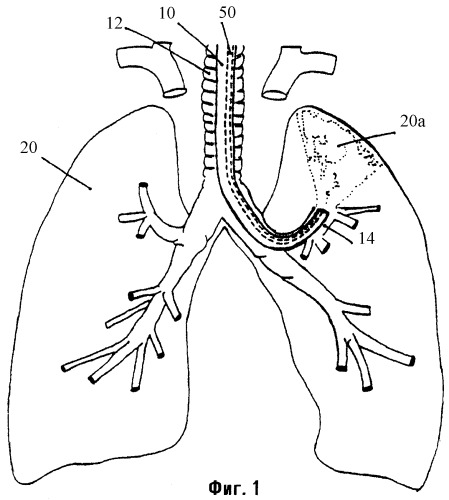
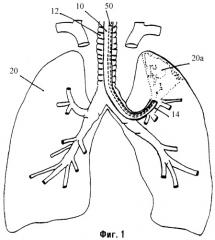
Фиг.1 является схематическим представлением BLVR.
Фиг.2а иллюстрирует катетер, который может быть введен через бронхоскоп.
Фиг.2b является видом в поперечном разрезе через стержень катетера, иллюстрируемого на фиг.2а.
Фиг.2с иллюстрирует картридж, который может быть присоединен к катетеру, иллюстрируемому на фиг.2а.
Фиг.2d иллюстрирует инъектор, который может быть использован для выталкивания материала из картриджа, иллюстрируемого на фиг.2с.
Фиг.2е иллюстрирует катетер фиг.2а, собранный в одно целое с картриджем фиг.2с, инъектором фиг.2d и имеющий защелку Люэра, заполненный воздухом шприц.
Фиг.3а и 3b являются графиками, изображающими поверхностное натяжение в зависимости от площади поверхности пленок сурфактанта из контрольной морской свинки (фиг.3а) и морской свинки, подвергнутой действию LPS (фиг.3b).
Фиг.4а и 4b являются диаграммами в виде столбцов, изображающими параметр стабильности поверхностных пленок (Gy/dA)1(А/у) в виде функции концентрации белок/липид для смесей сурфактантов фибриногена и альбумина.
Фиг.5а и 5b являются диаграммами в виде столбцов, изображающими динамическую (фиг.5а) и квазистатическую (фиг.5b) эластичность, спустя 3 месяца после того, как овцы были подвергнуты действию папаина, n=6.
Фиг.6а и 6b являются графиками, изображающими зависимость между физиологией (Cdyn, в виде % от фона, показан на фиг.6а, a rl, также в виде % от фона, показан на фиг.6b) и оценкой тяжести эмфиземы.
Фиг.7 является графиком, иллюстрирующим статическую эластичность легкого (объем в литрах в зависимости от Ptp в см Н2О) при базовой линии (фоне) (т.е. перед началом лечения) и при шести неделях после терапии папаином у овец.
Фиг.8а и 8b являются диаграммами в виде столбцов, суммирующими модули упругости полосок геля, содержащих компоненты ЕСМ (фиг.8а), и скорости полимеризации геля (фиг.8b).
Фиг.9 является линейным графиком процентного напряжения в зависимости от циклов до разрушения для полосок геля, состоящих только из фибрина или из смеси фибрин + ПЛЛ + ХС.
Фиг.10а и 10b являются диаграммами в виде столбцов пролиферации фибробластов человека на фибриновых гелях, содержащих компоненты ЕСМ.
Фиг.11 является диаграммой в виде столбцов, изображающей действия модифицированных промывочных растворов и клеев на физиологию легкого в овцах.
Фиг.12а и 12b являются линейными графиками, показывающими зависимости между квазистатическими давлением и объемом для овцы, обработанной 4×10 мл промывочного раствора для субсегментов легкого плюс фибриновый клей (результаты после двух недель показаны на фиг.12а), и овцы, обработанной промывочным раствором, содержащим компоненты ЕСМ (фиг.12b).
Фиг.13а, 13b и 13с являются схемами катетерной системы с двумя просветами.
Фиг.14а м 14b являются схемами катетерной системы, которая может быть использована для закрытия бронхоплевральных фистул.
Подробное описание изобретения
Устройства, композиции и способы, описанные здесь, могут быть использованы для репарации повреждений тканей или утечек в тканях, таких как легкое, которые могут быть вызваны травмой, заболеванием или хирургическими процедурами, а также для уменьшения объема ткани, которой присуще свойство спадания (коллапса). Например, объем легкого может быть уменьшен с использованием бронхоскопа (бронхоскопическое уменьшение объема легкого называют здесь в виде аббревиатуры BLVR). Как видно на фиг.1, гибкий бронхоскоп 10 вводят через трахею 12 пациента в участок-мишень 20а легкого 20, и баллонный катетер 50 с дистальным отверстием (портом) 60 просвета (фиг.2) вводят через канал в бронхоскопе. Участок-мишень 20а будет спадаться либо когда воздушный проход 14 к участку-мишени 20а является закупоренным, либо когда антисурфактант вводят через баллонный катетер 50 к участку-мишени 20а. Независимо от причины коллапса одна часть спавшегося участка-мишени будет слипаться с другой при воздействии одной или более композиций, описанных ниже. Эти композиции включают в себя вещества, которые могут полимеризоваться либо спонтанно (например, фибрин), либо в ответ на активатор (например, фибриноген). Кроме того, одна или более композиций содержат полипептидный фактор роста, который стимулирует фиброз, и может содержать антибиотик для содействия профилактике инфекции или дополнительный фактор (такой как трансглутаминаза фактора XI На) для активации полимеризации. После применения этой композиции (композиций) бронхоскоп удаляют.
Пациенты, которые имеют хроническую обструктивную болезнь легкого, могут получать пользу от BLVR. Эти пациенты включают в себя, но не ограничиваются ими, пациентов, которые имеют эмфизему, хроническую астму, хронический бронхит и бронхоэктаз. BLVR может также выполняться, когда легкое пациента повреждено травмой или в случае спонтанного пневмоторакса. Хотя композиции данного изобретения (которые могут называться далее различно: растворами, клеями и гелями) могут применяться с новыми устройствами данного изобретения, они могут также применяться независимо. Например, эти композиции могут применяться во время хирургического LVR или во время любой хирургической процедуры, которая ставит пациента в положение риска повреждения легкого, других тканей в дыхательных путях, других органов или других систем органов. Некоторые из этих применений для композиций данного изобретения описаны более конкретно под заголовком "Другие варианты".
Идентификация участка-мишени и получение доступа к участку-мишени легкого
Как только пациент определен в качестве кандидата для BLVR, участок-мишень 20а легкого может быть идентифицирован с использованием радиологических исследований (например, рентгена грудной клетки) и сканограмм компьютерной томографии. Когда эта процедура выполнена, пациента анестезируют и интубируют, и он может быть помещен на абсорбируемый газ (например, по меньшей мере 90% кислород и до 100% кислорода) на определенный период времени (например, на приблизительно 30 минут). Участок (участки) легкого, который был сначала идентифицирован радиологически, затем идентифицируют бронхоскопически.
Подходящие бронхоскопы включают в себя бронхоскопы, изготавливаемые Pentax, Olympus и Fujinon, которые позволяют визуализировать освещенное поле. Врач направляет бронхоскоп 10 в трахею 12 и через бронхиальное дерево таким образом, что открытый кончик 60 бронхоскопа 10 располагается у входа в участок-мишень 20а (т.е. в участок легкого, который должен быть уменьшен в объеме). Бронхоскоп 10 может направляться через прогрессивно сужающиеся ветви бронхиального дерева для достижения различных субсегментов любого легкого 20. Например, как показано на фиг.1, бронхоскоп может быть направлен к субсегменту в нижней доле левого легкого пациента.
Баллонный катетер 50, упомянутый выше (и описанный более полно ниже), направляют затем через бронхоскоп 10 к участку-мишени 20а легкого 20. Когда катетер 50 расположен в бронхоскопе 10, баллон 58 раздувают таким образом, что материал, проходящий через катетер, будет содержаться в участках легкого, дистальных относительно баллона. Участок-мишень может быть подвергнут лаважу (промыванию) солевым раствором для уменьшения количества сурфактанта, который природно присутствует, и физиологически совместимую композицию, содержащую антисурфактант (т.е. агент, который увеличивает поверхностное натяжение жидкостей, выстилающих альвеолы), наносят в участок-мишень легкого через этот катетер. Предпочтительно, эту композицию готовят в виде раствора или суспензии, и она включает в себя фибрин или фибриноген. Преимущество введения этих веществ заключается в том, что каждое из них не только может действовать как антисурфактант, но и может участвовать также в адгезивном процессе.
Растворы на основе фибриногена
Фибриноген может функционировать в качестве антисурфактанта, так как он увеличивает поверхностное натяжение жидкостей, выстилающих альвеолы, и он может функционировать в качестве герметика или адгезива, так как он может участвовать в каскаде коагуляции, в котором он превращается в мономер фибрина, который затем полимеризуется и перекрестно сшивается с образованием стабильной сетки. Фибриноген, который был также назван фактором I, представляет приблизительно 2-4 г/л белка плазмы крови и является мономером, который состоит из трех пар связанных дисульфидными связями полипептидных цепей, названных (Aα)2, (Вβ)2 и γ2. Цепи "А" и "В" представляют два небольших N-концевых пептида и известны так же как фибринопептиды А и В, соответственно. Расщепление фибриногена тромбином приводит к получению соединения, называемого фибрином I, а последующее расщепление фибринопептида В приводит к получению фибрина II. Хотя эти расщепления уменьшают лишь незначительно молекулярную массу фибриногена, они тем не менее обнажают сайты полимеризации. В процессе нормального образования сгустков этот каскад инициируется, когда фибриноген подвергается действию тромбина, и этот процесс может точно копироваться в связи с уменьшением объема легкого, когда фибриноген подвергается действию активатора, такого как тромбин, или агониста рецептора тромбина, в водном растворе, содержащем кальций (например, 1,5-5,0 мМ кальций).
Фибриногенсодержащая композиция может включать в себя 3-12% фибриногена и предпочтительно включает в себя приблизительно 10% фибриноген в солевом растворе (например, 0,9% солевом растворе) или другом физиологически приемлемом водном растворе. Объем вводимого антисурфактанта будет варьироваться в зависимости от размера участка легкого, оцененного из просмотра сканов компьютерной томографии грудной клетки. Например, участок-мишень может быть промыт 10-100 мл (например, 50 мл) раствора фибриногена (10 мг/мл). Для облегчения коллапса легкого участок-мишень может быть подвергнут действию (например, ополоснут или подвергнут лаважу) неполимеризованного раствора фибриногена и затем подвергнут действию второго раствора фибриногена, который затем полимеризуют с активатором фибриногена (например, тромбином или агонистом рецептора тромбина).
Антисурфактант может содержать фибриноген, который был получен из пациента перед началом нехирургической процедуры уменьшения легкого (т.е. антисурфактантная или адгезивная композиция может включать в себя аутологичный фибриноген). Применение аутологичного вещества является предпочтительным, так как это уменьшает риск, что пациент будет заражен какой-либо формой гепатита (например, гепатита В или гепатита не А, не В), синдромом приобретенного иммунодефицита (СПИДа) или другой передаваемой кровью инфекцией. Этими инфекциями можно, более вероятно, заразиться, когда фибриногеновый компонент экстрагируют из объединенной плазмы человека (см., например, Silberstein et al., Transfusion 28:319-321, 1988). Фибриноген человека является коммерчески доступным через поставщиков, известных специалистам в данной области, или может быть получен из банков крови или подобных депозитариев.
Полимеризация антисурфактантов на основе фибриногена может быть получена добавлением активатора фибриногена. Эти активаторы известны в данной области и включают в себя тромбин, батроксобин (такой как батроксобин из В. Moojeni, В. Maranhao, В. atrox, В. Ancrod или A. Rhodostoma) и агонисты рецептора тромбина. При объединении фибриноген и активаторы фибриногена реагируют подобно реакции в конечных стадиях природного процесса свертывания крови, с образованием фибринового матрикса. Более конкретно, полимеризация может быть достигнута добавлением тромбина (например, 1-10 единиц тромбина на нг фибриногена). Если желательно, 1-5% (например, 3%) трансглутаминаза фактора XI На может быть добавлена для стимуляции перекрестного сшивания.
Кроме того, для усиления фиброза (или образования рубцов) в месте, где один участок спавшегося легкого прилипает к другому, одна или более композиций, применяемых для получения уменьшения объема легкого (например, композиция, содержащая фибриноген), может содержать полипептидный фактор роста. Могут быть включены многочисленные факторы роста. Предпочтительными являются тромбоцитарный фактор роста (PDGF) и факторы роста из семейств фибробластных факторов роста и трансформирующих факторов роста бета.
Например, полипептидым фактором роста, включенным в композицию, вводимую для уменьшения объема легкого (например, описанные здесь композиции на основе фибриногена, активатора фибриногена или фибрина), может быть основной FGF (bFGF), кислый FGF (aFGF), генный продукт hst/Kfgf, FGF-5, FGF-10 или int-2. Номенклатура в области полипептидных факторов роста является сложной, прежде всего потому, что многие факторы были выделены независимо разными исследователями и, исторически, названы по типу ткани, используемой в качестве теста во время очистки данного фактора. Эта сложность иллюстрируется основным FGF, который называли, по меньшей мере, 23 различными названиями (в том числе лейкозный фактор роста, макрофагальный фактор роста, полученный из почек эмбриона фактор ангиогенеза 2, фактор роста предстательной железы, астроглиальный фактор роста 2, эндотелиальный фактор роста, фактор ангиогенеза опухолей, фактор роста гепатомы, фактор роста хондросаркомы, полученный из хряща фактор роста 1, полученный из глаз фактор роста 1, гепаринсвязывающие факторы роста класса II, миогенный фактор роста, фактор, очищенный из плаценты человека, полученный из матки фактор роста, фактор роста, полученный из эмбрионального рака, фактор роста гипофиза человека, полученный из гипофиза фактор роста хондроцитов, фактор роста адипоцитов, остеобластный фактор предстательной железы и полученный из опухоли молочной железы фактор). Таким образом, любой фактор, называемый одним из вышеуказанных названий, находится в рамках данного изобретения.
Композиции могут также включать в себя "функциональные полипептидные факторы роста", т.е. факторы роста, которые, несмотря на присутствие мутации (будь то замена, деления или добавление аминокислотных остатков), сохраняют способность стимулировать фиброз в связи с уменьшением объема легких. Таким образом, альтернативные молекулярные формы полипептидных факторов роста (такие как формы bFGF, имеющие молекулярные массы 17,8, 22,5, 23,1 и 24,2 кД) находятся в объеме данного изобретения (формы с более высокой молекулярной массой являются колинеарными N-концевыми удлинениями bFGF 17,8 кД (Florkiewicz et al., Proc. Natl. Acad. Sci. USA 86:3978-3981, 1989)).
Вполне в рамках квалификации специалиста в данной области находится определение, сохраняет ли по существу полипептидный фактор роста, независимо от мутаций, которые влияют на его содержание аминокислот или размер, способность активировать фиброз, как и полноразмерный, полипептидный фактор роста дикого типа (т.е. усиливает ли мутантный полипептид фиброз на, по меньшей мере, 40%, предпочтительно, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 70% и наиболее предпочтительно, по меньшей мере, 90% так же эффективно, как соответствующий фактор роста дикого типа). Например, можно исследовать отложение коллагена в культивируемых фибробластах после подвергания действию полноразмерных факторов и мутантных факторов роста. Мутантный фактор роста по существу сохраняет способность активировать фиброз, когда он активирует на, по меньшей мере, 40%, предпочтительно, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 70% и наиболее предпочтительно, по меньшей мере, 90% отложение коллагена в сравнении с соответствующим фактором дикого типа. Количество отложения коллагена может быть измерено различными путями. Например, экспрессия коллагена может быть определена иммуноанализом. Альтернативно, экспрессия коллагена может быть определена экстракцией коллагена из фибробластов (например, культивируемых фибробластов или фибробластов вблизи уменьшенной ткани легкого) и измерением гидроксипролина.
Полипептидные факторы роста, применимые в данном изобретении, могут быть природно встречающимися, синтетическими или рекомбинантными молекулами и могут состоять из гибридного или химерного полипептида, в котором, например, одна часть является bFGF или TGFβ, а вторая часть является отличающимся полипептидом. Эти факторы могут быть очищены из биологической пробы, химически синтезированы или получены рекомбинантно стандартными способами (см., например, Ausubel et al. Current Protocols in Molecular Biology, New York, John Wiley and Sons, 1993; Powels et al. Cloning Vectors: A Laboratory Manual, 1985, Suppl. 1987).
Конечно, различные стимулирующие фиброз факторы роста могут быть использованы в комбинации.
Специалист в данной области вполне сможет определить дозу полипептидного фактора роста, требуемую для стимуляции фиброза в связи с BLVR. Требуемая доза может варьироваться и может находиться в диапазоне от 1 до 100 нМ.
Кроме того, любые из композиций или растворов, описанных здесь для уменьшения объема легкого (например, описанная выше композиция на основе фибриногена), могут содержать один или более антибиотиков (например, ампициллин, гентамицин, цефотаксим, небацетин, пенициллин или сискомицин). Включение антибиотиков в терапевтически применяемые композиции хорошо известно специалистам в данной области.
Растворы на основе фибрина
Фибрин может также функционировать в качестве антисурфактанта, а также в качестве герметика или адгезива. Однако, в противоположность фибриногену, фибрин может быть превращен в полимер без применения активатора (такого как тромбин или фактор XI На). В самом деле, мономеры фибрина I могут спонтанно образовывать полимер фибрина I, который действует как сгусток, независимо от того, были ли они перекрестно сшиты, и независимо от того, превращается ли фибрин I далее в полимер фибрина II. Без ограничения данного изобретения соединениями, которые функционируют по какому-либо конкретному механизму, следует отметить, что, когда мономеры фибрина I приходят в контакт с кровью пациента, собственный тромбин и фактор XIII пациента могут превращать полимер фибрина I в структурированный (сшитый) полимер фибрина II.
Любая форма мономера фибрина, которая может быть превращена в полимер фибрина, может быть приготовлена в виде раствора и использована для уменьшения объема легкого. Например, композиции на основе фибрина могут содержать мономеры фибрина I, мономеры фибрина II, мономеры фибрина des ВВ или любую их смесь или комбинацию. Предпочтительно, эти мономеры фибрина не являются перекрестно сшитыми.
Фибрин может быть также получен из любого источника, пока его получают в форме, которая может быть превращена в полимер фибрина (подобным образом, несшитый фибрин может быть получен из любого источника, пока он может быть превращен в сшитый фибрин). Например, фибрин может быть получен из крови млекопитающего, такого как человек, и его предпочтительно получают от пациента, которому его впоследствии должны вводить (т.е. этот фибрин является аутологичным фибрином). Альтернативно, фибрин может быть получен из клеток, которые, в культуре, секретируют фибриноген.
Композиции на основе фибрина могут быть получены, как описано в патенте США 5739288 (который таким образом включен в качестве его полной ссылки), и могут содержать мономеры фибрина, имеющие концентрацию не менее, чем приблизительно 10 мг/мл. Например, мономеры фибрина могут присутствовать в концентрациях от приблизительно 20 мг/мл до приблизительно 200 мг/мл от приблизительно 20 мг/мл до приблизительно 100 мг/мл и от приблизительно 25 мг/мл до приблизительно 50 мг/мл.
Спонтанное превращение мономера фибрина в полимер фибрина может быть облегчено контактированием мономера фибрина с ионами кальция (как обнаружено, например, в хлориде кальция, например, 3-30 мМ растворе CaCl2). За исключением первых двух стадий в свойственном организму пути свертывания крови, ионы кальция необходимы для стимуляции превращения одного фактора коагуляции в другой. Таким образом, кровь не будет свертываться в отсутствие ионов кальция (но в живом организме концентрации ионов кальция никогда не падают достаточно низко, чтобы значимо влиять на кинетику свертывания крови; человек умер бы от мышечной тетании до того, как кальций снизится до этого уровня). Содержащие кальций растворы (например, стерильный 10%-ный CaCl2) может быть легко приготовлен или куплен у коммерческого поставщика.
Композиции на основе фибрина, описанные здесь, могут также включать в себя один или более полипептидных факторов роста, которые усиливают фиброз (или образование рубцов) в месте, где один участок спавшегося легкого слипается с другим. Многочисленные факторы могут быть включены, и предпочтительными являются факторы из семейств фибробластных факторов роста и трансформирующих факторов роста бета. Полипептидные факторы роста, пригодные для включения с композициями на основе фибрина, включают в себя все те факторы (описанные выше), которые пригодны для включения с композициями на основе фибриногена.
Растворы, которые включают в себя компоненты внеклеточного матрикса
Как описано здесь, эффективным способом получения безопасного, нехирургического уменьшения объема ткани является применение растворов, содержащих агенты, которые действуют не только механически, склеивая одну часть ткани с другой, но также биологически модулируют ответные реакции клеток в зонах, намеченных для уменьшения объема. Так, растворы на основе фибрина и фибриногена, описанные выше, могут содержать также один или более агентов, которые усиливают механические и биологические свойства этих растворов. Как описано выше, такие растворы могут быть использованы для лаважа (т.е. промывания) ткани или для приклеивания одной части этой ткани к другой.
Применимые агенты включают в себя агенты, которые: (1) стимулируют хемотаксис фибробластных и мононуклеарных клеток и отложение коллагена самоограничивающим и локализованным образом; (2) подавляют активность альвеолярных эпителиальных клеток, либо ингибированием их способности экспрессировать сурфактант, что стимулирует повторное открывание участков-мишеней, либо стимуляцией апоптоза эпителиальных клеткок, что вызывает воспаление; (3) стимулируют сжатие эпителиальных клеток, что уменьшает кровоток к участкам-мишеням, минимизируя тем самым несовпадение между вентиляцией и перфузией и любое получение отклонений от нормы газообмена. Более конкретно, могут быть использованы растворы, содержащие компоненты внеклеточного матрикса (ЕСМ), эндотелин-1 и/или проапоптотические реагенты. Подходящие проапоптотические агенты включают в себя белки в семействе Вс1-2 (например, Вах, Bid, Bik, Bad и Bim и их биологически активные фрагменты или варианты), белки в семействе каспаз (например, каспазу-3, каспазу-8, каспазу-9 и их биологически активные фрагменты и варианты) и белки в семействе аннексинов (например, аннексии V или его биологически активный фрагмент или вариант). Как описано дополнительно в примерах ниже, растворы, содержащие несколько из этих агентов, тестировали. Первые агенты для тестирования отбирали на основании их биологических признаков, их биофизических действий на поведение геля, их растворимости в водных растворах (при физиологических условиях) и стоимости. Специалисты в данной области смогут выбрать и использовать сравнимые агенты без обращения к чрезмерному экспериментированию.
Выбранными для применения агентами были первоначально ходроитинсульфат А, гиалуроновая кислота с низкой и высокой молекулярной массой, фибронектин, поли-L-лизин со средней и длинной цепью и дипептид коллагена пролин-гидроксипролин.
Хондроитинсульфат (ХС) является компонентом ЕСМ из семейства гликозаминогликанов (ГАГ). Он представляет собой сульфатированный углеводный полимер, состоящий из повторяющихся дисахаридных единиц галактозамина, связанных с глюкуроновой кислотой через связь бета-1-4-углерод. ХС не обнаруживается в виде свободной углеводной части in vivo, a скорее связан с коровыми (центральными) белками различных типов. Как таковой, он является компонентом нескольких важных протеогликанов ЕСМ, в том числе членов семейства синдеканов (синдекана 1-4), богатого лейцином семейства (десортина, бигликана) и гиалуронатсвязывающего семейства (CD44, аггрекана, версикана, нейронкана). Эти ХС-содержащие протеогликаны функционируют в связывании интегринов клеточной поверхности и факторов роста. ХС-содержащие протеогликаны могут функционировать в легком в качестве каркаса для депонирования коллагена фибробластами. Таким образом, компоненты ЕСМ в семействе гликозаминогликанов, в частности, углеводные полимеры, применимы в достижении уменьшения объема ткани (например, уменьшения объема легкого, проводимого бронхоскопически). Например, добавление хондроитинсульфата А или С при концентрациях в диапазоне от 0,05 до 3,00% оказывает специфическое и благоприятное действие как на механические, так и на биологические свойства фибриновых гелей. Подобным образом растворы, применимые для лаважа и склеивания ткани, могут содержать сравнимые количества одного или более протеогликанов, таких как синдекан 1-4, декортин, бигликан, CD44, аггрекан, версикан и нейронкан. В одном варианте композиция данного изобретения включает в себя этанол (например, 1-20%), фибриноген (например, 0,01-5,00%), ГК (например, 0,01-3,00%), ФН (например, 0,001-0,1%) и ХС (например, 0,01-1,0%). Например, применимая композиция данного изобретения включает в себя 10% этанол, 0,5% фибриноген, 0,3% ГК, 0,01% ФН и 0,1% ХС.
Гиалуроновая кислота (ГК), подобно ХС, является полисахаридом, состоящим из повторяющихся единиц глюкуроновой кислоты и N-ацетилглюкозамина, соединенных связью бета-1-3. Однако, в противоположность ХС и ГАГ, ГК действует in vivo в виде свободного углевода и не является компонентом какого-либо семейства протеогликанов. ГК является большой полианионной молекулой, которая предполагает случайно скрученную структуру в растворе и, вследствие ее самоагрегирующих свойств, придает высокую вязкость водным растворам. Она поддерживает как прикрепление, так и пролиферацию клеток. Кроме того, считают, что ГК усиливает хемотаксис моноцитов/макрофагов и стимулирует секрецию ингибитора активатора цитокина и плазмина из этих клеток. Таким образом, полисахариды, которые включают в себя повторяющиеся единицы, например, глукуроновую кислоту и N-ацетилглюкозамин, применимы в достижении уменьшения объема ткани (например, уменьшения объема легкого, проводимого бронхоскопически). Например, добавление ГК с высокой или низкой молекулярной массой при концентрациях в диапазоне от 0,05 до 3,00% будет оказывать специфическое и благоприятное действие как на механические, так и на биологические свойства фибриновых гелей.
Фибронектин (Фн) является широкораспространенным гликопротеином, присутствующим в ЕСМ. Он присутствует в тканях в виде гетеродимера, в котором субъединицы ковалентно связаны парой дисульфидных связей вблизи карбокси-конца. Фн разделен на несколько доменов, каждый из которых имеет отличающуюся функцию. Амино-концевой участок имеет сайты связывания для фибрина, гепарина, фактора XIIIa и коллагена. Фн имеет центральный клеточносвязывающий домен, который узнается интегринами клеточной поверхности макрофагов, а также фибробластами, миофибробластами и недифференцированными интерстициальными клетками. Первичной функцией Фн in vivo является его функционирование в качестве регулятора заживления ран, клеточного роста и дифференцировки. Фн может усиливать связывание и хемотаксис фибробластов. Он может также действовать в качестве фактора компетентности клеточного цикла, позволяя фибробластам размножаться более быстро при подвергании действию подходящих "сигналов прогрессирования". In vitro, Фн усиливает миграцию фибробластов в сгустки плазмы. Кроме того, Фн стимулирует изменения в фенотипе альвеолярных клеток, которые приводят к снижению экспрессии сурфактанта. Таким образом, молекулы Фн, которые активируют коллапс ткани и образование рубцов, применимы в достижении уменьшения объема ткани (например, уменьшения объема легкого, проводимого бронхоскопически). Применимы изоформы Фн, генерируемые альтернативным сплайсингом, и лизофосфатидная кислота или ее соль могут быть добавлены к содержащим Фн растворам для усиления связывания Фн. Например, добавление Фн в концентрации в диапазоне 0,05%-3,00% оказывает специфическо