Способ осуществления реакций окисления органических соединений
Иллюстрации
Показать всеИзобретение относится к области химической технологии, экологии, а более подробно к способам проведения химических реакций, в частности окисления в сверхкритических средах-флюидах (или растворителях). Способ осуществления реакций окисления органических соединений включает подачу топлива и окислителя через устройство смешивания в каталитический пакет. Полученные продукты окисления с выхода каталитического пакета направляют в объем смешения на лопасти мешалки и в продукты окисления после каталитического пакета подают реагенты, содержащие органические соединения и окислитель. Полученные продукты реакции подают в трубчатую часть реактора для их полного окисления, при этом окисление органических соединений проводят в сверхкритической воде. В качестве окислителя используют нитрат аммония, смесь нитрата аммония и воздуха, смесь нитрата аммония и кислорода или смесь нитрата аммония и перекиси водорода. Часть окислителя подают непосредственно в трубчатую часть реактора. Изобретение позволяет повысить эффективность процесса окисления органических соединений. 5 з.п. ф-лы, 2 ил., 2 табл.
Реферат
Изобретение относится к области химической технологии, экологии, а более подробно к способам проведения химических реакций, в частности окисления в сверхкритических средах-флюидах (или растворителях), обеспечивающих многократное увеличение скорости химического процесса и контролируемую его селективность.
Многие жидкости в сверхкритическом состоянии вблизи критической точки, как среды для проведения химических реакций, обладают рядом особых свойств, которые позволяют с высокой скоростью осуществлять реакции дегидратации и гидролиза, синтеза, гидрирования и окисления большого числа органических и неорганических веществ. Такое состояние жидкости может быть результатом изменения ее структурных свойств в сверхкритических условиях. В частности, для воды в сверхкритическом ее состоянии вблизи критической точки характерно образование высокой концентрации ионов Н+ и ОН-, что обеспечивает свойства основного или кислотного катализа.
Среди сверхкритических растворителей, наиболее пригодных для проведения в них химических превращений и практического использования, следует выделить воду, СО2, гексан, аммиак, ряд предельных и непредельных углеводородов. Наиболее высоким сохраняется интерес к сверхкритической воде, находящейся вблизи своего критического состояния, как к среде для осуществления химических реакций. Поскольку осуществлять химические превращения в воде или другой жидкой среде мы просто вынуждены, так как именно в воде, чаще всего в стоках, содержатся малые примеси различных органических и неорганических веществ. И на сегодняшний день практически нет альтернативных и эффективных путей их удаления, кроме как проводить химические превращения с участием этих соединений в той среде, в которой они растворены. Среди реакций, на которые следует серьезно обратить внимание для их проведения в сверхкритической воде (СКВ), надо выделить окисление, дегидратацию, гидролиз и гидрирование.
Известны способы осуществления процессов окисления различного класса органических соединений в сверхкритической воде и устройства-реактора, в которых осуществляются эти реакции [Р.Е.Savage, S.Gopalan, T.I.Mizan, Ch.J.Martino, E.E.Brock. Reactions at supercritical conditions: Applications and fundamentals. AIChE Journal, 1995, 41, 1723-1778; US Pat. 5723045, Mar. 3, 1998].
К основным недостаткам таких способов осуществления химических реакций в сверхкритических растворителях можно отнести низкие скорости химических реакций (если это не окислительные реакции), не выбраны параметры, контролирующие и управляющие скоростью и селективностью химических превращений, реакции проводятся при температурах и давлениях, далеких от оптимальных, организация осуществления химических реакций в реакторах не обеспечивает требуемых степеней превращений. Нагрев растворителя для перевода его в сверхкритическое состояние производится вместе с растворенным в нем реагентом, в результате, растворенный реагент проходит вместе с водой много стадий нагревания, сопровождаемое различными скоростями химических превращений и селективностью. В итоге, по достижении флюидом своего сверхкритического состояния реагент частично прореагирует.
Наиболее близкими являются изобретения, в которых предлагаются различные реакторы и процессы окисления отходов и материалов в сверхкритической воде [US Pat. 5558783, Sep.24, 1996; US Pat. 5591415, Jan. 7, 1997; US Pat. 6264844, Jul. 24, 2001].
В этих патентах предлагается использовать проточный трубчатый реактор (Us Pat. 6264844, Jul. 24, 2001), выполненный в виде прямой трубы, для процессов окисления в СКВ (недостатки: сложно поддерживать изотермичность реакционной смеси, состав меняется по длине реактора): проточный реактор в виде сосуда высокого давления (реактор смешения) (US Pat. 5591415, Jan.7, 1997). К недостаткам такого типа реактора, как и практически любого реактора смешения, можно отнести трудности в достижении больших времен контакта реакционной смеси, что приводит к достижению невысоких степеней превращения.
Известен способ осуществления реакций окисления горючих материалов в сверхкритической воде (WO 01/96247, 20.12.2001). Здесь в качестве окислителя используется перекись водорода, воздух, кислород или их комбинации.
Известен способ осуществления реакций окисления горючих материалов в докритической воде, принятый нами за прототип [WO 91/11394, Aug. 8, 1991]. Здесь, в качестве окислителя используются воздух, кислород, кислородосодержащий газ, перекись водорода, азотная кислота и перхлорат.
К недостаткам способа осуществления химических реакций окисления прототипа можно отнести следующее: давление ниже критического при температуре выше сверхкритической температуры воды.
Изобретение решает задачу высокоэффективного осуществления реакций окисления органических соединений в сверхкритической воде в реакторах при проведении процессов, во-первых, уничтожения и утилизации токсичных и вредных веществ, во-вторых, синтеза новых соединений.
Задача решается способом осуществления реакций окисления органических соединений, по которому топливо и окислитель через устройство смешения подают в каталитический пакет, полученные продукты окисления с выхода каталитического пакета направляют в объем смещения на лопасти мешалки, в продукты окисления после каталитического пакета подают реагенты, содержащие органические соединения и окислитель, полученные продукты реакции подают в трубчатую часть реактора для их полного окисления, при этом окисление органических соединений проводят в сверхкритической воде.
В качестве окислителя используют нитрат аммония, или смесь нитрата аммония и воздуха, или смесь нитрата аммония и кислорода, или смесь нитрата аммония и перекиси водорода.
Часть окислителя можно подавать непосредственно в трубчатую часть реактора.
Основные идеи практической реализации осуществления химических реакций окисления в сверхкритических флюидах, в частности воде, предложенные в настоящем изобретении, заключаются в том, что, во-первых, в качестве окислителя органических соединений используются растворимые в воде неорганические соли нитрата аммония или в сочетании с кислородом, воздухом, перекисью водорода или перхлоратом; во-вторых, предложенная конструкция реактора позволяет достигать гарантированного полного окисления целевых органических соединений.
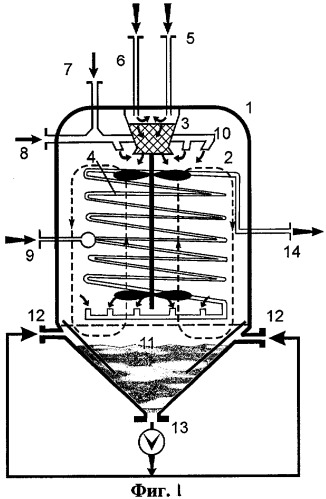
Принципиальная схема устройства, отражающего основные признаки изобретения, представлена на Фиг.1, где 1 - корпус реактора смешения, 2 - трубчатый реактор вытеснения, 3 - каталитический пакет, 4 - мешалка, 5 - подача топлива, 6, 7 и 9 - подача окислителя, 8 - устройство подачи реагентов, 10 - устройство смешения и ввода реакционной смеси, 11 - устройство ввода реакционной смеси в трубчатый реактор, 12 - устройство ввода орошающей воды, 13 - устройство вывода орошающей воды, 14 - устройство вывода продуктов реакции.
Предложенный реактор для проведения процессов полного, селективного окисления в сверхкритической воде в присутствии окислителя представляет собой последовательное сочетание объема смешения высокого давления 1 и трубчатого объема вытеснения 2, расположенного в центральной части объема смешения реактора.
Предлагаемый способ осуществляют следующим образом.
Топливо 5 и окислитель 6 поступают в устройство смешения, затем в каталитический пакет 3, где происходит окисление топлива с выделением тепла. Продукты окисления с выхода каталитическою пакета направляются на лопасти мешалки 4, вращая ее, тем самым обеспечивая изотермичность и хорошее перемешивание внутри объема реактора. В струю горячего газа после каталитического пакета подаются водные отходы 7, содержащие органические и неорганические соединения, и окислитель 8. В результате хорошего перемешивания и высокой температуры, близкой к критической температуре воды, органические отходы окисляются. Образующиеся неорганические соли выпадают из сверхкритического раствора и вследствие хорошей циркуляции потока в объеме реактора попадают в воду на дне объема реактора, в которой они растворяются и выводятся из реактора. Орошающая вода поступает через вводы 12 в нижнюю часть реактора и циркулируется насосом 13. Очищенные от солей продукты реакции через распределительный приемник 11 поступают в трубчатую часть реактора 2, где происходит полное окисление всех исходных реагентов. При необходимости, для достижения 100% степени превращения, в трубчатую часть реактора вводится дополнительное количество окислителя 9. Такое парциальное введение окислителя позволяет снизить избыток кислорода в объеме реактора и тем самым приводит к снижению коррозии стенок реактора. Продукты реакции выходят из реактора через выход 14.
Ниже приведены примеры осуществления способа.
Пример 1.
Окисление глицерина нитратом аммония в присутствии кислорода в СКВ.
Топливо (ацетон) и окислитель (кислород) в избытке поступают в каталитический пакет 3, где происходит полное окисление топлива с выделением тепла. В струю горячего газа после каталитического пакета подают водный раствор глицерина 7 и растворенный в воде окислитель (нитрат аммония) 8.
Реакция окисления глицерина в присутствии двух окислителей протекает в две стадии:
С3Н8О3+0.5O2=3СH3СООН
СН3СООН+4 NH4NO3=4N2+2СО2+10Н2O
Продукты реакции из объема смешения через распределительный приемник 11 поступают в трубчатую часть реактора, где происходит полное окисление уксусной кислоты (промежуточный продукт).
Пример 2.
Окисление диметилформамида нитратом аммония в СКВ.
Топливо (ацетон) 5 и окислитель (воздух или кислород) 6 в количестве, необходимом только для полного окисления топлива, подают в каталитический пакет 3, где происходит полное окисление топлива с выделением тепла. В струю продуктов полного окисления топлива после каталитического пакета подают водный раствор диметилформамида 7 и растворенный в воде нитрат аммония (окислитель) 8.
Превращения диметилформамида происходят в несколько стадий, две из которых являются гидролизом и прямым окислением:
C3H7ON+Н2O=C2H7N+НСООН
C2H7N+2H2O=NH3+2СH3OH
НСООН+NH4NO3=N2+СО2+3Н2О
СН3ОН+3NH4NO3+3N2+СО2+8Н2O
Продукты реакции из объема смешения через распределительный приемник 11 поступают в трубчатую часть реактора, где происходит полное окисление реактантов.
Пример 3.
Окисление сложной смеси органических соединений смесью нитрата аммония и воздуха в СКВ.
Топливо (ацетон) и окислитель (воздух) в избытке поступают в каталитический пакет 3, где происходит полное окисление топлива с выделением тепла. В струю горячего газа после каталитического пакета подают водный раствор нижеприведенной смеси органических соединений 7 и растворенный в воде окислитель (нитрат аммония) 8.
Состав отходов изменяется в пределах:
| Диметилформамид | 65-75% |
| Уксусная кислота | 15-25% |
| Этанол | 4-10% |
| Толуол | 2-5% |
| Неидентифицированные примеси | до 2% |
| Вода | до 8% |
Неорганические отходы содержат около 25% нитрата аммония и примеси других солей, в основном сульфатов.
В ходе проведенных исследований отбирают пробы раствора на анализ, по результатам которого оценивают степень окисления органических веществ (показатель «химическое потребление кислорода») и степень разложения нитрата аммония по показателям «содержание нитратов NO3 - и содержание аммонийного азота в катионе NH4 +».
Результаты представлены в таблице 1.
| Таблица 1. | ||||||
| Показатели | На входе | На выходе | Степень превращения, % | Температура, °С | Давление, МПа | |
| В реакторе | После реактора | |||||
| Содержание нитроэфиров, мг/л | 194 | нет | 100 | 634 | 577 | 24,2 |
| ХПК, мгО2/л | 40372 | 308,3 | 99,2 | То же | ||
| Азот аммиака, мг/л | 5936 | 58,8 | 99,0 | То же | ||
| Содержание нитратов, мг/л | 26106 | 592,9 | 97,7 | То же | ||
| Содержание сульфатов, (SO4 =), мг/л | 223,8 | 19,2 | 91,4 | То же | ||
| Значение РН | 4,05 | 6,54 | - | То же |
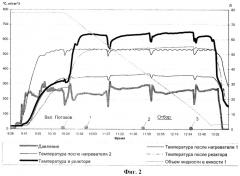
На Фиг.2 представлен график, который демонстрирует стабильность в поведении параметров процесса при окислении воздухом сточных вод с производства смеси нитроглицерина и динитрата диэтиленгликоля в присутствии ацетона и нитрата аммония.
Пример 4.
Окисление нитроэфиров смесью окислителей нитрата аммония и перекиси водорода. Топливо (ацетон) 5 и окислитель (воздух или кислород) 6 в количестве, необходимом только для полного окисления топлива, подают в каталитический пакет 3, где происходит полное окисление топлива с выделением тепла. В струю продуктов полного окисления топлива после каталитического пакета подают водный раствор смеси нитроэфиров и нитрата аммония 7 и 30% перекиси водорода (окислитель) 8. Непрореагировавшие реагенты и продукты реакции из объема смешения реактора через распределительный приемник 11 поступают в трубчатую часть реактора, где происходит их полное окисление.
Результаты превращений приведены в таблице 2.
| Таблица 2. | ||||||
| Показатели | На входе | На выходе | Степень превращения, % | Температура, °С | Давление, МПа | |
| В реакторе | После реактора | |||||
| ХПК, мгО2/л | 95277,8 | 103,5 | 99,89 | 652 | 434437 | 25,227,8 |
| Азот аммиака, мг/л | 3206,4 | 231,4 | 92,8 | То же | ||
| Содержание нитратов (NO3 -), мг/л | 9728,0 | 0,86 | 99,99 | То же | ||
| Содержание нитритов (NO2 -), мг/л | 23,49 | 0,49 | 97,9 | То же | ||
| Содержание сульфатов, (SO4 =), мг/л | нет | нет | --- | То же | ||
| Значение РН | 3,85 | 7,24 | --- | То же |
Пример 5.
Синтез терефталевой кислоты путем окисления пара-ксилола.
Синтез терефталевой кислоты осуществляют при окислении пара-ксилола перекисью водорода в сверхкритической воде без катализатора, при температуре 270-500°С и давлении 221-300 бар. Почти 100%-ная конверсия пара-ксилола наступает через 15-20 мин, достигается селективность процесса выше 90%.
Топливо 5 и окислитель 6 в количестве, необходимом только для полного окисления топлива, поступают в устройство смешения, затем в каталитический пакет 3, где происходит окисление топлива с выделением тепла. В струю горячего газа после каталитического пакета подают пара-ксилол 7 и 30% перекись водорода (окислитель) 8. Непрореагировавшие реагенты и продукты реакции из объема смешения реактора через распределительный приемник 11 поступают в трубчатую часть реактора. Для достижения полного окисления в трубчатую часть реактора вводят дополнительное количество окислителя 9. Продукты реакции - терефталиевая кислота - выходят из реактора через выход 14.
Таким образом, приведенные примеры показывают, что изобретение позволяет высокоэффективно осуществлять химические реакции в сверхкритической воде и может быть использовано для уничтожения и утилизации токсичных и вредных веществ и отходов, синтеза новых соединений.
1. Способ осуществления реакций окисления органических соединений, отличающийся тем, что топливо и окислитель через устройство смешивания подают в каталитический пакет, полученные продукты окисления с выхода каталитического пакета направляют в объем смешения на лопасти мешалки и в продукты окисления после каталитического пакета подают реагенты, содержащие органические соединения и окислитель, полученные продукты реакции подают в трубчатую часть реактора для их полного окисления, при этом окисление органических соединений проводят в сверхкритической воде.
2. Способ по п.1, отличающийся тем, что в качестве окислителя используют нитрат аммония.
3. Способ по п.1, отличающийся тем, что в качестве окислителя используют смесь нитрата аммония и воздуха.
4. Способ по п.1, отличающийся тем, что в качестве окислителя используют смесь нитрата аммония и кислорода.
5. Способ по п.1, отличающийся тем, что в качестве окислителя используют смесь нитрата аммония и перекиси водорода.
6. Способ по п.1, отличающийся тем, что часть окислителя подают непосредственно в трубчатую часть реактора.