Нестероидные модуляторы рецептора прогестерона
Иллюстрации
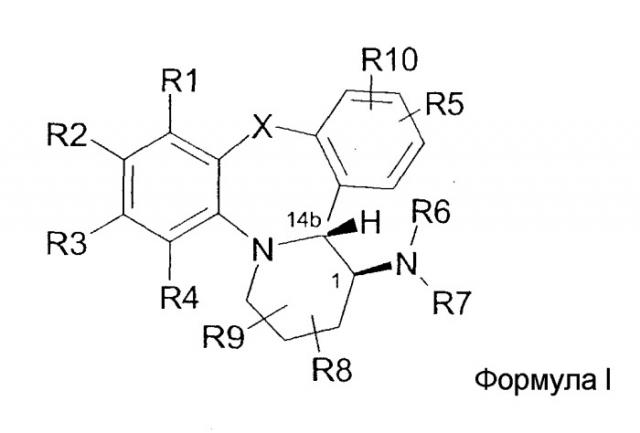
Показать всеИзобретение относится к нестероидным модуляторам рецептора прогестерона, имеющим общую формулу
или его фармацевтической приемлемой соли,
где R1, R3, R4, R5 и R10 независимо выбираются из группы, состоящей из Н, галогена, (1-4С)алкила, (2-4С)алкенила, CN, O(1-4С)алкила, С(O)(1-4С)алкила и NR19R20, R2 выбирается из группы, состоящей из Н, галогена, NO2 и NR11R12, R6 выбирается из группы, состоящей из Н, C(Y)R15, C(O)OR16, C(S)NR17, (1-6С)алкила, (1-6С)алкокси-замещенного (1-4С)алкила и (CH2)nC(O)OR21, R7 представляет собой Н или R7 выбирается из группы, состоящей из (1-4С)алкила и (2-4С)алкенила, причем все они необязательно замещены одним или несколькими атомами галогена, R8 и R9 представляют собой Н, R11 и R12 независимо выбираются из группы, состоящей из Н, (1-6С)алкоксикарбонила, (1-4С)алкилсульфонила и (6-10С)арилсульфонила, R15 представляет собой Н или R15 выбирается из группы, состоящей из (1-6С)алкила, (6-10С)арила, 1,4-бисарила, амино(1-4С)алкила, гидрокси(1-4С)алкила и карбокси(1-4С)алкила, причем все они необязательно замещены одним или несколькими атомами галогена, R16 представляет собой (1-6С)алкил, необязательно замещенный одним или несколькими атомами галогена, R17 выбирается из группы, состоящей из (1-4С)алкила, (2-4С)алкенила, (2-4С)алкинила и (3-6С)циклоалкила, причем все они необязательно замещены одним или несколькими атомами галогена, Х выбирается из группы, состоящей из О, S, CH2 и NR18, Y выбирается из группы, состоящей из О, S и NH, R18 выбирается из группы, состоящей из Н и (1-4С)алкила, R19 выбирается из группы, состоящей из Н и (1-4С)алкила, R20 выбирается из группы, состоящей из Н, СН2(6-10С)арила и С(O)(1-6С)алкила, R21 представляет собой Н, m равно 0, 1 или 2, и n равно 1, 2 или 3, при условии, что (i) когда Х представляет собой О, R1-R5 представляют собой Н, R8-R10 представляют собой Н и R6 представляет собой этил или С(O)СН3, тогда R7 не является Н; (ii) когда Х представляет собой О, R1-R5 представляют собой Н, R8-R10 представляют собой Н и R6 представляет собой метил, тогда R7 не является метилом; и (iii) когда Х представляет собой О, R1-R5 представляют собой Н, R8-R10 представляют собой Н и R6 представляет собой Н, тогда R7 не является Н, этилом или (СО)СН3. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами, которые могут найти свое применение в качестве лекарственного средства, обладающего активностью в отношении рецептора прогестерона. 14 з.п. ф-лы, 3 табл.
Реферат
Настоящее изобретение относится к соединениям, модулирующим рецепторы прогестерона, а также к применению этих соединений в терапии.
Внутриклеточные рецепторы представляют собой класс структурно родственных белков, вовлеченных в регуляцию генных белков. Стероидные рецепторы представляют собой подмножество этих рецепторов, включающее в себя рецептор прогестерона (PR), рецептор андрогена (AR), рецептор эстрогена (ER), глюкокортикоидный рецептор (GR) и минералокортикоидный рецептор (MR). Регуляция гена такими факторами требует внутриклеточного рецептора и соответствующего лиганда, который обладает способностью к селективному связыванию с рецептором таким способом, который воздействует на транскрипцию гена.
Модуляторы рецепторов прогестерона (прогестагены), как известно, играют важную роль в обеспечении здоровья женщины. Природный лиганд для рецептора PR представляет собой стероидный гормон прогестерон, но получены и синтетические соединения, которые также могут служить в качестве лигандов (смотри, например, Jones et al., патент США № 5688810).
Прогестагены в настоящее время широко используются для гормональной контрацепции и при HRT (гормон-заместительной терапии). Другими важными клиническими применениями прогестагенов являются лечение гинекологических расстройств (например, эндометриоза, дисменореи, дисфункциональных маточных кровотечений, острого предменструального синдрома), рака груди и лютиальная поддержка во время IVF (экстракорпорального оплодотворения). Агонисты PR используются в препаратах для контроля рождаемости, в то время как антагонисты PR могут использоваться при контрацепции, гормонально зависимых раковых заболеваниях, гормон-заместительной терапии, эндометриозе и тому подобное.
Используемые в настоящее время стероидные прогестагены, как показано, являются абсолютно безопасными и хорошо переносятся. Временами, однако, сообщается о побочных эффектах (например, болезненности груди, головных болях, депрессии и увеличении веса), которые приписываются этим стероидным прогестагенам, либо самим по себе, либо в сочетании с эстрогенными соединениями.
Стероидные лиганды к одному из рецепторов часто демонстрируют перекрестную реакционную способность к взаимодействию с другими стероидными рецепторами. Многие прогестагены также связываются, например, с глюкокортикоидным рецептором. Нестероидные прогестагены не имеют сходства молекулярных структур со стероидами, и по этой причине можно также ожидать различий в физико-химических свойствах, фармакокинетических (PK) параметрах, в распределении в тканях (например, в центральной и периферической нервной системе), и, что более важно, нестероидные прогестагены могут демонстрировать меньшую перекрестную реакционную способность по отношению к другим стероидным рецепторам или ее отсутствие. По этой причине, с этих точек зрения, нестероидные прогестагены будут оцениваться по-разному.
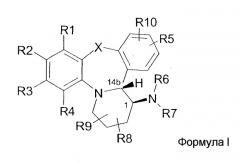
Настоящее изобретение предлагает нестероидные соединения, которые модулируют активность рецептора прогестерона. Более конкретно, настоящее изобретение предлагает нестероидные соединения с высокой аффиностью, которые являются агонистами, частичными агонистами или антагонистами рецептора прогестерона. Предпочтительно, эти соединения являются высокоспецифичными по отношению к рецептору прогестерона. В соответствии с настоящим изобретением предлагаются соединения, имеющие общую формулу I, их пролекарства или фармацевтически приемлемые соли, либо соединения, либо пролекарства.
где R1, R3, R4, R5 и R10 независимо выбираются из группы, состоящей из H, галогена, (1-4C)алкила, (2-4C)алкенила, (2-4C)алкинила, OH, CN, O(1-4C)алкила, S(O)m(1-4C)алкила (необязательно замещенного одним или несколькими атомами галогена), C(O)(1-4C)алкила, OC(O)(1-4C)алкила и NR19R20,
R2 выбирается из группы, состоящей из H, галогена, NO2, NR11R12, (1-4C)алкила, (2-4C)алкенила, (2-4C)алкинила, OH, О(1-4C)алкила, S(1-4C)алкила и OC(O)(1-4C)алкила,
R6 выбирается из группы, состоящей из H, C(Y)R15, C(O)OR16, C(S)NR17, (1-6C)алкила, (1-6C)алкокси-замещенного (1-4C)алкила и (CH2)nC(O)OR21,
R7 выбирается из группы, состоящей из (1-4C)алкила, (2-4C)алкенила и (2-4C)алкинила, причем все они необязательно замещены одним или несколькими атомами галогена, или R7 представляет собой H,
R8 и R9 независимо выбираются из группы, состоящей из H и (1-4C)алкила,
R11 и R12 независимо выбираются из группы, состоящей из H, (1-4C)алкила, (2-4C)алкенила или (2-4C)алкинила, (1-6C)алкоксикарбонила, (1-4C)алкилсульфонила и (6-10C)арилсульфонила,
R15 представляет собой H или R15 выбирается из группы, состоящей из (1-6C)алкила, (3-6C)циклоалкила, (2-4C)алкенила, (2-4C)алкинила, (6-10C)арила, 1,4-бисарила, амино(1-4C)алкила, гидрокси(1-4C)алкила и карбокси(1-4C)алкила, причем все они необязательно замещены одним или несколькими атомами галогена,
R16 представляет собой (1-6C)алкил, необязательно замещенный одним или несколькими атомами галогена,
R17 выбирается из группы, состоящей из (1-4C)алкила, (2-4C)алкенила, (2-4C)алкинила и (3-6C)циклоалкила, причем все они необязательно замещены одним или несколькими атомами галогена,
X выбирается из группы, состоящей из O, S, CH2 и NR18,
Y выбирается из группы, состоящей из O, S, и NH,
R18 выбирается из группы, состоящей из H и (1-4C)алкила,
R19 выбирается из группы, состоящей из H и (1-4C)алкила,
R20 выбирается из группы, состоящей из H, (1-4C)алкила, CH2(6-10C)арила, C(O)(1-6C)алкила и C(O)NH(1-4C)алкила,
R21 выбирается из группы, состоящей из H и (1-6C)алкила,
m равно 0, 1 или 2,
n равно 1, 2 или 3, при условии, что
(i) когда X представляет собой O, R1-R5 представляют собой H, R8-R10 представляют собой H и R6 представляет собой этил или C(O)CH3, тогда R7 не является H;
(ii) когда X представляет собой O, R1-R5 представляют собой H, R8-R10 представляют собой H и R6 представляет собой метил, тогда R7 не является метилом;
(iii) когда X представляет собой O, R1-R5 представляют собой H, R8-R10 представляют собой H и R6 представляет собой H, тогда R7 не является H, этилом или (CO)CH3.
Термин «(1-4C)алкил», как используется в определении настоящего изобретения, обозначает алкильную группу с разветвленной или неразветвленной цепью, имеющую 1-4 атома углерода, например метил, этил, пропил, изопропил, бутил, втор-бтил и трет-бутил.
Термин «(1-6C)алкил», как используется в определении настоящего изобретения, обозначает алкильную группу с разветвленной или неразветвленной цепью, имеющую 1-6 атомов углерода, например метил, этил, пропил, изопропил, бутил, втор-бтил, трет-бутил и гексил. (1-5C)Алкильные группы являются предпочтительными, (1-4C)алкил является наиболее предпочтительным.
Термин «галоген» обозначает фтор, хлор, бром или йод.
Термин «(1-6C)алкокси» обозначает алкоксигруппу, имеющую 1-6 атомов углерода, причем алкильный остаток имеет такую же формулу, как определено ранее. (1-2C)Алкоксигруппы являются предпочтительными.
Термин «(1-6C)алкоксикарбонил» обозначает алкоксикарбонильную группу, причем алкоксигруппа в ней содержит 1-6 атомов углерода и имеет такое же значение, как определено ранее. (1-4C)Алкоксикарбонильные группы являются предпочтительными.
Термин «(1-4C)алкилсульфонил» обозначает алкилсульфонильную группу, алкильная группа в которой содержит 1-4 атомов углерода и имеет такое же значение, как определено ранее. (1-2C)Алкилсульфонильные группы являются предпочтительными.
Термин «(6-10C)арил» обозначает ароматическую углеводородную группу, имеющую 6-10 атомов углерода, такую как фенил, нафтил, тетрагидронафтил или инденил, которая может необязательно быть замещена одним или несколькими заместителями, выбранными из гидрокси, амино, галогена, нитро, трифторметила, циано или (1-4C)алкила, причем алкильный остаток имеет такое же значение, как определено ранее. Предпочтительная ароматическая углеводородная группа представляет собой фенил.
Термин «(6-10)арилсульфонил» обозначает арилсульфонильную группу, арильная группа в которой содержит 6-10 атомов углерода и имеет такое же значение, как определено ранее. Фенилсульфонил является предпочтительным.
Термин «(2-4C)алкенил» обозначает алкенильную группу с разветвленной или неразветвленной цепью, имеющую 2-4 атома углерода, такую как этенил и 2-бутенил.
Термин «(2-4C)алкинил» обозначает алкинильную группу с разветвленной или неразветвленной цепью, имеющую 2-4 атома углерода, такую как этинил и пропинил.
Термин «амино(1-4C)алкил» обозначает аминоалкильную группу, алкильная группа в которой содержит 1-4 атома углерода и имеет то же самое значение, как определено ранее. Амино(1-2C)алкильные группы являются предпочтительными.
Термин «гидрокси(1-4C)алкил» обозначает гидроксиалкильную группу, алкильная группа в которой содержит 1-4 атома углерода и имеет то же самое значение, как определено ранее. Гидрокси(1-2C)алкильные группы являются предпочтительными.
Термин «1,4-бисарил» обозначает две фенильные группы, в которых вторая фенильная группа присоединена в 4-положении первой фенильной группы.
Термин «карбокси(1-4C)алкил» обозначает карбоксиалкильную группу, алкильная группа в которой содержит 1-4 атома углерода и имеет то же самое значение, как определено ранее. Карбокси(1-2C)алкильные группы являются предпочтительными.
Термин «(3-6C)циклоалкил» обозначает циклоалкильную группу, имеющую 3-6 атомов углерода, представляющую собой циклопропил, циклобутил, циклопентил и циклогексил.
Термин «фармацевтически приемлемая соль» представляет те соли, которые, в рамках медицинского суждения, являются пригодными для использования в контакте с тканями людей и/или животных без излишней токсичности, раздражения, аллергической реакции и тому подобное, и соотносятся с разумным отношением выигрыш/риск. Фармацевтически приемлемые соли являются хорошо известными в данной области. Они могут быть получены во время конечного выделения и очистки соединений по настоящему изобретению или отдельно, путем взаимодействия функциональной группы свободного основания с соответствующей минеральной кислотой, такой как хлористоводородная кислота, фосфорная кислота или серная кислота, или с органической кислотой, такой, например, как аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и тому подобное. Функциональная группа кислоты может взаимодействовать с органическим или минеральным основанием, подобным гидроксиду натрия, гидроксиду калия или гидроксиду лития.
Для целей настоящего изобретения термин «транс», когда он используется для названия конденсированных полициклических соединений, понимается, как обозначающий такую относительную стереохимию, где заместитель на кольце в положении 1, в формуле I, находится на стороне указанного кольца, противоположной по отношению к связи кольца с аннелированной кольцевой системой в положении 14b. Как следствие, заместитель в положении 1 находится на той же стороне кольцевой системы, что и являющийся частью мостика атом водорода, занимающий положение 14b. В дополнение к этому, использование термина «транс» будет понятно специалистам в данной области по иллюстрациям в различных диаграммах, фигурах и схемах реакций.
Пролекарства представляют собой соединения, которые быстро преобразуются in vivo в исходное соединение указанной выше формулы, например путем гидролиза в крови.
Соединения формулы I существуют как смеси стереохимических изомеров; предпочтительной является абсолютная стереохимия (1S,14bR).
Предпочтительными соединениями являются такие соединения, где R2 выбирается из группы, состоящей из H, галогена, NO2 и NR11R12, где R11 и R12 независимо выбираются из группы, состоящей из H, (1-6C)алкоксикарбонила, (1-4C)алкилсульфонила и (6-10C)арилсульфонила.
Особенно предпочтительными являются соединения формулы I, где R1 и R5 представляют собой H и R3 и R4 являются независимо выбранными из H или галогена.
X предпочтительно представляет собой O, S или CH2, более предпочтительно O или CH2. Другие представляющие интерес соединения представляют собой такие соединения, где R6 представляет собой H или C(Y)R15 и R15 представляет собой H или (1-4C)алкил, предпочтительно (1-2C)алкил, причем алкильные группы необязательно замещены одним или несколькими атомами галогена.
Также предпочтительными являются соединения, где R2 представляет собой H, галоген или NO2. Наиболее предпочтительными, в качестве R2, являются H и F.
Наиболее предпочтительными соединениями являются соединения, где R11 представляет собой H и R12 представляет собой (1-6C)алкоксикарбонил, (1-4C)алкилсульфонил или (6-10C)арилсульфонил.
Также в высшей степени предпочтительными являются соединения, где R2 представляет собой H, R3 представляет собой галоген, R15 представляет собой метил, необязательно замещенный 1-3 атомами галогена, и Y представляет собой O или S, более конкретно, те соединения, где R4 представляет собой H и X представляет собой O. Соединения, имеющие некоторые из предпочтений, указанных выше в связи с общей формулой I, или дополнительных, являются в высшей степени предпочтительными.
Дополнительными предпочтительными соединениями являются такие, где R2 представляет собой H или галоген, R3 и/или R4 являются независимо выбранными из группы, состоящей из H, CN, галогена, (2-4C)алкенила и C(O)(1-4C)алкила и R5 и/или R10 являются независимо выбранными из H или галогена.
Более предпочтительными являются соединения, где X выбирается из группы, состоящей из O, S и NCH3.
Также предпочтительными являются соединения, где R8 и R9 представляют собой H.
Кроме того, предпочтительными являются соединения, где R6 представляет собой H или C(Y)R15 и R15 представляет собой H или (1-4C)алкил, необязательно замещенный одним или несколькими атомами галогена.
Также предпочтительными являются соединения, где Y представляет собой O или S и R15 представляет собой метил, необязательно замещенный одним или несколькими атомами галогена.
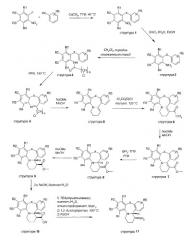
Схема I
Последовательности стадий для синтеза соединений по настоящему изобретению показаны на схемах I-XVIII. В каждой из схем группы R соответствуют структурам замещения, отмеченным в примерах и формуле I.
Тетрациклическая система (такая как структура 11) создается с помощью рутинных способов синтеза, как описывается в схеме I. Нуклеофильное ароматическое замещение 2-фторнитрофенилов соответственно замещенными фенолами, тиофенолами или анилинами дает диариловые простые эфиры, простые тиоэфиры или амины 1 соответственно. В случае X = CH2 структура 1 является коммерчески доступной. Восстановление нитрогруппы с помощью SnCl2 дает производные анилина 2. Ацилирование функциональной группы анилина 5-хлорвалерилхлоридом дает амиды 3. Следующее далее замыкание кольца осуществляется путем обработки амида PPA (полипарабановой кислотой) при 150°C. Обработка иминовых структур 4 метоксидом натрия приводит к внутримолекулярной циклизации и дает тетрациклические системы 5. Взаимодействие енаминовой функциональной группы с трихлорацетилхлоридом дает трихлорацетильные производные 6. Трихлорацетильная функциональная группа преобразуется в производные сложного метилового эфира 7 при обработке метоксидом натрия. Последующее восстановление алкеновой функциональной группы ненасыщенных карбоксилатов 7 бораном дает исключительно цис-изомеры, такие как структуры 8. Эпимеризация до транс-изомеров 9 осуществляется при обработке 8 метоксидом натрия. Омыление сложного эфира дает карбоксилат 10, который впоследствии преобразуется посредством классической реакции Курциуса в аминовую функциональную группу, приводит к получению производных транс-1-амино-тетрагидропиридодибензо(окс/ти/ди)азепина 11. Рацемическая смесь разделяется на ее чистые энантиомеры посредством хиральной ВЭЖХ (колонка OJ (25 x 0,46 см)).
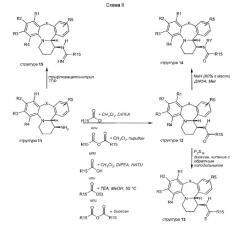
Тетрациклические соединения (11) используются в качестве исходных материалов в схемах II и III. На схеме II показано ацилирование аминовой функциональной группы структуры 11, которое осуществляется посредством многочисленных различных рутинных способов синтеза (например, хлорангидридов, ангидридов, карбоновых кислот со связывающими реагентами или амидирования). Полученные амидные структуры 12 являются мишенью для следующей далее модификации. Обработка амидов, таких как структура 12, пентасульфидом фосфора дает тиоамиды 13. Алкилирование амида в структуре 12 алкилирующими агентами в присутствии гидрида натрия дает структуры 14. Структуры 15 получают посредством образования амидина аминовой функциональной группы 11 путем обработки нитриловыми производными, такими как трифторацетонитрил.
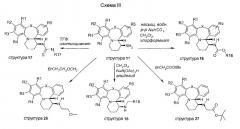
Схема III описывает образование уретановых структур 16, исходя из структур 11, посредством взаимодействия с хлорформиатами в присутствии бикарбоната натрия. Обработка структуры 11 изотиоцианатами дает производные тиомочевины структуры 17. Восстановительное алкилирование аминовой функциональной группы в структуре 11 альдегидами в присутствии триацетоксиборгидрида натрия дает структуры 18. Алкилирование аминовой функциональной группы 2-метоксиэтилбромидом дает структуры 26. Структуры 27 получают путем обработки трет-бтилбромацетатом.
Прямые электрофильные ароматические замещения в структурах каркаса дают различные альтернативные ароматические замещенные производные (схемы IV-V).
В схеме IV описывается хлорирование структуры 12, где R3 представляет собой Cl, N-хлорсукцинимидом в присутствии каталитического количества HCl; это приводит к образованию двух различных замещенных структур 19A и 19B, которые легко разделяются. В противоположность этому, бромирование структуры 12 N-бромсукцинимидом при идентичных условиях дает только соединение со структурой 20. Восстановительное дегалогенирование хлор-замещенного соединения (12) достигается путем обработки водородом в присутствии Pd/C и HCl, с получением водород-замещенного производного 21. Нитрирование структуры 12 азотной кислотой дает совершенно селективно моно-замещенное производное 22.
Прямое хлорирование на структуре 21 (схема V) N-хорсукцинимидом дает два региоизомера 23A и 23B, два соединения, которые легко разделяются с помощью хроматографических методов.
Как показано на схеме VI, восстановление нитро функциональной группы структур, таких как структуры 22, SnCl2·2H2O в этаноле, дает анилиновые производные 24. Сульфонирование или ацилирование этой анилиновой функциональной группы дает замещенные соединения, такие как структура 25.
Как изображено на схеме VII, обработка дихлорсоединения 19B K2CO3 приводит к образованию соответствующего амина 28, и последующее формилирование этилформиатом дает структуру 29.
Схемы VIII и IX описывают синтез бромпроизводных 36, где R4 = Br. Образование имина путем обработки смеси амина и салицилальдегида п-толуолсульфоновой кислотой и последующее замыкание кольца путем этерификации дает трициклические промежуточные соединения 31.
Схема IX описывает последовательности стадий синтеза соединения 36, исходя из трициклических промежуточных соединений, таких как соединения 31. Обработка трициклического имина 31 глутаровым ангидридом дает тетрациклы 32. Перегруппировка Курциуса с помощью DPPA и спирта приводит к образованию уретановых структур 33. Восстановление амидной функциональной группы осуществляется путем применения борана в ТГФ. Обработка уретановых структур 34 HBr в уксусной кислоте дает амины 35. Ацилирование аминовой функциональной группы трифторуксусным ангидридом дает соответствующие амиды 36.
Бромпроизводные 36 используют в качестве исходных материалов в схеме X. Реакции Штилле дают соединения с ацетильной (структуры 37) или винильной функциональной группой (структуры 39). Обработка бромпроизводных 36 CuCN дает соответствующие цианосоединения 38. Соединение 40 синтезируют с помощью реакции Негиши с палладиевым катализатором и метилцинкхлоридом. Обработка бромпроизводных 36 CuI и NaOMe дает метоксипроизводные 41.
Синтез соединений 46 осуществляют аналогично способу, описанному для бромпроизводных 36. Трициклическое промежуточное соединение 45 синтезируют способом, иным, чем описано на схеме XI. Синтез начинается с этерификации, с последующим восстановлением нитро функциональной группы и формилированием амина 43. Затем обработка PPA осуществляет замыкание кольца до трициклического соединения 45.
Бромпроизводное 46 используется в качестве исходного материала в схеме XII, где винильное (структура 49) и ацетильное производное (структура 47) образуется с помощью реакции Штилле. Нитрильная функциональная группа вводится путем обработки CuCN. Бензиламин вводится с помощью реакции Бухвальда; следующее далее гидрирование этого продукта генерирует амин 51. Взаимодействие с пропионилхлоридом дает соответствующий амид (структура 52).
Синтез производных при R5 ≠ H описывается в схемах XIII и XIV. Трициклическое промежуточное соединение получают путем образования имина и следующего далее замыкания кольца посредством этерификации.
Цианопроизводное 56, метиловое производное 57 и дихлорсоединение 58 получают путем обработки соединения 55 CuCN, метилцинкхлоридом или NCS соответственно, как описано на схеме X.
Способ синтеза с получением фторпроизводных 61 (R5 и/или R10 = F) изображен на схеме XV и подобен способу синтеза с получением производных с R5 ≠ H (схема XIII). В этом случае замыкание кольца путем этерификации осуществляется с помощью использования микроволновой печи.
Производные с X = N-Me (структуры 67, 68 и 69) синтезируют в соответствии со схемой XVI. Трициклическое промежуточное соединение 65 синтезируют путем сочетания 4-хлор-1-фтор-2-нитробензола и N-метиланилина, с последующим восстановлением нитро функциональной группы и формилированием амина. Замыкание кольца с получением промежуточного соединения 65 осуществляется путем обработки PPA. Последовательности стадий синтеза соединения 66 из соединения 65 описаны на схеме IX. Аминовая функциональная группа соединения 66 ацилируется, с получением амида 67, или алкилируется с получением соединения 68. Следующее далее омыление дает соединение 69.
Способ с получением производных с X = N-H осуществляют через трициклический амид 72, который получают путем внутримолекулярной конденсации. Восстановление с помощью LiAlH4 и следующее затем окисление с помощью MnO2 дает трициклическое промежуточное соединение 74. Соответствующий амид 75 синтезируют, как описано на схеме IX.
Применение 3-метилглутарового ангидрида при получении тетрациклического промежуточного соединения 78 и при следующем далее получении уретана приводит к получению смеси изомеров 80, 81 и 82, как показано на схеме XVIII. Обработка HBr в уксусной кислоте, со следующим далее ацилированием и разделением изомеров, приводит к получению амидов 86, 87 и 88.
Способы для определения связывания с рецептором, а также анализы in vitro и in vivo для определения биологической активности соединений хорошо известны. Как правило, экспрессированный рецептор обрабатывают соединением по настоящему изобретению и определяют связывание, или стимулирование, или ингибирование функциональной реакции.
Для измерения функциональной реакции изолированная ДНК, кодирующая ген рецептора прогестерона, предпочтительно рецептора человека, экспрессируется в соответствующие клетки хозяина. Такая клетка может представлять собой клетку яичника китайского хомячка (CHO), но и другие клетки также являются пригодными для использования. Предпочтительно клетки берутся у млекопитающих.
Способы конструирования рекомбинантных линий клеток, экспрессирующих рецепторы прогестерона, хорошо известны в данной области (Sambrook et al., Molecular Cloning: a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, самое последнее издание). Экспрессия рецептора достигается путем экспрессии ДНК, кодирующей желаемый белок.
Методики для сайт-ориентированного мутагенеза, лигирования дополнительных последовательностей, PCR (полимеразной цепной реакции) и конструирования соответствующих систем экспрессии сегодня являются, все, хорошо известными в данной области. Части ДНК или вся ДНК, кодирующая желаемый белок, может конструироваться синтетически, с использованием стандартных твердофазных методик, предпочтительно с включением сайтов рестрикции для простоты лигирования. Соответствующие элементы контроля для транскрипции и трансляции включенной кодирующей последовательности могут создаваться посредством кодирующих последовательностей ДНК. Как хорошо известно, сейчас доступны системы экспрессии, которые совместимы с широким множеством хозяев, включая прокариотических хозяев, таких как бактерии, и эукариотических хозяев, таких как дрожжи, растительные клетки, клетки насекомых, клетки млекопитающих, клетки птиц и тому подобное.
Клетки, экспрессирующие рецептор, затем приводятся в контакт с соединением по настоящему изобретению для наблюдения связывания, или стимулирования, или ингибирования функциональной реакции.
Альтернативно, выделенный цитозоль, содержащий экспрессированный рецептор, может использоваться для измерения связывания соединения по настоящему изобретению.
Для измерения связывания могут использоваться радиоактивные или флуоресцентномеченные соединения. В качестве эталонного соединения может использоваться нативный гормон или другие соединения, связывающиеся с рецептором. В качестве альтернативы могут осуществляться также анализы конкурентного связывания.
Другой анализ включает в себя скрининг на соединения - агонисты рецептора прогестерона по настоящему изобретению путем определения регуляции природной мРНК целевого гена, медиируемой рецептором, то есть генов, регулируемых рецептором посредством связывания рецептора в промоторной области гена. Уровни мРНК целевого гена будут понижаться или повышаться, в зависимости от ингибирующего или стимулирующего эффекта соединения по настоящему изобретению при связывании с рецептором.
В дополнение к непосредственному измерению уровней мРНК в подвергающихся воздействию клетках могут быть использованы клетки, которые, в дополнение к трансфицированию ДНК, кодирующей рецептор, трансфицируются также второй ДНК, кодирующей репортерный ген, экспрессия которого отвечает связыванию рецептора с чувствительными элементами в промоторе конкретного репортерного гена. Такие чувствительные элементы могут представлять собой классические гормон-чувствительные элементы, хорошо известные в данной области и описанные, например, в Beato, M., Chalepakis, G., Schauer, M., Slater, E.P. (1989) J. Steroid Biochem. 5:737-47 или могут конструироваться таким образом, что они соединяются с новыми чувствительными элементами. Как правило, экспрессия репортерного гена может контролироваться любым чувствительным элементом, реагирующим на связывание рецептора прогестерона. Соответствующие репортерные гены представляют собой, например, LacZ, щелочную фосфатазу, люциферазу светлячка и белок с зеленой флуоресценцией (GFP).
Для выбора активных соединений агонистов рецептора прогестерона исследование при 10-5 M должно приводить к получению активности, большей, чем 30% от максимальной активности, когда (16α)-16-этил-21-гидрокси-19-норпрегн-4-ен-3,20-дион (Org 2058) используется в качестве эталона. Для выбора соединений - антагонистов рецептора прогестерона исследование при 10-5 M должно приводить к активности, превышающей более чем на 10% максимальную активность, когда (6β,11β,17β)-11-[4-(диметиламино)фенил]-4',5'-дигидро-6-метилспиро[эстра-4,9-диен-17,2'(3'H)-фуран]-3-он (Org 31710) используется в качестве эталона. Другой критерий может представлять собой значение EC50, которое должно составлять <10-5 M, предпочтительно <10-7 M.
Специалист в данной области заметит, что желаемые значения EC50 зависят от того, какие соединения по настоящему изобретению исследуются. Например, соединение с EC50, которое меньше, чем 10-5 M, как правило, рассматривается как кандидат на выбор лекарственного средства. Предпочтительно, это значение, меньше, чем 10-7 M. Однако соединение, которое имеет более высокое значение EC50, но является селективным к конкретному рецептору, по-прежнему может быть кандидатом на поиск лекарственного средства.
В основном, любой анализ трансактивирования клеток млекопитающих (линии клеток или первичной культуры), который может дать информацию о возможном активировании рецептора, может использоваться для целей выбора сильнодействующих лигандов. Суммарное значение при использовании нескольких систем клеток с клетками, которые происходят от различных органов, может предоставлять нужную информацию по потенциальной тканевой специфичности лигандов, которая получается при этом. Примеры клеток, часто используемых для этой цели, представляют собой, наряду с клетками CHO, клетки, среди прочих, T47D, клетки MCF7, клетки ECC-1, клетки HeLa, первичные культуры эндометриальных клеток и гипофизарные клетки.
Настоящее изобретение, кроме того, относится к фармацевтической композиции, содержащей соединение общей формулы I или его соль.
Таким образом, соединения по настоящему изобретению могут использоваться в терапии.
Соединения по настоящему изобретению могут использоваться клинически в тех режимах, где используют прогестагены.
Следовательно, настоящее изобретение заключается в использовании соединения, имеющего общую формулу I, для изготовления медикамента для модуляции состояний здоровья у женщин, медиируемых рецептором прогестерона, более конкретно гормонально зависимых раковых заболеваний, таких как рак груди, яичников и матки; контроля эндометриоза и рождаемости. Настоящее изобретение также относится к лечению состояний, определенных выше, путем введения соединения по настоящему изобретению.
Соответствующие способы введения соединений формулы I или их фармацевтически приемлемых солей, также упоминаемых здесь как активный ингредиент, представляют собой внутримышечные инъекции, подкожные инъекции, внутривенные инъекции или внутрибрюшинные инъекции, пероральное и интраназальное введение. Предпочтительно соединения могут вводиться перорально. Конкретная доза и режим введения активного ингредиента или его фармацевтической композиции обязательно будет зависеть от терапевтического воздействия, которое должно быть достигнуто (например, лечение бесплодия; контрацепция, эндометриоз), и могут изменяться вместе с конкретным соединением, способом введения и возрастом и состоянием индивидуального субъекта, которому должен вводиться медикамент.
Как правило, парентеральное введение требует более низких доз, чем другие способы введения, которые сильнее зависят от поглощения. Однако дозировка для людей предпочтительно содержит 0,0001-25 мг на кг массы тела. Желаемая доза может быть представлена как однократная доза или как множество поддоз, вводимых через соответствующие интервалы, в течение дня или, в случае пациентов женского пола, как дозы, которые должны вводиться через соответствующие (дневные) интервалы в течение менструального цикла. Дозировка, как и режим введения, могут различаться для пациентов мужского и женского пола.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединение формулы I в смеси с фармацевтически приемлемыми вспомогательными веществами и, необязательно, другими терапевтическими веществами. Вспомогательные вещества должны быть "приемлемыми", в смысле, быть совместимыми с другими ингредиентами композиции и быть безвредными для пациентов.
Фармацевтические композиции включают в себя композиции, пригодные для перорального, ректального, назального, местного (включая трансдермальное, буккальное и сублингвальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и чрезкожное) введения или введения посредством имплантанта. Композиции могут быть получены с помощью любого способа, хорошо известного в области фармации, например, с использованием таких способов, как описаны в Gennaro et al., Remington's Pharmaceutical Sciences (18th ed., Mack Publishing company, 1990, смотри конкретно Part 8: Pharmaceutical Preparations and Their Manufacture).
Такие способы включают в себя стадию приведения в ассоциированное состояние активного ингредиента с любым вспомогательным веществом. Вспомогательное вещество (вещества), также именуемые дополнительные ингредиенты, включают в себя ингредиенты, обычные в данной области (Gennaro, выше), такие как наполнители, связующие, разбавители, дезинтеграторы, лубриканты, красители, ароматизаторы и смачивающие вещества.
Фармацевтические композиции, пригодные для перорального введения, могут быть представлены как дискретные дозированные единицы, такие как пилюли, таблетки или капсулы, или как порошок или гранулы, или как раствор или суспензия. Активный ингредиент также может быть представлен как болюс или паста. Кроме того, композиции могут включаться в суппозиторий или клизму, для ректального введения.
Кроме того, настоящее изобретение включает в себя фармацевтическую композицию, как описано выше, в сочетании с упаковочным материалом, включая инструкции для применения композиции, для такого использования, как описано выше.
Для парентерального введения соответствующие композиции включают в себя водные и неводные стерильные растворы для инъекций. Композиции могут быть представлены в однодозовых или многодозовых контейнерах, например в герметичных флаконах и ампулах, и могут храниться в высушенном вымораживанием (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например воды, перед использованием.
Композиции или препараты, пригодные для введения путем назальной ингаляции, включают в себя мелкодисперсные порошки или аэрозоли, которые могут генерироваться посредством аэрозольных ингаляторов, небулайзеров или инсуффляторов высокого давления с отмеряемыми дозами.
Производные по настоящему изобретению могут также вводиться в форме устройств, состоящих из сердцевины из активного материала, окруженной мембраной, регулирующей скорость высвобождения. Такие имплантанты должны применяться подкожно или местным образом, они будут высвобождать активный ингредиент примерно при постоянной скорости в течение относительно длительных периодов времени, например от недель до лет. Способы для изготовления имплантируемых фармацевтических устройств как таковых известны в данной области, например, как описано в Европейском патенте 0303306 (AKZO N.V.).
Настоящее изобретение иллюстрируется с помощью следующих далее примеров.
ПРИМЕРЫ
Пример 1
транс-7-Фтор-2,3,4,14b-тетрагидро-1H-дибензо[b,f]пиридо[1,2-d][1,4]оксазепин-1-амин
(Структура 11 схемы I, где R1 = H, R2 = H, R3 = F, R4 = H, R5 = H, R6 = H, R7 = H, X = O)
5-Фтор-2-феноксинитробензол
Cs2CO3 (12,1 г, 62,9 ммоль) добавляют к раствору фенола (5,9 г, 62,9 ммоль) в 400 мл ТГФ, в атмосфере N2. После перемешивания в течение 15 минут добавляют 2,5-дифторнитробензол (6,82 мл, 62,9 ммоль) в 50 мл ТГФ. Полученную смесь нагревают при 40°C в течение 25 часов. Реакцию отслеживают с помощью ВЭЖХ, до детектирования исчезновения 2,5-дифторнитробензола. Добавляют воду и этилацетат, с последующей экстракцией этилацетатом (2x). Объединенные органические слои последовательно промывают насыщенным водным раствором бикарбоната натрия (3x)