Лекарственное средство, оказывающее антиишемическое, антигипоксическое и противосудорожное действие при черепно-мозговой травме
Иллюстрации
Показать всеПредложено применение известного снотворного и модулятора активности ГАМК зопиклона в качестве лекарственного средства с многофакторным нейропротекторным действием на ишемию, гипоксию с гиперкапнией, судороги в острый период черепно-мозговой травмы. Изобретение обеспечивает профилактику вторичных осложнений, обусловленных черепно-мозговой травмой, и восстановление нервно-психического статуса. Показано, что в первые три дня пост-травматического периода зопиклон на 24,9-42,6% (против вазодилататора нимодипина или против антигипоксанта натрия оксибутирата) повышал устойчивость головного мозга при травме к ишемии, гипоксии, гиперкапнии и судорогам. 4 табл.
Реферат
Изобретение относится к медицине, конкретно к невропатологии. Предлагается известное снотворное средство зопиклон (др. название имован), которое в качестве нейропротектора может быть использовано для фармакологической коррекции нарушений в деятельности ЦНС, обусловленных черепно-мозговой травмой.
Цель изобретения - профилактика вторичных осложнений, обусловленных черепно-мозговой травмой, и восстановление нервно-психического статуса. Сущность способа заключается в применении известного снотворного средства зопиклона для нейропротекции повреждений деятельности ЦНС ишемического, гипоксического, судорожного и мнестического характера в остром периоде черепно-мозговой травмы.
Исходы лечения черепно-мозговой травмы определяются, в основном, вторичными повреждениями мозга вследствие ишемии, гипоксии с гиперкапнией, судорог, повышенного внутричерепного давления, посттравматической энцефалопатией. Для фармакологической коррекции этих синдромов применяют нейропротекторные средства, устраняющие расстройства микроциркуляции или метаболизма, ведущие к гибели нейронов мозга (Меддрум, 1995, Е.И.Гусев и др., 2001). С этих позиций применяют вазоактивные вещества (нимодипин, сермион, эуфиллин и др.), нейрометаболики (пирацетам, актовегин и др.), барбитураты (фенобарбитал), бензодиазепины (диазепам и др.), корректоры лактоацидоза (трометамин) и др. Однако используемые в настоящее время препараты обладают, как правило, нейропротекторным действием в отношении расстройств, вызываемых одним из многих факторов вторичного повреждения мозга. Вазоактивные вещества предупреждают развитие или устраняют ангиоспазмы, ведущие к ишемии. Барбитураты уменьшают интенсивность последствий гипоксии с гиперкапнией, препятствуя истощению метаболических резервов и повышению внутричерепного давления. Безодиазепины предупреждают возникновение вторичных судорожных эпизодов, усугубляющих влияние на травмированный мозг высокого внутричерепного давления, колебаний артериального давления, сниженной доставки кислорода, метаболического дефицита (И.А.Качков и др., 1999, Р.Д.Касымов, А.Н.Кондратьев, 2001, Т.А.Скоромец, 2002, A.I.Faden, 1996, Р.Мартуза, М.Проктор, 1997). Необходимо указать, что комбинированное применение этих средств считается одним из вариантов «агрессии» по отношению к больному с черепно-мозговой травмой (И.А.Качков и др., 1999).
Лекарственные средства с многофакторным нейропротекторным действием на ишемию, гипоксию с гиперкапнией, судороги и когнитивные нарушения в условиях черепно-мозговой травмы в настоящее время неизвестны. Поэтому лекарственное средство, предлагаемое нами для терапии раннего посттравматического периода, не имеет аналогов.
Целью изобретения является уменьшение повреждающего влияния на деятельность нервной ткани ишемии, гипоксии, судорог и одновременно позитивное влияние на адаптивные реакции, обеспечивающие быструю и стабильную компенсацию нервно-психических функций при черепно-мозговой травме.
Поставленная цель достигается тем, что в качестве средства с многофакторным действием на ключевые звенья патогенеза и саногенеза черепно-мозговой травмы применяют модулятор активности ГАМКа-рецепторного комплекса зопиклон.
Зопиклон (имован) является производным циклопирролана и относится к группе «небензодиазепиновых» модуляторов ГАМКа-рецепторного комплекса, усиливающих гамкергические процессы в мозге (Э.Д.Тревор, У.Л.Вэй, 1998). Препарат сокращает время засыпания, уменьшает количество ночных пробуждений, увеличивает общую продолжительность сна и не изменяет его структуру. Обладает также анксиолитическим и мышечно-расслабляющим эффектом.
Известно применение зопиклона в неврологической практике при различных формах бессонницы как снотворного средства (Справочник Видаль, 2002).
Применение зопиклона по новому назначению стало возможным благодаря выявленным нами новым фармакологическим свойствам препарата.
Впервые показано, что зопиклон в ранний период после черепно-мозговой травмы оказывает антиишемический, антигипоксический, противосудорожный эффект и способствует выработке новых адаптивных реакций. В литературе не описаны эти свойства зопиклона, которые в условиях черепно-мозговой травмы обеспечивают повышение устойчивости мозга к ишемии, гипоксии, гиперкапнии, судорогам и стимуляцию обучения. Такое многофакторное нейропротекторное действие зопиклона, предполагающее более быстрый темп восстановления нервных и психических функций при черепно-мозговой травме, в литературе не описано.
Экспериментально установлено, что 8-9 дневное введение зопиклона животным, перенесшим черепно-мозговую травму, продляет жизнедеятельность головного мозга при его полной ишемии, увеличивает резервное время при гипоксии с гиперкапнией, предупреждает развитие и уменьшает продолжительность судорог, а также устраняет нарушения скорости приобретения новых адаптивных реакций и их отсроченного воспроизведения.
Эксперименты проведены на мышах линии СВА массой 20-25 г и крысах линии Вистар массой 140-180 г. Животным наносили контактную черепно-мозговую травму. Начиная со 2 дня, опытной группе животных вводили зопиклон в дозе 2 и 7,5 мг/кг перорально /через зонд/. Животным группы сравнения вводили вазоактивный препарат нимодипин (2,5-5 мг/кг), антигипоксант натрия оксибутират (50 мг/кг), противосудорожный препарат магния сульфат (80 мг/кг) и ноотроп пирацетам (50 мг/кг), т.е. лекарственные средства, рекомендованные для применения при черепно-мозговой травме.
Нейропротекторную активность препаратов оценивали по устойчивости мозга к факторам его вторичного повреждения - ишемии, гипоксической гипоксии с гиперкапнией, судорожным явлениям, а также когнитивным нарушениям.
Для исследования антиишемической активности препаратов использовали декапитационную модель полной ишемии головного мозга (О.Н.Lowry et al., 1964, D.Gosal, J.E.Torres, 2001, В.И.Кулинский и др., 2001). С этой целью после декапитации на уровне 1 шейного позвонка определяли продолжительность и частоту агонального дыхания (гаспинга).
Антигипоксическую активность препаратов определяли по продолжительности резервного времени у мышей в условиях гермокамеры (Г.В.Ковалев, 1990).
Для оценки противосудорожной активности препаратов у крыс регистрировали продолжительность тонической экстензии при электрораздражении мозга через глазничные электроды и определяли защитный индекс - процент животных, у которых не возникали электрошоковые судороги (А.А.Дутов, 1998).
Оценка состояния мнестических и когнитивных функций у животных, перенесших черепно-мозговую травму, выполнена с использованием методики выработки и отсроченного воспроизведения условной реакции активного избегания (Г.В.Ковалев 1990). Эффекты препаратов оценивали по динамике времени обучения и числа проб, затраченных на выработку условных ответов до критерия обучения. Оценку состояния памяти производили по показателям отсроченного воспроизведения выработанных реакций (через 7 дней после сеанса обучения).
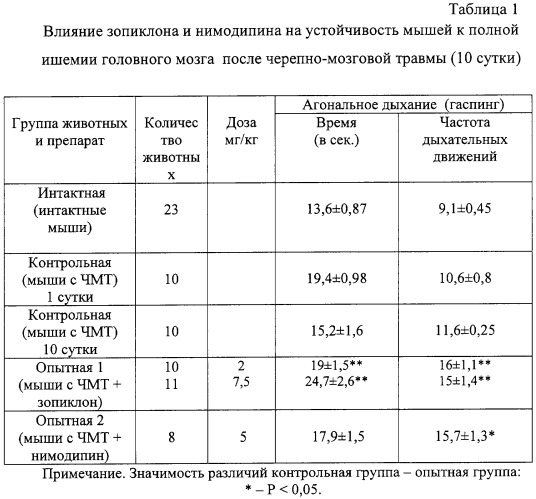
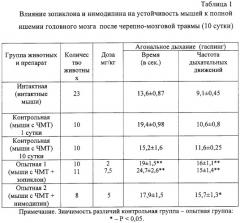
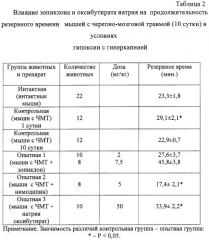
Проведенные исследования показали, что в первые три дня посттравматического периода наблюдается повышение на 24,9-42,6% устойчивости мозга к ведущим факторам его вторичного повреждения. Начиная с 3 суток, отмечается снижение показателей устойчивости головного мозга травмированных животных к ишемии, гипоксии, гиперкапнии и судорогам практически до уровня интактных животных (табл.1, 2, 3), что указывает на уменьшение активности эндогенных протекторных механизмов и повышение вероятности вторичного повреждения мозга.
Зопиклон оказывает выраженный протекторный эффект при ишемическом повреждении мозга. На 8-9 день введения зопиклона в дозе 2 мг/кг/сутки мышам с черепно-мозговой травмой продолжительность агонального дыхания на фоне полной ишемии головного мозга возросла на 25%, а его частота - на 37,9%. Максимальное увеличение продолжительности агонального дыхания (на 62,5%) наблюдалось при курсовом применении зопиклона в дозе 7,5 мг/кг/сутки. Частота агонального дыхания возросла на 29,3% в сравнении с контрольной группой. Эффективность препарата сравнения вазодилататора нимодипина, используемого в качестве вазоактивного средства при черепно-мозговой травме, была отчетливо ниже. В дозе 5 мг/кг/сутки нимодипин увеличивает продолжительность агонального дыхания при полной ишемии головного мозга травмированных животных на 17,8% (табл.1).
Экспериментально установлено, что курсовое введение зопиклона увеличивает резервное время у травмированных животных, помещенных в гермокамеру. В условиях черепно-мозговой травмы достоверное увеличение резервного времени у мышей отмечается после назначения 7,5 мг/кг/сутки (на 101%), что превышает эффект антигипоксического препарата сравнения натрия оксибутирата. Напротив, нимодипин в дозе 5 мг/кг/сутки уменьшал резервное время у травмированных животных на 33,9% (табл.2).
В сравнении с магния сульфатом зопиклон в дозе 7,5 мг/кг/сутки оказывал выраженное противосудорожное действие. Его курсовое введение предупреждает возникновение электрошоковых судорог у 83% травмированных животных. В остальных случаях отмечается уменьшение на 74,9% продолжительности тонической экстензии. Эксперименты показали, что противосудорожный эффект зопиклона превосходит противосудорожное действие препарата сравнения магния сульфата, входящего в стандарт лечения больных с черепно-мозговой травмой (табл. 3).
Таким образом, в отличие от симптоматических средств с избирательно вазоактивным (нимодипин), антигипоксическим (натрия оксибутират) или противосудорожным действием (магния сульфат) средство с гамкмиметической активностью зопиклон обладает многофакторным протекторным эффектом. Его позитивное влияние на течение ишемии, гипоксии, гиперкапнии и судорог не уступает или превосходит по силе нейропротекторного действия перечисленные выше препараты сравнения, которые входят в стандарт лечения в остром периоде черепно-мозговой травмы.
В серии исследований установлено, что наряду с многофакторным протекторным эффектом зопиклон обладает свойством активировать выработку адаптационных реакций.
Как показали контрольные наблюдения, на 3-6 сутки острого периода черепно-мозговой травмы у животных отмечается снижение на 122,5-76,4% скорости выработки адаптивного оборонительного ответа (Р≤0,05) и на 16,7% частоты его воспроизведения (Р≤0,05).
Курсовое применение зопиклона (7,5 мг/кг) не только полностью восстанавливает скорость обучения травмированных животных до уровня интактных животных, но и стимулирует приобретение поведенческих адаптивных ответов. Введение препарата сравнения пирацетама, эталонного ноотропного средства, рекомендованного для использования в подостром периоде для ускоренной нервно-психической реабилитации больных, восстанавливает показатели обучения адаптивным ответам до уровня интактных животных (табл. 4). Отсроченное воспроизведение адаптивных реакций (через 7 суток после сеанса обучения) не изменяется под влиянием курсового применения зопиклона и препарата сравнения пирацетама (табл.4).
Таким образом, полученные данные убедительно свидетельствуют о наличии у средства с гамкмиметической активностью зопиклона многофакторного нейропротекторного эффекта и способности активировать восстановление выработки адаптивных поведенческих реакций при черепно-мозговой травме.
| Таблица 3.Влияние зопиклона и нимодипина на течение электрошоковых судорог у крыс с черепно-мозговой травмой | |||||
| Группа животных и препарат | Количество животных | Доза (мг/кг) | Латентный период тонической экстензии (сек.) | Длительность тонической экстензии (сек.) | Защитный индекс |
| Интактная (интактные крысы) | 15 | 1,3±0,8 | 15,5±0,8 | 0/15 | |
| Контрольная (крысы с ЧМТ)1 сутки | 10 | 2,23±0,3 | 10,5±0,6 | 0/10 | |
| Контрольная (крысы с ЧМТ)10 суток | 10 | 1,6±0,8 | 13,9±1,3 | 0/10 | |
| Опытная 1 (крысы с ЧМТ + зопиклон) | 10 | 7,5 | 2,1±0,3 | 3,5±0,4* | 8/11* |
| Опытная 2 (крысы с ЧМТ + нимодипин) | 10 | 5 | 0,9±0,4 | 12,8±0,9 | 0/10 |
| Опытная 3 (крысы с ЧМТ + магния сульфат) | 10 | 80 | 1,6±0,3 | 9,6±0,3* | 5/10* |
| Примечание. Значимость различий контрольная группа - опытная группа: * - Р<0,05. |
| Таблица 4.Влияние зопиклона и пирацетама на выработку условной реакции активного избегания у мышей с черепно-мозговой травмой | |||||
| Группа животных и препарат | Количествоживотных | Доза (мг/кг) | Показатели выработки и отсроченного воспроизведения условной реакции активного избегания | ||
| Время поиска в первых трех пробах (с.) | Обучение до критерия (число проб) | Частота воспроизведения УРАИ через 7 суток (в%) | |||
| Интактная (интактные мыши) | 23 | 37,1±3,1 | 12,9±0,45 | 67,8±4,3 | |
| Контрольная (мыши с ЧМТ) 6 сутки | 12 | 62,1±6,6* | 22,4±1,4* | 51,1±3,9* | |
| Опытная 1 (мыши с ЧМТ + зопиклон) | 8 | 7,5 | 157,9±17** | 9,5±0,7* | 40,7±5,6 |
| Опытная 2 (мыши с ЧМТ + пирацетам) | 8 | 50 | 58,2±6,6 | 14,1±1,6* | 53,7±5 |
| Примечание. Значимость различий интактная группа - контрольная группа и контрольная группа - опытная группа: * - Р<0,05. |
Литература
1. Гусев Е.И., В.И.Скворцова. Ишемия головного мозга. - Москва: Медицина. 2001. - 327.
2. Дутов А.А. Исследование эффективности кавинтона и препаратов тиреоидных гормонов при эпилепсии // Автореф. докт. диссер. - Санкт-Петербург, 1998.
3. Касымов Р.Д., Кондратьев А.Н. Основные принципы хирургического лечения и интенсивной терапии тяжелой черепно-мозговой травмы. - Санкт-Петербург. - 2001.
4. Качков И.А., Амчеславский В.Г., Филимонов Б.А. Алгоритмы лечения тяжелой черепно-мозговой травмы // Consilium medicum. - 1999. -t.1. - №2. - 85-90.
5. Ковалев Г.В. Ноотропные средства. - Волгоград, 1990.
6. Кулинский В.И. Агонисты рецепторов - перспективные нейропротекторы // Вестник РАМН. - 2000. - №9. - С.39-43.
7. Мартуза З., Проктор М. Травма. - / Неврология под ред. Самуэльс М..М.: Практика, 1997. - С.355-398
8. Скоромец Т.А. Вторичная ишемия головного мозга в остром периоде черепно-мозговой травме // Автореф диссер. докт. мед. наук. - Санкт-Петербург, 2002. - с.44.
9. Справочник Видаль: лекарственные препараты в России. - М.: АстраФармСервис, 2002. - 1488 с.).
10. Тревор Э.Д., Вэй У.Л. Седативные и снотворные средства. - Базисная и клиническая фармакология. - Санкт-Петербург: Невский диалект, 1998 t.1 - С.411-429.
11. Faden A.I. Pharmacologic treatment of acute traumatic brain injury // JAMA 1996. - 276. - P.569-57.
12. Gostal D., J.E.Torres Brainstem nitric oxide tissue levels correlate with anoxiainduced gasping activity in the developing rat. // Biol. Neonate. - 2001. - Vol.79. - №22. - P.122-131.
13. Lowry O.H., Passoneau J.V., Hasselberger F.X., Schuiz D.W. Effect of ischemia on known substrates and cofactors of the glycolitic pathway in brain // J.Biol. Chem. - 1964. - Vol.239 - P 18-30.
Применение зопиклона в качестве нейропротекторного средства, угнетающего ишемические, гипоксические и судорожные явления в острый период черепно-мозговой травмы.