Применение производных пара-этоксианилинов, повышающих стойкость углеводородных топлив к детонации, и топливная композиция (варианты)
Иллюстрации
Показать всеИзобретение относится к применению N-ацетил-пара-этоксианилина, N-метил-N-ацетил-пара-этоксианилина, N-метил-пара-этоксианилина, N,N-диметил-пара-этоксианилина или их смеси, без или вместе с оксигенатами, в качестве компонентов или присадок для повышения стойкости углеводородных топлив к детонации для получения высокооктановой топливной композиции. Изобретение также относится к высокооктановым топливным композициям, содержащим указанные соединения. 4 н.п. ф-лы, 15 ил.
Реферат
Известно, что бензины прямой гонки состоят из устойчивых углеводородов, которые могут храниться в бензохранилищах без заметного смолообразования [1, 4]. Однако использование таких бензинов в двигателях внутреннего сгорания вызывает детонацию, которая способствует преждевременному его износу, уменьшению мощности, увеличению расхода топлива и неполному его сгоранию, что приводит к образованию окиси углерода и водорода, при этом происходит большое выделение дыма [1, 2, 4]. С появлением двигателей внутреннего сгорания, работающих на повышенных степенях сжатия, возникла проблема повышения октанового числа углеводородных горючих (топлив) [1, 2, 4]. Известно, что октановое число топлив возрастает с увеличением в топливе содержания разветвленных и ненасыщенных углеводородов и углеводородов ароматического ряда [1-7]. Так как бензины прямой гонки, или рифайнинг-бензины, сильно обогащены парафиновыми углеводородами нормального строения, их октановые числа обычно не превышают 60 ед. [1-4]. В настоящее время возрос спрос на высокооктановые углеводородные горючие (топлива) и продолжает расти [1-8, 16, 17]. Термический крекинг позволил резко поднять производство бензина и улучшить его качество [1, 4]. Уменьшение тенденций крекинг-бензинов к детонации обусловлено примесью в них олефиновых углеводородов, образующихся при термическом распаде больших молекул [1-7]. Постоянное развитие и совершенствование авиационной и автомобильной техники требует создание новых высокооктановых видов топлив [1-7]. Эту задачу можно решить созданием новых химических процессов риформинга бензинов прямой гонки, каталитического крекинга и каталитического риформинга или добавлением к углеводородным горючим (топливам) специальных антидетонационных добавок и высокооктановых компонентов [1, 4]. При этом может возникнуть эффект синергизма [1-7]. Хотя и считается перспективным получение высокооктановых углеводородных горючих (топлив, бензинов) технологическим путем, однако разработка самих методов и тем более создание и строительство новых технологических установок для получения высокооктановых топлив требует огромных капитальных затрат, что не всегда приемлемо для многих стран. Поэтому самым технологически и экономически выгодным является использование для получения высокооктановых углеводородных горючих (топлив, бензинов) антидетонационных добавок.
Известно, что для увеличения октанового числа топлив используют (применяют) как зольные, так и беззольные антидетонационные присадки (добавки) [1-17, 35].
Известными, но мало применяемыми в настоящее время зольными антидетонационными присадками (добавками), синергентами, являются органические соединения марганца, железа, меди, хрома, кобальта, никеля, редкоземельных элементов, свинца [1, 4, 5, 17, 35] и др., однако все они обладают высокой токсичностью, особенно органические соединения свинца. Соединения свинца и железа, как сами, так и продукты их сгорания, оказывают отрицательное воздействие на работу двигателей внутреннего сгорания, накапливаясь на электродах свечей зажигания, поршнях и стенках камеры сгорания, значительно сокращая его ресурс [1, 4, 5, 10-17, 35].
Беззольные антидетонационные добавки (присадки) хотя и менее эффективны, чем зольные, но находят более широкое распространение и применение, особенно в сочетании с другими компонентами [1-15, 17]. Наиболее известными и распространенными беззольными антидетонационными добавками (присадками) являются низкомолекулярные ароматические амины [N-метиланилин (ММА), ксилидин, толуидин]. Так, известна присадка экстралин, ТУ 6.02.571-90, содержащая в процентных массовых соотношениях диметиланилин до 4,5%, анилин до 6% и N-метиланилин до 100% [14]. Другой известной присадкой аналогичного типа является присадка АДА, ТУ 38-401-58-61-93, которая дополнительно содержит в своем составе антиокислительную добавку типа ионола [14]. Недостатками такого типа присадок являются ограничение их по содержанию в связи с увеличением продуктов окисления, смолообразования в бензине при хранении и нагарообразование во время эксплуатации в двигателе при повышенной их концентрации, и относительно невысокий прирост октанового числа в топливах [14, 17]. В качестве антидетонаторов известны также гомологи бензола: ксилол, этилбензол, толуол [14, 16, 17], которые весьма незначительно повышают октановое число топлив.
Известно использование в качестве антидетонаторов оксигенатов и их смеси этилового или метилового спирта с более высокомолекулярными спиртами: метил-трет-бутилового эфира и его смесь с изобутиловым спиртом в соотношениях 60-80% и 40-20% соответственно [14]. Недостатками таких добавок (присадок) являются незначительное поднятие октанового числа бензинов при высоком (до 25%) их содержании.
До настоящего времени имеется весьма ограниченный ассортимент беззольных антидетонационных добавок (присадок) в виде индивидуальных соединений (веществ), что не позволяет создавать на их основе новые виды высокооктановых углеводородных горючих (топлив) с требуемыми свойствами для каждого конкретного случая в зависимости от поставленных целей или с универсальными свойствами.
Добиться такого результата можно в случае использования в качестве компонентов добавок (присадок) к углеводородным горючим (топливам) предложенных нами веществ.
Общеизвестно, что свойства соединений (веществ) зависят в основном не только от элементов, входящих в состав их молекул, но и от взаимного расположения этих элементов или групп атомов элементов по отношению друг к другу, а также за счет каких связей проходит их объединение в молекуле вещества, то есть конструкция молекул, их состав и вид связей в них определенным образом влияют на физическое и химическое поведение веществ (соединений) как внутримолекулярное, так и межмолекулярное, включая взаимодействие между молекулами разных веществ (соединений), что в свою очередь может существенно повлиять на свойства всей системы в целом.
Известно, что углеводородные горючие (топлива) состоят из смеси различных углеводородов, которые могут при определенном сочетании компонентов приобретать нужные свойства в процессе их использования (применения), а именно как углеводородное горючее (топливо) в двигателях внутреннего сгорания, где для их оптимальной работы требуется одновременное достижение максимального давления паровоздушной смеси в момент прохождения поршнем верхней мертвой точки и разложение (возгорание) этой смеси от электрической искры свечи зажигания. Если эти условия не соблюдаются возникает детонация, которая отрицательно влияет на работу двигателя, расход топлива и состав отработанных газов [1-7].
Для регулирования таких процессов используются (принимаются) такие соединения (вещества), возбуждение молекул которых может происходить только от одного определенного фактора (например, электрической искры) и переносить возбуждение сенсибилизированно на всю систему и при этом тормозить другие факторы, преждевременно влияющие на этот процесс, например высокотемпературные воздействия (термическое) на систему, что является определяющим условием оптимальной работы двигателей внутреннего сгорания.
Ароматические амины могут в сочетании с углеводородными горючими (топливами), состоящими из смеси различных углеводородов, образовывать межмолекулярные связи с молекулами веществ, входящих в состав топлив, посредством возникновения комплексов с переносом заряда, π - комплексов, σ - копплексов, а также свободных стабильных радикалов и других активных промежуточных продуктов с резонансным обменом энергии или новых образований [18-32], что и определяет возможность проявления синергетического эффекта. Возбуждение системы может осуществляться различными и многочисленными факторами одновременно или избирательно только от какого-нибудь одного фактора, например от электрического разряда, что очень важно при протекании процессов определенной направленности, происходящих при данных условиях.
Известно применение этоксианилинов (фенетидинов, аминофенетолов) для получения лекарственных препаратов и для синтеза красителей (например, триарилметановых) [33].
Известно применение N-цетил-пара-этоксианилина (N-цетил-пара-фенетидина, фенацетина, ацетфенетидина) в качестве жаропонижающего, болеутоляющего и противовоспалительного средства при невралгиях, головных болях, воспалительных заболеваниях [33, 36].
Нами предложены соединения (вещества), проявляющие высокоэффективные антидетонационные свойства, в конструкции структур молекул которых имеются одновременно не только первичная или вторичная, или третичная аминогруппа, но и алкоксигруппа, что определяет их сродство как с ароматическими аминами, так и с оксигенатами, причем по своим антидетонационным свойствам они превосходят известные по аналогичному применению ароматические амины и значительно эффективнее оксигенатов, а наличие в составе молекул таких соединений кислородосодержащих групп может частично снизить дефицит кислорода в случае возникновения его недостатка по разным причинам в камере сгорания и тем самым уменьшить вероятность образования (как из веществ, входящих в состав самих бензиновых фракций, так и из компонентов, присадок класса ароматических аминов, добавляемых к топливам для повышения их октанового числа) канцерогенных соединений типа бензпирена, выбрасываемых в атмосферу вместе с выхлопными газами, что может улучшить экологию окружающей среды, а также снизить возможность смоло- и нагарообразования на внутренних деталях двигателей внутреннего сгорания в процессе их работы, а это в свою очередь может значительно увеличить процентное содержание предложенных нами соединений в углеводородных топливах по сравнению с известными ароматическими аминами. Таким образом, предложенные нами соединения (вещества), являющиеся одновременно и оксигенатами, и ароматическими аминами, обладающие совокупными свойствами каждого из них, существенно и выгодно отличаются от всех известных ароматических аминов и оксигенатов, используемых в настоящее время для повышения октанового числа углеводородных горючих (топлив).
Прототипами в данном случае могут быть выбраны как оксигенаты (этил- или метил-трет-бутиловый эфир), так и анилин, ксилидин, толуидин, N-метиланилин, N,N-диметиланилин, которые являются первичными, вторичными и третичными аминами.
Недостатками оксигенатов является необходимость их добавления в бензин в больших количествах (10-25%), для поднятия октанового числа на 3-8 единиц, при этом снижается энергетика топлив и отрицательное влияние на резинотехнические детали автомобилей [14, 16, 17].
Недостатками присадок, содержащих анилин и его известные по данному назначению производные, является их нестабильность, ограниченная растворимость некоторых из них в топливах, повышение смолообразования и нагарообразование, вследствие чего их допустимые концентрации ограничены 1-1,3% (мас.), и необходимость их применения в сочетании с антиоксидантами, оксигенатами, моющими присадками.
Эта задача решается использованием (применением) предложенных нами N-ацетил-пара-этоксианилина (N-ацетил-пара-фенетидина, фенацетина), и/или N-метил-N-ацетил-пара-этоксианилина (N-метил-N-ацетил-пара-фенетидина), и/или N-метил-пара-этоксианилина (N-монометил-пара-этоксианилина, N-метил-пара-фенетидина), и/или N,N-диметил-пара-этоксианилина (N,N-диметил-пара-фенетидина), индивидуальных или их смесей, в качестве компонентов или присадок (добавок) или/и синергентов без или с оксигенатами, для повышения стойкости углеводородных горючих (топлив) к детонации.
Так как периодическая и патентная литература не содержит достаточно полных и убедительных подтверждений, определяющих правильность соответствия приводимых в ней названий и формул веществ, то нами были синтезированы нашим способом соединения и выделены в чистом виде, что позволило исследовать и охарактеризовать их физико-химическими методами, полностью подтвердившими строение предложенных нами соединений, поэтому данные этих исследований приводятся нами в тексте, которые доказывают, что синтезированные нами соединения фактически получены и использованы нами для изучения их антидетонационных свойств.
Получение N-метил-N-ацетил-пара-этоксианилина.
22,78 г N-ацетил-пара-этоксианилина, полученного согласно методикам, описанным в [34, 36, 37, 38], растворяли в 150 мл ацетона, добавляли 20,36 г мелкорастертого едкого натра. Смесь доводили до кипения, порциями приливали раствор 12 мл йодистого метила в 50 мл ацетона. После 15 мин кипячения смеси максимально отгоняли ацетон. В реакционную массу добавляли 40 мл воды и перемешивали ее 5 мин при 50°С. Добавляли 150 мл толуола. Органический слой отделяли, сушили над КОН и после фильтрации перегоняли в вакууме, собирая фракцию с Т.кип.=115-117°С при 1 мм рт.ст. Получили 20 г (81,4%) светложелтой жидкости N-метил-N-ацетил-пара-этоксианилина, nD 20=1,5280; d=1,03 г/см3.
Найдено: С 68,39; Н 7,81; N 7,28%. М+193 (масс-спектром). C11H15NO2.
Вычислено: С 68,37; Н 7,82; N 7,25; О 16,56%. М 193,249.
Получение N-метил-пара-этоксианилина.
В круглодонную колбу на 0,15 л загружали 75 мл дистиллированной воды и при перемешивании прикапывали 14 мл концентрированной серной кислоты, затем добавили 20 г N-метил-N-ацетил-пара-этоксианилина. Полученная при интенсивном перемешивании эмульсия желтого цвета после нагрева до кипения образует гомогенную систему, в которую после 2-часового кипячения и последующего охлаждения добавляли 30 г едкого натра. Смесь переносили в делительную воронку и дважды экстрагировали целевой продукт толуолом по 70 мл. Толуольный раствор сушили, декантировали, толуол отгоняли, а остаток перегоняли в вакууме, собирая фракцию с Т.кип.=91-94°С при 1 мм рт.ст. Получили 15 г (95,86% от теор.) светло-желтой жидкости с nD 20=1,5520, d=0,990 г/см3 при 20°С.
Найдено: С 71,52; Н 8,70; N 9,23%. М+151 (масс-спектром). C9H13NO.
Вычислено: С 71,49; Н 8,67; N 9,26; О 10,58%. М 151,210.
Получение N,N-диметил-пара-этоксианилина.
В круглодонную колбу на 0,25 л, снабженную эффективно действующим обратным холодильником, загружали смесь 100 мл (106,52 г) (0,775 М) свежеперегнанного пара-этоксианилина (пара-фенетидина) и 61,82 мл (140,89 г) (0,993 М) йодистого метила и эту реакционную массу нагревали до кипения и кипятили в течение двух часов, при этом вся масса затвердевала. Затем реакционную массу охлаждали до комнатной температуры и при охлаждении к ней небольшими порциями (частями) прибавляли раствор 48,03 г (1,2 М) едкого натра, растворенного в 144,44 мл дистиллированной воды. Выделившийся N-метил-пара-фенетидин отделяли в делительной воронке и снова кипятили в колбе с эффективным обратным холодильником с 61,82 мл (140,89 г) (0,993 М) йодистого метила до затвердевания всей массы. Полученную йодистоводородную соль N,N-диметил-пара-фенетидина растворяли в воде и кипятили этот раствор в течение нескольких минут, охлаждали и осторожно разлагали раствором 48,03 г (1,2 М) едкого натра в 144,44 мл дистиллированной воды. Образовавшийся N,N-диметил-пара-фенетидин переносили в делительную воронку и извлекали из смеси 280 мл (184,8 г) (2,144 М) гексана, прибавляя его небольшими порциями в делительную воронку, и интесивно встряхивали смесь. Гексановые растворы, содержащие N,N-диметил-пара-фенетидин, отделяли и объединяли. Затем переносили в колбу для перегонки. Гексан упаривали, а остаток перегоняли в вакууме, отбирая фракцию с Т.кип.=129-131°С при 3 мм рт.ст. Получили 83,39 г (65% от теор.) желтоватоватых кристаллов с Т.пл=36,5-39°С, nD 40=1,5400.
Найдено: С 72,67; Н 9,18; N 8,51%. М+165 (масс-спектром). C10H15NO.
Вычислено: С 72,69; Н 9,15; N 8,48; О 9,68%. М 165,237.
Получение N-метил-пара-этоксианилина и N,N-диметил-пара-этоксианилина.
N-Монометил-пара-этоксианилин и N,N-диметил-пара-этоксианилин были получены так же с использованием диметилсульфата, бикарбоната натрия, едкого натрия или калия по методике, описанной в [Вейганд-Хильгетаг. Методы экспиремента в органической химии. - Москва: Химия, 1964. - 944 с.] с выходом 50 и 65% от теоретического соответственно.
Показатели преломления, плотности (удельные веса), УФ-, ИК-, ЯМР-, масс-спектры полностью идентичны спектрам этих же веществ (соединений), полученных другими способами. [Ю.К.Юрьев. Практические работы по органической химии. Выпуск первый и второй. 2-ое дополнение издание. - Москва.: Издательство Московского университета. 1961. - 420 с.].
Физико-химические исследования полученных веществ (соединений) полностью подтвердили их строение и идентичность.
Исследование N-метил-пара-этоксианилина методом ЯМР.
Спектры ЯМР 1Н и 13С раствора N-метил-пара-этоксианилина (4-этокси-N-метиланилина) в CDCl3 измерены на спектрометре Bruker AM-360 на частотах 360 и 90 МГц соответственно.
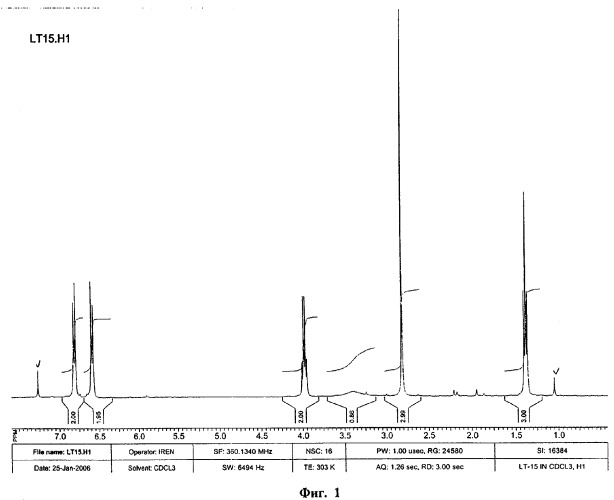
В спектре ЯМР 1Н N-метил-пара-этоксианилина (фиг.1)
наблюдаются следующие сигналы резонансов протонов молекулы:
триплет метильных протонов этоксигруппы при 1,39 м.д. с J (H-H)=7,2 Гц;
синглет протонов метильной группы при атоме N при 2,81 м.д.;
уширенный синглет протона при атоме азота (группы NH) при 3.33 м.д.;
квадруплет протонов СН2-группы при атоме О при 3.98 м.д. с J (H-H)=7,2 Гц;
дублет двух протонов при атомах С6 и С2 при 6,58 м.д. J (H-H)=9,36 Гц;
дублет двух протонов при атомах С3 и С5 при 6,82 м.д. J (H-H)=8,64 Гц.
В спектре ЯМР 13С N-метил-пара-этоксианилина (фиг.2) наблюдаются следующие сигналы резонансов углеродных атомов молекулы:
при 14,80 м.д. - сигнал метильного углерода этоксигруппы;
при 31,34 м.д. - сигнал от метильного атома углерода при атоме N;
при 63,95 м.д. - сигнал метиленового атома углерода этоксигруппы;
при 113,40 м.д. - сигнал от двух атомов углерода С6 и С2;
при 115,62 м.д. - сигнал от двух атомов углерода С3 и С5;
при 143,51 м.д. - сигнал атома углерода при атоме азота в ароматическом кольце;
при 151,12 м.д. - сигнал атома углерода при атоме кислорода в ароматическом кольце.
Таким образом, спектры ЯМР 1Н и 13С полностью подтверждают химическую структуру (порядок соединения атомов в молекуле) N-метил-пара-этоксианилина,
Исследования N-метил-пара-этоксианилина методом ИК-спектрофотометрии.
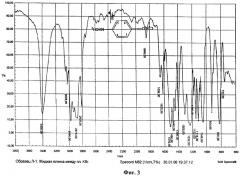
ИК-спектр измерен в капиллярном слое в KBr на спектрофотометре Specord M82.
Спектр N-метил-пара-этоксианилина (фиг.3) содержит полосы поглощения с максимумами при 647, 705, 752, 1116, 1152, 1180, 1448, 1480 см-1 (слабой интенсивности), при 924, 1308, 1396 см-1 (средней интенсивности), при 820, 1048 см-1 (высокой интенсивности), а также характеристические полосы поглощения валентных колебаний связи С-O при 1232 см-1 (сильная), С=С при 1620 см-1 (слабая) и связи С-Н при 2808, 2876, 2935, 2980 и 3028 см-1. Группа N-H проявляется в спектре интенсивными полосами деформационных колебаний при 1516 см-1 и валентных колебаний при 3400 см-1.
Основные характеристические частоты поглощения соответствуют и подтверждают данную структуру молекулы N-метил-пара-этоксианилина.
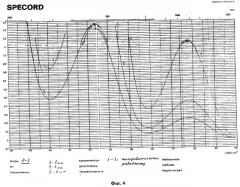
Исследования N-метил-пара-этоксианилина методом УФ-спектрофотометрии.
УФ-спектры измерены в растворе этанола в кюветах 1 см на приборе SPECORD UV VIS (Carl Zeiss, Jena).
В УФ-спектрах N-метил-пара-этоксианилина (фиг.4) с характерной концентрационной зависимостью интенсивности полос поглощения отмечаются максимумы при 242 и 307 нм и минимумы при 218 и 275 нм.
Масс-спектрометрические исследования
N-метил-пара-этоксианилина
Масс-спектр измерен на масс-спектрометре Finnigan MAT 95 XL пропусканием через капиллярную колонку (фаза - полидиметилсилоксан, содержащий 5% фенильных групп) при энергии ионизирующих электронов 70 эВ.
В спектре N-метил-пара-этоксианилина (фиг.5) наблюдается пик молекулярного иона [М]+ с m/z 151 (относительная интенсивность 60%), пик иона [М-С2Н5]+ с m/z 122 (100%), а также малоинтенсивные пики продуктов распада последнего с m/z 108, 94, 77 и 65 с относительной интенсивностью 2-7%.
Исследование N,N-диметил-пара-этоксианилина методом ЯМР.
Спектры ЯМР 1Н и 13С раствора N,N-диметил-пара-этоксианилина (4-этокси-N,N-диметиланилина) в CDCl3 измерены на спектрометре Bruker AM-360 на частотах 360 и 90 МГц соответственно.
В спектре ЯМР 1Н N,N-диметил-пара-этоксианилина (фиг.6) наблюдаются следующие сигналы резонансов протонов молекулы:
триплет метильных протонов этоксигруппы при 1,39 м.д. с J (H-H)=7,2 Гц;
синглет протонов двух метильных групп при атоме N при 2,88 м.д.; квадруплет протонов СН2-группы при атоме О при 4,0 м.д. с J (H-H)=7,2 Гц;
дублет двух протонов при атомах С6 и С2 при 6,76 м.д. J (H-H)=8,64 Гц;
дублет двух протонов при атомах С3 и С5 при 6,86 м.д. J (H-H)=8,64 Гц.
В спектре ЯМР 13С N,N-диметал-пара-этоксианилина (фиг.7) наблюдаются следующие сигналы резонансов углеродных атомов молекулы:
при 14,85 м.д. - сигнал метильного углерода этоксигруппы;
при 41,62 м.д. - сигнал от двух метильных атомов углерода при атоме N;
при 63,85 м.д. - сигнал метиленового атома углерода этоксигруппы;
при 114,71 м.д. - сигнал от двух атомов углерода С6 и С2;
при 115,34 м.д. - сигнал от двух атомов углерода С3 и С5;
при 145,56 м.д. - сигнал атома углерода при атоме азота в ароматическом кольце;
при 151,13 м.д. - сигнал атома углерода при атоме кислорода в ароматическом кольце.
Таким образом, спектры ЯМР 1Н и 13С полностью подтверждают химическую структуру (порядок соединения атомов в молекуле) N,N-диметил-пара-этоксианилина.
Исследования N,N-диметил-пара-этоксианилина методом ИК-спектрофотометрии.
ИК-спектр измерен в капиллярном слое в KBr на спектрофотометре Bruker IFS-113.
Спектр N,N-диметил-пара-этоксианилина (фиг.8) содержит полосы поглощения с максимумами при 679, 922, 1090, 1117, 1162, 1185 см-1 (слабой интенсивности), при 705, 948, 1296, 1337, 1446, 1479 см-1 (средней интенсивности), при 816, 1052 см-1 (высокой интенсивности), а также характеристические полосы поглощения валентных колебаний связи С-O при 1239 см-1 (сильная), С=С при 1511 (сильная) и 1616 см-1 (слабая), и связи С-Н при 2794, 2876, 2935, 2979 и 3046 см -1.
Основные характеристические частоты поглощения соответствуют и подтверждают данную структуру молекулы N,N-диметил-пара-этоксианилина.
Исследования N,N-диметил-пара-этоксианилина методом УФ-спектрофотометрии.
УФ-спектры измерены в растворе этанола на приборе SPECORD UV VIS (Carl Zeiss, Jena). В УФ-спектрах N,N-диметил-пара-этоксианилина (фиг.9) с характерной концентрационной зависимостью интенсивности полос поглощения отмечаются максимумы при 247 и 308 нм и минимумы при 221 и 283 нм.
Масс-спектрометрические исследования N,N-диметил-пара-этоксианилина.
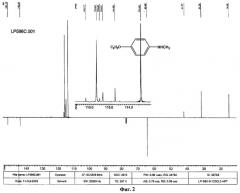
Масс-спектр измерен на масс-спектрометре Finnigan MAT 95 XL пропусканием через капиллярную колонку (фаза - полидиметилсилоксан, содержащий 5% фенильных групп) при энергии ионизирующих электронов 70 эВ.
В спектре N,N-диметил-пара-этоксианилина (фиг.10) наблюдается пик молекулярного иона [М]+с m/z 165 (относительная интенсивность 47%), пик иона [М-C2H5]+с m/z 136 (100%), а также малоинтенсивные пики (менее 3%) продуктов распада последнего с m/z 122, 108, 93 и 65.
Исследование N-метил-N-ацетил-пара-этоксианилина методом ЯМР.
Спектр ЯМР 1Н и 13С раствора N-метил-N-ацетил-пара-этоксианилина (4-этокси-N-метил-N-ацетил-пара-этоксианилина) в CDCl3 измерен на спектрометре Bruker AM-360 на частоте 360 МГц соответственно.
В спектре ЯМР 1Н (фиг.11) наблюдаются следующие сигналы резонансов протонов молекулы:
триплет метильных протонов этоксигруппы при 1,42 м.д. с J (H-H)=6,48 Гц;
синглет протонов метильной группы ацильного заместителя при 1,84 м.д.;
синглет протонов метильной группы при атоме азота при 3,21 м.д.;
квадруплет метиленовых протонов этоксигруппы при 4,03 м.д. с J (H-H)=6,48 Гц;
дублет двух протонов при атомах С2 и С6 при 6,88 м.д. с J (H-H)=8,64 Гц;
дублет двух протонов при атомах С3 и С5 при 7,07 м.д. с J (H-H)=8,64 Гц.
В спектре ЯМР 13С (фиг.12) наблюдаются следующие сигналы резонансов углеродных атомов молекулы:
при 14,52 м.д. - сигнал метильного углерода этоксигруппы;
при 22,06 м.д. - сигнал метильного углерода ацетильной группы;
при 37,01 м.д. - сигнал от метильного атома углерода при атоме N;
при 63,49 м.д. - сигнал метиленового атома углерода этоксигруппы;
при 115,09 м.д. - сигнал от двух атомов углерода С3 и С5;
при 127,86 м.д. - сигнал от двух атомов углерода С2 и С6;
при 137,09 м.д. - сигнал атома углерода при атоме азота в ароматическом кольце;
при 157,98 м.д. - сигнал атома углерода при атоме кислорода в ароматическом кольце;
при 170,67 м.д. - сигнал карбонильного атома углерода.
Таким образом, спектры ЯМР 1Н и 13С полностью подтверждают химическую структуру (порядок соединения атомов в молекуле) N-метил-N-ацетил-пара-этоксианилина.
Исследования N-метил-N-ацетил-пара-этоксианилина методом ИК-спектрофотометрии.
ИК-спектр измерен в капиллярном слое в KBr на спектрофотометре Specord M82.
Спектр N-метил-N-ацетил-пара-этоксианилина (фиг.13) содержит полосы поглощения с максимумами при 808, 924, 976, 1012, 1088, 1116, 1144, 1172, 1420 и 1480 см-1 (слабой интенсивности), при 844, 1048, 1300 и 1380 см-1 (средней интенсивности), при 1248, 1516 и 1664 см-1 (высокой интенсивности). Последняя полоса характерна для амидного карбонила. Характеристические полосы поглощения валентных колебаний связи С-Н проявляются при 2900, 2920 и 2980 см-1.
Основные характеристические частоты поглощения соответствуют и подтверждают данную структуру молекулы N-метил-N-ацетил-пара-этоксианилина.
Исследования N-метил-N-ацетил-пара-этоксианилина методом УФ-спектрофотометрии.
УФ-спектры измерены в растворе этанола в кюветах 1 см на приборе SPECORD UV VIS (Carl Zeiss, Jena).
В УФ-спектрах N-метил-N-ацетил-пара-этоксианилина (фиг.14) с характерной концентрационной зависимостью интенсивности полос поглощения отмечаются максимумы при 228 и 275 нм, плечо при 282 нм и минимумы при 216 и 263 нм.
Масс-спектрометрические исследования
N-метил-N-ацетил-пара-этоксианилина.
Масс-спектр измерен на масс-спектрометре Finnigan MAT 95 XL пропусканием через капиллярную колонку (фаза - полидиметилсилоксан, содержащий 5% фенильных групп) при энергии ионизирующих электронов 70 эВ.
В спектре N-метил-N-ацетил-пара-этоксианилина (фиг.15) наблюдается пик молекулярного иона [М]+ с m/z 193 (относительная интенсивность 50%), пик иона [М-СОСН3+Н]+ с m/z 151 (23%), пик иона [С6Н5ОС2Н5]+, а также малоинтенсивные пики продуктов распада последнего с m/z 108, 94, 77 и 65 с относительной интенсивностью 2-7% и пики иона [NCOCH2]+ и продуктов его распада с m/z 56 (15%) и 43 (10%).
Нами были получены и исследованы спектральными методами и элементным анализом N-метил-пара-этоксианилин, N,N-диметил-пара-этоксианилин и N-метил-N-ацетил-пара-этоксианилин, а также определены их температуры плавления, кипения, показатели преломления и плотности.
Типичные примеры, подтверждающие эффективность указанных соединений, смесей.
Эффективность предложенных нами соединений, определялась по приросту октанового числа, определяемого моторным методом (ОЧМ) и исследовательским методом (ОЧИ), в эталонной топливной смеси изооктана и нормального гептана (70:30 об.% соответственно) и на бензинах прямой гонки из нефти, бензине газовом стабильном (БГС) и др. товарных бензинах.
Пример 1. N-Метил-пара-этоксианилин, взятый 1,3 мас.%, по отношению к эталонной топливной смеси дал прирост ОЧ на 6 ед. (ОЧМ) и 8 ед. (ОЧИ).
Пример 2. N-Метиланилин, взятый 1,3 мас.%, по отношению к эталонной топливной смеси дал прирост ОЧ на 5,5 ед. (ОЧМ) и 7 ед. (ОЧИ). Смесь N-метил-пара-этоксианилина и N-метиланилина в соотношении 1:1, взятого 1,3 мас.%, по отношению к эталонной топливной смеси дала прирост ОЧ на 7,2 ед. (ОЧМ) и 8,5 ед. (ОЧИ). Отмечено увеличение стабильности N-метиланилина в топливной смеси. Данный пример показывает эффект синергизма, когда эффективность смеси веществ превосходит их индивидуальную эффективность. Анологично синергизм был проявлен со многими известными по данному назначению присадками, в том числе и с металлсодержащими.
Пример 3. N,N-Диметил-пара-этоксианилин, взятый 1,3 мас.%, по отношению к эталонной топливной смеси, дал прирост ОЧ 3 ед. (ОЧМ) и 5,3 ед. (ОЧИ).
Пример 4. Смесь N-ацетил-пара-этоксианилина и бутанола в соотношении 1:1 соответственно, взятая 5 мас.%, по отношению к эталонной топливной смеси дала прирост ОЧ 3,5 ед. (ОЧМ) и 5 ед. (ОЧИ).
Пример 5. Смесь N-метил-пара-этоксианилина и N,N-диметил-пара-этоксианилина в соотношении 1:1, взятая 2 мас.%, по отношению к эталонной топливной смеси, дала прирост ОЧ 6,5 ед. (ОЧМ) и 8 ед. (ОЧИ).
Пример 6. Смесь N-метил-N-ацетил-пара-этоксианилина, N-метил-пара-этоксианилина и N,N-диметил-пара-этоксианилина в соотношении 1:1:1, взятая 2 мас.%, по отношению к эталонной топливной смеси, дала прирост ОЧ 7 ед. (ОЧМ) и 9 ед. (ОЧИ).
Пример 7. Смесь N-метил-пара-этоксианилина и МТБЭ в соотношении 1:1, взятая 3 мас.%, по отношению к эталонной топливной смеси, дала прирост ОЧ 8 ед. (ОЧМ) и 10,5 ед. (ОЧИ).
Пример 8. Смесь N,N-диметил-пара-этоксианилина и изопропилового спирта в соотношении 1:1 соответственно, взятая 3 мас.%, по отношению к эталонной топливной смеси, дала прирост ОЧ 7,5 ед. (ОЧМ) и 9,5 ед. (ОЧИ).
Пример 9. Смесь N,N-диметил-пара-этоксианилина и МТБЭ в соотношении 1:1 соответственно, взятая 3 мас.%, по отношению к эталонной топливной смеси, дала прирост ОЧ на 4,5 ед. (ОЧМ) и 7 ед. (ОЧИ).
Пример 10. Смесь N,N-диметил-пара-этоксианилина и изопропилового спирта в соотношении 1:1 соответственно, взятая 3 мас.%, по отношению к эталонной топливной смеси, дала прирост ОЧ на 4 ед. (ОЧМ) и 6,5 ед. (ОЧИ).
Пример 11. N-Метил-N-ацетил-пара-этоксианилин, взятый 2 мас.%, по отношению к эталонной топливной смеси, дал прирост ОЧ 1 ед. (ОЧМ) и 1,5 ед. (ОЧИ).
Пример 12. N-Метил-пара-этоксианилин, взятый 5 мас.%, по отношению к эталонной топливной смеси, дал прирост ОЧ 18 ед. (ОЧМ) и 21 ед. (ОЧИ).
В качестве оксигенатов также были использованы, проверены и получены сходные результаты с фенетолом, анизолом, метил-трет-амиловым, метил-втор-пентиловым, этил-трет-бутиловым, диизопропиловым и др. эфирами, метиловым, этиловым, бутиловыми и др. спиртами, различными эфирными фракциями и кубовыми остатками, в том числе бутиловых спиртов и их смесями.
Сходные результаты получены на образцах бензина прямой гонки (из нефти), бензина газового стабильного (БГС), авиационного бензина, авиационного керосина, товарных бензинов марок АИ 80, АИ 92, АИ 95, АИ 98.
Источники информации, принятые во внимание.
1. Топлива, смазочные материалы, технические жидкости. Ассортимент и применение. Справочник. / И.Г.Анисимов, К.М.Бадыштова, С.А.Бнатов и др. Под ред. В.М.Школьникова. Издание второе, переработанное и дополненное. - Москва.: Издательский центр «Техинформ», 1999. - 596 с., ил.
2. Б.А.Павлов и А.П.Терентьев. Курс органической химии. - Москва.: Государственное научно-техническое издательство химической литературы, 1961. - 592 с.
3. Е.С.Хотинский. Курс органической химии. - Харьков.: Издательство Харьковского ордена Трудового Красного Знамени государственного университета им. А.М.Горького, 1959. - 724 с.
4. Э.Г.Розанцев. Разрушение и стабилизация органических материалов. - Москва.: Издательство «Знание», 1974. - 64 с.
5. А.Е.Чичибабин. Основные начала органической химии. Том I. - Москва.: Государственное научно-техническое издательство химической литературы, 1963. - 912 с.
6. Н.Л.Глинка. Общая химия. Издание двенадцатое. - Москва, Ленинград.: Издательство «Химия», 1965. - 688 с.
7. Б.Н.Степаненко. Курс органической химии. Часть I. Алифатические соединения. - Москва.: Издательство «Высшая школа», 1976. - 448 с.
8. Г.И.Шор, В.А.Винокуров, И.А.Голубева. Производство и применение присадок к нефтепродуктам в новых условиях хозяйствования. Под ред. И.Г.Фукса. - Москва.: Издательство «Нефть и газ», 1996. - 44 с.
9. А.С. 152526, кл. С10L 1/18; С10L 1/26 (СССР). Присадка к бензинам (В.А.Зайцев, А.Н.Несмеянов, К.И.Анисимов, М.О.Лернер, А.А.Егорова и др. - Опубл. в БИ, 1963, №1.
10. Патент 2032708, кл. С10L 1/18 (РФ). Антидетонационная присадка к бензину. - Опубл. в БИ 1995, №10.
11. К.К.Панок, И.А.Рагозин. Словарь по топливам, маслам, смазкам, присадкам и специальным жидкостям. - Москва.: Издательство «Химия», 1975. - 326 с.
12. Патент 2064965, кл. С10L 1/18, 1/20 (РФ). Многофункциональная присадка к бензину «Экстравит-Ф».- Опубл. в БИ 1996, №22.
13. Патент 461512, кл. С10L 1/18 (СССР). Топливная композиция. Херберт Майерхоффер, Вильгельм Шнайдер, Хардо Нюринг и Вольфганг Экспер.- Опубл. в БИ 1975, №7.
14. Патент 2078118, кл. С10L 1/18, 1/22. Многофункциональная присадка к углеводородным топливам для двигателей внутреннего сгорания и топливная композиция, ее содержащая. Ребров И.Ю. - Опубл. в БИ 27.04.1997, №12.
15. Патент 2184767, кл. С10L 1/18, С10L 1/22 (РФ). Добавка к бензину и автомобильное топливо, ее содержащее. Аветисян В.Е. Дата публикации: 2002.07.10.
16. С.Н.Онойченко. Применение оксигенатов при производстве перспективных автомобильных бензинов. - Москва.: Издательство «Техника» ООО «Тума Групп». 2003. - 64 с.
17. А.М.Данилов. Применение присадок в топливах. - Москва.: Издательство «Мир», 2005. - 288 с., ил.
18. А.Н.Несмеянов, Н.А.Несмеянов. Начала органической химии. Книга первая. - Москва.: Издательство «Химия», 1974. - 624 с.
19. А.Н.Несмеянов, Н.А.Несмеянов. Начала органической химии. Книга вторая. - Москва.: Издательство «Химия», 1974. - 744 с.
20. Дж.Роберте, М.Касерио. Основа органической химии. Том 1. - Москва.: Издательство «Мир», 1978. - 848 с.
21. Дж.Робертс, М.Касерио. Основа органической химии. Том 2. - Москва.: Издательство «Мир», 1978. - 888 с.
22. Ф.Керн, Р.Сандберг. Углубленный курс органической химии. Книга 1. Структура и механизмы. - Москва.: Издательство «Химия», 1981. - 520 с.
23. Дж.Марч. Органическая химия. Реакции, механизмы и структура. Том 1. - Москва.: Издательство «Мир», 1987. - 384 с.
24. Дж.Марч. Органическая химия. Реакции, механизмы и структура. Том 3. - Москва.: Издательство «Мир», 1987. - 464 с.
25. К.Ингольд. Теоретические основы органической химии. - Москва.: Издательство «Мир», 1973. - 1056 с.
26. Ж.Матье, Р.Панико. Курс теоретических основ органической химии. - Москва.: Издательство «Мир», 1975. - 556 с.
27. Изв. АН СССР. Сер. Хим., 1978, №9, с. 2134-2136.
28. Изв. АН СССР. Сер. Хим., 1980, №2, с. 421-424.
29. Изв. АН СССР. Сер. Хим., 1980, №4, с. 942-943.
30. Изв. АН СССР. Сер. Хим., 1981, №9, с. 2008-2014.
31. Изв. АН СССР. Сер. Хим., 1993, №7, с. 1321.
32. Координационная химия, 1994, том 20, №4, с.311-317.
33. Краткая химическая энциклопедия. Ред. кол. И.Л.Кнунянц (отв. ред.) и др. т.5, М.: Советская энциклопедия, 1967 (Энциклопедии. Словари. Справочники), т.5. Т-Я. 1967, 1184 стр. с ил.
34. А.М.Беркенгейм. Химия и технология синтетических лекарственных средств. - Москва.: ОНТИ. Главная редакция химической литературы, 1935. - 642 с.
35. Перевалова Э.Г., Решетова М.Д., Грандберг К.И. Железоорганические соединения. Ферроцен. - М.: Наука, 1983. - 544 с. (Серия «Методы элементоорганической химии»).
36. Швицер Ю. Производство химико-фармацевтических и технохимических препаратов, пер. с нем., М.-Л., 1934.
37. Препаративная органическая химия. Издание 2-е, М.: Госхимиздат.1964.
38. Агрономов А.Е., Шабаров Ю.С. Лабораторные работы в органическом практикуме. Изд. 2-е, пер. и доп. М.: Химия, 1974. 376 с., 18 табл., 113 рис.
1. Применение соединений общей формулы I
выбранных из N-метил-пара-этоксианилина, N,N-диметил-пара-этоксианилина, N-метил-N-ацетил-пара-этоксианилина, обладающих антидетонационными свойствами, для получения высокооктановых углеводородных топлив.
2. Применение N-ацетил-пара-этоксианилина, и/или N-метил-N-ацетил-пара-этоксианилина, и/или N-метил-пара-этоксианилина, и/или N,N-диметил-пара-этоксианилина, или их смеси, без или вместе с оксигенатами, в качестве компонентов или присадок для повышения стойкости углеводородных топлив к детонации для получения высокооктановой топливной композиции.
3. Высокооктановые топливные композиции, отличающиеся тем, что в качестве компонентов или присадок для повышения октанового числа углеводородных топлив они содержат N-ацетил-пара-этоксианилин, и/или N-метил-N-ацетил-пара-этоксианилин, и/или N-метил-пара-этоксианилин, и/или N,N-диметил-пара-этоксианилин, или их смеси, взятые в массовых соотношениях 0,1-30% по отношению к углеводородным топливам.
4. Высокооктановые топливные композиции, отличающиеся тем, что в качестве компонентов или присадок для повышения октанового числа углеводородных топлив они содержат N-ацетил-пара-этоксианилин, и/или N-метил-N-ацетил-пара-этоксианилин, и/или N-метил-пара-этоксианилин, и/или N,N-диметил-пара-этоксианилин, или их смеси, и оксигенаты при содержании соответствующих анилинов или их смеси 0,1-95 мас.% и остальное до 100 мас.% оксигенат