Производные аминоалкилпиридинов, способы их получения и фармацевтические композиции на их основе
Иллюстрации
Показать всеИзобретение относится к новым производным аминоалкилпиридинов общей формулы I
где n означает целое число от 1 до 4; R1 представляет собой атом водорода, гидроксильную группу или низшую (C1-С6)алкоксигруппу, R2 представляет собой атом водорода или низшую (C1-С6)алкильную группу с линейной или разветвленной цепью, Х представляет собой водород, фтор, хлор, бром, гидроксильную группу, трифторметильную группу, 3,4-ди-Cl, 2,4-ди-Cl или низшую (C1-С6)алкоксигруппу, или к солям этих соединений - продуктам присоединения физиологически приемлемой кислоты. Данное изобретение относится также к фармацевтической композиции, ингибирующей биосинтез холестерина, на основе этих соединений. Также рассматривается применение вышеуказанных соединений для получения фармацевтической композиции и способ получения соединений формулы I. Технический результат - получение новых соединений, обладающих ценными биологическими свойствами, и фармацевтической композиции на их основе. 4 н. и 6 з.п. ф-лы, 12 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области химии биологически активных соединений из группы гетероциклических соединений и к фармацевтической промышленности, представлены новые производные аминоалкилпиридинов, способы их получения, фармацевтические композиции, содержащие эти соединения, и их применение для ингибирования биосинтеза холестерина. Новые производные аминоалкилпиридинов согласно настоящему изобретению представляют собой лиганды сигма-рецепторов, ингибиторы биосинтеза холестерина на уровне стерол-Δ7,8-изомеразы и могут быть использованы для лечения гиперхолестеринемии и гиперлипидемии у человека.
Техническая задача
Существует постоянная необходимость в новых биологически активных соединениях, которые ингибируют биосинтез холестерина, в эффективных агентах, оказывающих воздействие против гиперхолестеринемии и гиперлипидемии, и таких, которые являются более целенаправленными при терапии и обладают меньшим побочным действием по сравнению с биологически активными веществами, известными из предшествующего уровня техники.
Предшествующий уровень техники
Поскольку высокое содержание холестерина в крови рассматривают как фактор риска развития атеросклероза, целью многочисленных исследований был поиск лекарственных средств, которые позволили бы снизить содержание холестерина в крови у млекопитающих и таким образом были бы весьма эффективными при лечении гиперхолестеринемии и гиперлипидемии. Было установлено, что одним из способов лечения является снижение биосинтеза холестерина при воздействии ингибиторов биосинтеза холестерина.
Некоторые ингибиторы биосинтеза холестерина, работающие на уровне ингибирования 3-гидрокси-3-метилглутарил-кофермент А редуктазы (HMG-CoA редуктаза), что описано, например, в патентах США US 4231938 (ловастатин), US 4444784 (симвастатин), US 4346227 (правастатин натрий) или US 5273995 (аторвастатин), уже используются в терапии и представляют собой коммерческие препараты мевакор (Mevacor®), синвакор (Sinvacor®), липитор (Lipitor®). Эти ингибиторы HMG-CoA редуктазы, которые также известны под общепринятым названием статины, значительно снижают содержание холестерина в крови.
Производные пиридинэтаноламина, которые могут быть использованы для лечения ожирения и/или диабета, в особенности для лечения ожирения, наблюдающегося у взрослых пациентов, известны из патента US 4800206.
Известно, что сигма-лиганды связываются с сигма-рецепторами, которые имеют структуру, гомологичную структуре стерол-Δ8,7-изомеразы (F.F.Moebius et al., Brit. J. Pharmacol. (1997), 121, 1-C6), и относятся к заключительным стадиям биосинтеза холестерина. Однако нет активных соединений или лекарственных средств, которые могли бы ингибировать биосинтез холестерина на уровне стерол-Δ8,7-изомеразы.
Описание решения технической задачи, включая примеры
Целью настоящего изобретения является нахождение новых активных веществ, которые могли бы значительно снизить содержание холестерина в крови у млекопитающих посредством ингибирования биосинтеза холестерина на завершающих стадиях биосинтеза, то есть на уровне стерол-Δ7,8-изомеразы, осуществляя таким образом более селективное ингибирующее воздействие, чем воздействие известных статинов, которые ингибируют HMG-CoA редуктазу на начальных стадиях биосинтеза холестерина.
Применение новых соединений согласно настоящему изобретению могло бы позволить осуществить более направленное терапевтическое воздействие с меньшими побочными эффектами по сравнению с воздействием биологически активных соединений, уже используемых в медицине.
Поставленная задача решается настоящим изобретением, которое относится к новым производным аминоалкилпиридина, к способам их получения, к фармацевтическим композициям, содержащим эти соединения, и к применению этих соединений в соответствии с настоящим изобретением для лечения гиперхолестеринемии и гиперлипидемии.
Новые аминоалкилпиридины согласно настоящему изобретению представляют собой соединения общей формулы I
в которой n означает целое число от 1 до 4,
R1 представляет собой атом водорода, гидроксильную группу или низшую (С1-С6)алкоксигруппу;
R2 представляет собой атом водорода или (C1-С6)алкильную группу с линейной или разветвленной цепью,
X представляет собой водород, фтор, хлор, бром, гидроксильную группу, трифторметильную группу, 3,4-ди-Cl, 2,4-ди-Cl или низшую (C1-C6)алкоксигруппу,
а также соли этих соединений - продукты присоединения физиологически приемлемых кислот.
Термин низшая алкильная группа относится к низшей алкильной группе с линейной или разветвленной цепью, содержащей 1-6, предпочтительно 1-4, атома углерода (т.е. к группе (C1-С6алкил)), например, такой как метильная, этильная, н-пропильная, изопропильная, н-бутильная и изобутильная группа. Термин низшая алкоксигруппа относится к алкоксигруппе, содержащей 1-6, предпочтительно 1-4, атома углерода (т.е. к группе (C1-С6алкокси)), например, к такой группе, как метокси, этокси, пропокси, изопропокси, бутокси и изобутокси.
Соединения формулы I образуют соли с кислотами и такие соли входят в объем настоящего изобретения. Примеры таких солей включают соли, образованные с физиологически совместимыми минеральными кислотами, например, такими как хлороводородная кислота, бромоводородная кислота, фосфорная кислота, или с органическими кислотами, например, такими как метансульфоновая кислота, лимонная кислота, щавелевая кислота, малеиновая кислота, бензолсульфоновая кислота и другие кислоты.
Новые соединения согласно настоящему изобретению содержат по меньшей мере один асимметрический атом углерода и могут, таким образом, существовать в виде оптически активных энантиомеров, например, таких как диастереомеры, или в виде рацематов.
Соединения формулы I, в которых n=2 и в которых R1 означает гидроксильную группу, R2 означает метильную или н-пропильную группу и Х означает атом водорода или два атома хлора в положениях 3 и 4 фенильного ядра, являются новыми производными аминоалкилпиридинов и относятся к предпочтительным соединениям согласно настоящему изобретению.
Что касается соединений, указанных выше, то предпочтительными соединениями являются следующие:
1-(3-пиридил)-2-(N-(2-фенилэтил)-N-пропиламино)этанол и его соль - дигидробромид - формулы II (обозначение ВК-31 в описании и на чертежах)
1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-метиламино)этанол и его соль - дигидробромид - формулы III (обозначение ВК-33 в описании и на чертежах)
1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-пропиламино)этанол и его соль - дигидробромид - формулы IV (обозначение ВК-35 в описании и на чертежах)
и 1-(4-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-метиламино)этанол и его соль - дигидробромид - формулы V (обозначение ВК-38 в описании и на чертежах)
Из числа вышеупомянутых соединений в особенности предпочтительными в качестве ингибитора биосинтеза холестерина являются соединение 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-пропиламино)этанол и его соль - дигидробромид (ВК-35 · 2HBr), вследствие чего они подходят для лечения гиперхолестеринемии и гиперлипидемии.
Соединения, являющиеся предметом настоящего изобретения, могут быть получены двумя различными способами, которые показаны на приведенной ниже схеме как вариант (а) и вариант (б).
Вариант (а)
алкилирование вторичных аминов формулы VI
в которой R2 является таким, как определено выше, и Z представляет собой группу
где Х является таким, как определено выше,
пиридилоксираном (пиридилэтиленоксидом) формулы VII
с получением аминоалкилпиридинов формулы I и, если это необходимо, последующее превращение этих соединений в их соль - продукт присоединения физиологически приемлемой кислоты.
Вторичные амины формулы VI могут быть получены посредством алкилирования первичных аминов формулы XII
алкилиодидами формулы XIII
в соответствии со следующей схемой реакции:
где заместители R2 и Z являются такими, как определено выше.
Первичные амины формулы XII и алкилиодиды формулы XIII являются известными и коммерчески доступными химическими соединениями.
2-, 3- или 4-Замещенные пиридилоксираны формулы VII, используемые при осуществлении способа алкилирования вторичных аминов формулы VI, получают in situ посредством взаимодействия 2-, 3- или 4-замещенных бромацетилпиридингидробромидов с комплексными гидридами металлов, например, такими как борогидрид натрия, в инертном растворителе, таком как низший алифатический спирт (алканол), например этанол, при температуре, приблизительно равной комнатной температуре.
2-, 3- или 4-Замещенный гидробромид бромацетилпиридина получают взаимодействием исходного 2-, 3- или 4-замещенного ацетилпиридина, который является известным и коммерчески доступным соединением, осуществляя бромирование бромом и бромоводородной кислотой.
Стадию алкилирования вторичных аминов формулы VI пиридилоксираном формулы VII осуществляют при температуре приблизительно от комнатной температуры до температуры образования флегмы реакционной смесью, в инертном растворителе, например таком как низший алифатический спирт (алканол), например этанол.
Полученные неочищенные аминоалкилпиридины формулы I выделяют и очищают в соответствии с общепринятыми методиками, известными из предшествующего уровня техники, предпочтительно посредством колоночной хроматографии.
Вариант (б)
Алкилирование первичных аминов формулы VIII
в которой R2 является таким, как определено выше,
пиридилоксираном формулы VII
с получением при этом промежуточных соединений формулы IX
где R2 является таким, как определено выше,
и конденсация с производными фенилуксусной кислоты формулы X
где Z является таким, как определено выше,
с получением при этом промежуточных соединений формулы XI
в которой заместители R2 и Z являются такими, как указано выше,
и их восстановление с получением аминоалкилпиридинов формулы I, и, если это необходимо, последующее превращение их в соли - продукты присоединения физиологически приемлемой кислоты.
Первичные алифатические амины формулы VIII, например, такие как метиламин или н-пропиламин, являются известными и коммерчески доступными химическими соединениями, которые подвергают алкилированию с использованием пиридилоксирана формулы VII в инертном растворителе, таком как низший алифатический спирт (алканол), например этанол, с получением при этом промежуточных соединений формулы IX. Эти промежуточные соединения подвергают конденсации с производными фенилуксусной кислоты формулы X, в которой заместитель Z является таким, как определено выше, в инертном растворителе и при температуре, приблизительно равной комнатной температуре. Могут быть использованы конденсирующие агенты, известные из предшествующего уровня техники, например, такие как дициклогексилкарбодиимид (ДЦГ), а в качестве инертного растворителя, например, метиленхлорид (дихлорметан).
На заключительной стадии синтеза карбонильную группу в новых промежуточных соединениях XI восстанавливают до спиртовой группы. Взаимодействие проводят, используя обычные восстанавливающие агенты, предпочтительно такие, которые подходят для восстановления карбонильной группы в группу -R2HN-СО-. Наиболее подходящим является комплексный гидрид металла, например, такой как LiAlH4, в инертном растворителе, предпочтительно в эфирном растворителе, таком как тетрагидрофуран (ТГФ), диэтиловый эфир, диоксан и подобные растворители. Образующиеся целевые указанные в заголовке аминоалкилпиридины формулы I выделяют и очищают общепринятым образом, предпочтительно посредством колоночной хроматографии на силикагеле, и затем, если это необходимо, их превращают в их соль - продукт присоединения физиологически приемлемой кислоты.
Способы получения новых производных аминоалкилпиридина формулы I в соответствии с вариантами (а) и (б) показаны на фиг.5.
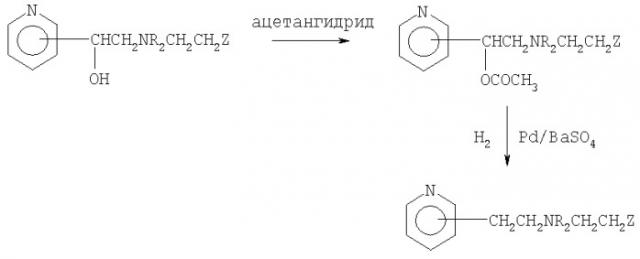
Синтез новых производных аминоалкилпиридинов формулы I, в которой R1 означает атом водорода, могут быть осуществлен таким образом, что новые соединения формулы I в соответствии с настоящим изобретением, в которых R1 означает гидроксильную группу, сначала подвергают ацилированию общепринятым образом, например, с использованием ацетангидрида, и затем образующиеся O-ацетилпроизводные каталитически гидрируют в соответствии с общепринятыми методиками, например, с использованием палладия на носителе, таком как сульфат бария, согласно следующему варианту (в):
Согласно другому варианту могут быть получены новые производные аминоалкилпиридина формулы I, в которой R1 представляет собой атом водорода, в соответствии со следующим вариантом (г):
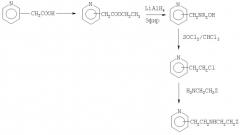
Исходная замещенная в положении 2-, 3- или 4-пиридилуксусная кислота подвергается этерификации общепринятым образом, как это известно из предшествующего уровня техники, например посредством превращения ее в сложный этиловый эфир пиридилуксусной кислоты, который затем восстанавливают с использованием общепринятых восстановителей, предпочтительно таких, которые используют для восстановления сложноэфирной группы в спиртовую группу. Особенно подходящими являются комплексные гидриды металлов, например, такие как литийалюминийгидрид (LiAlH4) в инертном растворителе, предпочтительно в эфирном растворителе, например, таком как диэтиловый эфир, тетрагидрофуран, диоксан и подобные растворители. Получаемые по этой методике 2-, 3- или 4-замещенные пиридилэтанолы превращают в 2-, 3- или 4-замещенные пиридилэтиленхлориды, используя общепринятые хлорирующие агенты, например, такие как тионилхлорид в инертном растворителе, таком как хлороформ. Полученный замещенный пиридилэтиленхлорид используют для алкилирования первичных аминов формулы VI с получением при этом указанных в заголовке производных аминоалкилпиридинов формулы I, в которых R1 означает атом водорода.
В соответствии с целью изобретения оценивают воздействие новых производных аминоалкилпиридина в качестве лигандов сигма-рецепторов на процесс ингибирования биосинтеза холестерина. Используют методику ex vivo введения метаболической метки иммортальных гепатоцитов человека. Радиоактивно меченный ранний предшественник холестерина [3Н] ацетат добавляют к клеткам без добавления или с добавлением сигма-лигандов. Проводят два независимых эксперимента с введением метаболической метки и анализом стерола. Результаты этих двух анализов являются воспроизводимыми и свидетельствуют о том, что тестируемые соединения значительно снижают синтез холестерина.
Что касается новых лигандов сигма-рецепторов, являющихся предметом настоящего изобретения, то наиболее высокий потенциал ингибирования биосинтеза холестерина проявляет соединение 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-пропиламино)этанол в виде соли - дигидробромида (обозначение ВК 35 · 2HBr).
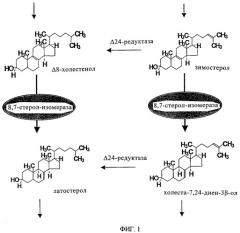
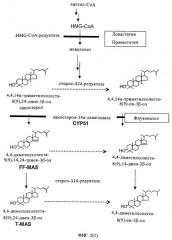
В последнее время было установлено, что сигма-лиганды связываются с сигма-рецепторами, которые имеют структуру, гомологичную структуре стерол-Δ8,7-изомеразы, поскольку они относятся к тому же самому семейству генов. Стерол-Δ8,7-изомераза вносит свой вклад на заключительной стадии биосинтеза холестерина, что следует из сведений, приведенных на фиг.1. На фиг.1 показано, что наиболее часто используемыми субстратами являются Δ8-холестенол и зимостерол, которые отличаются по насыщенности боковой цепи в положении Δ24,25. На фиг.2 показан биосинтез холестерина, где указаны участки воздействия ингибиторов биосинтеза холестерина.
Воздействие новых аминоалкилпиридинов в качестве сигма-лигандов в соответствии с настоящим изобретением является более селективным, чем действие статинов, используемых в терапии, таких как ловастатин или правастатин, которые ингибируют HMG-CoA редуктазу, имеющую отношение к ранней ступени биосинтеза холестерина.
При использовании новых аминоалкилпиридинов, являющихся предметом настоящего изобретения, обеспечивается более селективное воздействие с меньшими побочными эффектами вследствие ингибирования биосинтеза холестерина на последних стадиях процесса его биосинтеза. Следовательно, эти соединения в особенности полезны для лечения гиперхолестеринемии и гиперлипидемии. Такое действие новых аминоалкилпиридинов является совершенно неожиданным и неочевидным, поскольку в медицинской практике и терапии нет соединений, которые могли бы снижать уровень холестерина посредством целевого воздействия на ферменты на заключительных стадиях биосинтеза холестерина.
Применение новых аминоалкилпиридинов формулы I, являющихся предметом настоящего изобретения, в значительной степени снижает повышенный из-за патологии уровень холестерина в крови у получающих лечение пациентов. Дозировка и частота использования зависят от характеристик конкретного лекарственного средства, его биодоступности и фармакокинетических характеристик, а также от состояния пациента.
Фармацевтические препараты содержат активное соединение совместно с физиологически совместимым органическим или неорганическим носителем, например, таким как вода, лактоза, крахмал и его производные, стеарат магния, тальк, растительные масла и подобные вещества. Фармацевтические препараты предпочтительно вводят перорально, например, в виде таблеток, капсул, пилюль, порошков, гранул, растворов, сиропов, суспензий, эликсиров и подобного. Введение также может быть осуществлено парентерально, например, в виде стерильных растворов, суспензий или эмульсий. Фармацевтические препараты могут быть простерилизованы и/или могут включать другие ингредиенты, такие как консерванты, стабилизаторы, эмульгаторы, буферные вещества и другие добавки.
Настоящее изобретение проиллюстрировано приведенными ниже примерами, которые никоим образом не ограничивают объема изобретения.
Пример 1
1-(3-Пиридил)-2-(N-(2-фенилэтил)-N-пропиламино)этанол (ВК 31)
Получение исходных соединений
N-Пропил-(β-фенилэтил)амин
В колбу помещают 1,2 мл (9,5 ммоль) фенилэтиламина, 0,93 мл (9,5 ммоль) н-пропилиодида, 5 мл триэтиламина и 5 мл ТГФ (тетрагидрофуран) и затем реакционную смесь кипятят с обратным холодильником в течение 3,5 часов, после чего охлаждают. Образовавшуюся соль отфильтровывают, полученный раствор упаривают и очищают целевое соединение колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:СН3ОН=10:3). В результате получают 0,62 г (выход 40%) N-пропил-(β-фенилэтил)амина в виде маслянистого вещества (молекулярная масса 163,264, брутто-формула C11H17N).
Гидробромид 3-бромацетилпиридина
К 10 г (82,5 ммоль) 3-ацетилпиридина добавляют 30 мл 48%-ной бромоводородной кислоты. Реакционную смесь нагревают до 70°С и добавляют по каплям 4,2 мл брома при перемешивании. После завершения добавления брома реакционную смесь перемешивают дополнительно в течение 15 минут при той же самой температуре и охлаждают на льду. Образовавшееся кристаллическое соединение отфильтровывают и тщательно промывают ацетоном. В результате получают 21 г (выход 90%) 3-бромацетилпиридина гидробромида, температура плавления составляет 195-200°С.
Получение указанного в заголовке 1-(3-пиридил)-2-(N-(2-фенилэтил)-N-пропиламино)этанола
К 1,01 г (3,6 ммоль) 3-бромацетилпиридина гидробромида добавляют 20 мл абсолютного этанола и 0,5 г (13,2 ммоль) борогидрида натрия. Реакционную смесь перемешивают при 20°С в течение 2 часов, фильтруют и затем к фильтрату, содержащему 3-пиридилоксиран, добавляют 0,96 г (5,9 ммоль) N-пропил-(β-фенилэтил)амина. Полученную реакционную смесь кипятят с обратным холодильником в течение 4 часов и упаривают до получения сухого остатка, к которому добавляют 20 мл хлороформа. Твердую часть отфильтровывают, фильтрат упаривают и образовавшийся маслянистый остаток очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:СН3ОН=10:3). В результате получают 0,56 г (выход 55%) указанного в заголовке соединения в виде маслянистого основания.
0,56 г (2 ммоль) очищенного маслоподобного основания - 1-(3-пиридил)-2-(N-(2-фенилэтил)-N-пропиламино)этанола растворяют в 5 мл ацетона. Полученный раствор охлаждают на льду и при перемешивании добавляют 2,5 мл этанольного раствора бромоводородной кислоты (0,35 г (4,3 ммоль HBr)). К образовавшемуся осадку добавляют 3 мл диэтилового эфира. После перемешивания в течение 2 часов на льду кристаллический продукт отфильтровывают и промывают диэтиловым эфиром. В результате получают 0,7 г (выход 80%) дигидробромида 1-(3-пиридил)-2-(N-(2-фенилэтил)-N-пропиламино)этанола, температура плавления 113-120°С (молекулярная масса 446,238, брутто-формула C18H24N2O · 2HBr).
1Н ЯМР-спектр, D2O, м.д. относительно стандарта DSS (0 м.д.): 8,89, 8,80 (2Н), 8,65, 8,57 (1Н), 8,10 (1H), 7,38 (5H), 5,47 (1Н), 3,7-3,1 (8H), 1,80 (2Н), 0,97 (3Н).
ИК-спектр (таблетка с KBr) приведен на фиг.6.
Пример 2
1-(3-Пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-метиламино)этанол (ВК 33)
Получение 1-(3-пиридил)-2-метиламиноэтанола
К 1,01 г (3,6 ммоль) гидробромида 3-бромацетилпиридина, полученного, как описано в примере 1, добавляют 20 мл абсолютного этанола и 0,5 г (13,2 ммоль) борогидрида натрия, реакционную смесь перемешивают при 20°С в течение 2 часов и фильтруют. К фильтрату, содержащему 3-пиридилоксиран, добавляют 1,3 мл 33%-ного этанольного раствора метиламина и кипятят с обратным холодильником в течение 5 часов. Затем реакционную смесь упаривают до получения сухого остатка и к этому остатку добавляют 20 мл хлороформа. Твердую часть отфильтровывают, фильтрат упаривают и образовавшийся маслянистый остаток очищают колоночной хроматографией на силикагеле (подвижная фаза CHCl3:СН3ОН=10:3). В результате получают 0,33 г (выход 60%) указанного в заголовке соединения в виде маслянистого вещества - основания (молекулярная масса 152,196, брутто-формула C8H12N2O).
Получение 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил-N-метиламино)этанола
В колбу, содержащую 542 мг (2,6 ммоль) ДЦГ (дициклогексилкарбодиимид) добавляют 2 мл метиленхлорида и затем добавляют по каплям раствор 538 мг (2,6 ммоль) 3,4-дихлорфенилуксусной кислоты в 3 мл метиленхлорида при перемешивании, что приводит к образованию осадка. После перемешивания в течение 5 минут к реакционной смеси добавляют 400 мг (2,6 ммоль) 1-(3-пиридил)-2-метиламиноэтанола и дополнительно перемешивают в течение 1 часа при 20°С. Образовавшийся осадок отфильтровывают и полученный раствор упаривают. Полученный в результате упаривания фильтрат очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:СН3ОН=10:0,5). В результате получают 715 мг (выход 80%) 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил-N-метиламино)этанола (молекулярная масса 339,224, брутто-формула C16H16N2O2Cl2).
Получение указанного в заголовке 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил-N-метиламино)этанола (ВК-33)
В колбу помещают 0,53 г (13,9 ммоль) литийалюминийгидрида (LiAlH4), добавляют 6 мл безводного тетрагидрофурана (ТГФ) и полученную смесь охлаждают на льду. К реакционной смеси добавляют по каплям при перемешивании раствор 1,1 г (3,2 ммоль) 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил)-N-этиламино)этанола в 10 мл безводного тетрагидрофурана (ТГФ). После завершения добавления реакционную смесь перемешивают дополнительно в течение 1 часа при 20°С, охлаждают на льду и при энергичном перемешивании постепенно добавляют 6,5 мл 15%-ного раствора NaOH и затем 16 мл метиленхлорида (CH2Cl2). Отделяют органическую фазу, высушивают над безводным Na2SO4 и упаривают на роторном испарителе, получая при этом маслянистый остаток, который затем очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза СН3ОН:этилацетат=10:2). В результате получают 0,63 г (выход 60%) указанного в заголовке соединения в виде маслянистого вещества - основания.
Затем 0,60 г (1,84 ммоль) очищенного маслянистого вещества - основания - растворяют в 3,5 мл ацетона. Полученный раствор охлаждают на льду и при перемешивании добавляют 2,4 мл этанольного раствора бромоводородной кислоты (0,328 г HBr; 4,1 ммоль). К образовавшемуся остатку добавляют 2 мл диэтилового эфира. После перемешивания реакционной смеси в течение 2 часов на льду образовавшийся кристаллический продукт отфильтровывают и промывают диэтиловым эфиром. В результате получают 0,72 г (выход 80%) 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-метиламино)этанола дигидробромида, температура плавления 157-161°С (молекулярная масса 487,074, брутто-формула C17H18N2OCl2 · 2HBr).
1Н ЯМР-спектр, D2О, м.д. по отношению к DSS (0 м.д.): 8,90 (1Н), 8,78 (1Н), 8,64 (1Н), 8,10 (1Н), 7,50 (2Н), 7,24 (1Н), 5,50 (1Н), 3,52 (4Н), 3,08 (5Н).
ИК-спектр (таблетка с KBr) приведен на фиг.9.
Пример 3
1-(3-Пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-пропиламино)этанол (ВК-35)
Получение 1-(3-пиридил)-2-пропиламиноэтанола
К 1,01 г (3,6 ммоль) 3-бромацетилпиридина гидробромида, полученного, как описано в примере 1, добавляют 20 мл абсолютного этанола и 0,5 г (13,2 ммоль) борогидрида натрия (NaBH4). Реакционную смесь перемешивают при 20°С в течение 2 часов и фильтруют. К фильтрату, содержащему 3-пиридилоксиран, добавляют 0,7 мл (8,5 ммоль) н-пропиламина и кипятят с обратным холодильником в течение 5 часов. Реакционную смесь затем упаривают до получения сухого остатка, к которому добавляют 20 мл хлороформа, твердую часть отфильтровывают, полученный фильтрат упаривают и образовавшийся маслянистый остаток очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:этилацетат=10:2). В результате получают 0,33 г (выход 50%) 1-(3-пиридил)-2-пропиламиноэтанола в виде маслянистого вещества - основания (молекулярная масса 180,25, брутто-формула C10H16N2O).
Получение 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил)-N-пропиламино)этанола
В колбу, содержащую 630 мг (3,1 ммоль) ДЦГ (дициклогексилкарбодиимид), добавляют 3 мл метиленхлорида и при перемешивании добавляют по каплям раствор 625 мг (3,1 ммоль) 3,4-дихлорфенилуксусной кислоты в 5 мл метиленхлорида, что приводит к образованию осадка. Реакционную смесь перемешивают в течение 5 минут и затем добавляют к ней 550 мг (3,05 ммоль) 1-(3-пиридил)-2-метиламиноэтанола в 6 мл метиленхлорида, затем перемешивают дополнительно в течение 1 часа при 20°С. Образовавшийся осадок отфильтровывают и раствор упаривают. Полученный при упаривании фильтрат очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:СН3ОН=10:0,5). В результате получают 0,56 г (выход 50%) 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил)-N-пропиламино)этанола в виде маслянистого вещества (молекулярная масса 367,278, брутто-формула C18H20N2O2Cl2).
Получение указанного в заголовке 1-(3-пиридил)-2-[N-(2-(3,4-дихлорфенил)этил)-N-пропиламино]этанола (ВК-35)
В колбу помещают 0,43 г (11,3 ммоль) литийалюминийгидрида (LiAlH4), добавляют 6 мл безводного тетрагидрофурана (ТГФ) и полученную смесь охлаждают на льду. К реакционной смеси добавляют по каплям при перемешивании раствор 1 г (2,7 ммоль) 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил)-N-пропиламино)этанола в 10 мл безводного ТГФ. После завершения добавления реакционную смесь дополнительно перемешивают в течение 1 часа при 20°С, охлаждают на льду и при энергичном перемешивании постепенно добавляют 6,4 мл 15% NaOH и затем 16 мл метиленхлорида. Отделяют органическую фазу, высушивают над безводным Na2SO4 и упаривают на роторном испарителе. Полученный в результате упаривания остаток очищают колоночной хроматографией на силикагеле (силикагель 60, первая подвижная фаза CHCl3:СН3ОН=10:0,5; вторая подвижная фаза этилацетат:СН3ОН=10:1,5). В результате получают 0,58 г (выход 60%) указанного в заголовке соединения в виде маслянистого вещества - основания.
0,50 г (1,4 ммоль) полученного очищенного маслянистого вещества - основания - растворяют в 4 мл ацетона. Полученный раствор охлаждают на льду и при перемешивании добавляют 1,1 мл этанольного раствора бромоводородной кислоты (0,25 г HBr; 3,1 ммоль). Образуется белый осадок, к которому добавляют 3 мл диэтилового эфира и затем после перемешивания на льду в течение 2 часов образовавшийся кристаллический продукт отфильтровывают и промывают диэтиловым эфиром. В результате получают 0,62 г (выход 85%) дигидробромида 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-пропиламино)этанола, температура плавления 198-202°С (молекулярная масса 515,124; брутто-формула C18H22N2OCl2 · 2HBr).
1Н ЯМР-спектр, D2O, м. д. по отношению к DSS (0 м.д.): 8,91 (1Н), 8,81 (1Н), 8,64 (1Н), 8,12 (1Н), 7,54 (2Н), 7,27 (1Н), 5,50 (1Н), 3,58 (2Н), 3,48 (2Н), 3,34 (2Н), 3,16 (2Н), 1,82 (2Н), 1,00 (3Н).
ИК-спектр (таблетка с KBr) приведен на фиг.8.
Пример 4
1-(4-Пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-метиламино)этанол (ВК-38)
Получение 1-(4-пиридил)-2-метиламиноэтанола
К 1,01 г (3,6 ммоль) 4-бромацетилпиридина гидробромида, полученного, как описано в примере 1, добавляют 20 мл абсолютного этанола и 0,5 г (13,2 ммоль) борогидрида натрия и реакционную смесь перемешивают при 20°С в течение 2 часов, после чего фильтруют и к фильтрату, содержащему 4-пиридилоксиран, добавляют 1,3 мл 33%-ного этанольного раствора метиламина. Реакционную смесь кипятят с обратным холодильником в течение 3 часов, упаривают до получения сухого остатка, к которому добавляют 20 мл хлороформа, и затем твердую часть отфильтровывают. Фильтрат упаривают и полученный маслянистый остаток очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:этилацетат=10:2). В результате получают 0,30 г (выход 55%) указанного в заголовке соединения в виде маслянистого вещества - основания (молекулярная масса 152,196, брутто-формула C8H12N2O).
Получение 1-(4-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил)-N-метиламино)этанола
В колбу, содержащую 0,54 г (2,6 ммоль) ДЦГ (дициклогексилкарбодиимид), добавляют по каплям 2 мл метиленхлорида и 0,54 г (2,6 ммоль) 3,4-дихлорфенилуксусной кислоты в 4 мл метиленхлорида для того, чтобы вызвать образование осадка. Реакционную смесь перемешивают в течение 5 минут и затем добавляют 400 мг (2,6 ммоль) 1-(4-пиридил)-2-метиламиноэтанола в 3 мл метиленхлорида, после чего перемешивают дополнительно в течение 1 часа при 20°С. Образовавшийся осадок отфильтровывают и полученный раствор упаривают. Полученный при упаривании фильтрат очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:СН3ОН=10:0,5). В результате получают 0,53 г (выход 60%) 1-(4-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил)-N-метиламино)этанола.
Получение указанного в заголовке 1-(4-пиридил)-2-[N-(2-(3,4-дихлорфенил)этил)-N-метиламино]этанола (ВК-38)
В колбу помещают 510 мг (13,5 ммоль) литийалюминийгидрида (LiAlH4), добавляют 6 мл безводного ТГФ и полученную смесь охлаждают на льду. К реакционной смеси добавляют по каплям при перемешивании раствор 1,02 г (3 ммоль) 1-(4-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил)-N-метиламино)этанола в 10 мл безводного ТГФ. После завершения добавления реакционную смесь дополнительно перемешивают в течение 1 часа при комнатной температуре, охлаждают на льду и при энергичном перемешивании постепенно добавляют 6,6 мл 15% NaOH и затем 16 мл метиленхлорида. Отделяют органическую фазу, высушивают над безводным Na2SO4 и упаривают на роторном испарителе, получая при этом маслянистый остаток, который очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:СН3ОН=10:1). В результате получают 0,54 г (выход 55%) указанного в заголовке соединения в виде маслоподобного основания.
0,50 г (1,54 ммоль) очищенного маслоподобного основания растворяют в 3 мл ацетона. Полученный раствор охлаждают на льду и при перемешивании добавляют 1,8 мл этанольного раствора бромоводородной кислоты (0,274 г HBr; 3,4 ммоль). Образуется осадок, к которому добавляют 3 мл диэтилового эфира. После перемешивания реакционной смеси на льду в течение 2 часов образовавшийся кристаллический продукт отфильтровывают и промывают диэтиловым эфиром. В результате получают 0,64 г (выход 85%) дигидробромида 1-(4-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-метиламино)этанола, температура плавления 191-194°С (молекулярная масса 487,074; брутто-формула C17H18N2OCl2 · 2HBr).
1Н ЯМР-спектр, D2O, м.д. по отношению к DSS (0 м.д.): 8,81 (2Н), 8,14 (2Н), 7,47 (2Н), 7,22 (1Н), 5,54 (1H), 3,50 (4H), 3,08 (5Н).
ИК-спектр (таблетка с KBr) приведен на фиг.7.
Пример 5
Тестирование четырех лигандов сигма-рецепторов (ВК-31 · 2HBr, ВК-33 · HBr, ВК-35 · 2HBr и ВК-38 · 2HBr), полученных согласно примерам 1-4, ингибиторов биосинтеза холестерина на уровне стерол-Δ7,8-изомеразы
Проведена оценка ингибирующего воздействия на биосинтез холестерина четырех новых лигандов сигма-рецепторов - ВК-31 · 2HBr, ВК-33 · 2HBr, ВК-35 · 2HBr и ВК-38 · 2HBr), полученных согласно примерам 1-4. Используют методику ex vivo для введения метаболической метки иммортальных гептоцитов человека. Радиоактивно меченный предшественник биосинтеза холестерина [3Н] ацетат добавляют к клеткам с введением или без введения сигма-лигандов. В заключение проводят два независимых эксперимента по введению метаболической метки и по анализу стерола для каждого соединения.
Материалы и методы
Культура клеток и добавление сигма-лигандов рецепторов
Клетки иммортальных гепатоцитов человека линии HepG2 помещают в колбы емкостью 75 см2 в соотношении 1:2, по две колбы для каждого вида условий. Клетки выращивают в среде DMEM (L-аргинин · HCl 0,084 г/л, L-цистеин · 2HCl 0,0626 г/л, L-глутамин 0,584 г/л, глицин 0,03 г/л, L-гистидин · HCl·Н2О 0,042 г/л, L-изолейцин 0,105 г/л, L-лейцин 0,105 г/л, L-лизин · HCl 0,146 г/л, L-метионин 0,03 г/л, L-фенилаланин 0,066 г/л, L-серин 0,042 г/л. L-треонин 0,095 г/л, L-триптофан 0,016 г/л, L-тирозин 2Na · 2Н2О 0,10379 г/л, L-валин 0,094 г/л, хлорид холина 0,004 г/л, фолиевая кислота 0,004 г/л, миоинозитол 0,0072 г/л, ниацинамид 0,004 г/л, D-пантотеновая кислота 0,004 г/л, пиридоксаль · HCl 0,004 г/л, рибофлавин 0,0004 г/л, тиамин · HCl 0,004 г/л, хлорид кальция · 2Н2O 0,265 г/л, нитрат железа · 9H2O 0,0001 г/л, сульфат магния [безводный] 0,09767 г/л, хлорид калия 0,4 г/л, хлорид натрия 6,4 г/л, одноосновный фосфат натрия [безводный] 0,109 г/л, глюкоза 4,5 г/л и феноловый красный, Na 0,0159 г/л) с 5% бычьей сыворотки и 1% L-глутамина. Через 24 часа среду с 100 мкМ лигандов сигма-рецепторов (ВК-31 · 2HBr, ВК-33 · 2HBr, ВК-35 · 2HBr и ВК-38 · 2HBr) добавляют к клеткам. В качестве положительного контроля используют известные ингибиторы биосинтеза холестерина, 100 мкМ ловастатина или правастатина, которые оба являются ингибиторами HMG-СоА редуктазы, и 100 мкМ флуконазола, который ингибирует ферменты семейства Р450, к которому также принадлежит ланостерол-14α-деметилаза (CYP51). Клетки, выращенные в нормальной среде без добавления ингибиторов, используют в качестве отрицательного контроля. Среду заменяют через 24 часа. Через 48 часов добавляют 40 микроКюри [3Н] ацетата на 1 мл среды (400 микроКюри на флакон). Среду удаляют через 24 часа и затем клетки обрабатывают трипсином, используя 2 мл. Клетки собирают в 4 мл среды, центрифугируют, и осадок клеток ресуспендируют в дистиллированной воде (1 мл на колбу). Клетки гомогенизируют посредством замораживания и оттаивания. Стеролы экстрагируют из гомогената. Концентрацию белка в гомогенате определяют, используя реагент Био-рад (Bio-rad) в соответствии с инструкцией производителя.
Экстрак