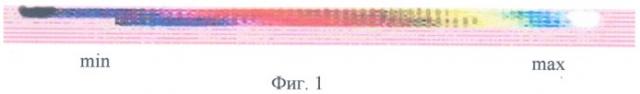Способ лечения больных пороками клапанов сердца
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к кардиохирургии 1. Проводят хирургическую коррекцию порока и кровоснабжения миокарда. При этом в случае наличия зон миокарда со снижением перфузии более 50% осуществляют трансплантацию аутологичной мононуклеарной фракции клеток костного мозга в указанные зоны, а также в коронарные артерии или в аорто- и маммарокоронарные шунты. Аутологичную мононуклеарную фракцию клеток костного мозга получают сепарацией клеток костного мозга, забранного пункционно из грудины перед стернотомией в объеме 120±5 мл. Способ позволяет восстановить микрососудистое русло миокарда. 1 з.п. ф-лы, 9 ил.
Реферат
Изобретение относится к медицине, а именно к кардиохирургии, и может быть использовано при лечении больных пороками клапанов сердца.
Больные пороками клапанов сердца составляют значительную часть среди пациентов кардиологических и кардиохирургических отделений. В зависимости от этиологии различают врожденные пороки клапанов сердца (аномалия развития) и приобретенные пороки клапанов сердца, как следствие и осложнение таких заболеваний как ревматизм, инфекционный эндокардит, атеросклероз, травма сердца. Порок клапана сердца выражается либо в нарушении запирательной функции клапана и появлении на нем обратного тока крови - регургитации (недостаточность клапана) либо в появлении на клапане гидродинамического сопротивления току крови вследствие сужения клапана (стеноз клапана) или в комбинации стеноза и недостаточности. Следствием этого является нарушение внутрисердечной гемодинамики, ведущее к перегрузке в работе как отдельных камер сердца, так постепенно и всего сердца, т.е. к развитию сердечной недостаточности. При пороках клапанов сердца, особенно аортального клапана, отмечается возникновение хронической прогрессирующей ишемии миокарда, которая обусловлена рядом причин. Во-первых, из-за особенностей кровотока в аорте, вызванного нарушением функции аортального клапана, снижается диастолическое наполнение коронарных артерий. Во-вторых, у больных с пороками клапанов сердца постепенно происходит ремоделирование миокарда: развивается гипертрофия сердечной мышцы; при приобретенных пороках также часто появляются участки кардиосклероза и очаги воспаления в миокарде как следствие болезней, приведших к развитию порока: ревматизма, инфекционного эндокардита; интрамуральная внутрисосудистая сеть сердца не соответствует гипертрофии миокарда, многие мелкие сосуды необратимо разрушены либо сдавлены, их стенки изменены, в просвете отмечается стаз форменных элементов крови, объемный кровоток через микрососудистое русло миокарда снижен [Рашмер Р.Ф. Динамика сердечно-сосудистой системы: пер. с англ. - М.: Медицина, 1981. - С.387]. В-третьих, у многих больных пороками клапанов сердца имеется сочетанное поражение коронарных артерий (спазм, стеноз или окклюзия из-за атеросклероза либо тромбоза), что уменьшает приток крови к измененному миокарду и дополнительно усиливает его ишемию.
Для лечения больных пороками клапанов сердца используют как медикаментозную терапию, так и хирургическое лечение. Показано, что фармакотерапия применяется лишь как вспомогательное средство, т.к. не может радикально устранить порок клапана сердца, поэтому ведущим способом лечения является хирургическое лечение.
Известный способ современного стандартного хирургического лечения больных пороками клапанов сердца включает в себя коррекцию порока клапанов сердца (протезирование клапанов или клапаносохраняющие операции) и при необходимости коррекцию измененных коронарных артерий при наличии в них гемодинамически значимых стенозов: аортокоронарное и маммарокоронарное шунтирование, эндатерэктомия, балонная коронаропластика и стентирование [Сердечно-сосудистая хирургия: руководство / под ред. акад. АМН СССР В.И.Бураковского, проф. Л.А.Бокерия.- М.: медицина. 1989. - С.384, С.446]. Этот способ выбран в качестве прототипа.
Недостатком прототипа является отсутствие непосредственного коррелирующего воздействия на измененное интрамуральное микрососудистое русло миокарда. Поэтому у больных несмотря на коррекцию порока клапанов сердца и восстановление кровоснабжения по коронарным артериям микрососудистая ишемия миокарда при наличии зон резкого или значительного снижения перфузии миокарда сохраняется и может являться причиной постепенного прогрессирования сердечной недостаточности.
Задачей изобретения является создание способа лечения больных пороками клапанов сердца, направленного на коррекцию не только порока клапанов сердца и коронарного кровотока, но и на возможность коррекции измененной интрамиокардиальной сосудистой сети в зависимости от степени тяжести ее изменений.
Технический результат, достигаемый при решении поставленной задачи, заключается в возможности восстановления микрососудистого русла миокарда при наличии зон снижения перфузии миокарда более чем на 50%.
Указанный технический результат является новым и достигается тем, что в известном способе лечения больных пороками клапанов сердца, включающем хирургическую коррекцию порока и кровоснабжения миокарда, согласно изобретению при наличии зон миокарда со снижением перфузии более 50% осуществляют трансплантацию аутологичной мононуклеарной фракции клеток костного мозга в указанные зоны, а также в коронарные артерии или в аорто- и маммарокоронарные шунты.
При этом целесообразно аутологичную мононуклеарную фракцию клеток костного мозга получать сепарацией клеток костного мозга, забранного пункционно из грудины перед стернотомией в объеме 120±5 мл.
Изобретение основано на возможности дооперационной диагностики и локализации с помощью однофотонной компьютерной томографии сердца (ОФЭКТ) областей миокарда с нарушением внутритканевого кровотока, оценки степени тяжести этих нарушений [Нифонтов Е.М., Рудомаков О.Г., Рожкова Д.В. Применение современных методов диагностики при ишемической болезни сердца и их значение для выбора врачебной тактики: Пособие для врачей. - СПб.: Изд-во СПбГМУ, 2001. - С.39], а также обнаруженного в последние годы явления неоангиогенеза в зонах ишемии при применении клеточной терапии, в частности мононуклеарной фракции клеток костного мозга [Смолянинов А.Б., Жаров Е.В., Козлов К.Л., Кириллов Д.А. Основы клеточной и генной терапии сердечно-сосудистых заболеваний. - М., 2005. - С.70].
В 2004-2006 годах в клинике госпитальной хирургии №2 СПбГМУ им. акад. И.П.Павлова у 50 больных с пороками клапанов сердца в состоянии функционального покоя выполнено исследование микрососудистого кровотока миокарда с помощью ОФЭКТ (использовался радиофармпрепарат Те 99m технетрил) на томографической гамма-камере (ДДК-61, Piccer, США). Было выявлено, что исходно у всех больных (даже при отсутствии поражения коронарных артерий) имеются участки снижения перфузии миокарда от умеренного до резкого. В отдаленные сроки после традиционных операций (протезирование клапанов сердца или их сочетание с аорто- и маммарокоронарным шунтированием) дефекты перфузии миокарда сохранялись, если они были исходно резкими или выраженными (снижение перфузии более чем на 50%) и могли исчезать, если были умеренными или незначительными.
Таким образом, проведенные исследования позволили оценить степень снижения перфузии миокарда, при которой необходима хирургическая коррекция микрососудистого русла, позволяющая восстановить его путем трансплантации аутологичной мононуклеарной фракции клеток костного мозга в зоны снижения перфузии более 50%, а также в коронарные артерии или в аорто- и маммарокоронарные шунты.
Сущность способа поясняется графическими изображениями на фиг.1-9:
На фиг.1 представлена шкала, отражающая в цвете градацию уровня перфузии миокарда от минимального (соответствующего рубцовому изменению миокарда) до максимального (соответствующего уровню перфузии здорового миокарда) по данным ОФЭКТ.
На фиг.2-5 представлена динамика перфузии миокарда по данным ОФЭКТ до и после лечения больных пороками клапанов сердца традиционным хирургическим способом (в примерах 1-4).
На фиг.6 представлена динамика перфузии миокарда по данным ОФЭКТ по результатам экспериментальных исследований.
На фиг.7-9 представлена динамика перфузии миокарда по данным ОФЭКТ до и после лечения больных пороками клапанов сердца предлагаемым способом (в примерах 5-7).
Способ осуществляют, например, следующим образом.
Первоначально перед оперативным лечением наряду с традиционной диагностикой порока сердца и состояния коронарных артерий выявляют зоны с выраженным и резким дефектом перфузии миокарда (снижение накопления радиофармпрепарата более чем 50% от максимума) с помощью ОФЭКТ с Те 99m технетрилом по общепринятой технологии. Затем в начале операции под наркозом перед стернотомией производят пункционно забор из грудины 120 мл костного мозга, смешивая его в шприце в стерильных условиях с раствором гепарина в соотношении 100 ЕД гепарина на 1 мл взвеси костного мозга. Параллельно с оперативной коррекцией порока клапанов сердца и при необходимости вмешательства на коронарных артериях выделяют аутологичную мононуклеарную фракцию костного мозга по принятой в СПбГМУ им. акад. И.П.Павлова технологии [Шавва С.А. Разработка и клиническое применение эффективных методов криоконсервирования костного мозга онкологических больных: Дисс.... канд. мед. наук. - СПб., 1994. - 158 с.]. Для этого смесь костного мозга с гепарином из шприца помещают в стерильный полимерный контейнер для заготовки крови (двойной или тройной гемакон, Терумо), добавляют в качестве седиментирующего агента расчетную дозу 6% гидроксиэтилированного крахмала (6% HAES, Фрезениус) в соотношении 1:4 (к смеси костного мозга с гепарином), содержимое контейнера хорошо перемешивают, после чего контейнер подвешивают при температуре 37°С на 60 минут отводными магистралями книзу. После оседания эритроцитов их медленно удаляют под действием силы тяжести в другой подсоединенный полимерный контейнер. В первичном контейнере оставляют слой клеток толщиной 0,3-0,4 см, содержимое вновь тщательно перемешивают и цетрифугируют в режиме 980 g в течение 10 минут, после чего супернатант переводят во второй подсоединенный полимерный контейнер, оставляя в первичном контейнере 20-40 мл клеточной взвеси (мононуклеарная фракция), содержащей в среднем (1,0±0,3)×109 клеток. Проводят забор проб для оценки количества клеток, их жизнеспособности и характеристики. Процесс выделения аутологичной мононуклеарной фракции продолжается около 100 минут, после чего путем множественных микроинъекций (игла 29G, объем трансплантата 0,1-0,15 мл на одну инъекцию) производится ее интрамиокардиальная трансплантация в выявленные на этапе предоперационной диагностики участки с выраженным и резким нарушением перфузии (снижение перфузии более чем на 50%) миокарда. Общий объем интрамиокардиальной трансплантации не превышает 6 мл, остальная часть мононуклеарной фракции вводится селективно в коронарные артерии или в аорто- и маммарокоронарные шунты.
Способ иллюстрируется следующими примерами.
Пример 1. Больная Н., 59 лет. Диагноз: ревматизм, комбинированный порок митрального клапана, протезирование митрального клапана 3 года назад. По данным эхокардиографии функция искусственного клапана сердца удовлетворительная. По данным коронарографии патологических изменений коронарных артерий не выявлено. По данным ОФЭКТ миокарда в состоянии функционального покоя сохраняются выраженные и резкие дефекты перфузии миокарда (снижение перфузии более чем на 50%) практически всех стенок левого желудочка сердца (фиг.2).
Пример 2. Больной Б., 58 лет. Диагноз: атеросклероз аорты, коронарных артерий, атеросклеротический стеноз аортального клапана, ишемическая болезнь сердца, постинфарктный кардиосклероз задней стенки левого желудочка сердца. Выполнено протезирование аортального клапана и наложение трех аортокоронарных шунтов полтора года назад. По данным эхокардиографии функция искусственного клапана сердца удовлетворительная. По данным ОФЭКТ миокарда в состоянии функционального покоя остаются выраженные и резкие дефекты перфузии (снижение перфузии более чем на 50%) миокарда (фиг.3).
Пример 3. Больной Г., 56 лет. Диагноз: ревматизм, сочетанное поражение митрального и аортального клапанов. До операции по данным ОФЭКТ миокарда в состоянии функционального покоя выявляются участки выраженного и резкого дефекта перфузии (фиг.4А). Выполнено протезирование митрального и аортального клапанов. Осмотрен через полгода после операции. По данным эхокардиографии функция искусственных клапанов сердца удовлетворительная, однако по данным ОФЭКТ миокарда в состоянии функционального покоя сохраняются участки выраженного и резкого дефекта перфузии (снижение перфузии более чем на 50%) (фиг.4Б).
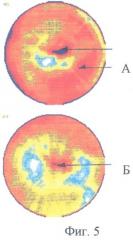
Пример 4. Больной Л., 42 года. Диагноз: инфекционный эндокардит с поражением бикуспидального аортального клапана, аортальная недостаточность. По данным ОФЭКТ миокарда в состоянии функционального покоя выявляются участки умеренного дефекта перфузии (фиг.5А). Через год после протезирования аортального клапана по данным эхокардиографии функция искусственного клапана сердца удовлетворительная. По данным ОФЭКТ миокарда в состоянии функционального покоя отмечается выраженная положительная динамика перфузии (фиг.5Б).
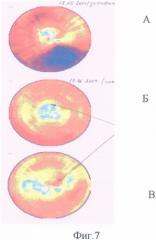
Пример 5. Больной А., 55 лет. Диагноз: ревматизм, критический аортальный порок сердца. ИБС, атеросклероз коронарных артерий: стеноз краевой ветви левой коронарной артерии 90%, постинфарктный рубец на задней стенке левого желудочка сердца. По данным ОФЭКТ с технетрилом в состоянии функционального покоя в области задней и нижней стенки левого желудочка сердца резкое снижение перфузии (на 70% от максимума), умеренные нарушения (40-50%) на передней стенке (фиг.7А). 19.05.04 выполнена операция в условиях искусственного кровообращения: протезирование аортального клапана протезом Мединж-2, наложение маммарокоронарного анастомоза с краевой ветвью левой коронарной артерии, при этом в начале операции под наркозом перед стернотомией произвели пункционно забор из грудины 120 мл костного мозга, смешивая его в шприце в стерильных условиях с раствором гепарина в соотношении 100 ЕД гепарина на 1 мл взвеси костного мозга. После сепарации клеток костного мозга произведено интрамиокардиальное введение аутологичной мононуклеарной фракции клеток костного мозга (введено 0,8×109 клеток) вокруг зоны рубца по задней стенке левого желудочка и в дистальный отдел анастомоза. Уже через 1 месяц перфузия миокарда резко улучшилась (фиг.7Б), эффект сохраняется и через 1 год (фиг.7В).
Пример 6. Больной И., 31 год. Диагноз: инфекционный эндокардит с поражением бикуспидального аортального клапана, аортальная недостаточность 4 степени. До операции по данным ОФЭКТ с технетрилом в состоянии функционального покоя определялись значительные нарушения перфузии (снижение перфузии более чем на 50%) верхушки и нижнезадней стенки левого желудочка (фиг.8А). 14.10.04 больному выполнено протезирование аортального клапана протезом Мединж-2, интрамиокардиально в зоны сниженной перфузии и интракоронарно введена аутологичная мононуклеарная фракция клеток костного мозга (введено 1,2×109 клеток). Спустя один год после операции по данным эхокардиографии функция протеза удовлетворительная, а по данным ОФЭКТ перфузия значительно улучшилась (фиг.8Б).
Пример 7. Больная О., 56 лет. Диагноз: инфекционный эндокардит с поражением митрального клапана: митральная недостаточность 4 степени. ИБС. постинфарктный кардиосклероз на задней стенке левого желудочка сердца. По данным коронарографии стеноз передней межжелудочковой ветви левой коронарной артерии менее 50%. По данным ОФЭКТ с технетрилом в состоянии функционального покоя определялись выраженные и резкие нарушения перфузии (снижение перфузии более чем на 50%) верхушки и нижнезадней стенки и частично передней стенки левого желудочка сердца (фиг.9А). 18.05.05. выполнено протезирование митрального клапана протезом Мединж-2 и интрамиокардиальное и интракоронарное введение аутологичной фракции клеток костного мозга (1,2×109 клеток). Осмотрена через 6 месяцев после операции - функция протеза удовлетворительная. По данным ОФЭКТ - выраженная положительная динамика перфузии миокарда (фиг.9Б).
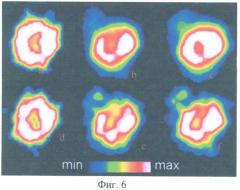
До проведения клинических исследований была выполнена серия хронических экспериментальных исследований на 65 кроликах с моделью ишемии миокарда, в которой была показана эффективность интрамиокардиальной трансплантации аутологичной мононуклеарной фракции клеток костного мозга для восстановления кровоснабжения в зоне инфаркта и отсутствие отрицательных изменений миокарда в зонах клеточной трансплантации. Фиг.6 демонстрирует динамику перфузии миокарда до (фиг.6а) и спустя 1,5 (фиг.6е) и 12 месяцев (фиг.6f) после моделирования инфаркта у животных контрольной группы и у животных основной группы в соответствующие сроки (фиг.6а, фиг.6b, фиг.6с), в которой моделирование инфаркта миокарда сочеталось с интрамиокардиальным введением в зону ишемии аутологичной мононуклеарной фракции клеток костного мозга. Как видно из этой фигуры, у животных контрольной группы (нижний ряд) после моделирования инфаркта миокарда развился дефект перфузии миокарда, который прогрессировал и сохранялся спустя 12 месяцев, тогда как в опытной группе животных уровень перфузии миокарда в зоне моделированного инфаркта через 12 месяцев практически вернулся к исходному (фиг.6а).
После получения результатов экспериментальных исследований у 10 больных с пороками клапанов сердца на основе их добровольного письменного информированного согласия одновременно с традиционным кардиохирургическим вмешательством выполнено интрамиокардиальное введение аутологичной мононуклеарной фракции костного мозга в зоны выраженного или резкого нарушения перфузии миокарда (снижение перфузии более чем на 50%) по описанному выше способу. В отдаленный срок после трансплантации (через 6-12 месяцев) в местах введения клеток дефект перфузии значительно уменьшился, что подтверждает достижение технического результата по восстановлению микрососудистого русла миокарда.
1. Способ лечения больных пороками клапанов сердца, включающий хирургическую коррекцию порока и кровоснабжения миокарда, отличающийся тем, что при наличии зон миокарда со снижением перфузии более 50%, осуществляют трансплантацию аутологичной мононуклеарной фракции клеток костного мозга в указанные зоны, а также в коронарные артерии или в аорто и маммарокоронарные шунты.
2. Способ по п.1, отличающийся тем, что аутологичную мононуклеарную фракцию клеток костного мозга получают сепарацией клеток костного мозга, забранного пункционно из грудины перед стернотомией в объеме 120±5 мл.