Способ получения протективной белоксодержащей фракции бактерий
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к вакцинным препаратам, и касается способа получения протективных антигенов на основе секретируемых белоксодержащих фракций бактерий. Способ включает культивирование бактерий на жидких питательных средах, отделение культуральной среды от бактерий, ее очистку и концентрацию методом ультрафильтрации с порогом отсечения белка 30 кДа и колоночной хроматографии с помощью гель-фильтрации на сефадексе G-75, последующей очистке на ДЕАЕ-сефарозе в градиенте NaCl до получения фракций с молекулярной массой 30-50 кДа и содержанием белка 4-5 мг/мл. Способ позволяет получать профилактические и лечебные иммунопрепараты. 1 з.п. ф-лы, 8 табл., 2 ил.
Реферат
Изобретение относится к медицине, а именно к вакцинным препаратам, и касается способа получения протективных антигенов на основе секретируемых белоксодержащих фракций бактерий, которые могут быть использованы для получения профилактических и лечебных иммунопрепаратов.
Проблема бактериальных инфекций на протяжении многих лет является одной из наиболее важных проблем медицинской науки и здравоохранения. Для профилактики этих заболеваний кроме анатоксинов используют большое количество вакцин, конструируемых на основе антигенов микробной клетки. Эти вакцины характеризуются различной степенью протективной активности и строгой серотиповой специфичностью.
Известен способ получения протективных профилактических препаратов (анатоксины), состоящих из белоксодержащих фракций (токсинов), секретируемых токсинобразующими бактериями; дальнейшая обработка культуральной среды, содержащей токсин производится путем обезвреживания токсина формалином, концентрации и очистки от балластных веществ.
(Анатоксины. Руководство по вакцинному и сывороточному делу под ред. П.Н.Бургасова, 1978, с.103-157.)
Недостатком этого метода является невозможность получения протективных секретируемых препаратов при использовании нетоксигенных штаммов бактерий.
Техническим результатом, на решение которого направлено данное изобретение, является создание универсального способа получения бактериальных антигенов из любых видов бактерий на основе секретируемых белоксодержащих фракций различных видов бактерий, характеризующихся высокой внутривидовой перекрестной протективной активностью.
Для достижения указанного технического результата в способе получения протективной белоксодержащей фракции бактерий, включающем культивирование бактерий на жидких питательных средах, отделение культуральной среды от бактерий, согласно изобретению культуральную среду, содержащую секретируемые белоксодержащие фракции, подвергают очистке и концентрируют методом ультрафильтрации с порогом отсечения белка 30 кДа и колоночной хроматографии с помощью гель-фильтрации на сефадексе G-75 и последующей очистке на ДЕАЕ-сефарозе в градиенте NaCl до получения фракций с молекулярной массой 30-50 кДа и содержанием белка 4-5 мг/мл.
Для получения протективных антигенов на основе секретируемых белоксодержащих фракций используют нетоксигенные штаммы грамотрицательных или грамположительных микроорганизмов.
Сущность изобретения поясняется на следующих примерах.
Пример 1. Способ получения протективных секретируемых белоксодержащих антигенов клебсиеллы К2, предусматривающий следующие стадии:
а) культивирование клебсиеллы К2 на жидкой полусинтетической питательной среде.
б) инактивация микробной массы;
в) отделение надосадочной жидкости, центрифугирование;
г) концентрирование и очистка надосадочной жидкости методом колоночной хроматографии;
д) фракционирование по молекулярной массе с помощью ультрафильтрации с порогом отсечения белка 30 кДа.
Штамм K.pneumoniae K2 (В5055) из Эталонной международной коллекции клебсиелл, находящийся в лиофилизированном состоянии в ампулах, засевают в 50 мл 0,2% сахарного бульона на 4 часа, затем на жидкую полусинтетическую среду следующего состава:
КН2РО4 - 4,50 г/л
К2НРО4 - 5,00 г/л
(NH4)2SO4-1,00 г/л
MgSO4×7Н2О - 0,30 г/л
Цитрат натрия - 0,50 г/л
Глюкоза - 10 г/л
Аминопептид -103,0 мл
Культивирование штаммов K.pneumoniae проводят в ферментере, например, фирмы "Анкум" при непрерывном перемешивании и подаче воздуха в объеме 10 л при рН 7,8 t=37°C в течение 5-6 часов. Концентрация микроорганизмов составляет (8,0±1,0)·109 микробных клеток/ мл. Микробную суспензию инактивируют азидом натрия. Полноту инактивации микробных клеток контролируют путем высева на питательный агар. Над осадочную жидкость отделяют от микробных клеток центрифугированием при 6 000 g в течение 30 минут при температуре 4°С, как и все последующие процедуры. К полученному супернатанту прибавляют сульфат аммония до 80% насыщения по методу N. Koide et al. Осадок отделяют центрифугированием при 10 000 g в течение 30 минут, растворяют в 50 мл фосфатного буфера рН 7,4, проводят ультрафильтрацию с порогом отсечения белка 30 кДа и фракционируют с помощью гель-фильтрации на сефадексе G-75 (Pharmacia, Швеция). Последующую очистку белоксодержащей фракции проводят на DEAE-сефарозе в градиенте NaCl (от 0 до 50 М NaCl) до получения фракций с мол. массой 30-50 кДа и содержанием белка 4-5 мг/мл.
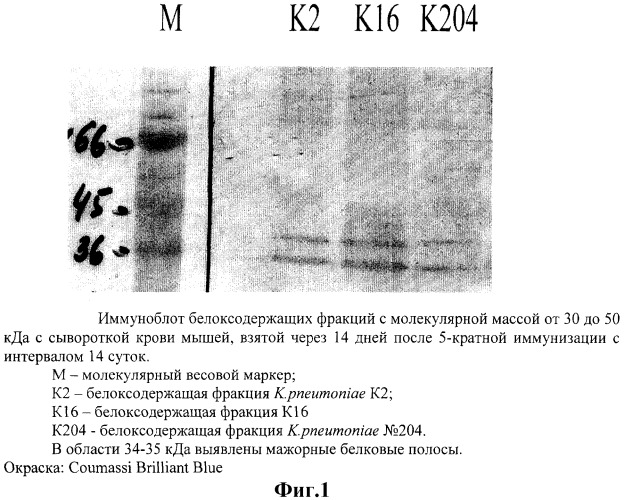
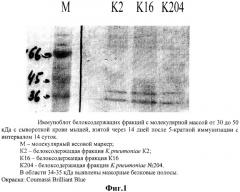
Принадлежность полученных фракций к белоксодержащим соединениям определяли методом иммуноблоттинга. После электрофоретического разделения исследуемой фракции по молекулярной массе к ним прибавляли гипериммунную сыворотку мышей, иммунизированных препаратом на основе указанной фракции (первичные антитела), а затем прибавляли меченые антитела к иммуноглобулинам мыши (вторичные антитела). Полосы преципитации при тестировании фракций, содержащих иммунологически активные соединения, выявляли в области 35-40 кДа (фиг.1).
Принадлежность исследуемых фракций к секретируемым белкам K.pneumoniae определяли методом проточной цитофлуориметрии. Метод основан на обработке микробных клеток 0,5% параформом в 0,9% фосфатно-солевом буфере (ФСБ) и рекомендован для фиксации бактериальных клеток или клеток млекопитающих при работе на проточном цитофлуориметре. Перед постановкой реакции микробные клетки трижды отмывали центрифугированием при 800 g в ФСБ без параформа. Отмытые клетки переносили в объеме 200 мкл в специальные пробирки (по 50·103 клеток на пробирку) и добавляли 10, 50 или 100 мкл сыворотки (первичные антитела), полученной после гипериммунизации мышей исследуемыми белковыми фракциями. В контрольные пробирки прибавляли соответствующее количество ФСБ буфера или сыворотки крови интактных мышей (отрицательный контроль). В качестве положительного контроля использовали сыворотки крови мышей, выживших после инфицирования штаммом K.pneumoniae K2. Пробы инкубировали 1 час при 37°С. После этого в каждую пробирку прибавляли по 3 мл изотонического раствора хлорида натрия и трижды отмывали от сыворотки центрифугированием при 800 g. Затем клетки ресуспендировали в 200 мкл ФСБ и вносили вторичные FITC меченые кроличьи антитела против иммуноглобулинов мыши (Caltag Labs, США). Пробирки снова инкубировали 30 мин при 37°С. Результаты учитывали на проточном цитофлуориметре FacsCalibur (фирмы Becton Dickinson, США). Измеряли уровень флуоресценции, выделенной в гейте популяции микробных клеток в канале FL-1H. Среднегеометрическую интенсивность флуоресценции клеток (Gm) рассчитывали с помощью общепринятой программы для обработки данных проточного цитофлуориметра WinMdi 2.8 и выражали в условных единицах (у.е.).
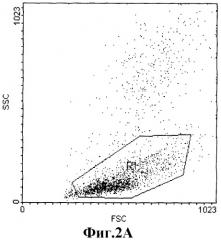
На фиг.2А показан дот-плот микробных клеток К. pneumoniae. Видно, что выделенная популяция микробных клеток представляет собой однородную клеточную популяцию, формирующую четкое "облако". Факт выделения такой однородной популяции позволяет считать, что использованный метод выделения микробных клеток не вызывает их разрушения или слипания и, следовательно, клеточная популяция пригодна для анализа. На фиг.2Б показана гистограмма свечения исходной популяции микробных клеток в канале FL-1H. Видно, что исходно популяция микробных клеток обладала низким уровнем флуоресценции в присутствии вторичных FITC-меченых антител. Прибавление гипериммунной сыворотки, содержащей антитела к секретируемым белоксодержащим фракциям с молекулярной массой 30-50 кДа в присутствии вторичных FITC-меченых антител, также не приводило к увеличению флуоресценции микробных клеток (рис.2В). Это указывает на отсутствие связывания этих антител с препаратом микробных клеток. Такие же результаты получены для белковой фракции с молекулярной массой 21 кДа. В то же время, добавление сыворотки крови переболевших животных, содержащей антитела к антигенам микробной клетки сопровождалось усилением флуоресценции в присутствии вторичных FITC-меченых антител (средний уровень флуоресценции Gm возрос с 3 до 150 у.е.) (фиг.2Г).
Содержание белка составляет 4-5 мг/мл.
Определение антигенной и иммуногенной активности полученных белоксодержащих фракций. Для иммунизации животных белоксодержащие фракции штамма К2 предварительно сорбируют на гидроокиси алюминия. Для оценки протективной активности полученных фракций иммунизацию мышей проводят 2-кратно с интервалом 2 недели. Сыворотку крови от иммунизированных животных для изучения антигенной активности, превентивных свойств и других тестов получают через 14 суток после последней иммунизации.
Для изучения протективной активности белоксодержащих фракций, сорбированных на гидроокиси алюминия, мышей иммунизировали двумя 10-кратно убывающими дозами препаратов и заражали штаммом К. pneumoniae K2 в дозе 500 микробных клеток, что соответствовало 178 LD50 (табл.1, 2). Контроль заражающей дозы проводили на интактных животных. Белоксодержащая фракция с молекулярной массой 21 кДа оказалась малоиммуногенной. Белоксодержащая фракция с молекулярной массой 34-35 кДа характеризовалась высокой протективной активностью, которая имела дозозависимый характер. Защита от заражения при иммунизации иммунизирующей дозой (10 мкл) составляла 70%.
Белоксодержащие фракции с молекулярной массой 30-50 кДа с содержанием белка 4-5 мг/мл, полученные из штамма К16 и нетипируемого 204, обладали внутривидовой перекрестной протективной активностью при заражении штаммом К2 (табл.2, группы 3,4). В свою очередь, препарат из штамма К2 защищал мышей от заражения штаммами К16 и 204 (табл.3).
Белоксодержащая фракция К. pneumoniae K2 с молекулярной массой 30-50 кДа в гомологичной системе обладала протективной активностью без адъюванта (табл.4). В качестве референс-препарата использовали поликомпонентную бактериальную вакцину Иммуновак-ВП-4, состоящую из антигенов микробных клеток Klebsiella pneumoniae, Proteus vulgaris, Escherichia coli и Staphylococcus aureus, содержащую в своем составе в качестве основного компонента ЛПС, ассоциированный с белком наружной мембраны грамотрицательных микроорганизмов, пептидогликан, тейхоевые кислоты и лабильные белковые антигены S. aureus. Препараты вводили по единой схеме.
Протективная активность белоксодержащей фракции 30-50 кДа была выше, чем Иммуновак-ВП-4 (содержит с своем составе антигены микробной клетки гетерологичного штамма K.pneumoniae 204, обладающего межвидовой перекрестной протективной активностью).
Методом твердофазного ИФА установлено, что при иммунизации мышей фракцией 21 кДа не происходит увеличение уровня антител или они обладают низкой аффинностью (табл.5). При иммунизации мышей фракцией 30-50 кДа выявлено повышение уровня антител, зависящее от величины иммунизирующей дозы. Перекрестной антигенной активности между исследуемыми фракциями выявлено не было, что свидетельствует о хорошей степени очистки исследуемых препаратов.
Гипериммунная сыворотка, полученная после 4-кратной вакцинации мышей белоксодержащей фракцией 30-50 кДа в дозе 50 мкл, введенная мышам через 2 часа, 1 сутки и 2 суток после заражения, защищала их от летальной клебсиеллезной инфекции, вызванной K.pneumoniae K2. Сыворотка, полученная при иммунизации мышей фракцией 21 кДа была неэффективной (табл.6).
Пример 2. Протективная активность секретируемых белоксодержащих фракций пневмококка.
Белоксодержащие фракции получали как в примере 1.
При иммунизации мышей фракцией 10-30 кДа выявлен слабый протективный эффект (ИЭ 1,99), практически не отличающийся от контроля (табл.7). Значительный эффект был получен при иммунизации мышей фракцией >30 кДа (ИЭ 8,9).
Далее было проведено фракционирование надосадочной жидкости, полученной после культивирования S. pneumoniae типа 3 на фракцию 30-50 кДа и больше 50 кДа (табл.8). Наибольшей протективной активностью характеризовалась фракция с молекулярной массой 30-50 кДа, ИЭ=50,1. Фракция с молекулярной массой более 50 кДа была менее иммуногенной, ИЭ=7,9.
Преимущество изобретения заключается в создании универсального способа получения протективных антигенов на основе секретируемых белоксодержащих фракций грамотрицательных и грамположительных бактерий, при инфицировании которыми токсинообразование не является ведущим патогенетическим механизмом в развитии заболевания.
| Таблица 1 | ||||||
| Протективная активность препаратов из штамма Klebsiella pneumoniae K2 при заражении штаммом K.pneumoniae K2 в дозе 178 LD50 | ||||||
| № группы | Препарат | Иммунизирующая доза, мкл | Заражающая доза, микр. клеток | Выжило | ED50, мкл | |
| Абс. | % ±m | |||||
| 1 | Белоксодержащая фракция К.pneumoniae K2 с молекулярной массой 21 кДа | 1 | 500 | 1/10 | 10,0±9,5 | >10,0 |
| 10 | 500 | 0/10 | 0 | |||
| 2 | Белоксодержащая фракция К.pneumoniae K2 с молекулярной массой 34-35 кДа | 1 | 500 | 4/10 | 40,0±15,5* | 2,5 |
| 10 | 500 | 7/10 | 70,0±14,5* | |||
| 3 | Гидроокись алюминия | 1 | 500 | 0/10 | 0 | >10,0 |
| 10 | 500 | 0/10 | 0 | |||
| 4 | Невакцинированные (контроль) | - | 500 | 0/10 | 0 | |
| Примечание: | ||||||
| 1) достоверность разности между процентом выживших животных в опытных группах и в контроле, * р<0,01 |
| Таблица 2 | |||||||
| Прямая и перекрестная протективная активность препаратов из штамма Klebsiella pneumoniae K2, К16 и 204 при заражении штаммом K.pneumoniae K2 в дозе 15,8 LD50 | |||||||
| Группа | Белоксодержащая фракция К.pneumoniae | Молекулярная масса, кДа | Иммунизирующая доза, мкл | Заражаюшая доза, микр. клеток | Выжило | ED50, мкл | |
| Абс. | %±m | ||||||
| 1 | K2 | 21 | 1 | 500 | 0/10 | 0 | >100 |
| 10 | 500 | 0/10 | 0 | ||||
| 100 | 500 | 3/10 | 30,0±14,5 | ||||
| 2 | K2 | 34-35 | 1 | 500 | 1/10 | 10,0±9,5 | 3,0 |
| 10 | 500 | 10/10 | 100,0±6,0** | ||||
| 100 | 500 | 9/10 | 90±9,5** | ||||
| 3 | К16 | 34-35 | 1 | 500 | 3/10 | 30,0±14,5 | 60,0 |
| 10 | 500 | 3/10 | 30,0±14,5 | ||||
| 100 | 500 | 1/10 | 10,0±9,5 | ||||
| 4 | 204 | 34-35 | 1 | 500 | 1/10 | 10,0±9,5 | 25,0 |
| 10 | 500 | 5/10 | 50,0±15,8* | ||||
| 100 | 500 | 5/10 | 50,0±15,8* | ||||
| 5 | Невакцинированные (контроль) | - | 500 | 1/10 | 10,0±9,5 | ||
| Примечание: 1) достоверность разности между процентом выживших животных в опытных группах и в контроле, * р<0,05, ** р<0,01 |
| Таблица 3 | |||||||
| Прямая и перекрестная протективная активность препаратов из штамма Klebsiella pneumoniae K2, К 16 и 204 при заражении штаммом K.pneumoniae К 16 в дозе 2,3 LD50 | |||||||
| Группа | Белоксодержащая фракция К.pneumoniae | Молекулярная масса, кДа | Иммунизирующая доза, мкл | Заражающая доза, ×106 микр. кл/мл | Выжило | ED50, мкл | |
| Абс. | %±m | ||||||
| 1 | K2 | 34-35 | 1 | 20,0 | 4/10 | 40,0±15,5 | 8,0 |
| 10 | 20,0 | 6/10 | 60,0±15,5* | ||||
| 100 | 20,0 | 6/10 | 60,0±15,5* | ||||
| 2 | К16 | 34-35 | 1 | 20,0 | 3/10 | 30,0±14,5 | 8,0 |
| 10 | 20,0 | 6/10 | 60,0±15,5* | ||||
| 100 | 20,0 | 7/10 | 70,0±145** | ||||
| 3 | 204 | 34-35 | 1 | 20,0 | 3/8 | 37,5±15,3 | 2,5 |
| 10 | 20,0 | 6/8 | 75,0±13,7** | ||||
| 100 | 20,0 | 8/8 | 100,0** | ||||
| 4 | Невакцинированные (контроль) | - | 20,0 | 1/10 | 10,0±9,5 | ||
| Примечание: 1) достоверность разности между процентом выживших животных опытных группах и в контроле, * р<0,05, ** р<0,01 |
| Таблица 4 | |||||||
| Протективная активность фракции секретируемого белка K.pneumoniae K2 с молекулярной массой 34-35 кДа не сорбированного на гидроокиси алюминия в дозе 2 LD50 | |||||||
| № | Препарат | Кратность введения препаратов | Иммунизирующая доза | Заражающая доза, микр. клеток | Выжило/ всего | %±m | Достоверность разности между опытом и контролем, p |
| 1 | Белоксодержащая фракция K.pneumoniae K2 с молекулярной массой 34-35 кДа, не сорбированная на гидроокиси алюминия | 2 | 40,0 мкл | 25,0 | 9/9 | 100,0* | <0,001 |
| 2 | Поликомпонентная вакцина Иммуновак-ВП-42) | 2 | 200 мкг | 25,0 | 6/10 | 60,0±15,5 | 0,05 |
| Невакцинированные (контроль) | - | - | 25,0 | 2/10 | 20±12,6 | ||
| Примечание. 1) Препараты вводили 2-кратно, чередуя внутрибрюшинное и подкожное введение с интервалом 14 суток. Заражение проводили штаммом K.pneumoniae K2 в дозе 25 микробных клеток на 12 сутки. | |||||||
| * Достоверность разности между группами вакцинированных мышей (группы 1 и 2), р<0,05 |
| Таблица 5 | |||
| Антигенная активность секретируемых белоксодержащих антигенов K.pneumoniae K2 с молекулярной массой 34-35 кДа в ИФА | |||
| Молекулярая масса белковой фракции для сорбции на планшетах и иммунизации мышей, кДа | Иммунизирующая доза исследуемой белковой фракцией, мкл/мышь | Уровень антител в сыворотке крови мышей, иммунизированных фракциями с молекулярной массой..., кДа | |
| ОП492 | Δ ОП | ||
| 34-35 | 1 | 0,320±0,022 | 0,066 |
| 10 | 0,368±0,029 | 0,114 | |
| 100 | 0,601±0,152*** | 0,347 | |
| Невакцинированные | 0,254±0,016 | ||
| Примечание. | |||
| * ОП492 - оптическая плотность при длине волны 492 нм; | |||
| **Δ ОП - разница ОП сыворотки между вакцинированными и невакцинированными мышами | |||
| * * * Достоверность разности уровня антител с сыворотках вакцинированных и невакцинированных мышей р<0,001 |
| Таблица 6 | |||||
| Терапевтическая активность противоклебсиеллезной сыворотки при экспериментальной инфекции, вызванной K.pneumoniae К2 | |||||
| № | Сыворотка мышей, иммунизированных белоксодержащией фракцией с молекулярной массой | Кратность введения сыворотки | Заражающая доза, микробные клетки | Выжило/всего | % ±m |
| 1 | 21 кДа | 2 | 500 | 0/10 | 0 |
| 2 | 34-35 кДа | 3 | 500 | 7/10 | 70,0±14,5* |
| 3 | Невакцинированные | - | 500 | 0/10 | 0 |
| * Достоверность разности р2 и 1,3 <0,05 |
| Таблица 7 | |||||
| Протективная активность препаратов из штамма пневмококка серотипа 3 при заражении S.pneumoniae типа 3 в дозе 10,1 LD50 | |||||
| № группы | Белоксодержащая фракция, S.pneumoniae типа 3 иммунизирующая доза 100 мкл | Заражающая доза, микр. клеток | Выжило/всего | LD50, микр. клеток | ИЭ |
| 1 | 10-30 кДа, 6 часов культивирования | 7×10 | 9/10 | 1380 | 1,99 |
| 7×102 | 7/10 | ||||
| 7×103 | 2/10 | ||||
| 2 | >30 кДа, 6 часов культивирования | 7×10 | 10/10 | 6165 | 8,9 |
| 7×102 | 10/10 | ||||
| 7×103 | 4/9 | ||||
| 3 | Невакцинированные (контроль) | 7×10 | 9/10 | 692 | - |
| 7×102 | 3/10 | ||||
| 7×103 | 3/10 | ||||
| Примечание: ИЭ - индекс эффективности - отношение LD50 в опыте к LD50 в контроле; |
| Таблица 8 | |||||
| Протективная активность препаратов из штамма пневмококка серотипа 3 при заражении S. pneumoniae типа 3 в дозе 12,6 LD50. | |||||
| № группы | Белоксодержащая фракция, S.pneumoniae типа 3, иммунизирующая доза 100 мкл | Заражающая доза, микр. клеток | Выжило /всего | LD50, микр. клеток | ИЭ |
| 1 | 30-50 кДа | 103 | 8/10 | 39810,7 | 50,1 |
| 104 | 6/10 | ||||
| 105 | 7/10 | ||||
| 2 | >50 кДа | 103 | 4/10 | 6309,6 | 7,9 |
| 104 | 5/10 | ||||
| 105 | 4/10 | ||||
| 3 | Невакцинированные (контроль) | 103 | 4/10 | 794,3 | - |
| 104 | 0/10 | ||||
| 105 | 0/10 | ||||
| Примечание: ИЭ - индекс эффективности - отношение LD50 в опыте к LD50 в контроле; |
1. Способ получения протективной белоксодержащей фракции бактерий, включающий культивирование бактерий на жидких питательных средах, отделение культуральной среды от бактерий, отличающийся тем, что культуральную среду, содержащую секретируемые белоксодержащие фракции, подвергают очистке и концентрируют методом ультрафильтрации с порогом отсечения белка 30 кДа и колоночной хроматографии с помощью гель-фильтрации на сефадексе G-75 и последующей очистке на ДЕАЕ-сефарозе в градиенте NaCl до получения фракций с молекулярной массой 30-50 кДа и содержанием белка 4-5 мг/мл.
2. Способ по п.1, отличающийся тем, что для получения протективных антигенов на основе секретируемых белоксодержащих фракций используют нетоксигенные штаммы грамотрицательных или грамположительных микроорганизмов.