Синтез эпотилонов, их промежуточных продуктов, аналогов и их применения
Иллюстрации
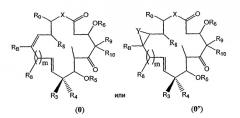
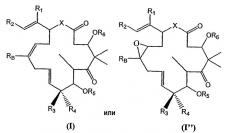
Показать всеДанное изобретение относится к соединениям формулы (I):
в которой R1 означает водород или низший алкил; R2 означает замещенный или незамещенный тиазолинильный или оксазолинильный остаток; R5 и R6 каждый независимо означает водород или защитную группу; Х означает О, S или NR7, где в каждом случае независимо R7 означает водород или низший алкил; RB независимо для каждого случая означает водород, C1-6алкил, -CY3, -CHY2 или -CH2Y, где Y означает F, Br, Cl или I. Данное изобретение также относится к фармацевтической композиции, содержащей соединения формулы (I) и обладающей цитотоксической активностью, и применению этого соединения для лечения злокачественной опухоли с множественной лекарственной резистентностью. 5 н. и 39 з.п. ф-лы, 77 ил., 6 табл.
Реферат
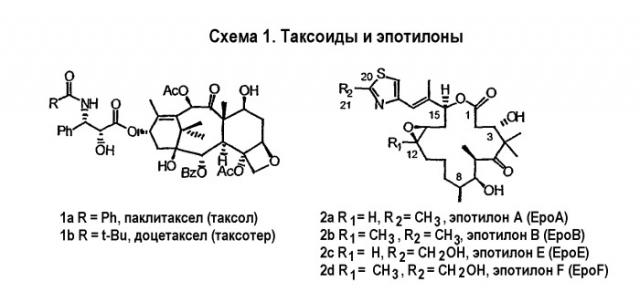
Эпотилоны A и B (2a и 2b, схема 1) являются встречающимися в природе цитотоксическими макролидами, которые были выделены из разрушающей целлюлозу микобактерии Sorangium cellulosum (Höfle et al. Angew. Chem., Int. Ed. Engl. 1996, 35, 1567 и J. Antibiot. 1996, 49, 560; каждая из публикаций включена в данное описание в виде ссылки). Несмотря на огромное количество различных структур эпотилоны A и B имеют общий механизм действия, такой же, как механизм действия паклитаксела (Taxol®), который вовлечен в ингибирование роста опухолевых клеток в результате полимеризации тубулина и стабилизации сборки из микротрубочек (Bollag et al. Cancer Res. 1995, 55, 2325; включено в виде ссылки). Несмотря на свое бесспорное клиническое значение в качестве химиотерапевтического средства переднего края, Taxol® далек от идеального лекарственного средства. Его незначительная растворимость в воде делает необходимым прибегать к помощи наполнителей для композиции, таких как кремофоры, которые сами по себе создают риск и проблемы при работе с ними (Essayan et al. J. Allergy Clin. Immunol. 1996, 97, 42; публикация включена в данное описание в виде ссылки). Кроме того, Taxol® уязвим по отношению к дезактивации вследствие множественной лекарственной резистентности (MDR) (Giannakakou et al. J. Biol. Chem. 1997, 272, 17118; публикация включена в данное описание в виде ссылки). Однако также показано, что эпотилоны A и B сохраняют заметную эффективность против опухолевых MDR-клеток (Kowalski et al. Mol. Biol. Cell 1995, 6, 2137; публикация включена в данное описание в виде ссылки). Кроме того, повышенная растворимость в воде по сравнению с паклитакселом может быть полезна для возможности готовить композиции эпотилонов. В то время как встречающееся в природе соединение, эпотилон B (2b, EpoB на схеме 1), является эффективным представителем эпотилонового семейства природных продуктов, к сожалению, он обладает, по меньшей мере у мышей с ксенотрансплантатами, вызывающим беспокойство ограниченным терапевтическим индексом (Su et al. Angew. Chem. Int. Ed. Engl. 1997, 36, 1093; Harris et al. J Org. Chem. 1999, 64, 8434; каждая публикация включена в данное описание в виде ссылки).
Имея ввиду ограниченный терапевтический индекс EpoB, исследовали другие аналоги эпотилона, в частности 12,13-дезоксиэпотилоны, в отношении их способности давать улучшенный терапевтический профиль (см. патенты США №№ 6242469, 6284781, 6300355, 6369234, 6204388, 6316630; каждый из которых включен в данное описание в виде ссылки). Эксперименты in vivo, проведенные на различных мышиных моделях, показали, что 12,13-дезоксиэпотилон B (3b, dEpoB на схеме 2) обладает терапевтическим потенциалом против различных чувствительных и резистентных опухолей человека в ксенотрансплантатах мышей (Chou et al. Proc. Natl. Acad. Sci. U. S. A. 1998, 95, 9642 and 15798; публикация включена в данное описание в виде ссылки). Недавно терапевтическое преимущество указанных дезоксиэпотилонов по сравнению с другими противоопухолевыми агентами окончательно показано посредством сравнительных исследований (Chou et al. Proc. Natl. Acad. Sci. U. S. A. 2001, 98, 8113; публикация включена в данное описание в виде ссылки). Вследствие впечатляющего профиля in vivo dEpoB был далее подвергнут токсикологическим исследованиям на собаках и в настоящее время проходит испытания на человеке в качестве противоопухолевого лекарственного средства.
В свете многообещающей терапевтической пользы 12,13-дезоксиэпотилонов может быть желательным исследовать дополнительные аналоги, а также дополнительные методики синтеза для синтеза существующих эпотилонов, дезоксиэпотилонов и их аналогов, а также их новых аналогов. В частности при наличии интереса к терапевтическому применению данного класса соединений может быть желательна разработка методик, способных обеспечивать значительные количества любых эпотилонов или дезоксиэпотилонов, описанных ранее или описанных в данной заявке, для клинических испытаний и для крупномасштабного получения.
Описание чертежей
Фиг.1 представляет собой таблицу значений IC50 для эпотилонов по отношению к росту клеток CCRF-CEM, CCRF-CEM/VBL и CCRF-CEM/таксол. Ингибирование роста клеток измеряли с помощью анализа на основе тетразония XTT после 72-часовой инкубации в течение роста клеток, как описано ранее (Scudiero et al. Cancer Res. 46: 4827-4833, 1988; публикация включена в данное описание в виде ссылки). Значения IC50 определяли на основе взаимосвязи доза-эффект при шести или семи концентрациях каждого лекарственного средства, используя компьютерную программу (Chou et al. Adv. Enzyme Regul. 22: 27-55, 1984; Chou et al. CalcuSyn for Windows (Biosoft, Cambridge, UK), 1997; каждая из которых включена в данное описание в виде ссылки), как описано ранее (Chou et al. Proc. Natl. Acad. Sci. USA 95: 15798-15802, 1998; публикация включена в данное описание в виде ссылки).
Фиг.2 является 1H-ЯМР-спектром транс-9,10-дегидро-12,13-дезоксиEpoB.
Фиг.3 является 13C-ЯМР-спектром транс-9,10-дегидро-12,13-дезоксиEpoB.
На фиг.4 показана схема синтеза 11-R- и 14-R-эпотилонов с использованием метатезиса олефинов с замыканием цикла LACDAC, и иллюстрируются некоторые замещения, доступные в случае способов синтеза, которые проходят через 9,10-дегидроэпотилон.
На фиг.5 представлены данные относительной цитотоксичности по отношению к лейкозным клеткам человека in vitro для ряда соединений и производных эпотилона, включая некоторые 9,10-дегидросоединения (например, соединение 7 на фиг.5A и соединение 88 и 89 на фиг.5B).
На фиг.6 изображена альтернативная методика синтеза для получения аналогов 9,10-дегидроэпотилона. На фиг.6A показана методика Макро-Стилле, методика сопряжения sp3-sp3 и методика β-Сузуки. На фиг.6B показана методика олефинирования Джулии, методика Вадсворт-Эммонса и методика Макро-Реформатского. На фиг.6C показана методика сочетания МакМурри и синтез аналога лактама.
На фиг.7 показаны различные аналоги 9,10-дегидро-12,13-дезоксиEpoB.
На фиг.8 показано терапевтическое действие 9,10-дегидро-dEpoB и dEpoB у мышей nude, несущих ксенотрансплантат карциномы молочной железы человека MX-1 (в/в-инфузия, Q2Dx3).
На фиг.9 показана стабильность аналогов эпотилона в плазме мышей. Epo 1 означает 12,13-дезоксиEpoB, Epo 2 означает 26-F3-12,13-дезоксиEpoB, Epo 3 означает (E)-9,10-дегидро-12,13-дезоксиEpoB и Epo 4 означает 26-F3-(E)-9,10-дегидро-12,13-дезоксиEpoB.
На фиг.10 изображено терапевтическое действие аналогов эпотилона у мышей nude (голых), несущих ксенотрансплантат HCT-116 (в/в-инфузия, Q2Dx7, n=3). Стрелки указывают введение лекарственного средства. Epo 3 означает (E)-9,10-дегидро-12,13-дезоксиEpoB.
На фиг.11 показаны эффективности различных аналогов эпотилона против роста опухолевых клеток in vitro и терапевтический индекс по сравнению с паклитакселом и винбластином.
Фиг.12 представляет собой таблицу, суммирующую действие dEpoB, таксола и 26-триF-9,10-deH-dEpoB против ксенотрансплантата MX-1 у мышей nude.
На фиг.13 показано терапевтическое действие 26-трифтор-9,10-дегидро-dEpoB и 9,10-дегидро-EpoB на размер опухолей у мышей nude, несущих ксенотрансплантаты MX-1 (6-часовая в/в-инфузия, Q2Dx6 и Q2Dx9, соответственно).
На фиг.14 показаны изменения массы тела мышей nude, несущих ксенотрансплантат опухоли карциномы молочной железы человека MX-1, после лечения 26-трифтор-9,10-дегидро-dEpoB и 9,10-дегидро-EpoB (6-часовая инфузия, Q2Dx6 и Q2Dx9, соответственно).
На фиг.15 показано терапевтическое действие 26-трифтор-9,10-дегидро-dEpoB и 9,10-дегидроEpoB на размер опухолей у мышей nude, несущих ксенотрансплантаты MX-1 (6-часовая в/в-инфузия, Q2Dx6 и Q2Dx9, соответственно).
На фиг.16 показаны изменения массы тела у мышей nude, несущих ксенотрансплантат опухоли карциномы молочной железы человека MX-1, после лечения 26-трифтор-9,10-дегидро-dEpoB и 9,10-дегидро-EpoB (6-часовая в/в-инфузия, Q2Dx6 и Q2Dx9, соответственно).
На фиг.17 показано терапевтическое действие 9,10-дегидро-dEpoB на размер опухолей у мышей nude, несущих ксенотрансплантаты HCT-116 (в/в-инфузия, Q2Dx7).
На фиг.18 показано действие 9,10-дегидро-dEpoB на размер опухолей у мышей nude, несущих ксенотрансплантаты карциномы ободочной кишки человека HCT-116 (в/в-инфузия, Q3Dx5).
На фиг.19 показано действие 9,10-дегидро-dEpoB на размер опухолей у мышей nude, несущих ксенотрансплантаты A549/Taxol (6-часовая в/в-инфузия, Q3Dx7).
На фиг.20 показаны изменения массы тела у мышей nude, несущих ксенотрансплантат A549/Taxol, обработанных 26-трифтор-9,10-дегидро-dEpoB и 9,10-дегидро-dEpoB (6-часовая в/в-инфузия, Q3Dx7).
На фиг.21 показано действие 26-трифтор-9,10-дегидро-dEpoB и 9,10-дегидро-dEpoB на размер опухолей у мышей nude, несущих ксенотрансплантаты A549/Taxol (6-часовая в/в-инфузия, Q2Dx7).
На фиг.22 показаны изменения массы тела мышей nude, несущих ксенотрансплантаты A549/Taxol, обработанных 26-трифтор-9,10-дегидро-dEpoB и 9,10-дегидро-dEpoB (6-часовая в/в-инфузия, Q2Dx7).
На фиг.23 показано действие 9,10-дегидро-EpoB на размер опухолей у мышей nude, несущих ксенотрансплантаты опухоли HCT-116 карциномы ободочной кишки человека (6-часовая в/в-инфузия).
На фиг.24 показаны изменения массы тела у мышей nude, несущих ксенотрансплантат опухоли HCT-116 карциномы ободочной кишки человека, после лечения 9,10-дегидро-EpoB (6-часовая в/в-инфузия).
На фиг.25 показано образование микротрубочек из тубулина в присутствии различных аналогов эпотилона при 37°C.
На фиг.26 показано образование микротрубочек из тубулина в присутствии различных аналогов эпотилона при 4°C.
На фиг.27 показано действие 9,10-дегидро-dEpoB и dEpoB на размер опухолей у мышей nude, несущих ксенотрансплантаты HCT-116 (в/в-инфузия, Q2Dx6).
На фиг.28 показаны изменения массы тела у мышей nude, несущих ксенотрансплантаты HCT-116, после лечения 9,10-дегидро-dEpoB и dEpoB (в/в-инфузия, Q2Dx6).
На фиг.29 показано действие 9,10-дегидро-dEpoB на размер опухолей у мышей nude, несущих ксенотрансплантаты HCT-116 карциномы ободочной кишки человека (в/в-инфузия, Q3Dx4).
На фиг.30 показаны изменения массы тела мышей nude, несущих ксенотрансплантаты HCT-116 опухоли карциномы ободочной кишки человека, после лечения 9,10-дегидро-dEpoB (5 мг/кг, в/в-инфузия, X3Dx4).
Фиг.31 представляет собой таблицу со значениями IC50 для аналогов эпотилона по отношению к росту клеток CCRF-CEM.
На фиг.32 показана метаболическая стабильность аналогов эпотилона in vitro.
Фиг.33 представляет собой таблицу, детализирующую терапевтические эффекты различных аналогов эпотилона против ксенотрансплантатов опухолей человека у мышей в случае 6-часовой в/в-инфузии.
На фиг.34 показано действие 9,10-дегидро-EpoB на размер опухолей у мышей nude, несущих ксенотрансплантат опухоли HCT-116 карциномы ободочной кишки человека (6-часовая в/в-инфузия, Q2Dx7).
На фиг.35 показаны изменения массы тела мышей nude, несущих ксенотрансплантаты опухоли HCT-116 карциномы ободочной кишки человека, после лечения 9,10-дегидро-EpoB и оксазол-EpoD (6-часовая инфузия, Q2Dx7).
На фиг.36 показано действие 26-трифтор-9,10-дегидро-dEpoB и 9,10-дегидро-dEpoB на размер опухолей у мышей nude, несущих ксенотрансплантаты A549/Taxol (6-часовая в/в-инфузия, Q2Dx4).
На фиг.37 показано действие 9,10-дегидро-dEpoB на размер опухолей у мышей nude, несущих ксенотрансплантаты A549/Taxol (6-часовая в/в-инфузия, Q3Dx3).
На фиг.38 показана стабильность аналогов эпотилона в 20% плазме мышей/PBS.
На фиг.39 показана стабильность аналогов эпотилона в 10% фракции S9 печени человека/PBS.
На фиг.40 показана хроматограмма стабильности EpoD в 10% печени человека S9/PBS.
На фиг.41 представлены таблицы, описывающие действие различных аналогов эпотилона на полимеризацию микротрубочек in vitro при 37°C в отсутствие GTP (A) и цитотоксичность различных аналогов эпотилона в линии клеток легкого человека A549 (B).
На фиг.42 показана стабилизация образования микротрубочек эпотилонами при 35°C и 4°C.
На фиг.43 показано терапевтическое действие 9,10-дегидро-dEpoB у мышей nude, несущих ксенотрансплантат карциномы молочной железы человека T (MX-1) (6-часовая инфузия, Q2Dx5).
На фиг.44 показано изменение массы тела мышей nude, несущих ксенотрансплантат карциномы молочной железы человека (MX-1), после лечения 9,10-дегидро-dEpoB (6-часовая инфузия, Q2Dx8).
На фиг.45 показано изменение массы тела мышей nude, несущих ксенотрансплантат HCT-116, после лечения 9,10-дегидро-dEpoB (в/в-инфузия, Q2Dx7).
На фиг.46 показано терапевтическое действие 9,10-дегидро-dEpoF, dEpoB и таксола на размер опухолей у мышей nude, несущих ксенотрансплантат опухоли карциномы молочной железы человека (MX-1) (6-часовая в/в-инфузия, Q2Dx6).
На фиг.47 показаны изменения массы тела мышей nude, несущих ксенотрансплантат опухоли карциномы молочной железы человека (MX-1), после лечения 9,10-дегидро-dEpoF, dEpoB и таксолом (6-часовая инфузия, Q2Dx6).
На фиг.48 показано терапевтическое действие 9,10-дегидро-dEpoF и dEpoB у мышей nude, несущих ксенотрансплантат HCT-116 карциномы ободочной кишки человека (6-часовая инфузия, Q2Dx8).
На фиг.49 показаны изменения массы тела мышей nude, несущих ксенотрансплантат HCT-116, после лечения 9,10-дегидро-dEpoF и dEpoB (6-часовая инфузия, Q2Dx8).
На фиг.50 показано терапевтическое действие 9,10-дегидро-dEpoF и dEpoB у мышей nude, несущих ксенотрансплантат резистентной к таксолу карциномы легкого человека (A549/Taxol) (6-часовая инфузия, Q2Dx5).
На фиг.51 показаны изменения массы тела мышей nude, несущих ксенотрансплантат резистентной к таксолу карциномы легкого человека (A549/Taxol), после лечения 9,10-дегидро-dEpoF и dEpoB (6-часовая инфузия, Q2Dx5).
Фиг.52 представляет собой таблицу сравнения эффективности различных аналогов эпотилона по отношению к ингибированию опухолевого роста in vitro и относительному терапевтическому индексу.
На фиг.53 показано терапевтическое действие 9,10-дегидро-dEpoB у мышей nude, несущих ксенотрансплантат MX-1 (Q3Dx9, 6-часовая в/в-инфузия).
На фиг.54 показаны изменения массы тела мышей nude, несущих ксенотрансплантат MX-1, после лечения 9,10-дегидро-dEpoB (Q3Dx9, 6-часовая в/в-инфузия).
На фиг.55 показано терапевтическое действие 9,10-дегидроэпотилона B у мышей nude, несущих ксенотрансплантат MX-1 (Q3Dx9, 6-часовая инфузия).
На фиг.56 показаны изменения массы тела мышей nude, несущих ксенотрансплантат MX-1, после лечения 9,10-дегидроэпотилоном B (Q3Dx9, 6-часовая в/в-инфузия).
На фиг.57 показано терапевтическое действие низких доз 26-трифтор-9,10-дегидро-dEpoB у мышей nude, несущих ксенотрансплантат MX-1 (6-часовая в/в-инфузия, Q2Dx12).
На фиг.58 показаны изменения массы тела мышей nude, несущих ксенотрансплантат MX-1, после лечения низкими дозами 26-трифтор-9,10-дегидро-dEpoB (6-часовая в/в-инфузия, Q2Dx12).
На фиг.59 показано химиотерапевтическое действие аналогов эпотилона против ксенотрансплантатов опухолей человека у мышей nude. Ткань опухоли (40-50 мг) имплантировали п/к в день 0. Лечение начинали, когда размер опухоли достигал примерно 100 мм3 или больше, как указано. Все обработки, которые указаны стрелками, проводили с помощью 6-часовой в/в-инфузии через хвостовую вену, используя миникатетер и программируемый насос, как описано ранее (Su, D.-S. et al, Angew. Chem. Int. Ed. 1997, 36, 2093; Chou, T. C. et al. Proc. Natl. Acad. Sci. USA. 1998, 95, 15798; каждая публикация включена в данное описание в виде ссылки). Каждая группа дозирования состояла из четырех или более мышей. Массой тела называли суммарную массу тела минус массу опухоли, полагая, что 1 мм3 опухоли равен 1 мг опухолевой ткани. A. Ксенотрансплантат карциномы молочной железы MX-1, обработанный низкими дозами 25-трифтор-(E)-9,10-дегидро-12,13-дезоксиEpoB (10 мг/кг) при сравнении с обработками в таблице 1 (20 мг/кг и 30 мг/кг). B. Крупные ксенотрансплантаты MX-1 (500 мм3) обрабатывали 25-трифтор-(E)-9,10-дегидро-12,13-дезоксиEpoB (25 мг/кг) и dEpoB (30 мг/кг). C. Медленно растущий ксенотрансплантат карциномы легкого A549, обработанный 25-трифтор-(E)-9,10-дегидро-12,13-дезоксиEpoB (25 мг/кг) и dEpoB (30 мг/кг). D. Ксенотрансплантат A549/Taxol (44-кратная резистентность к паклитакселу in vitro), обработанный 25-трифтор-(E)-9,10-дегидро-12,13-дезоксиEpoB (20 мг/кг) и (E)-9,10-дегидро-12,13-дезоксиEpoB (4 мг/кг). Обработка deH-dEpoB на 28 день была пропущена вследствие заметного и быстрого снижения массы тела.
На фиг.60 изображен синтез C-21-модифицированных 9,10-(E)-дегидроэпотилонов. На фиг.60A показан синтез 26-трифтор-21-метиламино-9,10-(E)-дегидро-12,13-дезоксиэпотилона B. Фиг.60B является схемой синтеза для получения 26-трифтор-21-амино-9,10-(E)-дегидро-12,13-дезоксиэпотилона B в качестве промежуточного продукта синтеза 26-трифтор-21-диметиламино-9,10-(E)-дегидро-12,13-дезоксиэпотилона B.
Фиг.61 представляет собой таблицу со значениями IC50 для C-21-модифицированных эпотилонов по отношению к линии опухолевых клеток CCRF-CEM и ее подлиний, резистентных к лекарственным средствам.
На фиг.62 показано терапевтическое действие 26-трифтор-9,10-дегидро-dEpoB и таксола у мышей nude, несущих ксенотрансплантат T-клеточного лимфобластного лейкоза человека CCRF-CEM (6-часовая в/в-инфузия, Q2Dx8).
На фиг.63 показаны изменения массы тела у мышей nude, несущих ксенотрансплантат T-клеточного лимфобластного лейкоза человека CCRF-CEM, после лечения 25-трифтор-9,10-дегидро-dEpoB и таксолом (6-часовая в/в-инфузия, Q2Dx8).
На фиг.64 показано терапевтическое действие 26-трифтор-9, 10-дегидро-dEpoB и таксола у мышей nude, несущих ксенотрансплантат T-клеточного лимфобластного лейкоза человека CCRF-CEM/Taxol (резистентный к таксолу) (6-часовая в/в-инфузия, Q2Dx7, x5).
На фиг.65 показаны изменения массы тела у мышей nude, несущих ксенотрансплантат T-клеточного лимфобластного лейкоза человека CCRF-CEM/Taxol (резистентный к таксолу), после лечения 26-трифтор-9,10-дегидро-dEpoB и таксолом (6-часовая в/в-инфузия, Q2Dx7, x5).
На фиг.66 показано терапевтическое действие 26-трифтор-9,10-дегидро-dEpoB и таксола у мышей nude, несущих ксенотрансплантат карциномы ободочной кишки человека HCT-116 (Q2Dx4, x2, 6-часовая в/в-инфузия).
На фиг.67 показаны изменения массы тела у мышей nude, несущих ксенотрансплантат карциномы ободочной кишки человека HCT-116, после лечения 26-трифтор-9,10-дегидро-dEpoB и таксолом (Q2Dx4, x2, 6-часовая в/в-инфузия).
На фиг.68 показано терапевтическое действие 9,10-дегидро-EpoB у мышей nude, несущих ксенотрансплантат MX-1 (6-часовая в/в-инфузия).
На фиг.69 показаны изменения массы тела у мышей nude, несущих ксенотрансплантат карциномы молочной железы человека MX-1, после лечения 9,10-дегидро-EpoB (6-часовая инфузия в/в-инфузия).
На фиг.70 показано терапевтическое действие 9,10-дегидро-EpoB у мышей nude, несущих ксенотрансплантат T-клеточного лимфобластного лейкоза человека CCRF-CEM/Taxol (резистентный к таксолу) (6-часовая в/в-инфузия, Q3Dx5, x2).
На фиг.71 показаны изменения массы тела у мышей nude, несущих ксенотрансплантат T-клеточного лимфобластного лейкоза человека CCRF-CEM/Taxol (резистентный к таксолу), после лечения 9,10-дегидро-EpoB (6-часовая в/в-инфузия, Q3Dx5, x2).
На фиг.72 показано терапевтическое действие 26-трифтор-dEpoB и 26-трифтор-9,10-дегидро-dEpoF у мышей nude, несущих ксенотрансплантат карциномы молочной железы человека MX-1 (Q2Dx11, в/в-инъекция).
На фиг.73 показаны изменения массы тела у мышей nude, несущих ксенотрансплантат карциномы молочной железы человека MX-1, после лечения 26-трифтор-dEpoB и 26-трифтор-9,10-дегидро-dEpoF (Q2Dx11, в/в-инъекция).
На фиг.74 показано терапевтическое действие 9,10-дегидро-dEpoB у мышей nude, несущих ксенотрансплантат карциномы молочной железы человека MX-1 (Q3Dx9, 6-часовая в/в-инфузия).
На фиг.75 показаны изменения массы тела у мышей nude, несущих ксенотрансплантат карциномы молочной железы человека MX-1, после лечения 9,10-дегидро-dEpoB (Q3Dx9, 6-часовая в/в-инфузия).
На фиг.76 показано терапевтическое действие 26-трифтор-9,10-дегидро-dEpoF у мышей nude, несущих ксенотрансплантат карциномы легкого человека (MX-1) (6-часовая в/в-инфузия и в/в-инъекция).
На фиг.77 показаны изменения массы тела у мышей nude, несущих ксенотрансплантат MX-1, после лечения 26-трифтор-9,10-дегидро-dEpoF (6-часовая в/в-инфузия и в/в-инъекция).
Определения
Некоторые предлагаемые в данном изобретении соединения и определения конкретных функциональных групп также описаны более подробно ниже. В данном изобретении химические элементы идентифицированы в соответствии с Периодической таблицей элементов, CAS-версия, Handbook of Chemistry and Physics, 75th Ed., внутренняя сторона обложки, и конкретные функциональные группы, как правило, определяют как описано в данной заявке. Кроме того, общие принципы органической химии, а также конкретные функциональные остатки и химическая активность описаны в «Organic Chemistry», Thomas Sorrel, University Science Books, Sausalito: 1999, полное содержание которой включено в данное описание в виде ссылки. Кроме того, специалисту в данной области будет понятно, что в способах синтеза, которые приведены в данном описании, используется ряд защитных групп. Под термином «защитная группа», используемым в данном описании, подразумевается, что конкретный функциональный остаток, например O, S или N, временно блокируют, так чтобы реакция осуществлялась избирательно в другом химически активном сайте в многофункциональном соединении. В предпочтительных вариантах защитная группа избирательно взаимодействует, с хорошим выходом давая защищенный субстрат, который стабилен по отношению к намеченным реакциям; защитная группа должна избирательно удаляться с хорошим выходом легко доступными, предпочтительно нетоксичными реагентами, которые не воздействуют на другие функциональные группы; защитная группа образует легко отделяемое производное (более предпочтительно без образования новых стереогенных центров); и защитная группа имеет минимум дополнительной функциональности, чтобы избежать дополнительных реакционных сайтов. Как подробно изложено в данном описании, можно использовать защитные группы кислорода, серы, азота и углерода. Примеры защитных групп подробно указаны в данном описании, однако будет понятно, что это не означает, что данное изобретение ограничивается указанными защитными группами; точнее множество дополнительных эквивалентных защитных групп можно легко идентифицировать, используя указанные выше критерии, и использовать в способе, предлагаемом в данном изобретении. Кроме того, ряд защитных групп описаны в «Protective Groups in Organic Synthesis» Third Ed. Greene, T. W. and Wuts, P.G., Eds., John Wiley and Sons, New York: 1999, полное содержание которой тем самым включено в виде ссылки.
Будет понятно, что соединения, которые указаны в описании, могут быть замещены любым количеством заместителей или функциональных остатков. В общем, термин «замещенный», которому предшествует или не предшествует термин «необязательно», и заместители, входящие в формулы согласно данному изобретению, относятся к замене водородных радикалов в данной структуре радикалом определенного заместителя. В том случае, когда в какой-либо данной структуре могут быть замещены более одного положения более чем одним заместителем, выбранным из определенной группы, заместители во всех положениях могут быть либо одинаковыми, либо разными. В используемом в данном описании смысле предполагается, что термин «замещенный» включает в себя все допустимые заместители органических соединений. В широком аспекте допустимые заместители включают ациклические и циклические, разветвленные и неразветвленные, карбоциклические и гетероциклические, ароматические и неароматические заместители органических соединений. В настоящем изобретении гетероатомы, такие как азот, могут иметь водородные заместители и/или любые допустимые заместители органических соединений, описанных в данной публикации, которые удовлетворяют валентностям гетероатомов. Кроме того, подразумевается, что данное изобретение никоим образом не ограничено допустимыми заместителями органических соединений. Комбинациями заместителей и переменных, предполагаемых в данном изобретении, предпочтительно являются комбинации, которые приводят к образованию стабильных соединений, применимых для лечения, например, пролиферативных расстройств, включая, но не ограничивая указанным, злокачественную опухоль. Термин «стабильное», используемый в данном описании, предпочтительно относится к соединениям, которые обладают стабильностью, достаточной для того, чтобы обеспечить возможность производства, и которые сохраняют целостность соединения в течение периода времени, достаточного для его регистрации, и предпочтительно в течение периода времени, достаточного для его использования в целях, подробно указанных в данном описании.
Термин «алифатический» в используемом в данном описании смысле включает в себя как насыщенные, так и ненасыщенные, с прямой цепью (т.е. неразветвленные), разветвленные, циклические или полициклические алифатические углеводороды, которые необязательно замещены одной или несколькими функциональными группами. Как будет понятно специалисту в данной области, в данном описании подразумевается, что термин «алифатический» включает, но не ограничен указанным, алкильный, алкенильный, алкинильный, циклоалкильный, циклоалкенильный и циклоалкинильный остатки. Таким образом, используемый в данном описании термин «алкил» включает неразветвленные, разветвленные и циклические алкильные группы. Аналогичное условие применимо к другим общим терминам, таким как «алкенил», «алкинил» и тому подобным. Кроме того, используемые в данном описании термины «алкил», «алкенил», «алкинил» и тому подобные охватывают как замещенные, так и незамещенные группы. В некоторых вариантах используемый в данном описании термин «низший алкил» используют для указания алкильных групп (циклических, ациклических, замещенных, незамещенных, разветвленных или неразветвленных), имеющих 1-6 атомов углерода.
В некоторых вариантах алкильные, алкенильные и алкинильные группы, используемые в изобретении, содержат 1-20 алифатических атомов углерода. В некоторых других вариантах алкильные, алкенильные и алкинильные группы, используемые в изобретении, содержат 1-10 алифатических атомов углерода. В других вариантах алкильные, алкенильные и алкинильные группы, используемые в изобретении, содержат 1-8 алифатических атомов углерода. В следующих вариантах алкильные, алкенильные и алкинильные группы, используемые в изобретении, содержат 1-6 алифатических атомов углерода. Кроме того, в других вариантах алкильные, алкенильные и алкинильные группы, используемые в изобретении, содержат 1-4 атома углерода. Таким образом, иллюстративные алифатические группы включают, но не ограничены указанным, например, остатки метила, этила, н-пропила, изопропила, циклопропила, -CH2-циклопропила, аллила, н-бутила, втор-бутила, изобутила, трет-бутила, циклобутила, -CH2-циклобутила, н-пентила, втор-пентила, изопентила, трет-пентила, циклопентила, -CH2-циклопентила, н-гексила, втор-гексила, циклогексила, -CH2-циклогексила и тому подобные, которые к тому же могут нести один или несколько заместителей. Алкенильные группы включают, но не ограничены указанным, например, этенил, пропенил, бутенил, 1-метил-2-бутен-1-ил и тому подобное. Типичные алкинильные группы включают, но не ограничены указанным, этинил, 2-пропинил (пропаргил), 1-пропинил и тому подобные.
Термин «алкоксигруппа» или «тиоалкил», используемый в данном описании, относится к алкильной группе, которая определена ранее, связанной с остатком родительской молекулы через атом кислорода или через атом серы. В некоторых вариантах алкильная группа содержит 1-20 алифатических атомов углерода. В некоторых других вариантах алкильная группа содержит 1-10 алифатических атомов углерода. В других вариантах алкильные, алкенильные и алкинильные группы, используемые в изобретении, содержат 1-8 алифатических атомов углерода. В следующих вариантах алкильная группа содержит 1-6 алифатических атомов углерода. В других вариантах алкильная группа содержит 1-4 алифатических атома углерода. Примеры алкоксигрупп включают, но не ограничены указанным, метокси-, этокси-, пропокси-, изопропокси-, н-бутокси-, трет-бутокси, неопентокси- и н-гексоксигруппу. Примеры тиоалкила включают, но не ограничены указанным, метилтио-, этилтио-, пропилтио-, изопропилтио-, н-бутилтиогруппу и тому подобные.
Термин «алкиламиногруппа» относится к группе, имеющей структуру -NHR', где R' означает алкил, который определен в данном описании. В некоторых вариантах алкильная группа содержит 1-20 алифатических атомов углерода. В некоторых других вариантах алкильная группа содержит 1-10 алифатических атомов углерода. В других вариантах алкильные, алкенильные и алкинильные группы, используемые в изобретении, содержат 1-8 алифатических атомов углерода. В следующих вариантах алкильная группа содержит 1-6 алифатических атомов углерода. В других вариантах алкильная группа содержит 1-4 алифатических атомов углерода. Примеры алкиламиногрупп включают, но не ограничены, метиламино-, этиламино-, изо-пропиламиногруппой и тому подобными.
Некоторые примеры заместителей описанных выше алифатических (и других) остатков соединений, предлагаемых в изобретении, включают, но не ограничены указанным, алифатическую группу; гетероалифатическую группу; арил; гетероарил; арилалкил; гетероарилалкил; алкоксигруппу; арилоксигруппу; гетероалкоксигруппу; гетероарилоксигруппу; алкилтиогруппу; арилтиогруппу; гетероалкилтиогруппу; гетероарилтиогруппу; F; Cl; Br; I; -OH; -NO2; -CN; -CF3; -CH2CF3; -CHCl2; -CH2OH; -CH2CH2OH; -CH2NH2; -CH2SO2CH3; -C(O)RX; -CO2(RX); -CON(RX)2; -OC(O)RX; -OCO2RX; -OCON(RX)2; -N(RX)2; -S(O)2RX; -NRX(CO)RX, где в каждом случае RX независимо включает, но не ограничен указанным, алифатическую группу, гетероалифатическую группу, арил, гетероарил, арилалкил или гетероарилалкил, где любой из алифатических, гетероалифатических, арилалкильных или гетероарилалкильных заместителей, описанных выше и в данном случае, может быть замещенным или незамещенным, разветвленным или неразветвленным, циклическим или ациклическим, и где любой из арильных или гетероарильных заместителей, описанных выше и в данном случае, может быть замещенным или незамещенным. Дополнительные примеры обычно применимых заместителей иллюстрированы конкретными вариантами, показанными в примерах, которые приведены в данном описании.
Термины «арил» и «гетероарил», используемые в данном описании, относятся к стабильным моно- или полициклическим, гетероциклическим, полициклическим и полигетероциклическим ненасыщенным остаткам, имеющим предпочтительно 3-14 атомов углерода, каждый из которых может быть замещенным или незамещенным. Заместители включают без ограничения любой из ранее упомянутых заместителей, т.е. заместителей, перечисленных для алифатических остатков или для других остатков, которые описаны в данной публикации, которые приводят к образованию стабильного соединения. В некоторых вариантах осуществления данного изобретения «арил» относится к моно- или бициклической карбоциклической кольцевой системе, имеющей одно или два ароматических кольца, включая, но не ограничиваясь указанным, фенил, нафтил, тетрагидронафтил, индалил, инденил и тому подобное. В некоторых вариантах осуществления данного изобретения термин «гетероарил», используемый в данном описании, относится к циклическому ароматическому радикалу, имеющему от пяти до десяти атомов в цикле, из которых один атом в цикле выбран из S, O и N; ноль, один или два атома в цикле являются дополнительными гетероатомами, независимо выбранными из S, O и N; и остальные атомы в цикле являются атомами углерода, при этом радикал связан с остальной частью молекулы посредством любого атома в цикле, например, такой как пиридил, пиразинил, пиримидинил, пирролил, пиразолил, имидазолил, тиазолил, оксазолил, изооксазолил, тиадиазолил, оксадиазолил, тиофенил, фуранил, хинолинил, изохинолинил и тому подобное.
Будет понятно, что арильные и гетероарильные группы (включая бициклические арильные группы) могут быть незамещенными или замещенными, при этом замещение включает замену в них одного, двух или трех атомов водорода независимо любым одним или несколькими из следующих остатков, включая без ограничения: алифатическую группу; гетероалифатическую группу; арил; гетероарил; арилалкил; гетероарилалкил; алкоксигруппу; арилоксигруппу; гетероалкоксигруппу; гетероарилоксигруппу; алкилтиогруппу; арилтиогруппу; гетероалкилтиогруппу; гетероарилтиогруппу; F; Cl; Br; I; -OH; -NO2; -CN; -CF3; -CH2CF3; -CHCl2; -CH2OH; -CH2CH2OH; -CH2NH2; -CH2SO2CH3; -C(O)RX; -CO2(RX); -CON(RX)2; -OC(O)RX; -OCO2RX; -OCON(RX)2; -N(RX)2; -S(O)2RX; -NRX(CO)RX, где в каждом случае RX независимо включает, но не ограничен указанным, алифатическую группу, гетероалифатическую группу, арил, гетероарил, арилалкил или гетероарилалкил, где любой из алифатических, гетероалифатических, арилалкильных или гетероарилалкильных заместителей, описанных выше и в данном случае, может быть замещенным или незамещенным, разветвленным или неразветвленным, циклическим или ациклическим, и где любой из арильных или гетероарильных заместителей, описанных выше и в данном случае, может быть замещенным или незамещенным. Дополнительные примеры обычно применимых заместителей иллюстрированы конкретными вариантами, показанными в примерах, которые приведены в данном описании.
Термин «циклоалкил», используемый в данном описании, в частности, относится к группам, имеющим от трех до семи, предпочтительно от трех до десяти атомов углерода. Подходящие циклоалкилы включают, но не ограничены указанным, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и тому подобное, которые, как и в случае других алифатических, гетероалифатических или гетероциклических остатков могут быть необязательно замещены заместителями, включая без ограничения алифатическую группу; гетероалифатическую группу; арил; гетероарил; арилалкил; гетероарилалкил; алкоксигруппу; арилоксигруппу; гетероалкоксигруппу; гетероарилоксигруппу; алкилтиогруппу; арилтиогруппу; гетероалкилтиогруппу; гетероарилтиогруппу; F; Cl; Br; I; -OH; -NO2; -CN; -CF3; -CH2CF3; -CHCl2; -CH2OH; -CH2CH2OH; -CH2NH2; -CH2SO2CH3; -C(O)RX; -CO2(RX); -CON(RX)2; -OC(O)RX; -OCO2RX; -OCON(RX)2; -N(RX)2; -S(O)2RX; -NRX(CO)RX, где в каждом случае RX независимо включает, но не ограничен указанным, алифатическую группу, гетероалифатическую группу, арил, гетероарил, арилалкил или гетероарилалкил, где любой из алифатических, гетероалифатических, арилалкильных или гетероарилалкильных заместителей, описанных выше и в данном случае, может быть замещенным или незамещенным, разветвленным или неразветвленным, циклическим или ациклическим, и где любой из арильных или гетероарильных заместителей, описанных выше и в данном случае, может быть замещенным или незамещенным. Дополнительные примеры обычно применимых заместителей иллюстрированы конкретными вариантами, показанными в примерах, которые приведены в данном описании.
Термин «гетероалифатический», используемый в данном описании, относится к алифатическим остаткам, которые содержат один или несколько атомов кислорода, серы, азота, фосфора или кремния, например, вместо атомов углерода. Гетероалифатические остатки могут быть разветвленными, неразветвленными, циклическими или ациклическими и включают насыщенные и ненасыщенные гетероциклы, такие как морфолиногруппу, пирролидинил и т.д. В некоторых вариантах гетероалифатические остатки замещены независимой заменой в них одного или нескольких атомов водорода одним или несколькими остатками, включая без ограничения алифатическую группу; гетероалифатическую группу; арил; гетероарил; арилалкил; гетероарилалкил; алкоксигруппу; арилоксигруппу; гетероалкоксигруппу; гетероарилоксигруппу; алкилтиогруппу; арилтиогруппу; гетероалкилтиогруппу; гетероарилтиогруппу; F; Cl; Br; I; -OH; -NO2; -CN; -CF3; -CH2CF3; -CHCl2; -CH2OH; -CH2CH2OH; -CH2NH2; -CH2SO2CH3; -C(O)RX; -CO2(RX); -CON(RX)2; -OC(O)RX; -OCO2RX; -OCON(RX)2; -N(RX)2; -S(O)2RX; -NRX(CO)RX, где в каждом случае RX независимо включает, но не ограничен указанным, алифатическую группу, гетероалифатическую группу, арил, гетероарил, арилалкил или гетероарилалкил, где любой из алифатических, гетероалифатических, арилалкильных или гетероарилалкильных заместителей, описанных выше и в данном случае, может быть замещенным или незамещенным, разветвленным или неразветвленным, циклическим или ациклическим, и где любой из арильных или гетероарильных заместителей, описанных выше и в данном случае, может быть замещенным или незамещенным. Дополнительные примеры обычно применимых заместителей иллюстрированы конкретными вариантами, показанными в примерах, которые приведены в данном описании.
Термин «галоген», используемый в данном описании, относится к атому, выбранному из фтора, хлора, брома и йода.
Термин «галогеналкил» означае