Белки, вызывающие измененную иммуногенную реакцию, и способы их получения и использования
Иллюстрации
Показать всеИзобретение относится к биотехнологии и касается варианта белка субтилизина Bacillus amyloliguefaciens с заменой Y217L, содержащий Т-клеточный эпитоп, при этом указанный Т-клеточный эпитоп указанного варианта включает одну или несколько аминокислотных замен, выбранных из группы, состоящей из остатков, соответствующих положениям 76, 79 и 122, где указанный вариант субтилизина необязательно имеет замену в одном или нескольких из положений 3, 31, 40, 41, 46, 47, 48, 50, 76, 101, 104, 107, 111, 128, 147, 154, 181, 182, 183, 185, 206, 215, 216, 218, 238, 247, 248, 250, 254, 258, 262. Изобретение относится также к молекулам ДНК, которые кодируют варианты субтилизина, клеткам-хозяевам, содержащим данную ДНК, а также к композициям для ухода за кожей, содержащим указанный вариант субтилизина. Изобретение позволяет получить варианты субтилизина, которые проявляют уменьшенную иммуногенную реакцию у человека по сравнению с исходным субтилизином. 8 н. и 23 з.п. ф-лы, 16 ил., 3 табл.
Реферат
Предпосылки изобретения
Белки, используемые в промышленных, фармацевтических и коммерческих применениях, приобретают все большее распространение. Индивидуумы, подвергаемые действию белков, могут становиться сенсибилизированными ими, после чего последующее их воздействие может вызывать аллергические реакции. Например, некоторые протеазы могут вызывать реакции гиперчувствительности у некоторых индивидуумов. В результате, несмотря на полезность протеаз в промышленности, например, в детергентах, применяемых для стирки, в косметике, обработке текстильных изделий и т.д., и интенсивную исследовательскую работу, выполняемую в данной области, для получения улучшенных протеаз, которые, например, более эффективно удаляют пятна в условиях моющего действия, применение протеаз в промышленности было проблематичным.
Большая работа была проведена для снижения этих проблем. Среди стратегий, исследованных для снижения иммуногенного потенциала протеаз, использовали усовершенствованные промышленные способы, которые уменьшают потенциальный контакт посредством контроля и минимизации концентраций на рабочем месте частиц пыли или аэрозоля, несущих находящуюся в воздухе протеазу, улучшенные способы грануляции, которые снижают количество пыли или аэрозоля, фактически продуцируемого из протеазного продукта, и улучшенные способы извлечения для уменьшения уровня потенциально аллергенных загрязнителей в конечном продукте. Однако попытки уменьшения аллергенности протеазы, per se, были относительно неуспешными. Альтернативно, прилагались усилия к тому, чтобы замаскировать эпитопы в протеазе, которые распознаются иммуноглобулином Е (IgE) у гиперчувствительных индивидуумов (PCT публикация No. WO 92/10755), или для увеличения или изменения природы антигенных детерминант присоединением полимеров или пептидов/белков к неблагоприятной протеазе.
Когда имеет место адаптивная иммунная реакция в преувеличенной или неадекватной форме, говорят, что индивидуум, подверженный этой реакции, является гиперчувствительным. Реакции гиперчувствительности являются результатом обычно благоприятных иммунных реакций, действующих неадекватно и иногда вызывающих воспалительные реакции и повреждение тканей. Они могут быть спровоцированы многими аллергенами; и причина реакции гиперчувствительности будет варьироваться от одного индивидуума к другому. Гиперчувствительность обычно не проявляется при первом контакте с аллергеном, но обычно появляется при последующем контакте. Одна форма гиперчувствительности имеет место, когда IgE-ответная реакция направлена против безвредных антигенов окружающей среды, таких как пыльца, клещи домашней мыши или перхоть животных. Происходящее при этом высвобождение фармакологических медиаторов IgE-сенсибилизированными тучными клетками вызывает острую воспалительную реакцию с такими симптомами, как астма или ринит.
Тем не менее, стратегия, предусматривающая модификацию сайтов IgE, обычно не будет успешной в профилактике причины начальной реакции сенсибилизации. Таким образом, подобные стратегии, хотя, возможно, и нейтрализующие или уменьшающие тяжесть последующей реакции гиперчувствительности, не будут уменьшать число индивидуумов или лиц, фактически сенсибилизированных. Например, когда известно, что определенное лицо является гиперчувствительным к определенному антигену, общим способом контроля такой ситуации является изоляция гиперчувствительного лица от данного антигена, насколько это возможно. Действительно, любой другой способ действия мог бы быть угрожающим для здоровья гиперчувствительного индивидуума. Таким образом, хотя уменьшение угрозы специфического белка для гиперчувствительного индивидуума является важным, для промышленных целей было бы гораздо более полезным в первую очередь уменьшение или устранение способности данного белка инициировать реакцию гиперчувствительности.
Т-лимфоциты (Т-клетки) являются ключевыми участниками в индукции и регуляции иммунных реакций и в выполнении функций иммунологических эффекторов. Известно, что специфический иммунитет против инфекционных агентов и опухолей зависит от таких клеток, и считается, что они способствуют заживлению ран. С другой стороны, неспособность контролировать такие реакции может приводить к аутоагрессии. Обычно, антиген презентируется Т-клеткам в форме антигенпрезентирующих клеток, которые через различные поверхностно-клеточные механизмы захватывают и представляют антиген или частичный антиген таким образом, что он распознается Т-клеткой. При распознавании специфического эпитопа рецепторами на поверхности Т-клеток (Т-клеточными рецепторами) Т-клетки начинают серию комплексных взаимодействий, в том числе пролиферацию, которая приводит к продуцированию антитела В-клетками. Хотя как Т-клетки, так и В-клетки активируются антигенными эпитопами, которые существуют в конкретном белке или пептиде, фактические эпитопы, распознаваемые этими мононуклеарными клетками, обычно не являются идентичными. Действительно, эпитоп, который активирует Т-клетку для инициации создания иммунологического разнообразия, очень часто не находится на том же самом эпитопе, который позднее распознается В-клетками в ходе иммунологической реакции. Таким образом, что касается гиперчувствительности, хотя специфическое антигенное взаимодействие между Т-клеткой и антигеном является критическим элементом в инициации иммунной реакции в отношении экспонирования антигена, специфика этого взаимодействия, т.е. распознаваемый эпитоп, часто не имеет отношения к последующему развитию резко выраженной аллергической реакции, опосредованной IgE-антителом.
В PCT публикации No. WO 96/40791 описан способ получения конъюгатов полиалкиленоксид-протеазы с уменьшенной аллергенностью с использованием полиалкиленоксида в качестве исходного вещества.
В PCT публикации No. WO 97/30148 описан конъюгат полипептида с уменьшенной аллергенностью, который содержит одну полимерную молекулу-носитель, имеющую две или более полипептидных молекул, связанных ковалентно друг с другом.
В PCT публикации No. WO 96/17929 описан способ получения полипептидов с уменьшенной аллергенностью, включающий стадию конъюгации 1-30 полимолекул с исходным полипептидом.
В PCT публикации No. WO 92/10755 описан способ получения вариантов белков, индуцирующих уменьшенную иммуногенную реакцию у животных. В этой заявке представляющие интерес белки, ряд протеаз и их вариантов использовали для иммунизации крыс. Сыворотки от данных крыс использовали затем для измерения реактивности поликлональных антител, уже продуцированных и присутствующих в иммунизированных сыворотках, к представляющему интерес белку и его вариантам. Из этих результатов можно было определить, были ли антитела в препарате сравнительно более или менее реактивными с белком и его вариантами, что делало возможным анализ того, какие изменения в белке, вероятно, должны нейтрализовать или уменьшать способность Ig к связыванию. Из испытаний на крысах был сделан вывод, что изменение любого из 309 остатков субтилизина, соответствующих положениям 127, 128, 129, 130, 131, 136, 151, 152, 153, 154, 161, 162, 163, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 186, 193, 194, 195, 196, 197, 247, 251, 261, будет приводить к изменению иммунологического потенциала.
В PCT публикации No. WO 94/10191 описаны низкоаллергенные белки, содержащие олигомерные формы исходного мономерного белка, где данный олигомер по существу сохранял его активность.
В PCT публикации No. WO 99/49056 описано множество вариантов субтилизина, имеющих аминокислотные замены в определенном участке эпитопа. Однако из-за большого числа описанных вариантов специалист в данной области поставлен перед проблемой идентификации оптимального протеазного продукта для личной гигиены или других применений у людей, который имеет пониженное иммуногенное действие.
В PCT публикации No. WO 01/07578 описано множество вариантов субтилизина, имеющих аминокислотные замены в определенных участках эпитопа. Однако из-за большого числа описанных вариантов специалист в данной области поставлен перед проблемой идентификации оптимального протеазного продукта для личной гигиены или других применений у людей, который имеет пониженное иммуногенное действие.
Хотя некоторые исследования обеспечили способы уменьшения аллергенности некоторых белков и идентификации эпитопов, которые вызывают аллергические реакции у некоторых индивидуумов, анализы, используемые для идентификации таких эпитопов, обычно включают измерение антител IgE и IgG в сыворотках крови, перед воздействием антигена. Однако инициирование Ig-реакции свидетельствует о произошедшей сенсибилизации. Поэтому существует необходимость идентификации белков, которые вызывают усиленную иммунологическую реакцию, и необходимость получения белков, которые вызывают уменьшенную иммунологическую реакцию. Данное изобретение удовлетворяет эти и другие потребности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Способы и композиции, представленные в данном изобретении, могут быть использованы для получения гипоаллергенных композиций. Как используется в данном описании, "гипоаллергенная" означает, что композиция вызывает меньшую иммуногенную реакцию, чем та же самая композиция, с предшественниками белков данного изобретения. Как используется в данном описании, "гипераллергенная" означает, что композиция вызывает более сильную иммуногенную реакцию, чем та же самая композиция, с предшественниками белков данного изобретения.
Композиции данного изобретения могут быть воплощены, например, в очищающих композициях, продуктах гидролиза пептидов, косметических формах, композициях для ухода за кожей, волосами и полостью рта, фармацевтических продуктах, таких как продукты для удаления сгустков крови, продуктов для исследований, таких как ферменты и терапевтические агенты, в том числе вакцины.
В одном аспекте данного изобретения отобрана и представлена представляющая интерес протеаза. Представляющая интерес протеаза предпочтительно является протеазой, имеющей Т-клеточный эпитоп, и затем варьируется, как описано ниже. Однако представляющая интерес протеаза может быть также выбрана на основе природных свойств и быть неизмененной.
В одном аспекте данного изобретения представлен вариант представляющей интерес протеазы, содержащий Т-клеточный эпитоп. Данный вариант отличается от представляющей интерес протеазы тем, что он имеет измененный Т-клеточный эпитоп, так что указанный вариант и указанная представляющая интерес протеаза вызывают различные (например, увеличенную, уменьшенную или устраненную) иммуногенные реакции у человека.
Протеазой может быть любая представляющая интерес протеаза. В одном аспекте протеаза является протеазой субтилизина. В предпочтительных вариантах представляющая интерес протеаза и вариант указанной представляющей интерес протеазы обладают, по меньшей мере, частью той же самой активности. Например, если представлен вариант протеазы, указанный вариант будет вызывать измененную иммуногенную реакцию, но будет сохранять детектируемую и предпочтительно сравнимую активность и стабильность протеазы.
Если представлен вариант представляющей интерес протеазы, Т-клеточный эпитоп может быть изменен рядом путей, в том числе аминокислотными заменами, делециями, добавлениями и их комбинациями. Предпочтительно, Т-клеточный эпитоп изменен таким образом, что он содержит аминокислотные замены. В одном описываемом в данном описании варианте аминокислотные замены произведены в отношении соответствующих аминокислот гомолога представляющей интерес протеазы, где гомолог не содержит тот же самый Т-клеточный эпитоп в соответствующем положении, что и представляющая интерес протеаза. В одном аспекте концевая часть представляющей интерес протеазы, содержащая, по меньшей мере, один Т-клеточный эпитоп, заменена соответствующей концевой частью гомолога представляющей интерес протеазы, где данная замена вызывает указанную отличающуюся иммуногенную реакцию.
В другом варианте осуществления представлены нуклеиновые кислоты, кодирующие протеазы, вызывающие желательную иммуногенную реакцию. Кроме того, изобретение включает экспрессирующие векторы и клетки-хозяева, содержащие представленные в данном описании нуклеиновые кислоты. После идентификации протеаз настоящего изобретения и их вариантов могут быть идентифицированы и представлены в данном описании по существу гомологичные последовательности данных протеаз и их вариантов или последовательности, которые гибридизуются с данными протеазами и вариантами. Термин "гомологичные" определяется дополнительно ниже и может относиться к сходству или идентичности, причем термин идентичность является предпочтительным. Предпочтительно, гомологичные последовательности являются аминокислотными последовательностями или нуклеиновыми кислотами, кодирующими пептиды, обладающие активностью представленных в данном описании протеаз и их вариантов.
Еще в одном аспекте данного изобретения представлена протеаза, имеющая измененную иммуногенную реакцию. В одном варианте представляющая интерес протеаза или ее вариант содержит эпитоп, определяемый способом данного изобретения, который включает (а) получение из единственного источника крови раствора дендритных клеток и раствора "наивных" CD4+ и/или CD8+ Т-клеток; (b) стимуляцию дифференцировки в указанном растворе дендритных клеток; (с) объединение указанного раствора дифференцированных дендритных клеток и указанных "наивных" CD4+ и/или CD8+ Т-клеток с указанным белком; и (d) измерение пролиферации Т-клеток в указанной стадии (с).
Было обнаружено, что сериновые протеазы, обычно известные как субтилизины, в том числе субтилизин BPN', имеют выступающие участки эпитопов в положении аминокислот 70-84, первом участке эпитопа, и 109-123, втором участке эпитопа, соответствующем BPN'. Такой субтилизин был генетически переконструирован для изменения, например, для ослабления иммунологических свойств, приписываемых этим участкам эпитопов. Таким образом, были обнаружены субтилизины, которые индуцируют уменьшенную иммунологическую реакцию при сохранении их активности эффективных протеаз. Кроме того, были обнаружены субтилизины, которые индуцируют такую уменьшенную иммунологическую реакцию и являются термо- и рН-стабильными. Таким образом, данные протеазы пригодны для применения в нескольких типах композиций, включающих, но не ограничивающихся ими, фармацевтические композиции, моющие композиции для стирки, композиции для мытья посуды, твердой поверхности, для ухода за кожей, ухода за волосами, косметического ухода, ухода за полостью рта и композиции для контактных линз.
Было обнаружено, что сериновые протеазы, обычно известные как субтилизины, в том числе субтилизин BPN', имеют выступающие участки эпитопов в положении аминокислот 70-84, первом участке эпитопа, и 109-123, втором участке эпитопа, соответствующем BPN'. Такой субтилизин был генетически переконструирован для изменения, например, для ослабления иммунологических свойств, определяемых данными участками эпитопов. Таким образом, были обнаружены субтилизины, которые индуцируют уменьшенную иммунологическую реакцию при сохранении их активности эффективных протеаз. Кроме того, были обнаружены субтилизины, которые индуцируют такую иммунологическую реакцию и являются термо- и рН-стабильными. Таким образом, данные протеазы пригодны для применения в нескольких типах композиций, включающих, но не ограничивающихся ими, фармацевтические композиции, моющие композиции для стирки, композиции для мытья посуды, твердой поверхности, для ухода за кожей, ухода за волосами, косметического ухода, ухода за полостью рта и композиции для контактных линз.
В одном варианте осуществления были обнаружены варианты представляющей интерес протеазы, причем указанный вариант отличается от представляющей интерес протеазы тем, что он имеет измененный Т-клеточный эпитоп, так что данный вариант и представляющая интерес протеаза вызывают различные иммуногенные реакции у человека. Представляющий интерес Т-клеточный эпитоп включает замену положений аминокислотных остатков, выбранных из положений, состоящих из остатков, соответствующих остаткам 76, 79 и 122 субтилизина Bacillus amyloliquefaciens. В другом варианте представляющая интерес Т-клетка включает положение аминокислотного остатка, выбранное из группы, состоящей из положений 76 и 122. В другом варианте представляющая интерес Т-клетка включает замену положения аминокислотного остатка в положении 122 и в одном или обоих положениях 76 и 79. Иммуногенная реакция, вызываемая данным вариантом, в одном варианте осуществления изобретения, является меньшей, чем иммуногенная реакция, вызываемая представляющей интерес протеазой. В другом варианте изобретения иммуногенная реакция, вызываемая данным вариантом, является более высокой, чем иммуногенная реакция, вызываемая представляющей интерес протеазой. Могут быть также включены дополнительные замены в одном или более из положений 3, 31, 40, 41, 111, 147, 218, 206 и/или 217. Могут быть также включены дополнительные замены в одном или более из положений 216, 181, 101, 215, 216, 217, 247, 46, 154, 128, 182, 107, 250, 254, 258, 50, 47, 48, 182, 183, 185, 248 и/или 262. Были также обнаружены специфические наборы замен, включающие различные пермутации указанных выше остатков.
В другом варианте разработан способ уменьшения иммуногенной реакции протеазы, включающий получение протеазы-предшественника; и получение варианта указанной протеазы-предшественника, причем данный вариант имеет, по меньшей мере, один Т-клеточный эпитоп протеазы-предшественника, где данный вариант проявляет измененную иммуногенную реакцию, которая отличается от иммуногенной реакции протеазы-предшественника.
В другом варианте выделена нуклеиновая кислота, кодирующая заявляемые вариантные протеазы, экспрессирующие векторы, клетки-хозяева, трансформированные экспрессирующими векторами, очищающие композиции, композиции для очистки полости рта, фармацевтические композиции и композиции для ухода за кожей (включающие косметически приемлемые носители, активные ингредиенты для ухода за кожей, влагоудерживающие агенты, смягчающие агенты, эмульгаторы, полимерные загущающие агенты и силиконовые масла).
Другие аспекты данного изобретения будут понятными специалисту в данной области из следующего описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
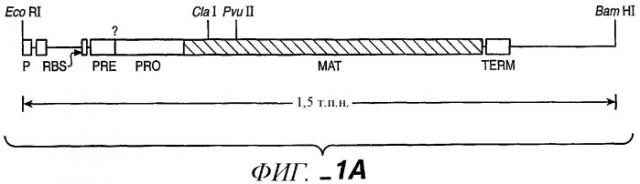
Фиг.1А, 1B-1, 1В-2 иллюстрируют последовательность ДНК (SEQ ID:NO 1) и последовательность аминокислот (SEQ ID:NO 2) для субтилизина Bacillus amyloliquefaciens (BPN') и частичную рестрикционную карту этого гена.
Фиг.2 иллюстрирует консервативные аминокислотные остатки субтилизинов Bacillus amyloliquefaciens (SEQ ID:NO 3) и Bacilluslentus (дикого типа) (SEQ ID:NO 4).
Фиг.3А и 3В иллюстрируют сопоставление аминокислотной последовательности протеаз типа субтилизина Bacillusamyloliquefaciens (BPN'), Bacillussubtilis, Bacilluslicheniformis (SEQ ID:NO 5) и Bacillus lentus. Символ * обозначает отсутствие конкретных аминокислотных остатков в сравнении с субтилизином BPN'.
Фиг.4А иллюстрирует аминокислотную последовательность протеазы-предшественника Р1.
Фиг.4B иллюстрирует ответную реакцию in vitro на белковый вариант Р1 субтилизина (BPN'-Y217L) в сравнении с вариантами LAP2 (BPN'-Y217L/I79A/I122A), LAP3 (BPN'-Y217L/N76D/I122A) и LAP4 (BPN'-Y217L/N76D/I79A/I122A).
Фиг.4B иллюстрирует процент респондеров на пептид 70-84 BPN' и различные варианты (n = 20).
Фиг.5 иллюстрирует индекс стимуляции (SI) респондеров на сайт остатков 109-123 Р1 (BPN'-Y217L).
Фиг.6 иллюстрирует 13 пептидных последовательностей, имеющих различные замены аланином в эпитопе, простирающемся от остатка 109 до остатка 123, используемых для определения измененной иммуногенной реакции субъектов-людей на рассматриваемые пептиды.
Фиг.7 иллюстрирует индекс стимуляции (SI) пяти субъектов-людей, подвергнутых действию синтезированных содержащих аланиновые замены пептидов фиг. 6.
Фиг.7А иллюстрирует SI нескольких субъектов-людей, подвергнутых действию пептидных последовательностей фиг. 6.
Фиг.7B иллюстрирует реакции иммунизированных Р1 в квасцах самок мышей HLA-DR3/DQ2 на Р1.
Фиг.7С иллюстрирует реакции иммунизированных Р1 в квасцах самцов мышей HLA-DR3/DQ2 на Р1.
Фиг.8 иллюстрирует гидролиз раствора 5 мг/мл субстрата диметилказеина при рН 5,5, показанный изменением оптической плотности субстрата, различными концентрациями вариантов субтилизина (Р1 -⋄-; -- LAP2; -Δ- LAP3; и -х- LAP4).
Фиг.9 иллюстрирует гидролиз раствора 5 мг/мл субстрата диметилказеина при рН 6,5, показанный изменением оптической плотности субстрата, различными концентрациями вариантов субтилизина (Р1 -⋄-; -- LAP2; -Δ- LAP3; и -х- LAP4).
Фиг.10 иллюстрирует гидролиз раствора 5 мг/мл субстрата диметилказеина при рН 7,5, показанный изменением оптической плотности субстрата, различными концентрациями вариантов субтилизина (Р1 -⋄-; -- LAP2; -Δ- LAP3; и -х- LAP4).
Фиг.11 иллюстрирует гидролиз раствора 5 мг/мл субстрата диметилказеина при рН 8,5, показанный изменением оптической плотности субстрата, различными концентрациями вариантов субтилизина (Р1 -⋄-; -- LAP2; -Δ- LAP3; и -х- LAP4).
Фиг.12 иллюстрирует гидролиз раствора 5 мг/мл субстрата бычьего коллагена при различных рН (5,5-8,5), показанный изменением оптической плотности субстрата, различными вариантами субтилизина (Р1 -⋄-; -- LAP2; -Δ- LAP3; и -х- LAP4).
Фиг.13 иллюстрирует гидролиз раствора 5 мг/мл субстрата эластина при различных рН (5,5-8,5), показанный изменением оптической плотности субстрата, различными вариантами субтилизина (Р1 -⋄-; -- LAP2; -Δ- LAP3; и -х- LAP4).
Фиг.14 иллюстрирует гидролиз раствора 5 мг/мл субстрата бычьего кератина при различных рН (5,5-8,5), показанный изменением оптической плотности субстрата, различными вариантами субтилизина (Р1 -⋄-; -- LAP2; -Δ- LAP3; и -х- LAP4).
Фиг.15 иллюстрирует изменение периода полужизни фермента на протяжении диапазона температур 42-56°С как меры термостабильности различных вариантов протеазы в 50 мМ PIPES (рН 6,5) (Р1 -⋄-; -- LAP2; -Δ- LAP3; и -х- LAP4).
Фиг.16 иллюстрирует изменение периода полужизни фермента на протяжении диапазона температур 42-56°С как меры термостабильности различных вариантов протеазы в 50 мМ TES (рН 7,5) (Р1 -⋄-; - - LAP2; -Δ- LAP3; и -х- LAP4).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте данного изобретения целью является представление варианта протеазы с измененной иммуногенной реакцией и аллергенным потенциалом в сравнении с протеазой-предшественником или представляющей интерес протеазой, так как уменьшение такого потенциала делает возможным более безопасное применение фермента. Хотя данное изобретение применимо для изменения потенциала иммуногенной реакции, описываемые мутации могут быть использованы в комбинации с мутациями, известными в данной области для получения измененной термостабильности и/или измененной субстратной специфичности, модифицированной активности, увеличенной удельной активности, измененной устойчивости к щелочи или измененного В-клеточного эпитопа, в сравнении с предшественником.
Согласно данному изобретению представлен вариант протеазы с измененной иммуногенной реакцией, причем данный вариант содержит Т-клеточный эпитоп, где вариант представляющего интерес пептида отличается от пептида-предшественника или представляющего интерес пептида тем, что он имеет измененный Т-клеточный эпитоп, так что представляющий интерес вариант пептида вызывает отличные иммуногенные реакции у человека. Было предположено, что измененная иммуногенная реакция включает измененную аллергенность, включающую как увеличенную, так и уменьшенную иммуногенную реакцию. Т-клеточный эпитоп может включать замену аминокислоты, выбранной из остатков в идентифицированном эпитопе. Вариант протеазы данного изобретения, включающий такие замены с уменьшением иммуногенной реакции, может характеризоваться активностью, сравнимой с активностью протеазы-предшественника, сайт-направленных мутационных вариантов, которые не вызывают иммуногенной реакции, или гибридных вариантов протеазы.
Таким образом, данное изобретение включает также способ изменения, например, увеличения или уменьшения иммуногенной реакции протеазы, включающий: получение протеазы-предшественника и модификацию протеазы-предшественника для получения варианта или производного указанной протеазы-предшественника, причем данный вариант имеет, по меньшей мере, один измененный Т-клеточный эпитоп протеазы-предшественника. Кроме того, данный вариант отличается проявлением измененной иммуногенной реакции, которая отличается от иммуногенной реакции протеазы-предшественника. Как описано в другом месте данной заявки, имеются, по меньшей мере, два Т-клеточных эпитопа в субтилизиновых протеазах, первый эпитоп, соответствующий остаткам 70-84 Bacillusamyloliquefaciens, и второй эпитоп, соответствующий остаткам 109-123 Bacillus amyloliquefaciens. Способ может дополнительно включать определение остатков, которые увеличивают или уменьшают такую иммуногенную реакцию. Такие остатки могут быть определены способами скрининга пептидов, описанными в другом месте данной заявки. В одном варианте данный вариант протеазы содержит аминокислотную замену в группе положений, соответствующих положениям аминокислот 76, 79 и 122 Bacillus amyloliquefaciens, причем указанные замены находятся, по меньшей мере, в одном из указанных эпитопов. Полученный вариант проявляет измененную иммуногенную реакцию в сравнении с иммуногенной реакцией протеазы-предшественника.
Понятно, что термины белок, полипептид и пептид используются в данном описании иногда взаимозаменяемо. Специалист в данной области сможет понять, когда пептид является частью белка, по контексту, в котором используется данный термин.
В одном варианте пептид, имеющий измененную иммуногенную реакцию, например, увеличенную или уменьшенную иммуногенную реакцию, получают из представляющей интерес протеазы. Представляющая интерес протеаза может быть протеазой дикого типа, мутированным вариантом, конъюгированным вариантом, гибридным вариантом, имеющим делеции, замены или добавления аминокислот в представляющем интерес эпитопе, который может вызывать сенсибилизацию у индивидуума или в выборке индивидуумов. Эпитоп может быть идентифицирован при помощи анализа, который идентифицирует эпитопы и не-эпитопы, следующим образом: дифференцированные дендритные клетки объединяют с "наивными" CD4+ и/или CD8+ Т-клетками и с представляющим интерес пептидом. Более конкретно, может быть представлен представляющий интерес пептид с уменьшенной иммуногенной реакцией, в котором Т-клеточный эпитоп распознается с использованием способа, включающего стадии: (а) получения из единственного источника крови раствора дендритных клеток и раствора "наивных" CD4+ и/или CD8+ Т-клеток; (b) стимуляции дифференцировки в указанном растворе дендритных клеток; (с) объединения указанного раствора дифференцированных дендритных клеток и указанных "наивных" CD4+ и/или CD8+ Т-клеток с представляющим интерес пептидом; и (d) измерения пролиферации Т-клеток в указанной стадии (с).
В варианте данного изобретения получают ряд пептидных олигомеров, которые соответствуют всей представляющей интерес протеазе или ее части. Например, получают пептидную библиотеку, охватывающую соответствующую часть белка или весь белок. В одном варианте способ получения пептидов заключается во введении перекрывания в пептидную библиотеку, например, с получением первого пептида, соответствующего аминокислотной последовательности 1-10 рассматриваемого белка, второго пептида, соответствующего аминокислотной последовательности 4-14 рассматриваемого белка, третьего пептида, соответствующего аминокислотной последовательности 7-17 рассматриваемого белка, четвертого пептида, соответствующего аминокислотной последовательности 10-20 рассматриваемого белка, и т.д., пока не будут созданы репрезентативные пептиды, соответствующие всей молекуле. Анализом каждого из данных пептидов индивидуально в представленном в данном описании анализе можно точно идентифицировать местоположение эпитопов, распознаваемых Т-клетками. В приведенном выше примере более высокая реакция одного конкретного пептида, чем реакция его соседних пептидов, будет облегчать идентификацию якорного участка эпитопа до трех аминокислот. После определения местоположения эпитопов можно изменять аминокислоты в каждом эпитопе, пока данный пептид не станет вызывать отличающуюся Т-клеточную реакцию в сравнении с исходным белком. Кроме того, могут быть идентифицированы белки, которые имеют желательную низкую силу Т-клеточного эпитопа, которые могут быть использованы в их природных формах.
"Антигенпрезентирующая клетка", как используется в данном описании, является клеткой иммунной системы, которая презентирует антиген на ее поверхности, который распознается рецепторами на поверхности Т-клеток. Примерами антигенпрезентирующих клеток являются дендритные клетки, смыкающиеся клетки (клетки с дендритной морфологией, находящейся в тимусзависимой области лимфатических узлов), активированные В-клетки и макрофаги.
"Т-клеточная пролиферация", как используется в данном описании, означает число Т-клеток, продуцируемых во время инкубирования Т-клеток с антигенпрезентирующими клетками, с антигеном или без антигена.
"Т-клеточная фоновая пролиферация", как используется в данном описании, означает Т-клеточную пролиферацию, которая обычно наблюдается у индивидуума в ответ на воздействие антигенпрезентирующих клеток в отсутствие пептидного или белкового антигена. Для преследуемых в данном изобретении целей уровень фоновой Т-клеточной пролиферации определяли в расчете на пробу для каждого индивидуума в виде пролиферации Т-клеток в ответ на антигенпрезентирующие клетки в отсутствие антигена.
"Т-клеточный эпитоп" означает признак пептида или белка, который распознается рецептором Т-клеток в инициации иммунологической реакции на пептид, содержащий антиген. Считается, что распознавание Т-клеточного эпитопа Т-клеткой происходит посредством механизма, в котором Т-клетки распознают пептидные фрагменты антигенов, которые связаны с молекулами главного комплекса гистосовместимости (МНС) класса I или класса II, экспрессируемыми на антигенпрезентирующих клетках (см., например, Moeller, G. ed., "Antigenic Requirements for Activation of MHC-Restricted Responses", ImmunologicalReview, Vol. 98, p. 187 (Copenhagen; Munksgaard) (1987)).
"Проба" в данном контексте обозначает мононуклеарные клетки, которые являются "наивными", т.е. несенсибилизированными к рассматриваемому антигену.
"Гомолог", как используется в данном описании, означает белок или фермент, который имеет сходные каталитическое действие, структуру и/или использование с представляющим интерес белком. Для целей данного изобретения гомолог и представляющий интерес белок не являются обязательно эволюционно родственными, например, одним и тем же функциональным белком из различных видов. Желательно найти гомолог, который имеет третичную и/или первичную структуру, сходную с представляющим интерес белком, так как замена эпитопа в представляющем интерес белке аналогичным сегментом из данного гомолога будет уменьшать разрушаемость такого изменения. Таким образом, близко гомологичные ферменты будут обеспечивать наиболее желательный источник эпитопных замен. Альтернативно, если это возможно, предпочтительно рассматривать человеческие аналоги для конкретного белка. Например, замена специфического эпитопа в бактериальном субтилизине последовательностью из человеческого аналога субтилизина (например, субтилизина человека) должна приводить к уменьшенной иммуногенной реакции в бактериальном белке.
"Аналогичная" последовательность может быть определена обеспечением того, что аминокислоты замены обнаруживают сходные функцию, третичную структуру и/или консервативные остатки относительно аминокислот в представляющем интерес белке в эпитопе или вблизи от эпитопа. Таким образом, где эпитоп содержит, например, альфа-спираль или структуру бета-складки, аминокислоты замены должны сохранять эту специфическую структуру.
Затем определенные или идентифицированные эпитопы могут быть модифицированы для изменения, например увеличения или уменьшения, иммунологического потенциала представляющего интерес белка. В одном варианте эпитоп, подлежащий модификации, вызывает более чем трехкратный уровень фоновой пролиферации Т-клеток в пробе. После модификации этот эпитоп вызывает меньшую, чем трехкратная фоновая, пролиферацию, предпочтительно меньшую, чем двукратная фоновая, пролиферацию, и наиболее предпочтительно, меньшую, чем фоновая, пролиферацию или пролиферацию, равную фоновой пролиферации. В другом варианте подлежащий модификации эпитоп вызывает уровень пролиферации Т-клеток, в три раза меньший, чем фоновая пролиферация Т-клеток в пробе. После модификации этот эпитоп вызывает большую, чем трехкратная фоновая, пролиферацию, предпочтительно большую, чем двукратная фоновая, пролиферацию, и наиболее предпочтительно пролиферацию, большую, чем фоновая пролиферация, или равную фоновой пролиферации.
Эпитоп может быть модифицирован различными путями, например: (а) аминокислотная последовательность эпитопа может быть заменена аналогичной последовательностью человеческого гомолога представляющего интерес белка; (b) аминокислотная последовательность эпитопа может быть заменена аналогичной последовательностью не-человеческого гомолога представляющего интерес белка, которая вызывает меньшую иммуногенную, например аллергенную, реакцию вследствие распознавания Т-клеточного эпитопа, чем последовательность представляющего интерес белка; (с) аминокислотная последовательность эпитопа может быть заменена последовательностью, которая по существу имитирует признаки основной третичной структуры эпитопа, но которая вызывает меньшую иммуногенную, например аллергенную, реакцию вследствие узнавания Т-клеточного эпитопа, чем последовательность представляющего интерес белка.
Специалисту в данной области должно быть понятно, что эпитопы могут быть модифицированы и другими путями в зависимости от желаемого результата. Например, если желательным является аутоиммунная реакция против аутологичного антигена, предполагается, что аминокислотная последовательность эпитопа будет заменяться аминокислотами, которые уменьшают или вызывают смещение в воспалительной или другой иммунной реакции.
Данное изобретение охватывает все белки, иммуногенную реакцию против которых желательно модулировать. Специалисту в данной области будет понятно, что белки и пептиды данного изобретения не должны быть обязательно природными белками и пептидами. Действительно, в одном варианте данного изобретения рассматриваются подвергнутые перетасовке гены, обладающие измененной иммунологической реакцией. В отношении описания перетасовки генов и экспрессии таких генов см. Stemmer, Proc. Natl. Acad. Sci. USA 91:10747 (1994); Patten, et al., Current Opinion in Biotechnol. 8:724 (1997); Kuchner & Arnold, Trends Biotechnol. 15:523 (1997; Moore, et al., J. Mol. Biol. 272:336 (1997); Zhao, et al., Nature Biotechnol. 16:258 (1998); Giver, et al., Proc. Natl. Acad. Sci. USA 95:12809 (1998); Harayama, Trends Biotechnol. 16:76 (1998); Lin, et al., Biotechnol., Prog. 15:467 (1999) and Sun, J. Comput. Biol. 6:77 (1999). Белки могут быть изменены для модуляции иммунологической реакции на этот белок.
Предпочтительно, протеазы данного изобретения выделяют или очищают. Под очисткой или выделением подразумевается, что протеазу изменяют из ее природного состояния путем отделения протеазы от некоторых или всех природных компонентов, с которыми она связана в природе. Это может выполняться известными в данной области способами разделения, такими как ионообменная хроматография, аффинная хроматография, гидрофобная хроматография, диализ, обработка протеазами, осаждение сульфатом аммония или друго