Ингибирование stat-1
Иллюстрации
Показать всеДанное изобретение относится к применению ДНК-олигонуклеотида, пригодного для ингибирования активности транскрипционного фактора STAT-1, для изготовления лекарства для ослабления воспалительных реакций и для предотвращения или терапии: ишемических/реперфузионных повреждений при хирургических операциях и трансплантации органов соответственно. Изобретение обеспечивает повышение эффективности терапии. 10 ил.
Реферат
Настоящее изобретение относится к применению ингибиторов транскрипционного фактора STAT-1 для изготовления лекарства для предупреждения или терапии сердечно-сосудистых осложнений, таких как рестеноз после чрескожной ангиопластики или стеноз венозных шунтов, реакции трансплантат против хозяина, ишемических/реперфузионных повреждений при хирургических операциях и трансплантации органов соответственно, иммунологических реакций гиперчувствительности, в частности аллергического ринита, лекарственных и пищевых аллергий, в частности крапивницы и глютеновой болезни (спру), контактной экземы и комплексных иммунных заболеваний, в частности альвеолита, артрита, гломерулонефрита и аллергического васкулита, воспалительных хондро- и остеопатий, в частности артроза, подагры, остита и остеомиелита, полиневрита, как острого, так и подострого соответственно, инфекционного контингента и в особенности постинфекционных воспалительных болезней, в частности бронхита, эндокардита, гепатита, миокардита, нефрита, перикардита, перитонита и панкреатита, в том числе септического шока.
Одна из важных целей расшифровки человеческого генома заключается в том, чтобы идентифицировать патологические гены (на основании механизма действия их продуктов) и патологические изменения в структуре этих генов (полиморфизмы) соответственно и отнести их к определенной клинической картине болезни. Поэтому этиотропная терапия большинства заболеваний является достижимой, если принимать, что их причиной является определенное количество генных продуктов, которые экспрессируются слишком сильно, слишком слабо или с ошибками. В действительности для целого ряда наследственных заболеваний (например для кистозного фиброза) уже известен, как правило, единичный генетический дефект (моногенетические заболевания), тогда как ситуация для других заболеваний (например гипертонии) представляется намного более сложной. Последние, очевидно, являются результатом не единичных, а множественных генетических дефектов (полигенетические заболевания), которые предопределяют развитие болезни у пораженных людей при воздействии определенных факторов окружающей среды. Несмотря на это ограничение направленное вмешательство в экспрессию одного или более генов дает возможность для этиотропной, и не только симптоматической, терапии.
Транскрипционные факторы представляют собой ДНК-связывающие белки, которые присоединяются к промоторному участку одного или более генов в ядре клетки и таким образом регулируют их экспрессию, то есть синтез белка, который этот ген кодирует. Наряду с физиологически важной ролью контроля процессов развития и дифференцировки в человеческом организме транскрипционные факторы имеют высокий болезнетворный потенциал, прежде всего, когда экспрессия гена активируется не в нужный момент. Дополнительно (возможно, те же) транскрипционные факторы могут блокировать гены с защитными функциями и действовать как предопределяющие развитие какой-либо болезни. В этом отношении описанный ниже принцип терапии противотранскрипционными факторами направлен на ингибирование патологических генов и, наоборот, на активирование защитных генов.
Воспаление представляет собой защитную реакцию организма и его тканей от повреждающих стимулов с целью коррекции повреждения или по меньшей мере его локального ограничения, а также устранения причины повреждения (например, проникнувшие бактерии или инородные тела). Инициирующим фактором воспаления могут быть микроорганизмы (бактерии, вирусы, грибы или паразиты), инородные тела (пыльца, кристаллы асбеста или силикатные кристаллы), разрушение ткани посредством механического повреждения, химические повреждающие факторы и физические воздействия, а также факторы собственного организма (распадающиеся опухолевые клетки, внесосудистая кровь, аутоиммунные реакции) или кристаллы веществ, выпавших в осадок в организме (мочевая кислота, оксалат и фосфат кальция, холестерин).
Быстрая активация тучных клеток (в ткани) или базофильных гранулоцитов в крови является примером инициирования очень сильной острой воспалительной реакции и характерной для иммунологической реакции гиперчувствительности немедленного типа (гуморальная аллергия I типа). Если организм уже вступил в контакт с антигеном (или аллергеном, соответственно, в случае гиперчувствительности), то в качестве ответной реакции на него будут сенсибилизироваться уже произведенные В-лимфоциты. В-лимфоциты преобразуются в плазмоциты при взаимодействии с предварительно сенсибилизированными СD4-положительными Т-хелперами 2 типа (Тh2-клетки) и начинают продуцировать антитела типа IgE против данного антигена. В данном процессе дифференцировки костимуляция В-лимфоцитов через CD40-рецептор Тh2-клетками, экспрессирующими соответствующие лиганды (CD154), имеет решающее значение. При связывании IgE-антител, нагруженных антигеном, с соответствующими рецепторами (тип ) на тучных клетках последние высвобождают различные медиаторы воспаления, в частности гистамин, интерлейкин-8, лейкотриен и фактор некроза опухоли-α (ФНОα). Вследствие этого происходит привлечение профессиональных воспалительных клеток, в особенности эозинофильных и нейтрофильных гранулоцитов и моноцитов, а также Т-лимфоцитов в место события (хемотаксис). Одновременно происходит гистамин-зависимое расширение кровеносных сосудов и увеличение проницаемости клеток эндотелия, выстилающих стенки сосудов. Вследствие расширения сосудов скорость течения падает, что облегчает установление физического контакта привлеченных лейкоцитов с клетками эндотелия. Эти клетки эндотелия экспонируются цитокинам (например ФНОα), уже таким образом активированные экспрессируют на своей люминальной поверхности повышенное количество селектинов (например Е-селектина), которые вызывают роллинг лейкоцитов вдоль клеток эндотелия и вследствие этого активацию дальнейших молекул адгезии (интегринов; например, молекулы межклеточной адгезии 1 [ICAM-1] или васкулярно-клеточной молекулы адгезии 1 [VCAM-1]). Лейкоциты могут теперь прилипать к стенке сосуда (маргинация), а увеличение проницаемости, обусловленное гистамином (ослабление связи клеток эндотелия), способствует их последующему выходу во внесосудистое пространство (диапедез). Одновременно увеличенное количество жидкости, богатой белками (воспалительный экссудат), достигает интерстициального пространства, образуя отек. Вследствие увеличивающегося давления тканей и под воздействием других медиаторов, образованных воспалительными клетками, окружающие нервные окончания раздражаются и вызывают боли, тем самым приводя к осознанию повреждения ткани.
Гранулоциты, которые мигрируют к месту воспаления, и моноциты, передифференцировавшие в макрофаги, пытаются элиминировать агенты, вызвавшие воспаление, посредством фагоцитоза или лизиса соответственно, при этом высвобождаются, среди прочего, протеолитические ферменты и кислородные радикалы, которые могут повредить также окружающие ткани. В особенности этому может способствовать активация макрофагов разнообразными способами (например, высвобождение цитокинов, таких как интерлейкин-1β или интерлейкин-6), так что целый организм включается в изначально местную воспалительную реакцию в форме ответа острой фазы. Типичными признаками ответа острой фазы являются усталость, подавленность и лихорадка, повышенное высвобождение лейкоцитов из костного мозга (лейкоцитоз), обнаружение белков острой фазы в крови (например, С-реактивного белка), стимуляция иммунной системы, а также потеря веса ввиду измененного обмена веществ.
Если причина воспаления может быть устранена, то начинается процесс заживления, при котором разрушенная ткань восстанавливается. В наилучшем случае она будет полностью восстановлена (восстановление до целого), тогда как при больших повреждениях или чрезмерном образовании соединительной ткани (в особенности коллагена), образуется рубец, который может быть ассоциирован со значительными функциональными нарушениями из-за пораженной ткани. Если причина не может быть немедленно устранена (инородные тела или раневая инфекция), то заживление раны замедляется из-за одновременного усиления иммиграции и активности фагоцитов с последующей гибелью ткани (некроз) вплоть до формирования полостей (абсцесс). Результатом практически всегда является рубцовая перестройка ткани с соответствующей потерей функции. Если не происходит локального ограничения воспаления, вызванного возбудителем, оно распространяется через лимфатическую систему на весь организм. Результатом этого является сепсис с возможным смертельным исходом (септический шок).
Нарушение заживления раны также имеет место, когда процессы воспаления и заживления находятся в равновесии. Результатом является хроническое воспаление, которое может быть фиброзным (чрезмерный синтез коллагена) или гранулематозным (организация воспалительных клеток в виде грануляционной ткани) и которое, как правило, приводит к непрерывному разрушению или возрастающему ограничению функций пораженных тканей.
Помимо описанных общих воспалительных реакций, которые могут переходить в хронические, существуют воспалительные заболевания, которые обнаруживают общие особенности, но также и особые различия в плане патогенеза, лежащего в их основе. Двумя такими воспалительными заболеваниями являются, например, осложнения после кардиохирургического вмешательства и иммунологические реакции гиперчувствительности, которым посвящается больше места в данных материалах заявки ввиду их огромного клинического значения.
Механическое расширение с помощью баллонного катетера (чрескожная ангиопластика), а также шунтирование атеросклеротических суженных артерий с помощью венозных шунтов соответственно по-прежнему представляет собой терапию выбора у пациентов с коронарными и периферическими нарушениями кровообращения соответственно для предотвращения угрожающего инфаркта или органной недостаточности. Однако частота повторной закупорки артерий (рестеноза), которые были механически расширены и (в большинстве случаев) снабжены металлическими эндопротезами сосудов (стентами), неприемлемо повышается на 20-50% за 6 месяцев. Также частота повторной закупорки аортокоронарных и периферических венозных шунтов, составляющая 50-70% за 5 месяцев, является более чем неудовлетворительной, в особенности на фоне риска во время процедуры и послеоперационного риска у оперируемых пациентов соответственно. Вероятно, из-за механического повреждения стенки сосудов (в данном случае пораженными являются как клетки эндотелия, так и гладкомышечные клетки сосудов) рестеноз после ангиопластики проявляет, в особенности на ранней стадии, выраженный воспалительный компонент, который характеризуется среди прочего инфильтрацией профессиональных воспалительных клеток (прежде всего моноцитов и Т-лимфоцитов) в стенку сосуда. Формирование фибропролиферативного стеноза (гиперплазия внутренней оболочки сосуда) в аортокоронарных, а также периферических венозных шунтах соответственно, по-видимому, также основано на воспалительной реакции, причиной которой являются, в частности, механические и физические повреждающие факторы. Также давно известно, что разрушение ткани, обусловленное воспалением, сопутствует так называемым ишемическим/реперфузионным повреждениям при хирургических вмешательствах или трансплантации органов, когда решающую роль играет в особенности взаимодействие клеток эндотелия и профессиональных воспалительных клеток (прежде всего гранулоцитов, но также и моноцитов и Т-клеток), а также высвобождение веществ, повреждающих ткань (кислородных радикалов, цитокинов).
В отношении упомянутых сердечно-сосудистых осложнений важно, что существуют защитные механизмы, прежде всего в клетках эндотелия и клетках гладкой мускулатуры стенки сосуда, которые помогают ограничить степень воспалительной реакции и последующее адаптивное восстановление ткани. К таким механизмам относится, например, синтез оксида азота (NO) посредством NO-синтазы в клетках эндотелия. NO, возможно, в качестве эндогенного антагониста супероксидных кислородных радикалов, ингибирует среди прочего экспрессию провоспалительных хемокинов (например моноцитарного хемоаттрактантного белка-1, МСР-1) и молекул адгезии (например ICAM-1)) в клетках эндотелия, экспрессию рецепторов для факторов роста в клетках гладкой мускулатуры (например, рецептора эндотелина В), а также высвобождение факторов роста из лейкоцитов. Поэтому легко понять, что механическое, так же как и функциональное повреждение эндотелия (например, посредством цитокин-индуцированного снижения экспрессии NO-синтазы в этих клетках), противодействует процессам воспаления и последующей фибропролиферативной перестройки стенки сосуда, лежащим в основе упомянутых сердечно-сосудистых осложнений.
Все предыдущие попытки медикаментозно кконтролировать рестеноз после ангиопластики не имели желаемого эффекта у большинства пациентов. В настоящее время преимущественно используют два локальных принципа терапии: уже разрешенная сосудистая брахитерапия - способ сдерживания клеточного роста посредством кратковременного радиоактивного облучения расширенного отрезка сосуда, а также еще находящиеся на клиническом испытании стенты, элюирующие лекарства. При этом способе вводят покрытые полимером стенты, которые «импрегнированы» лекарствами, ингибирующими рост (цитостатиками, иммуносупрессорами), и медленно высвобождают эти лекарства в течение нескольких недель. Последние клинические исследования подтверждают, что оба терапевтических подхода несмотря на первоначально обнадеживающие результаты не исключают некоторых серьезных проблем (например, тромбозы в стентах с опасностью инфаркта).
Помимо уже описанных иммунологических реакций несовместимости типа I существуют, в принципе, четыре другие формы аллергии, а также нарушений иммунорегуляции соответственно. Реакцию типа I как таковую можно делить, в принципе, на две фазы после произошедшей сенсибилизации: быстрое высвобождение и синтез активных в отношении сосудов медиаторов воспаления из обогащенных IgE тучных клеток, а также поздняя реакция, опосредованная привлеченными эозинофильными и нейтрофильными гранулоцитами. Реакция типа I может протекать местно или генерализованно в зависимости от экспозиции аллергену. Аллергены во вдыхаемом воздухе запускают реакции в дыхательном тракте, обычно сопровождающиеся отеками слизистой оболочки и гиперсекрецией (аллергическая ринопатия, вазомоторный ринит), а также бронхоспазмом (астма), тогда как пищевые аллергены в первую очередь вызывают такие желудочно-кишечные симптомы, как тошнота, рвота и диарея. Кожа реагирует на аллергены зудом и крапивницей, а также атопическим дерматитом (нейродерматит). Но если аллерген попадает непосредственно в кровяное русло (например, инфузия продуктов крови, лекарственных препаратов) или экспозиция аллергена особенно сильная, то в результате развивается системная реакция немедленного типа, которая в некоторых условиях вызывает опасное для жизни снижение кровяного давления (анафилактический шок).
При реакции II типа в центре внимания находятся антигенно активные клетки (например, чужеродные клетки крови) или внеклеточные белки (например, индуцированное лекарствами изменение поверхности собственных клеток организма). После аллергизации при вторичном контакте образуются аллерген-специфичные антитела типа IgG и IgM, которые в большом количестве связываются с поверхностью аллергенной клетки (опсонизация). Посредством этого активируются система комплемента (образование мембраноатакующего комплекса) и специальная субпопуляция лимфоцитов - натуральные киллеры (НК-клетки). Результатом является разрушение аллергенной клетки путем цитолиза. Похожая реакция индуцируется, когда аутоантитела присоединяются к структурам собственного организма, таким как, например, базальная мембрана капилляров почечных клубочков, и вследствие этого развивается быстро прогрессирующий гломерулонефрит с угрозой почечной недостаточности. Помимо Т-хелперов 1 типа (ТП1-клетки, см. выше) активированные НК-клетки являются основными источниками интерферона-γ - цитокина, который значительно усиливает воспалительную реакцию, в частности, посредством активирования макрофагов.
Реакция III типа характеризуется образованием и отложением иммунокомплексов (комплекс антиген-антитело) с последующим активированием системы комплемента и фагоцитов (гранулоцитов, макрофагов). Они циркулируют в крови и постепенно накапливаются, прежде всего в капиллярах почечных клубочков, но также в суставах или в коже. Воспалительная реакция, индуцированная таким образом, может привести среди прочего к (иммунокомплексному) гломерулонефриту, болях в суставах, а также к крапивнице. Также системную реакцию III типа могут вызвать инфекции, если иммунной системе не удалось ликвидировать возбудителя (например, стрептококков). Типичными местными реакциями III типа являются так называемые реакции Артюса в коже после прививки или экзогенный аллергический альвеолит - при осаждении комплексов антиген-антитело в легких (например, болезнь любителей голубей). Также реакцией III типа является системная красная волчанка, правда, в том смысле что она является аутоиммунным заболеванием в результате образования аутоантител.
Реакция IV типа, в противоположность упомянутым выше реакциям гиперчувствительности является не гуморальной, а клеточной и достигает своего максимума, как правило, впервые через несколько дней (замедленный тип реакции, или гиперчувствительность замедленного типа). Запускающими факторами являются прежде всего белки проникнувших чужеродных организмов (бактерий, вирусов, грибов и паразитов), другие чужеродные белки (например, глиадин из пшеницы - в случае целиакии), а также гаптены (лекарства, металлы (например, никель - в случае контактного дерматита), косметика и части растений). Также реакцией IV типа является первичное отторжение трансплантированного органа. Антиген подвергается фагоцитозу (тканевыми) макрофагами, процессингу и презентации наивным Т-хелперам (СD4-положительным); сенсибилизация Т-хелперов продолжается несколько дней. При вторичном контакте сенсибилизированные таким образом Т-хелперы превращаются в Тh1-клетки; при этом важную роль играет CD154-опосредованная костимуляция антиген-презентирующих клеток (они экспрессируют СD40-рецептор), так как через этот сигнальный путь происходит высвобождение интерлейкина-12 из макрофагов. Интерлейкин-12 запускает дифференцировку и пролиферацию Т-хелперов. Тh1-клетки, в свою очередь, посредством определенных факторов роста (например, GM-CSF) вызывают образование моноцитов в костном мозге, пополняют их пул с помощью определенных хемокинов (например, MIF) и активируют их посредством высвобождения интерферона-γ (ИФН-γ). Развивающаяся в результате этого очень сильная воспалительная реакция может в большом объеме разрушать ткань собственного организма (например, туберкулез) или трансплантированную ткань. Более того, в отторжении трансплантата участвуют СD8-положительные цитотоксические Т-клетки (цитолиз), которые, как и СD4-положительные Th1-клетки, способны распознавать свою мишень (поверхность чужеродной клетки) только посредством предшествующей презентации антигена и «вооружаться» соответственно.
Нарушение иммунорегуляции, подобное реакции IV типа, лежит в основе, например, ревматоидного артрита или рассеянного склероза (аутореактивные Тh1-клетки), а также сахарного диабета - (аутореактивные цитотоксические Т-клетки). Помимо соответствующей генетической предрасположенности (МНС-белки, дисбаланс Th1/Th2) и бактериальных суперантигенов (например, возбудитель туберкулеза) при этих аутоиммунных заболеваниях могут потенциально играть роль Т-клетки, направленные против определенных антигенов возбудителей (например, стрептококков), которые перекрестно реагируют с аутоантигенами (продуцируемыми в организме: молекулярная мимикрия). Реакции V типа, напротив, могут быть вызваны среди прочего активирующими или блокирующими аутоантителами рецепторов гормонов (например, тиреотропина - при базедовой болезни) или нейротрансмиттеров (например, ацетилхолина - при тяжелой псевдопаралитической миастении).
Сравнимой с отторжением трансплантата, опять же - в обратном смысле, является реакция «трансплантат против хозяина» (GHVD), которая встречается у примерно 40% реципиентов в ходе трансплантаций аллогенного костного мозга (от генетически не идентичных индивидуумов). В течение острой фазы, продолжающейся до трех месяцев, Т-клетки донора, пересаженные вместе со стволовыми клетками, атакуют организм-хозяин. Возникающая в результате возможно тяжелая воспалительная реакция проявляется прежде всего в коже, в желудочно-кишечном тракте и в печени.
Для лечения острых воспалительных заболеваний в зависимости от предполагаемых причин используют, как правило, нестероидные противовоспалительные средства (НПВС; среди прочего, ингибирование синтеза простагландина) и/или противоинфекционную (для уничтожения бактерий, грибов или паразитов) или противовирусную химиотерапию, также возможно местное применение глюкокортикоидов (общее ингибирование экспрессии генов). При серьезных или хронических рецидивирующих воспалительных заболеваниях системно вводят глюкокортикоиды или иммуносупрессоры (ингибирование активации Т-клеток) или цитостатики, такие как метотрексат. Это используют также при трансплантации органов или костного мозга. Несмотря на их неоспоримое терапевтическое значение системное применение упомянутых выше лекарственных средств, в особенности при длительном применении может оказывать тяжелые побочные действия. Например, у 25% пациентов, принимающих метотрексат в течение двух или более лет, развивается тяжелый цирроз печени. Новые активные вещества, в особенности назначаемые при хронических рецидивирующих воспалительных заболеваниях, блокируют провоспалительное действие ФНОα: антитела против самого цитокина или его рецептора, низкомолекулярные антагонисты рецептора, а также растворимые рецепторные белки, полученные рекомбинантным способом, которые захватывают цитокин. Однако возрастает количество ссылок на повышенное число инфекционных заболеваний при лечении рецепторными белками (среди них туберкулез), а примерно 40%, по-видимому, совсем не реагируют на лечение (невосприимчивы). Кроме того, для разрешенных гуманизированных ФНОα-антител имеется соответствующее предупреждение относительно появления инфекций вплоть до сепсиса через 2-4 года после начала лечения. Более того, противопоказано применение обоих типов лекарственных препаратов при остром воспалении. В дополнение, низкомолекулярные антагонисты рецепторов разрешены для лейкотриенов, которые прежде всего находят применение при лечении астмы, а также ингибиторы циклооксигеназы-2, новый класс нестероидных противовоспалительных средств (НПВС) со значительно сниженными желудочно-кишечными побочными явлениями по сравнению с классическими НПВС. Более того, имеется ряд других подходов, как правило, на основе антител - обычно гуманизированных - или олигонуклеотидов, направленных против молекул адгезии лейкоцитов или клеток эндотелия, цитокиновых рецепторов Т-хелперов или IgE-антител, которые находятся на различных фазах клинических испытаний. Чтобы отказаться от глюкокортикоидов и противоинфекционных средств как группы, упомянутые лекарства в целом должны быть направлены специфично против терапевтически релевантной молекулы-мишени.
Таким образом, настоящее изобретение основано на проблеме, состоящей в том, чтобы предложить вещества для предотвращения или терапии сердечно-сосудистых осложнений, таких как рестеноз после чрескожной ангиопластии или стеноз венозного шунта, реакции трансплантат против хозяина, ишемических/реперфузионных повреждений при хирургических операциях и трансплантации органов соответственно, иммунологических реакций гиперчувствительности, в частности аллергического ринита, лекарственных и пищевых аллергий, в частности крапивницы и глютеновой болезни (спру), контактной экземы и комплексных иммунных заболеваний, в частности альвеолита, артрита, гломерулонефрита и аллергического васкулита, воспалительных хондро- и остеопатий, в частности артроза, подагры, остита и остеомиелита, полиневрита, как острого, так и подострого соответственно, инфекционного контингента и, в частности, постинфекционных воспалительных болезней, в частности бронхита, эндокардита, гепатита, миокардита, нефрита, перикардита, перитонита и панкреатита, в том числе септического шока, которые составляют более широкий (заведомо не моноспецифический) и поэтому потенциально более эффективный терапевтический подход.
Данную задачу решает объект, определенный в формуле изобретения.
Данное изобретение пояснено подробнее следующими фигурами.
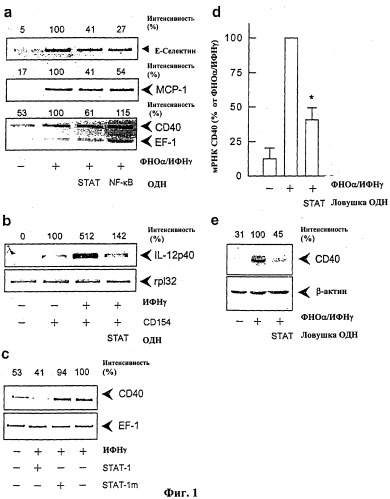
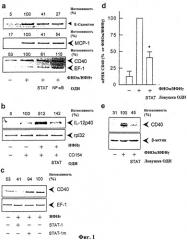
На Фиг.1 показано ингибирование цитокин-стимулированной экспрессии CD40 (а, с, d и е), Е-селектина и МСР-1 (а) и индукция лигандом CD40 экспрессии интерлейкина-12р40 (b) в культивируемых клетках эндотелия человека посредством нейтрализации транскрипционного фактора STAT-1 с помощью соответствующей цис-элемент ловушки (SEQ ID NO: 33). (а) Репрезентативный анализ ПЦР с обратной транскриптазой (ОТ-ПЦР) экспрессии м-РНК Е-селектина, МСР-1 и CD40 (включая денситометрический анализ («интенсивность»), данный в процентах от стимулированного контроля и отнесенный к внутреннему стандарту EF-1) в клетках эндотелия, которые предварительно инкубировали в течение 4 часов со STAT-1 (SEQ ID NO: 33) или NF-кВ цис-элемент ловушкой (10 мкМ) и затем инкубировали в течение 9 часов с 100 Е/мл фактора некроза опухоли-α и 1000 Е/мл интерферона-γ. (b) Репрезентативный анализ экспрессии мРНК интерлейкина-12р40 путем полимеразной цепной реакции (ПЦР) с обратной транскриптазой (включая денситометрический анализ («интенсивность»), данный в процентах от стимулированного контроля и отнесенный к внутреннему стандарту rpl32) в клетках эндотелия, которые предварительно инкубировали в течение 4 часов со цис-элемент ловушкой STAT-1 (10 мкМ; SEQ ID NO: 33) с последующей инкубацией в течение 12 часов с примерно 670000 РЗхТВ.А7-клетками/мл (эти клетки миеломы мышей стабильно экспрессируют лиганды к CD40 человека - CD154) и 1000 Е/мл интерферона-γ. (с) Репрезентативный анализ экспрессии мРНК CD40 путем ПЦР с обратной транскриптазой (включая денситометрический анализ («интенсивность»), данный в процентах от стимулированного контроля и отнесенный к внутреннему стандарту EF-1) в клетках эндотелия, которые в течение 4 часов предварительно инкубировали со цис-элемент ловушкой STAT-1 (SEQ ID NO: 33) или с соответствующим контрольным олигонуклеотидом (STAT-1-25mut) (концентрация 10 мкМ) с последующей инкубацией в течение 9 часов с 100 Е/мл фактора некроза опухоли-а и 1000 Е/мл интерферона-γ. (d) Статистическое обобщение 5 независимых экспериментов по действию цис-элемент ловушки STAT-1 (SEQ ID NO: 33) на цитокин-стимулированную экспрессию мРНК CD40 в культивированных клетках эндотелия (*р<0,05 против стимулированных контрольных клеток), (е) Репрезентативный Вестерн-блот-анализ, включая денситометрический анализ («интенсивность» дана в процентах от стимулированного контроля и отнесенная к внутреннему стандарту (β-актину) действия цис-элемент ловушки STAT-1 (SEQ ID NO: 33) на цитокин-стимулированную экспрессию белка CD40 в культивированных клетках эндотелия через 24 часа. В дальнейших экспериментах были получены сравнимые результаты.
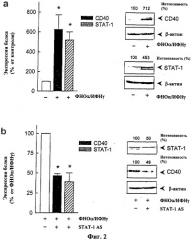
На Фиг.2 показано ингибирование цитокин-индуцированной экспрессии гена CD40 в культивируемых клетках эндотелия человека посредством основанной на антисмысловом олигонуклеотиде регуляции экспрессии транскрипционного фактора STAT-1 по механизму отрицательной обратной связи. (а) Экспрессия белков CD40 и STAT-1 соответственно в состоянии покоя и после 14-часовой инкубации клеток со 100 Е/мл фактора некроза опухоли-α и 1000 Е/мл интерферона-γ. В левой части рисунка показано статистическое обобщение 2-4 экспериментов с различными сериями клеток, в правой части рисунка показан в каждом случае репрезентативный Вестерн-блот-анализ с дополнительным денситометрическим анализом («интенсивность»), данным в процентах от стимулированного контроля и отнесенным к внутреннему стандарту β-актину (*р<0,05 против нестимулированных контрольных клеток). (b) Сравнительное ингибирование экспрессии белков CD40 и STAT-1 в стимулированных клетках эндотелия посредством 24-часовой предварительной обработки STAT-1-антисмысловым олигонуклеотидом (1 мкМ; SEQ ID NO: 33). Обобщение 2 экспериментов (левая часть рисунка; *р<0,05 против стимулированных контрольных клеток) и репрезентативный Вестерн-блот анализ (правая часть рисунка).
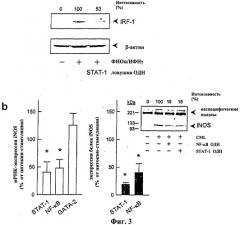
На Фиг.3 показано ингибирование экспрессии транскрипционного фактора IRF-1 в линии моноцитов ТНР-1 (а), а также индуцибельной изоформы NO-синтазы в культивированных клетках гладких мышц человека (b) посредством нейтрализации транскрипционного фактора STAT-1 с помощью соответствующей цис-элемент-ловушки (SEQ ID NO: 33). (а) Репрезентативный Вестерн-блот-анализ с дополнительным денситометрическим анализом («интенсивность»), данным в процентах от стимулированного контроля и отнесенным к внутреннему стандарту β-актину. Культивируемые ТНР-1 клетки предварительно инкубировали в течение 4 часов с цис-элемент-ловушкой (10 мкМ) и затем инкубировали в течение 3 часов с 100 Е/мл фактора некроза опухоли-α и 1000 Е/мл интерферона-γ. (b) Левая часть рисунка: статистическое обобщение 3 экспериментов с различными линиями культивируемых клеток гладкой мускулатуры человека, которые предварительно инкубировали в течение 4 часов со STAT-1 (SEQ ID NO: 33), NF-кВ или GATA-1-цис-элемент-ловушкой (10 мкМ) и затем инкубировали в течение 9 часов с 1000 Е/мл интерферона-γ, 60 Е/мл интерлейкина-1β, 100 Е/мл фактора некроза опухоли-α и 1 мкг/мл бактериального липополисахарида. Анализ экспрессии мРНК для индуцибельной изоформы NO-синтазы путем ПЦР с обратной транскриптазой (*Р<0,05 против стимулированных клеток = 100%). Правая часть рисунка: статистическое обобщение 3 экспериментов с различными клеточными линиями и репрезентативный Вестерн-блот-анализ ингибирования цитокин-стимулированной экспрессии белка МО-синтазы (через 20 часов экспозиции) посредством предварительной инкубации со STAT-1 (SEQ ID NO: 33) и NF-кВ цис-элемент ловушкой соответственно ((*Р<0,05 против стимулированных клеток = 100%).
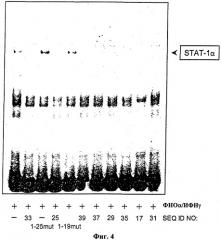
На Фиг.4 показана нейтрализация эндогенного STAT-1 в экстракте клеточных ядер линии моноцитов ТНР1 различными цис-элемент ловушками (SEQ ID NO: 17, 25, 29, 31, 33, 35, 37, 39 и мутантные контрольные олигонуклеотиды STAT-1-19mut и STAT-1-25mut). Репрезентативный анализ изменения электрофоретической подвижности (EMSA). Культивированные ТНР-1 клетки инкубировали 3 часа со 100 Е/мл фактора некроза опухоли-α и 1000 Е/мл интерферона-γ и далее использовали для приготовления экстракта ядер. Экстракт ядер клеток инкубировали вместе с двунитевым SIE-олигонуклеотидом, меченным [32Р] (Santa Cruz Biotechnologie, Heidelberg, Германия), и соответствующей цис-элемент ловушкой и контрольным олигонуклеотидом в течение 20 минут при комнатной температуре, и затем подвергали анализу изменения электрофоретической подвижности.
На Фиг.5 показан эффект выбранных STAT-1-цис-элемент ловушек (SEQ ID NO: 17, 31, 35, 37) на экспрессию мРНК Е-селектина и МСР-1 в клетках гладкой мускулатуры вены тимуса человека. Культивированные клетки (пассирование 2) предварительно инкубировали 4 часа с соответствующей цис-элемент-ловушкой и затем инкубировали 9 часов со 100 Е/мл фактора некроза опухоли-α и 1000 Е/мл интерферона-γ. Репрезентативный анализ ПЦР с обратной транскриптазой, сравнимые результаты были получены в дальнейших экспериментах.
На Фиг.6 схематически показана структура STAT-1-антисмыслового вектора экспрессии pCI/ STAT-1 AS в виде генетической карты.
На Фиг.7 показан результат нейтрализации STAT-1 в культивированных клетках эндотелия человека различными цис-элемент ловушками (SEQ ID NO: 17, 19, 27, 33 и 39). Репрезентативный анализ EMSA в дополнение к денситометрическому анализ («интенсивность»). Культивированные клетки эндотелия инкубировали 4 часа с олигонуклеотидами-ловушками (10 мкмоль/л) и затем стимулировали в течение 30 минут 100 Е/мл фактора некроза опухоли-α и 1000 Е/мл интерферона-γ. Для анализа EMSA использовали экстракты ядер стимулированных клеток и двунитевые SIE-олигонуклеотиды, меченные [32Р] (Santa Cruz Biotechnologie, Heidelberg, Германия).
На Фиг.8 показан гистологический анализ действия STAT-1 - олигонуклеотида-ловушки (STAT-1 конс, 10 нмоль, SEQ ID NO: 19), но не мутантного контрольного олигонуклеотида (STAT-1 mut, 10 нмоль, SEQ ID NO: 61), на DNCB-индуцированный контактный дерматит у самцов морской свинки (оригинал×400, типичный результат для в общей сложности 17 подопытных морских свинок).
Авторы изобретения охарактеризовали транскрипционные факторы, принимающие участие в опосредованном цитокинами усилении экспрессии провоспалительных генных продуктов (CD40, Е-селектина, индуцибельной изоформы NO-синтазы, интерлейкина-12[р40], МСР-1) в клетках эндотелия, клетках гладкой мускулатуры человека, а также в моноцитах. При этом показано, что при стимуляции культивированных клеток эндотелия ФНО-α или CD154 соответственно в комбинации с ИФН-γ имеет место синергизм между транскрипционными факторами: ядерным фактором кВ (NF-кВ) и переносчиком сигнала и активатором транскрипции-1 (STAT-1). То же самое соответственно справедливо и для культивированных клеток гладкой мускулатуры и моноцитов.
ИФН-γ сам по себе оказался способным усиливать экспрессию CD40 в клетках эндотелия человека, но не экспрессию Е-селектина или интерлейкина-12. Для экспрессии обоих этих генных продуктов, которые почти не экспрессируются в клетках эндотелия или экспрессируются неконститутивно, существенной является одновременная стимуляция клеток ФНО-α (для Е-селектина) и CD154 (для интерлейкина-12) соответственно. К тому же для опосредованного ИФН-γ усиления экспрессии CD40, но не Е-селектина, в клетках эндотелия и моноцитах необходима de novo экспрессия еще одного транскрипционного фактора - интерферон-регулирующего фактора-1 (IRF-1). В рамках этих исследований показано, что экспрессия белка IRF-1 при моностимуляции клеток ИФН-γ и в особенности ФНОα существенно слабее, чем в присутствии обоих цитокинов. Также при транскрипции гена IRF-1 транскрипционные факторы NF-кВ и STAT-1 действуют синергически (Ohmori et al., J. Biol. Chem., (1997), 272, 14899).
STAT-1 (номер регистрации в GenBank NM007315 и ХМ010893, а также http://transfac.gbf.de/cgi-bin/qt/getEntrv.pl?t0149 соответственно) принадлежит к группе транскрипционных факторов, содержащей по меньшей мере 6 членов. Продукт гена STAT-1 экспрессируется в большинстве клеток конститутивно, но, как правило, находится в цитоплазме в виде неактивного мономерного белка (91 кДа). Тирозин-фосфорилирование этой р91-субъединицы и последующее объединение (димеризация) двух таких р91-субъединиц (называемых STAT-1α) делает возможным транспорт теперь активного транскрипционного фактора в ядро клетки. Гетеродимеризация с р84-субъединицей STAT-1β (дифференциально сплайсированный продукт того же гена) также является возможной. Фосфорилирование конститутивно присутствующих субъединиц осуществляется посредством цитоплазматических Janus-киназ в зависимости от стимула. Так, обе Janus-киназы (Jak1 и Jak2) стимулируются ИФНα (лучше привлекаемый на рецептор интерферона); важнейший (пато)физиологический стимул для активации STAT-1 ИФНγ, напротив, стимулирует только Jak2. Также STAT-1 активируют различные факторы роста и пептидные гормоны (например ангиотензин II); кроме внутренних (фактор роста) рецептор-тирозинкиназ здесь также играет роль митоген-активируемая протеинкиназа (МАР-киназа). В противоположность STAT-1α STAT-1β не обладает трансактивирующей, то есть стимулирующей экспрессию генов активностью.
STAT-1 участвует в экспрессии ряда потенциальных провоспалительных генных продуктов в лейкоцитах, клетках эндотелия и клетках гладкой мускулатуры, где активация этого транскрипционного фак