Комбинированное применение полипептидов фактора vii и полипептидов фактора viii
Иллюстрации
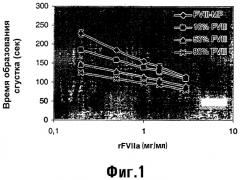
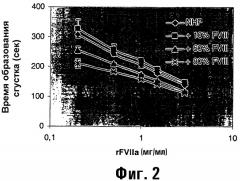
Показать всеИзобретение относится к области медицины, в частности к фармацевтическому препарату, содержащему фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид. Изобретение связано с применением фактора VII или родственного фактору VII полипептида и фактора VIII или родственного фактору VIII полипептида для производства лекарственного средства для фармацевтического применения, набора для лечения эпизодов кровотечения, а также со способами профилактики или лечения эпизодических кровотечений у субъекта. Изобретение позволяет уменьшить время свертывания FVIII-дефицитной плазмы. 16 н. и 27 з.п. ф-лы, 1 табл., 2 ил.
Реферат
ОБЛАСТЬ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Данное изобретение связано с фармацевтической композицией, содержащей препарат фактора VII или препарат полипептида, родственного фактору VII, и препарат фактора VIII или препарат полипептида, родственного фактору VIII. Изобретение связано также с набором компонентов для лечения эпизодов кровотечения, включающим в себя препарат фактора VII или препарат полипептида, родственного фактору VII, и препарат фактора VIII или препарат полипептида, родственного фактору VIII. Изобретение связано также с применением препарата фактора VII или препарата полипептида, родственного фактору VII, и препарата фактора VIII или препарата полипептида, родственного фактору VIII, для получения лекарственного средства. Кроме того, изобретение связано со способами лечения кровотечений, сокращения времени свертывания, усиления гемостаза, сокращения количества введений белка - фактора свертывания, необходимого для достижения остановки кровотечения (гемостаза), снижения количества вводимого белка - фактора свертывания, необходимого для достижения гемостаза, пролонгирования времени растворения тромба (фибринолиза), увеличения прочности кровяного сгустка и усиления образования фибринового сгустка.
ОСНОВА СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Фактор VII свертывания крови представляет собой плазменный фактор свертывания (FVII). Активированный фактор VII (FVIIa) инициирует нормальный процесс гемостаза путем образования комплекса с тканевым фактором (TF), экспонированным в результате повреждения сосудистой стенки, которая вслед за этим активирует факторы IX и X (FIX и FX), переводя их в их активированную форму, факторы IXa и Xa (FIXa и FXa). Фактор Xa конвертирует ограниченное количество протромбина в тромбин на поверхности клеток, несущих тканевый фактор. Тромбин активирует тромбоциты и факторы V и VIII в факторы Va и VIIIa (FVa и FVIIIa), оба из которых служат кофакторами в дальнейшем процессе, ведущем к полному выбросу тромбина (full thrombin burst). Этот процесс включает в себя выработку фактора Xa под действием фактора IXa (в комплексе с фактором VIIIa) и происходит на поверхности активированных тромбоцитов. Наконец, тромбин превращает фибриноген в фибрин, что приводит к образованию фибринового сгустка.
Фактор VII существует в плазме главным образом в виде одноцепочечного зимогена, который расщепляется под действием фактора Xa, превращаясь в свою двухцепочечную активированную форму, FVIIa. Рекомбинантный активированный фактор (rFVIIa) развивается в прогемостатический агент. Введение rFVIIa приводит к быстрому и высокоэффективному прогемостатическому ответу у больных гемофилией с кровотечениями, которых нельзя лечить продуктами факторов свертывания крови из-за процесса антителообразования. Также и больные с кровотечением, имеющие дефицит фактора VII, или больные, имеющие нормальную систему свертывания, но с повышенной кровоточивостью, могут эффективно подвергаться лечению с помощью фактора FVIIa. В этих исследованиях не было обнаружено никаких нежелательных побочных эффектов rFVIIa (в частности, возникновения тромбоэмболии).
Фактор VIII свертывания крови представляет собой гликопротеин (М.в. 330000), который циркулирует в крови. Он секретируется печенью и эндотелием и секретируется в плазму, где и циркулирует в виде комплекса с фактором фон Виллебранда. Фактор VIII функционирует в качестве кофактора в процессе свертывания крови, где он ускоряет превращение фактора X в фактор Xa в присутствии фактора IXa, кальция и фосфолипида. Несмотря на то что он синтезируется в виде одноцепочечной полипептидной цепи, в плазме он циркулирует в основном в виде двухцепочечной молекулы. Активация FVIII в активный кофактор требует дополнительного протеолиза под действием тромбина или какой-нибудь другой протеиназы. Снижение количества или активности фактора VIII в кровяном русле приводит к развитию гемофилии А. Уровень снижения активности фактора VIII прямо пропорционален тяжести заболевания. Традиционное лечение гемофилии А состоит в замещении недостающего белка полученным из плазмы или рекомбинантным фактором VIII (так называемое FVIII-замещение, или заместительное лечение или терапия).
Дефицит фактора свертывания (например, дефицит FVIII) отражает генные дефекты различных типов. В тех случаях когда имеются тяжелые генетические повреждения, такие как делеции или сдвиг рамки считывания, мРНК не продуцируется и в результате возникает (тяжелый) дефицит. Менее тяжелые формы генетических повреждений, например некритичным образом локализованные точковые мутации, приводят к секреции белка с пониженной биологической активностью. Ненаследуемый вариант носит рецессивный и X-сцепленный характер, означающий то, что он поражает только мужчин, у которых имеется только одна X-хромосома. Степень тяжести дефекта свертывания может носить слабый или выраженный характер. Степень тяжести зависит от концентрации нормально функционирующего фактора VIII в плазме. Целью заместительной терапии является повышение уровня активности фактора свертывания у больного (здесь и далее называемого "уровень фактора") до тех пор, пока не будет приблизительно восстановлен гемостаз, и затем поддержание этого уровня до окончания лечения, когда настанет выздоровление. Если начало эффективного лечения задерживается, заживление раны может оказаться замедленным, и тогда потребуется лечение, более интенсивное, чем обычно. Длительность и интенсивность лечения зависит от концентрации фактора свертывания в плазме, необходимой для гемостаза, для его восстановления в крови и времени полужизни материала трансфузии.
Уровень фактора VIII также может быть более или менее пониженным у некоторых индивидуумов (например, у женщин-носителей заболевания), которые являются гетерозиготными в отношении этого генного дефекта. Такие субъекты могут иметь повышенную тенденцию к кровотечениям по сравнению с таковой у больных, в умеренной степени пораженных гемофилией и могут быть подвергнуты соответствующему лечению.
У некоторых больных, получающих заместительную терапию в отношении фактора VIII (пораженных гемофилией А), наблюдается образование антител против вводимого фактора VIII. Однако у больных, родившихся с нормальным уровнем фактора VIII (которые не имеют врожденного дефицита фактора VIII), может по неизвестным причинам в более позднем возрасте развиться процесс образования аутоантител против фактора VIII (приобретенная гемофилия А). В обоих случаях антитела могут быть представлены в малом, умеренном или большом количестве. В случае когда у больных имеется низкий или средний титр ингибиторов (т.е. антител), их иногда можно лечить фактором VIII.
Проявляемая гемофилия может иметь самую разную степень тяжести. Больной, у которого фактор VIII не определяется или его уровень составляет менее 1%, обычно считается тяжелым больным с выраженными поражениями, у которого при малейшей травме, а иногда и случайно могут возникать кровотечения в ткани мышц и суставов. Небольшое количество фактора VIII дает значительную защиту, так что больные, имеющие уровень фактора VIII, составляющий 1-5% от нормального, обычно страдают только посттравматическим кровотечением и менее тяжелым кровотечением в ткани мышц и суставов и т.д. и зачастую считаются больными, пораженными средней степенью заболевания. Больные, у которых уровень фактора VIII составляет более 5%, обычно подвержены кровотечениям в случаях значительной травмы или хирургических вмешательств, и такие больные обычно считаются больными, пораженными в умеренной степени. Следует отметить, что эта классификация применима не во всех случаях. Некоторые больные с очень низкими показателями уровня фактора VIII в редких случаях подвержены кровотечениям, тогда как другие, у которых уровень фактора VIII составляет даже выше 5%, могут повторно подвергаться кровотечению в «ткани-мишени», исходно поврежденные в результате травматического гемартроза, и у таких больных заболевание считается "тяжело" выраженным. Однако обычно симптомы кровотечения менее выражены при более высоких уровнях этого фактора в крови, так что аномальные кровотечения обычно не происходят, когда уровень фактора VIII составляет порядка 35-40% нормальных уровней и выше. Обычная корреляция между содержанием этого фактора и симптомами гемофилии А показана ниже.
| Степень тяжести гемофилии в зависимости от фактора VIII: | ||
| Степень тяжести | Уровень фактора (% от нормального уровня) | Проявления |
| Тяжелая | 0-1 | Кажущиеся спонтанными кровотечения. Тяжелоекровотечение. |
| Средняя | 1-5 | Несколько кровоподтеков. Гемартроз, в основном травматического характера. |
| Слабая | 5-30 | Кровотечение посттравматического, постхирургического,постдентального происхождения. Несколько эпизодов. |
Обычно проводимое лечение гемофилии А состоит в заместительном восстановлении недостающего белка полученным из плазмы или рекомбинантным фактором VIII. Продукты фактора VIII используются для внутривенной инфузии (или инъекции) в случае необходимости для лечения острых кровотечений. Разные типы кровотечений делятся на следующие категории:
1. Гемартроз (кровотечение в суставах)
2. Кровотечения, представляющие угрозу жизни и конечности (кровотечения в забрюшинном пространстве, кровотечения в ЦНС, кровотечения в заглоточном пространстве, мышечные кровотечения с компартментным синдромом и массивные кровотечения желудочно-кишечного тракта)
3. Предупреждение кровотечения в связи с оперативным вмешательством (ортопедия, отдельные процедуры, хирургия в связи с несчастным случаем).
Опыт показывает, что если до завершения процесса заживления содержание фактора VIII устанавливается на уровне 30-40% от его нормального уровня, обычно поддерживается нормальный гемостаз. Однако большое значение имеют также и другие факторы. Перемещение поврежденных частей, как при гемартрозе, кашель или вставание с постели и передвижения больного после абдоминальной хирургии могут вызвать кровотечения. Физиотерапия или иное воздействие могут потребовать более высоких уровней, тогда как иммобилизация слабых повреждений может контролироваться относительно низкими уровнями этого фактора. Приблизительные уровни этого фактора в случае конкретных органов-мишеней в той или иной ситуации показаны ниже:
Лечение стандартного гемартроза (категория 1):
Обычно целью является достижение исходной концентрации фактора VIII в плазме крови на уровне по меньшей мере 30-40% от нормального уровня, а затем, в течение последующих 2-3 дней, поддержание на уровне по меньшей мере 10-20% от нормального уровня.
Лечение кровотечений, представляющих опасность для жизни и для конечности (категория 2):
Обычно целью является достижение начальной концентрации фактора VIII в плазме крови на уровне по меньшей мере 50%, а затем, в течение последующей одной недели, на уровне по меньшей мере 20%.
Предупреждение кровотечения в связи с оперативным вмешательством (категория 3):
Обычно целью является достижение концентрации фактора VIII в плазме крови на день оперативного вмешательства на уровне по меньшей мере 60-100%, затем, в течение последующих 2-7 дней, на уровне по меньшей мере 30-40%, а потом, в течение одной-двух недель, на уровне по меньшей мере 10-20%.
Если при лечении следовать приведенным выше указаниям, по поводу количества инъекций фактора VIII в связи с указанными типами кровотечений можно сказать следующее.
С учетом того, что средний период полужизни фактора VIII в плазме составляет от 10 до 12 часов, обычно в клинической практике используют в среднем следующее количество инъекций фактора VIII, сопровождающих каждый эпизод кровотечения:
Гемартроз (кровотечение в суставах): Домашнее лечение, незначительный гемартроз: 1-3 инъекции; лечение в стационаре, более обширный гемартроз: 6-14 инъекций.
Кровотечения, представляющие угрозу для жизни и конечности: 10-20 инъекций.
Предупреждение кровотечения в связи с оперативным вмешательством: 30-40 инъекций.
В настоящее время при лечении гемофилии в клинических условиях используют фактор VIIa для остановки кровотечений у больных, у которых присутствуют ингибиторы факторов VIII или IX (которые препятствуют заместительной терапии). Однако обычно клиницисты не склонны использовать фактор VIIa в качестве основного лечения в случаях больных гемофилией без ингибиторов (где могут быть использованы соответственно факторы VIII или IX), поскольку предполагается, что короткое время полужизни фактора VIIa по сравнению с таковым фактора VIII (2,5 часа по сравнению с 10-12 часами) потребует более частых инъекций фактора VIIa для поддержания определенного уровня гемостаза.
Европейский Патент No. 225160 (Novo Nordisk) относится к композициям фактора VIIa и способам лечения связанных с кровотечениями заболеваний, причиной которых не являются дефекты факторов свертывания или ингибиторы факторов свертывания крови.
Европейский Патент No. 82182 (Baxter Travenol Lab.) относится к композиции фактора VIIa, применяющейся для того, чтобы вызвать у больного противодействие дефицитам или эффектам ингибиторов факторов свертывания крови.
Публикация Lusher et al., Haemophilia, 1998, 4, pp. 790-798, связана с введением рекомбинантного фактора VIIa при лечении суставной, мышечной геморрагии и геморрагии слизистой у больных с гемофилией A и B, у которых имеются или не имеются ингибиторы.
Публикация Kjalke et al., Thrombosis and Haemostasis, 1999 (Suppl), 095 1, связана с введением экстра-экзогенного фактора VIIa и эффектом образования тромбина на поверхности активированных тромбоцитов на модельной системе, имитирующей условия гемофилий A или B.
Патент США No. 5891843 (Immuno) относится к композиции фактора VIIa в комбинации со вторым ингредиентом, имеющим FEIB-активность, например, активированным протромбиновым комплексом или препаратом FEIBA.
На сегодняшний день многие продукты фактора VIII, используемые при лечении гемофилии, содержат полученный рекомбинантным путем фактор VIII. Однако эти продукты могут быть также выделены из плазмы крови свиньи или человека. Эти очищенные продукты зачастую содержат меньшие количества других факторов свертывания или других компонентов из плазмы крови. Обычно такие добавочные компоненты плазмы нежелательны (потому что возникает риск внесения вирусной инфекции или других загрязнений), и замещение части таких продуктов рекомбинантным белком (например, фактором VIIa) расценивается как улучшение свойств композиции и лечения и как преимущество для больного.
На сегодняшний день у субъектов, имеющих пониженный уровень фактора VIII (например, у больных гемофилией А) и переживших эпизодические кровотечения, остановить кровотечение удается обычно только после лечения в виде нескольких инъекций или инфузий фактора VIII. Более того, необходимо определенное количество инъекций для поддержания гемостаза до тех пор, пока повреждение, вызвавшее кровотечение, полностью заживет.
Жертвы травм, которые страдают от избыточных кровотечений, обычно лечат большими объемами инфузируемых жидкостей, таких как жидкости для внутривенного введения, инфузируемые путем инъекции коллоидные продукты, альбумин, концентраты красных кровяных клеток и т.д. Обширные кровотечения, требующие массивных трансфузий крови, могут приводить к развитию недостаточности многих органов, включая ослабление функций легких и почек.
Более быстрая остановка кровотечения у таких субъектов могла бы создать очень большое преимущество. Таким образом, следовало бы сократить количество инъекций, необходимых для остановки кровотечения и поддержания гемостаза, и/или сократить количество свертывающего белка, используемого для остановки кровотечения и поддержания гемостаза.
По-прежнему существует необходимость в улучшенной терапии субъектов, переживших эпизодические кровотечения, включая субъектов, у которых случаи кровотечения связаны с пониженным уровнем фактора VIII свертывания крови. Остается также необходимость в улучшенных, надежных и широко применимых способах повышения свертывания, усиления или обеспечения формирования стабильных гемостатических сгустков, в повышении удобства применяемого способа лечения для пациентов или достижения полного или удовлетворительного гемостаза у больных, в частности у субъектов, у которых ослаблена выработка тромбина. Существует потребность в способах, позволяющих уменьшить количество фактора VIIa или количество фактора VIII, необходимое для достижения полного или удовлетворительного гемостаза. Существует также потребность в способах, позволяющих снизить общее количество белка - фактора свертывания, необходимого для достижения полного или удовлетворительного гемостаза, и в способах, дающих возможность укоротить период, необходимый для остановки кровотечения.
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
Одним объектом согласно изобретению является обеспечение композиций, которые могут эффективно быть использованы в лечении или профилактике случаев кровотечения или болезней свертывания.
Вторым объектом согласно изобретению является обеспечение композиций единичной дозированной лекарственной формы, которые могут эффективно быть использованы в лечении или профилактике случаев кровотечения или в качестве прокоагулянта. Другим объектом согласно изобретению является обеспечение композиций, способов лечения или наборов, оказывающих синергическое действие.
Другим объектом согласно изобретению является обеспечение композиций, способов лечения или наборов, не вызывающих существенных побочных эффектов, таких как высокий уровень системной активации системы свертывания крови.
Другие объекты согласно изобретению станут очевидны в процессе ознакомления с настоящим описанием.
В первом аспекте данное изобретение связано с фармацевтической композицией, содержащей препарат фактора VII или родственного фактору VII полипептида, и с получением фактора VIII или родственного фактору VIII полипептида.
Во втором аспекте данное изобретение относится к набору компонентов для лечения случаев кровотечения, включающему в себя: a) эффективное количество препарата фактора VII или родственного фактору VII полипептида и фармацевтически приемлемый носитель в первой единичной дозированной лекарственной форме; b) эффективное количество препарата фактора VIII или родственного фактору VIII полипептида и фармацевтически приемлемый носитель во второй единичной дозированной лекарственной форме; и c) контейнер для содержания указанных первой и второй лекарственных форм.
В другом аспекте данное изобретение относится к применению препарата фактора VII или родственного фактору VII полипептида в комбинации с препаратом фактора VIII или родственного фактору VIII полипептида для производства лекарственного средства для лечения у больного случаев кровотечения.
В другом аспекте данное изобретение относится к применению препарата фактора VII или родственного фактору VII полипептида в комбинации с препаратом фактора VIII или родственного фактору VIII полипептида для производства лекарственного средства для уменьшения времени образования сгустка.
В другом аспекте данное изобретение относится к применению препарата фактора VII или родственного фактору VII полипептида в комбинации с препаратом фактора VIII или родственного фактору VIII полипептида для производства лекарственного средства для увеличения времени фибринолиза (времени растворения тромба).
В другом аспекте данное изобретение относится к применению препарата фактора VII или родственного фактору VII полипептида в комбинации с препаратом фактора VIII или родственного фактору VIII полипептида для производства лекарственного средства для увеличения прочности сгустка.
В другом аспекте данное изобретение относится к способу лечения эпизодического кровотечения у субъекта, включающему в себя введение субъекту в случае необходимости первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора VIII или родственного фактору VIII полипептида, где первое и второе количество вместе являются эффективными для лечения кровотечений.
В другом аспекте данное изобретение относится к способу снижения времени образования сгустка у субъекта, включающему в себя введение субъекту в случае необходимости первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора VIII или родственного фактору VIII полипептида, где первое и второе количество вместе являются эффективными для уменьшения времени образования сгустка.
В другом аспекте данное изобретение относится к способу усиления гемостаза у субъекта, включающему в себя введение субъекту в случае необходимости первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора VIII или родственного фактору VIII полипептида, где первое и второе количество вместе являются эффективными для усиления гемостаза.
В другом аспекте данное изобретение относится к способу уменьшения числа введений белка - фактора свертывания крови, необходимого для остановки кровотечения и установления гемостаза у субъекта, включающему в себя введение субъекту в случае необходимости первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора VIII или родственного фактору VIII полипептида, где первое и второе количество вместе являются эффективными для остановки кровотечения и установления гемостаза.
В другом аспекте данное изобретение относится к способу снижения количества вводимого белка - фактора свертывания крови, необходимого для остановки кровотечения и установления гемостаза у субъекта, включающему в себя введение субъекту в случае необходимости первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора VIII или родственного фактору VIII полипептида, где первое и второе количество вместе являются эффективными для остановки кровотечения и установления гемостаза.
В другом аспекте данное изобретение относится к способу увеличения времени фибринолиза (времени растворения сгустка) у субъекта, включающему в себя введение субъекту в случае необходимости первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора VIII или родственного фактору VIII полипептида, где первое и второе количество вместе являются эффективными для увеличения времени фибринолиза.
В другом аспекте данное изобретение относится к способу увеличения прочности сгустка у субъекта, включающему в себя введение субъекту в случае необходимости первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора VIII или родственного фактору VIII полипептида, где первое и второе количество вместе являются эффективными для увеличения прочности сгустка.
В другом аспекте данное изобретение относится к способу усиления формирования фибринового сгустка у субъекта, включающему в себя введение субъекту в случае необходимости первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора VIII или родственного фактору VIII полипептида, где первое и второе количество вместе являются эффективными для усиления формирования фибринового сгустка.
В другом аспекте данное изобретение относится к набору компонентов для лечения случаев кровотечения, включающему в себя: a) эффективное количество препарата фактора VII или родственного фактору VII полипептида и эффективное количество препарата фактора VIII или родственного фактору VIII полипептида и фармацевтически приемлемый носитель в единичной дозированной лекарственной форме; и b) контейнер для содержания указанной единичной дозированной лекарственной формы.
В одной серии аспектов согласно изобретению фактор VII или родственный фактору VII полипептид представляет собой родственный фактору VII полипептид. В другом аспекте фактор VII или родственный фактору VII полипептид представляет собой полипептид фактора VII. В одной серии аспектов согласно изобретению указанный родственный фактору VII полипептид представляет собой вариант аминокислотной последовательности фактора VII. В одном аспекте соотношение между активностью родственного фактору VII полипептида и активностью нативного человеческого фактора VIIa (фактор VIIa дикого типа) составляет по меньшей мере приблизительно 1,25 при тестировании методом "гидролиза in vitro", как описано в материалах настоящей заявки.
В одной серии воплощений согласно изобретению фактор VII или родственный фактору VII полипептид представляет собой полипептид фактора VII. В одном из аспектов фактор VII представляет собой человеческий фактор VII. В одном из аспектов фактор VII представляет собой фактор VII быка, свиньи, собаки, лошади, мыши или лосося. В другом аспекте полипептид фактора VII представляет собой рекомбинантный фактор VII. В другом аспекте полипептид фактора VII представляет собой полученный из плазмы фактор VII. В другом аспекте полипептид фактора VII представляет собой полученный из плазмы фактор VII человека. В другом аспекте полипептид фактора VII представляет собой рекомбинантный фактор VII человека. В одной серии аспектов согласно изобретению фактор VII или родственный фактору VII полипептид представлен в своей активированной форме. В другом аспекте согласно изобретению полипептид фактора VII представляет собой рекомбинантный фактор VIIa человека.
В одной серии воплощений согласно изобретению фактор VIII или родственный фактору VIII полипептид представляет собой родственный фактору VIII полипептид. В одном из аспектов родственный фактору VIII полипептид представляет собой вариант аминокислотной последовательности фактора VIII. В одном аспекте соотношение между активностью родственного фактору VIII полипептида и активностью нативного человеческого фактора VIII (фактор VIII дикого типа) составляет по меньшей мере приблизительно 1,25 при тестировании методом "хромоникелевого анализа", как описано в материалах настоящей заявки. В одном аспекте фактор VIII или родственный фактору VIII полипептид представляет собой полипептид фактора VIII. В одном из аспектов фактор VIII представляет собой фактор VIII человека. В одном из аспектов фактор VIII представляет собой фактор VIII быка, свиньи, собаки, лошади, мыши или лосося. В другом аспекте полипептид фактора VIII представляет собой рекомбинантный фактор VIII. В другом аспекте полипептид фактора VIII представляет собой полученный из плазмы полипептид фактора VIII. В другом аспекте полипептид фактора VIII представляет собой полученный из плазмы полипептид человеческого фактора VIII. В другом аспекте полипептид фактора VIII представляет собой рекомбинантный человеческий фактор VIII. В одной серии аспектов согласно изобретению фактор VIII или родственный фактору VIII полипептид представлен в своей активированной форме. В одном воплощении родственный фактору VIII полипептид представляет собой фрагмент фактора VIII. В одном воплощении родственный фактору VIII полипептид представляет собой гибрид полипептида фактора VIII свиньи/человека.
В одном воплощении фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид представлены в массовом соотношении приблизительно между 100:1 и приблизительно 1:100 фактора VII к фактору VIII.
В одном воплощении родственные фактору VII полипептиды представляют собой варианты аминокислотной последовательности, содержащей не более 20 аминокислотных замен, делеций или инсерций по сравнению с фактором VII дикого типа (т.е. полипептида, описанного в патенте США No. 4784950). В другом аспекте варианты фактора VIIa содержат не более 15 аминокислотных замен, делеций или инсерций; в другом аспекте варианты фактора VII содержат не более 10 аминокислотных замен, делеций или инсерций; в другом аспекте варианты фактора VII содержат не более 8 аминокислотных замен, делеций или инсерций; в другом аспекте варианты фактора VII содержат не более 6 аминокислотных замен, делеций или инсерций; в другом аспекте варианты фактора VII содержат не более 5 аминокислотных замен, делеций или инсерций; в другом аспекте варианты фактора VII содержат не более 3 аминокислотные замены, делеции или инсерции по сравнению с фактором VII дикого типа. В одном из аспектов варианты фактора VII выбраны из списка L305V-FVIIa, L305V/M306D/D309S-FVIIa, L305I-FVIIa, L305T-FVIIa, F374P-FVIIa, V158T/M298Q-FVIIa, V158D/E296V/M298Q-FVIIa, K337A-FVIIa, M298Q-FVIIa, V158D/M298Q-FVIIa, L305V/K337A-FVIIa, V158D/E296V/M298Q/L305V-FVIIa, V158D/E296V/M298Q/K337A-FVIIa, V158D/E296V/M298Q/L305V/K337A-FVIIa, K157A-FVII, E296V-FVII, E296V/M298Q-FVII, V158D/E296V-FVII, V158D/M298K-FVII и S336G-FVII.
В следующем аспекте полипептиды фактора VII или родственные фактору VII полипептиды имеют повышенную независимую от тканевого фактора активность по сравнению с нативным человеческим фактором VIIa свертывания крови. В следующем аспекте повышенная активность не сопровождалась изменениями в субстратной специфичности. В другом аспекте согласно изобретению связывание фактора VII или родственных фактору VII полипептидов с тканевым фактором не должно быть ослабленным и фактор VII или родственные фактору VII полипептиды должны иметь по меньшей мере активность фактора VIIa дикого типа при связывании с тканевым фактором.
В одном предпочтительном воплощении фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид представляет собой рекомбинантный человеческий фактор VIIa и рекомбинантный человеческий фактор VIII.
В одном воплощении сокращается время образования сгустка в крови млекопитающего. В другом воплощении в крови млекопитающего усиливается гемостаз. В другом воплощении в крови млекопитающего удлиняется время фибринолиза. В другом воплощении увеличивается прочность сгустка в крови млекопитающего. В другом воплощении усиливается образование фибринового сгустка в крови млекопитающего. В одном воплощении кровь млекопитающего является кровью человека. В другом воплощении кровь млекопитающего является нормальной кровью; в другом воплощении кровь млекопитающего является кровью, имеющей нормальный уровень белков-факторов свертывания; в другом воплощении кровь млекопитающего является кровью, имеющей нормальный уровень фактора VIII; в другом воплощении кровь является нормальной кровью человека; в одном воплощении кровью является кровь, полученная у субъекта, имеющего нарушенную выработку тромбина. В одном воплощении кровью является кровь, полученная у субъекта, имеющего дефицит одного или более факторов свертывания; в другом воплощении кровь является кровью, полученной у субъекта, у которого имеются ингибиторы против одного или более факторов свертывания. В одном воплощении кровь является кровью, полученной у субъекта, у которого понижена концентрация фибриногена. В одном воплощении кровь является кровью человека с дефицитом фактора VIII.
В одном из воплощений настоящего изобретения фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид являются единственно используемыми гемостатическими агентами. В другом воплощении фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид являются единственно используемыми активными гемостатическими агентами. В другом воплощении фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид являются единственно используемыми факторами свертывания. В одном воплощении данного изобретения фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид являются единственно используемыми активными агентами. Здесь употребление "единственно" по отношению к агентам или факторам относится к ситуациям, при которых фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид, взятые вместе, являются единственно используемыми гемостатическими агентами, активными гемостатическими агентами или факторами свертывания, содержащимися в фармацевтической композиции или наборе, или являются единственными гемостатическими агентами, активными гемостатическими агентами или факторами свертывания, вводимыми пациенту в процессе особого курса лечения, такого, например, как в процессе лечения эпизодического кровотечения. Само собой разумеется, что такие ситуации входят в число случаев, при которых другие применимые гемостатические агенты или факторы свертывания не представлены либо в достаточном количестве, либо с достаточной активностью, так чтобы значительно повлиять на один или более параметров свертывания.
В другом воплощении фармацевтическая композиция составлена для внутривенного введения. В одном воплощении данного изобретения композиция дополнительно содержит фармацевтически приемлемый эксципиент.
В одном воплощении данного изобретения композиция представлена в виде единой лекарственной дозы, где единая лекарственная доза содержит оба фактора свертывания. В одном воплощении данного изобретения композиция представлена в виде набора частей (компонентов) содержащего препарат фактора VII или родственного фактору VII полипептида в качестве первой единичной дозированной лекарственной формы и препарат фактора VIII или родственного фактору VIII полипептида в качестве второй единичной дозированной лекарственной формы и содержащего контейнер, в который помещены указанные первая и вторая единичные дозированные лекарственные формы. В одном воплощении применимые композиция или набор дополнительно содержат инструкции по применению композиции или соответственно отдельных компонентов.
В одном воплощении данного изобретения фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид вводятся в виде единой дозированной лекарственной формы. В одном воплощении данного изобретения фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид вводятся в виде первой единой дозированной лекарственной формы, содержащей препарат фактора VII или родственного фактору VII полипептида, и второй единой дозированной лекарственной формы, содержащей препарат фактора VIII или родственного фактору VIII полипептида.
В одном воплощении данного изобретения фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид вводятся одновременно. В другом воплощении фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид вводятся последовательно. В одном воплощении фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид вводятся друг за другом с интервалом не более чем в 15 минут, предпочтительно - 10, более предпочтительно - 5, более предпочтительно - 2 минуты. В одном воплощении данного изобретения фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид вводятся один за другим с интервалом вплоть до 2 часов, предпочтительно - от 1 до 2 часов, более предпочтительно - вплоть до 1 часа, более предпочтительно - от 30 минут до 1 часа, более предпочтительно - вплоть до 30 минут, более предпочтительно - от 15 до 30 минут.
В одном воплощении эффективное количество фактора VII или родственного фактору VII полипептида составляет количество приблизительно от 0,05 мг/день приблизительно до 500 мг/день (для субъекта весом в 70 килограммов). В одном воплощении эффективное количество препарата фактора VIII или родственного фактору VIII полипептида составляет приблизительно от 0,01 мг/день приблизительно до 500 мг/день (для субъекта весом в 70 килограммов).
В одном воплощении фактор VII или родственный фактору VII полипептид и фактор VIII или родственный фактору VIII полипептид представлены в массовом соотношении приблизительно между 100:1 и приблизительно 1:100 фактора VII к фактору VIII.
В одном воплощении настоящего изобретения фармацевтическая композиция представлена в единой дозированной лекарственной форме и состоит в основном из препарата фактора VII или родственного фактору VII полипептида и препарата фактора VIII или родственного фактору VIII полипептида и одного или более компонентов, выбранных из списка фармацевтически приемлемых эксципиентов или носителей,