Пэгилированный интерферон для борьбы с вирусной инфекцией
Иллюстрации
Показать всеИзобретение относится к области медицины и касается нового пэгилированного интерферона для борьбы с вирусной инфекцией. Изобретение относится к пэгилированному интерферону формулы СН3ОСН2СН2(ОСН2СН2)2-O-SO2СН2-белок, где белок представляет собой интерферон, а n имеет такие значения, что средняя молекулярная масса звеньев полиэтиленгликоля составляет от приблизительно 13000 Да до приблизительно 17000 Да, более длительно сохраняющего антивирусную активность. Также изобретение относится к фармацевтической композиции, содержащей заявляемый пэгилированный интерферон и терапевтически инертный носитель, и к способу борьбы с вирусной инфекцией, включающему введение в организм заявляемого пэгилированного интерферона в эффективном количестве. 3 н. и 3 з.п. ф-лы, 1 ил., 1 табл.
Реферат
Изобретение относится к новому ПЭГ-производному интерферона, который может быть использован в медицине, например, при лечении вирусных заболеваний.
Лечение нативными препаратами пептидной структуры имеет ряд существенных недостатков: белки быстро гидролизуются в гастроинтестинальном отделе пищеварительного тракта и поэтому используются, как правило, парентерально. Относительно короткий период полураспада таких препаратов в организме пациента препятствует достижению их максимального терапевтического воздействия и предусматривает их многократное использование. Еще одним важным негативным фактором, ограничивающим применение нативных или рекомбинантных белковых препаратов, является их высокая иммуногенность и связанные с ней сенситивные реакции. Принципиальное изменение структуры их молекулы либо нивелирует их биологические свойства, либо влечет за собой увеличение побочных эффектов, связанных с их применением. Одним из путей повышения эффективности лекарственных препаратов белковой структуры является химическая модификация их молекулы, состоящая не в собственно изменении их структуры, а в физико-химической трансформации, достигаемой соединением нативной молекулы с полиэтиленгликолем (ПЭГ). Данный процесс получил название «пегилирование». Подобная химическая модификация фармакологических препаратов пептидной структуры направлена на улучшение их переносимости, снижение иммуногенности, повышение периода их полужизни и, как следствие всего перечисленного, на значительное увеличение эффективности лечения и повышение качества жизни в процессе его проведения.
ПЭГ в качестве потенциального объекта - модификатора веществ пептидной структуры привлек внимание исследователей еще в начале 1970 годов. Молекулы ПЭГ - это водорастворимые полимеры окиси этилена с двумя терминальными гидроксильными группами. Молекулярный вес молекул ПЭГ может колебаться в пределах 300-4000 Дальтон, а выстроенные в цепи макромолекулы ПЭГ могут формировать как разветвленную, так и линейную стереохимию. Именно масса ПЭГ и его стереохимическая структура, как правило, определяют свойства модифицированного пептидного субстрата.
Гидрофильность модифицированных ПЭГ-молекул формирует принципиально новые физико-химические свойства измененного пептида. Высокое содержание атомов водорода даже в одной молекуле ПЭГ позволяет ей связываться с 2-3 молекулами воды. Подобный эффект влечет за собой формирование «водного облака» вокруг модифицированной молекулы «ПЭГ-белок». Этот своеобразный «щит» воды вокруг модифицированной молекулы с одной стороны значительно повышает растворимость и биодоступность препарата, с другой - защищает молекулу от других белков (нейтрализующие антитела, комплемент). Таким образом ПЭГ-модифицированные пептиды значительно более защищены от опсонизации и активного фаго- и эндоцитоза клеточных структур макроорганизма.
Изменения фармакокинетических и фармакодинамических свойств ПЭГ-модифицированных пептидов зависят от массы молекулы ПЭГ, специфических мест связи с белком, строения молекулы модифицирующего агента.
Интерфероны - это группа биологически активных белков или гликопротеидов, синтезируемых клеткой в процессе защитной реакции на чужеродные агенты - вирусную инфекцию, антигенное или митогенное воздействие. ИФН не обладают специфичностью в отношении вирусов и действуют угнетающе на репродукцию различных вирусов. Важны также другие эффекты ИФН, интерес к ним обусловлен высокой эффективностью применения препаратов интерферона при таких патологических состояниях, как и онкологические заболевания, болезни крови, а также неуклонным ростом числа больных, страдающих вышеперечисленными заболеваниями.
Пегилированный интерферон представляет собой конъюгат молекулы интерферона и ковалентно прикрепленного к ней участка молекулы полиэтиленгликоля, который защищает молекулу интерферона от ферментного разрушения и обеспечивает препарату ряд других преимуществ.
Известны, в частности, пэгилированные производные интерферона, полученные присоединением молекулы разветвленного полиэтиленгликоля к интерферону альфа-2а (Патент РФ №2180595, 20.03.2002). Эти пэгилированные производные характеризуются более продолжительным временем полужизни в сыворотке крови по сравнению с немодифицированным интерфероном. Поэтому даже после однократного подкожного введения дозы в течение недели в сыворотке крови сохраняются оптимальные терапевтические концентрации вещества и обеспечивается противовирусная активность, что позволяет применять препарат один раз в неделю.
Наиболее близким аналогом заявленного изобретения является заявка WO 9004606, где раскрывается использование трезиловых производных ПЭГ для получения пегилированных белков.
Задачей, на решение которой направлено настоящее изобретение, является разработка полиэтиленгликольного производного - модифицирующего агента, пригодного для конъюгирования с интерфероном, обладающего повышенной терапевтической активностью по сравнению с известными аналогами. В ходе проведенных экспериментов было неожиданно обнаружено, что такое пэгилированное производное интерферона обладает значительно более высоким процентом сохранения антивирусной активности по сравнению с известными аналогами. Данное свойство позволит повысить эффективность проводимой терапии.
ПЭГ-производные интерферона согласно настоящему изобретению представляют собой конъюгат интерферона и производного полиэтиленгликоля формулы
СН3ОСН2СН2(ОСН2СН2)n-O-SO2СН2-белок,
где белок представляет собой интерферон, а n имеет такие значения, что средняя молекулярная масса звеньев полиэтиленгликоля составляет от приблизительно 13000 Да до приблизительно 17000 Да.
Предпочтительным вариантом является конъюгат, в котором n=400, a молекулярная масса звеньев полиэтиленгликоля составляет приблизительно 15000 Да. Конъюгированным белком может являться интерферон, в частности α-IFN, и в более предпочтительном варианте - α-2b IFN (Соединение 1). Изобретение также относится к фармацевтической композиции, обладающей противовирусной активностью, содержащей указанный конъюгат и терапевтически инертный носитель; и к способу борьбы с вирусной инфекцией, включающему введение в организм ПЭГ-конъюгата интерферона.
Пример 1. Получение ПЭГ-производных.
Вначале получают полиэтиленоксид многостадийным или одностадийным синтезом. В качестве стартового вещества использовали олигоэтиленоксид с молекулярной массой 250 (средняя степень полимеризации 4,5), полученный при взаимодействии окиси этилена с метилатом натрия. При одностадийном синтезе к 100 г стартового вещества постепенно в течение 12 дней при повышении температуры от 120 до 170°С под давлением 4-5 атм добавляли 2500 г окиси этилена.
Многостадийный синтез проводят следующим образом.
1 стадия. К 100 г стартового вещества добавляют 700 г окиси этилена. Реакцию проводят в стальном реакторе с мешалкой в атмосфере азота под давлением 4 атм при температуре 120°С в течение 8 часов.
2 стадия. К 100 г продукта, полученного на стадии 1, добавляют 700 г окиси этилена. Реакцию проводят в тех же условиях в течение 9 часов.
3 стадия. К 170 г продукта, полученного на стадии 2, добавляют 330 г окиси этилена. Реакцию проводят при температуре 140°С в течение 9 часов.
4 стадия. К 200 г продукта, полученного на стадии 3, добавляют 330 г окиси этилена. Реакцию проводят при температуре 140°С в течение 9 часов.
5 стадия. К 400 г продукта, полученного на стадии 4, добавляют 120 г окиси этилена. Реакцию проводят при температуре 160°С в течение 9 часов.
6 стадия. К 210 г продукта, полученного на стадии 5, добавляют 340 г окиси этилена. Реакцию проводят при температуре 170°С в течение 9 часов.
Синтез линейных полиэтиленоксидов с концевыми трезилатными группами осуществляли в 15% растворе перегнанного над P2O5 безводного 1,2-дихлорэтана. Растворы синтезированных ранее полиэтиленоксидов с концевыми спиртовыми группами обрабатывали хлористым трезилом в присутствии триэтиламина:
СН3О(СН2-СН2-O)хNa+ClSO2СН2CF3→СН3О(CH2-CH2-O)-SO2СН2CF3+NaCl
Реакцию проводили в стеклянной трехгорлой колбе с мешалкой в атмосфере аргона при 20°С в течение 0,5 часов и полученный продукт высаживали в четырехкратный избыток серного эфира, а затем трехкратно промывали им же.
Триэтиламин использовали для проведения реакции между полиэтиленоксидом с гидроксильными группами и хлористым трезилом:
СН3О(СН2-СН2-O)хН+ClSO2СН2CF3+(С2Н5)3N→СН3О(СН2-СН2-O)x-SO2СН2CF3+(С2Н5)3N·HCl
Таким образом получают трезиловые производные полиэтиленоксида формулы
CH3OCH2CH2(OCH2CH2)n-O-SO2CH2-CF3
Пример 2. Пэгилирование интерферона.
Возможность использования этих соединений для модификации белков продемонстрирована на примере интерферона. Интерферон-альфа-2в фирмы Hydrola Ltd. 20 мг препарата растворяют в 4 мл воды. Аликвоты по 1 мл (5 мг) переносят в реакционные флаконы. Для модификации рН раствора доводят до 9.5 50 мМ фосфатно-карбонатным буфером. Реагенты добавляют 5 раз в 10-кратном молярном избытке с интервалами в 6-12 часов. За ходом реакции следят с помощью проведения гель-фильтрационной ВЭЖХ. Спустя 60 часов реакцию останавливают добавлением 50 мМ метилового эфира глицина. Полученный таким образом конъюгат имеет следующие физико-химические характеристики: молекулярная масса (метод вертикального электрофореза) 16390 Дальтон, рН 9.5 (потенциометрически), осмоляльность (метод ЕФ, осмометр Vogel ОМ 802) 375 мОсм/кг.
Пример 3. Антивирусная активность конъюгатов интерферона
Отбирают пробы по 2 мл следующей расчетной активности:
1) стандарт (исходный интерферон) - 25 мкг/мл (3.5×106)
2) соединение 1-38 мкг/мл (5.32×106)
Противовирусную активность проверяют стандартным методом в культуре клеток легких человека Л-68 против вирусного везикулярного стоматита.
Биологическое тестирование дало следующие результаты:
| Препарат | Биоактивность расчетная | Биоактивность определенная | Биоактивность приведенная | Биоактивность удельная | % сохранения активности |
| Стандарт | 3.5×106 | 2.7×106 | 3.5×106 | 1.4×108 | 100% |
| Соединение 1 | 5.32×106 | 1.2×105 | 1.5×105 | 0.4×108 | 29% |
Биоактивность приведенная - биоактивность определенная, умноженная на коэффициент, получаемый от деления расчетной активности стандарта на определенную активность стандарта. Приведенную биоактивность рассчитывают для определения уменьшения удельной активности интерферона в процессе модификации.
Таким образом, модифицированный интерферон согласно данному изобретению сохраняет антивирусную активность, значительно превосходящую таковую известного аналога, для которого таковая составляет 7% при удельной биоактивности 1.4×107.
Пример 4. Исследование фармакокинетики препаратов
Беспородным крысам внутривенно вводили следующие препараты:
Соединение 1 по 0,56 мл = 13,5 мкг/крыса.
Известный аналог - пэгилированнное производное интерферона (согласно RU 2180595) - по 0,1 мл = 13,5 мкг/крыса.
У каждой крысы через 1 час после введения из хвостовой вены брали по 0,5 мл крови. Для этого скальпелем отсекали 1,5-2 мм плоти хвоста. Кровь собирали в пробирки типа Eppendorf. Пробирки помещали в термостат и инкубировали 30 минут при 37°С. Стеклянным капилляром отделяли образовавшийся тромб от стенок пробирки. Пробирки помещали в холодильную камеру и инкубировали при +4°С. Автоматической пипеткой отсасывали сыворотку и для удаления клеток крови центрифугировали при 5000 об/мин в течение 5 минут. Для стерилизации образцов сыворотки крови супернатанты переносили в системы фильтрации Ultrafree - MC (Amicron) и центрифугировали при 2000 об/мин в течение 10 минут. Образцы для тестирования хранили при +4°С.
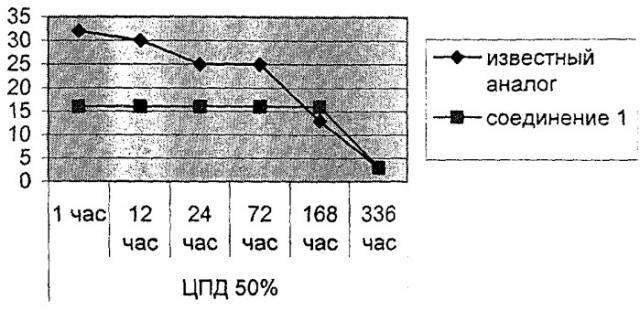
Результаты измерения уровня биологически активного интерферона за период 14 дней показаны на графике (чертеж).
График отражает уровень биологически активного интерферона в сыворотке крови в условных единицах активности. Из графика видно, что концентрация соединения 1 почти не изменялась на протяжении 7 дней, что свидетельствует о высокой стабильности препарата, сравнимой с таковой известного аналога.
Пример 5. Токсичность полученных ПЭГ-производных
Эксперименты по изучению острой токсичности выполнялись на белых нелинейных мышах и крысах. Для исследования каждой дозы препарата использовались группы по 6 животных. При использовании интервала доз от 1 до 15 МЕ/кг летальных эффектов не наблюдалось. Учитывая то, что терапевтическая доза для человека составляет от 0,0001 МЕ/кг до максимальной 0,03 МЕ/кг, препараты являются малотоксичными.
Пример 6. Противовирусная активность in vivo.
Для определения противовирусной активности 20 мышам весом 10-12 г вводят 0,2 мл препарата, 38 мкг/мл внутрибрюшинно за 24 и 2 ч до заражения вирусом клещевого энцефалита. Животных наблюдают в течение 14 дней. Если процент выживаемости составляет более 60%, то тестируемый препарат считается активным. Для соединения 1 этот показатель составил 85%, что позволяет отнести его к высокоактивным.
1. Пэгилированный интерферон для борьбы с вирусной инфекцией формулы СН3ОСН2СН2(ОСН2СН2)n-O-SO2СН2-белок, где белок представляет собой интерферон, а n имеет такие значения, что средняя молекулярная масса звеньев полиэтиленгликоля составляет от приблизительно 13000 Да до приблизительно 17000 Да.
2. Пэгилированный интерферон по п.1, где n=400.
3. Пэгилированный интерферон по п.1 или 2, в котором интерфероном является α-IFN.
4. Пэгилированный интерферон по п.1 или 2, в котором интерфероном является α-2b-IFN.
5. Фармацевтическая композиция, обладающая противовирусной активностью, содержащая пэгилированный интерферон по п.1 или 2 и терапевтически инертный носитель.
6. Способ борьбы с вирусной инфекцией, включающий введение в организм пэгилированного интерферона по п.1 или 2 в эффективном количестве.