4-метокси-5-нитро-6-тиоцианопиримидин, обладающий фунгицидной активностью, и способ его получения
Иллюстрации
Показать всеИзобретение относится к новому соединению - 4-метокси-5-нитро-6-тиоцианопиримидину формулы I, которое обладает фунгицидной активностью в опытах на отдельных штаммах грибов (in vitro) и в полевых условиях (in vivo). Изобретение также относится к способу получения 4-метокси-5-нитро-6-тиоцианопиримидина.
Способ заключается во взаимодействии 4-метокси-5-нитро-6-хлорпиримидина с тиоцианатом щелочных металлов или аммония. Обычно процесс проводят при температуре 20-50°С в органическом растворителе. 2 н.п. ф-лы, 6 табл.
Реферат
Изобретение касается соединения 4-метокси-5-нитро-6-тиоцианопиримидина формулы 1 (см на на стр.2), обладающего фунгицидной активностью,относящегося к классу 5-нитропиримидинов, и способ его получения.
Известны моноциклические пиримидины, обладающие фунгицидной активностью. Так в 1986 году японские исследователи запатентовали 4,6-диалкокси-2-алкилсульфонилпиримидины в качестве соединений, проявляющих высокую фунгицидную активность и могущих быть использованными при проведении агрохимических работ. Эти соединения имеют общую формулу Ш.
Соединения Ш не имеют тех недостатков, которые характерны для соединений общей формулы II. Однако их нельзя считать прямыми аналогами заявляемого соединения. Они не относятся к классу 5-нитропиримидинов, а также имеют заместитель во 2-м положении молекулы (Chem. Abstr. 1988, №11, 933047е).
Этот пример указывает на то, что пиримидиновый цикл является перспективным в плане поиска биологически активных соединений, однако проявление биологической активности существенным образом зависит от характера заместителей в пиримидиновом ядре и месте их расположения.
Наиболее близкими по технической сущности и достигаемому результату являются 5-нитропиримидины, замещенные по 4-му положению алкил (диалкил) аминогруппами, а в 6-м положении молекулы, имеющие в качестве заместителя атом хлора общей формулы II.
Эти соединения также проявляют высокую фунгицидную активность, однако для них характерна высокая токсичность для теплокровных (мыши), а также не устойчивость при хранении. Поэтому эти соединения не были подвергнуты более глубокому изучению и не нашли практического применения [Pharm. Res. 135 (3), 43-47 Chem. Abstr., v. 104, 30469].
Известен способ получения 2-хлор-4-тиоциано-5-нитропиримидина взаимодействием KCNS с исходньм 2.4-дихлор-5-нитропиримидином (Chem. Abstr., v.53, 1359 с.). Реакция проводится в среде уксусной кислоты при температуре 50°С. Получают 2-хлор-4-тиоциано-5-нитропиримидин. Однако предлагаемое нами соединение невозможно получить таким образом, т.к. исходный 4-метокси-5-нитро-6-хлорпиримидин в этих условиях осмоляется, а при температуре 20°С реакция вообще не идет (Chem. Abstr., v.53, 1359 с).
Задачей изобретения является получение такого производного пиримидина, которое характеризовалось бы стабильностью при хранении, и имело бы низкую токсичность для теплокровных, и при этом сохраняло бы высокую фунгицидную активность.
Поставленная задача решается получением соединения 4-метокси-5-нитро-6-тиоцианопиримидина, обладающего фунгицидной активностью. Поставленная задача решается также способом получения 4-метокси-5-нитро-6-тиоцианопиримидина, заключающегося в том, что исходное соединение 4-метокси-5-нитро-6-хлорпиримидин обрабатывается тиоционатом щелочного металла или аммония в среде ацетона, диоксана или ацетонитрила при температуре 20-50°С.
Целевое соединение выделяется известными способами (см. Примеры).
Если в качестве исходного взять 5-нитропиримидин, замещенный по 4-му положению различными группировками, а в 6-м положении молекулы имеющие атом галогена, т.е. соединение общей формулы I, то принимая во внимание, что в этих соединениях атом галогена сохраняет свою высокую подвижность и может легко замещаться под действием различных нуклеофилов, в качестве такого был выбран тиоцианатный анион. Так как известно, что введение в молекулу соединения тиоцианатной группы часто приводит к появлению биологической активности (а.с. СССР, 552940, 1977 г.). Поэтому нами были изучены методы получения производных 5-нитропиримидина, содержащих тиоцианатную группу, а также фунгицидная активность полученных производных пиримидина [Вейганд-Хильгетаг. Методы эксперимента в органической химии. Изд. Химия, Москва, 1968, 201].
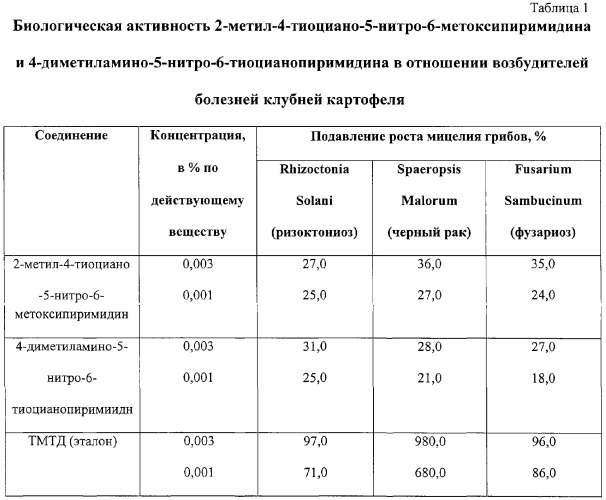
Оказалось, что наибольшую фунгицидную активность среди полученных веществ проявляет 4-метокси-5-нитро-6-тиоцианопиримидин, причем эта активность существенным образом зависит от характера заместителей и их положения в молекуле 5-нитропиримидина. Так, 2-метильный аналог заявляемого соединения, т.е. 2-метил-4-метокси-5-нитро-6-тиоцианпиримидин полностью был лишен фунгицидной активности, 4-диметиламино-5-нитро-6-тиоцианопиримидин также не обнаружил фунгицидного действия.
Установлено, что фунгицидная активность испытанных соединений в отношении мицелия гриба возбудителя ректимоза картофеля находится в пределах ошибки опыта, то есть они не активны.
Их фунгицидная активность составляет 24-25%, т.е. находится в пределах ошибки опыта. В тоже самое время активность заявляемого соединения, т.е. 4-метокси-5-нитро-6-тиоцианопиримидина в опытах на тех же штаммах грибов составило 98-100% (см. таблицу 2).
Испытания проводили в отделе 22 лаборатории 22: нач. лаб. Абеленцев В.И., Заикин В.А. и Дудников В.В. (ВНИХЗР).
Проведена оценка соединения (4-тиоциано-5-нитро-4-метоксипиримидина) в опытах in vitro на мицелии грибов: Rhizoctjnio Solani, Spaeropsis Malorum, Fusarium Sambucinum с использованием картофельно-глюкозной агаровой питательной среды. Испытуемое химическое вещество в виде раствора в ацетоне вводили в расплавленную агаровую среду при температуре 40-50°С и разливали в чашки Петри. Через 18-20 часов наносили мицелий гриба иглой в три точки агаровой пластинки. После соответствующей выдержки при температуре 20-25°С измеряли диаметр колоний гриба. По этому показателю сравнивали рост колоний в контроле, эталоне и на среде с введенном в нее соединением. Торможение роста колоний рассчитывали по формуле Эббота:
где Пк - диаметр колоний гриба в контроле,
ПО - диаметр колоний гриба в чашках, содержащих испытуемое соединение.
Результаты опыта приведены в таблице 2.
| Таблица 2Фунгицидная активность соединения в борьбе против различных возбудителей заболеваний | ||||
| Химическое название соединения | Концентрация,% по действующему веществу | Подавление роста мицелия грибов, % | ||
| Rhizoctonia Solani (ризоктониоз) | Fusarium sambucinum (фузариоз) | SpaeropsisMalorum (черный рак) | ||
| 4-тиоциано-5-нитро-6-метоксипиримидин | 0,003 | 100,0 | 100,0 | 100,0 |
| 0,001 | 100,0 | 50,0 | ||
| ТМТД (эталон) | 0,003 | 97,0 | 98,0 | 98,0 |
| 0,001 | 71,0 | 85,0 | 88,0 |
Пример 1. Оценка соединения в отношении возбудителей грибных болезней картофеля.
Испытание проводили методом определения контактной активности на картофельно-глюкозном агаре. Растворенное в ацетоне соединение вводили в расплавленную среду и разливали по чашкам Петри. Инокуляцию мицелием грибов 7-10-дневной культуры проводили методом укола. Чашки термостатировали 3-5 суток при 24-26°С, а затем измеряли величину роста колоний грибов, подсчитывали процент подавления роста по формуле Эббота. Результаты опыта представлены в таблице 2.
Установлена высокая биологическая активность заявляемого соединения в отношении мицелия гриба возбудителя ризоктониоза клубней картофеля, которая была выше, чем у стандартного эталона ТМТД.
Пример 2. Оценка препарата в качестве протравителя клубней картофеля в полевых условиях.
Эффективность препарата изучали методом влажного протравления клубней картофеля перед посадкой (экспозиция 3 минуты).
Учеты проводили по мере появления всходов и в период полных всходов, когда растения достигли 15-20 см высоты.
После созревания клубней картофеля сорта Раменский делали учет урожая.
Через 40 дней после уборки проводили клубневый анализ на поражение различными заболеваниями.
Результаты опыта представлены в таблице 3.
| Таблица 3Влияние протравливания препаратом на рост, развитие, урожай и биологическую эффективность в полевых условиях | ||||||
| Вариант опыта | Всхожесть, в % | Количество стеблей в кусте, шт. | Биологическая эффективность, в % | Средний урожай с куста, г | ||
| 1 учет | 2 учет | Ризоктониоз | Парша | |||
| 4-тиоциано-5-нитро-6-метотксипиридин 50% с.п. | 100,0 | 2,93 | 2,93 | 57,0 | 39,7 | 500,0 |
| 93,3 | 3,27 | 3,27 | 58,0 | 55,9 | 514,0 | |
| ТМТД (эталон) | 96,7 | 2,85 | 3,20 | 51,6 | 50,4 | 443,8 |
| Текто (эталон) | 96,7 | 3,00 | 3,20 | 56,7 | 42,4 | 496,2 |
| Контроль без обработки (развитие болезни, в %) | 83,3 | 2,23 | 2,20 | 42,4 | 61.5 | 445,0 |
| Примечание: Препарат 4-тиоциано-5-нитро-6-метотксипиридин изучался в концентрации 2,5 и 5,6% по препарату, текто - 2,8%. |
Препарат 4-тиоциано-5-нитро-6-метотксипиридин не влиял отрицательно на рост и развитие картофеля.
По биологической эффективности и урожаю препарат в борьбе с возбудителями клубней картофеля (ризоктониз и парша) не уступал эталонам ТМТД и текто (фирма "Мерк").
Итак, в результате оценки в лабораторных и полевых опытах установлена высокая эффективность предлагаемого соединения в соотношении ризоктониоза (таблицы 2, 3) и парши обыкновенной (таблица 3).
Установлена высокая активность соединения в отношении мицелия гриба возбудителя ризоктониониоза клубней картофеля, которая была выше, чем у стандартного эталона ТМТД (таблица 2).
Препарат 4-тиоциано-5-нитро-6-метотксипиридин изучали в борьбе против ризоктониоза и парши обыкновенной в качестве протравителей клубней перед посадкой в полевых условиях.
Опыт был заложен на сорте картофеля Раменский с естественным поражением склероциями гриба ризоктонии (15-20 склероций на клубень) и язвами парши.
Клубни протравливали методом окунания в раствор препаратов (экспозиция 3 минуты).
После посадки провели 2 учета на всхожесть, 2 учета по влиянию препаратов на количество продуктивных стеблей, учет урожая, а также клубневой анализ через 40 дней после уборки урожая.
Результаты опыта представлены в таблице 4.
| Таблица 4Влияние протравливания препаратом клубней на рост, развитие, урожай и биологическую эффективность в полевых условиях | |||||||
| Вариант опыта | Концентрация, в % по препарату | Всхожесть, в % | Количество стеблей в кусте, шт. | Биологическая эффективность, в % | Средний урожай с куста, г. | ||
| 1 | 2 | Ризоктониоз | Парша | ||||
| учет | учет | ||||||
| 4-тиоциано-5- | 2,5 | 100,0 | 2,93 | 2,93 | 57,0 | 39,7 | 500,0 |
| нитро-6-метотксипиридин 50% с.п. | 5,6 | 93,3 | 3,27 | 3,27 | 58,0 | 55,9 | 514,0 |
| ТМТД (эталон) | 3,5 | 96,7 | 2,85 | 3,20 | 51,6 | 50,4 | 443,8 |
| Текто (эталон) | 2,8 | 96,7 | 3,00 | 3,20 | 56,7 | 42,4 | 496,2 |
| Контроль без обработки (развитие болезни, %) | 83,3 | 2,23 | 2,20 | 42,4 | 61,5 | 445,0 | |
| Примечание: препарат 4-тиоциано-5-нитро-6-метотксипиридин изучался в концентрации 2,5 и 5,6% по препарату, текто - 2,8%. |
Препарат 4-тиоциано-5-нитро-6-метотксипиридин не влиял отрицательно на рост и развитие картофеля.
По биологической эффективности в борьбе с ризоктониозом и паршой препарат не уступал эталонам ТМТД и текто (фирма "Мерк").
В результате увеличения ассимиляционной поверхности листьев, сохранения корневой и проводящих систем растений и в целом фитосинтетического потенциала картофеля, препарат дал возможность получить несколько более высокий урожай по сравнению с контролем и эталонами.
Пиримидины, содержащие в кольце тиоцианатную группу, описаны в литературе. Так известно, что 2,4-дихлор-5-нитропиримидин образует тиоциановое производное при его обработке тиоцианатом калия в среде уксусной кислоты при t 50°С, а 2,4-дихлор-5-нитро-6-диметиламинопиримидин при обработке тиоцианатом натрия в среде этанола образует 2-хлор-4-тиоциана-5-нитро-6-диметиламинопиримидин (Chem. Pharm. Bull., v.16, N4, p.752 (1968)).
В то же время замещение на тиоциановую группу галогена во 2-м положении молекулы пиримидина в литературе не описано. Видимо наличие заместителя во 2-м положении оказывает существенное влияние на процесс замещения. Действительно, нами установлено, что на процесс замещения существенное влияние оказывает не только характер и положение заместителей в молекуле исходного пиримидина, но и растворитель, в котором проводится реакция (см. таблицу 5).
| Таблица 5Таблица опытов | |||||||
| №п/п | Количество соединения III (г) | Количество KSCN (г)** | Растворитель, мл | Время реакции | Температура реакции | Выход | |
| г | % | ||||||
| 1 | 4 | 2 | Метанол (20) | 3 часа | Кипение | 2,0 | 44,7 |
| 2 | 20 | 10 | Метанол (100) | 3 часа | Кипение | 12 | 53,6 |
| 3 | 0,8 | 0,4 | Метанол (40), Ацетон (30) | 4 часа | Кипение | - | - |
| 4 | 1,5 | 0,77 | Изопропанол (50) | 20 мин кипения+2 часа при 20°С | Кипение 20°С | 1,2 | 71,5 |
| 5 | 1,5 | 0,77 | Диметилформамид (25) | 4 часа | 20°С | 0,8 | 47,6 |
| 6 | 1,5 | 0,77 | Диметилсульфоксид (25) | 4 часа | 20°С | Исх. | - |
| 7 | 1,5 | 0,77 | Уксусная кислота (7) | 20 мин | 10°С | Исх. | - |
| 8 | 1,5 | 0.77 | Уксусная кислота (7) | 4 часа | 20°С | Исх. | - |
| 9 | 1,5 | 0,77 | Этанол (40) | 3 часа | Кипение | 0,6 | 35,7 |
| 10 | 1,5 | 0,77 | Ацетонитрил (30) | 1 час | 20°С | 1,25 | 74,5 |
| 11 | 1,5 | 0,85 | Ацетон (50) | 2 часа | 20°С* | 1,05 | 62,5 |
| 12 | 1,5 | 0,85 | Диоксан (30), вода (15) | 2 часа | 20°С* | 1,0 | 59,6 |
| * реакционная масса кратковременно (15 минут) нагревалась до кипения.** Замена тиоцианата калия на тиоцианат натрия или аммония не оказывает существенного влияния на выход целевого продукта (колебание выхода составляет 1-2%, т.е. находится в пределах ошибки опыта). |
Так в среде уксусной кислоты при t=20°С реакция между 4-метокси-5-нитро-6-хлорпиримидином и тиоцианатом калия не идет. Из реакционной массы были выделены исходные соединения. Напротив, в тех же условиях, в которых было осуществлено замещение галогена на тиоциановую группу в 2,4-дихлор-5-нитропиримидине в нашем случае наблюдалось полное осмоление реакционной массы. Аналогичная картина была зафиксирована и тогда, когда в качестве растворителя был использован ДМSO. В этаноле реакция замещения происходила, но с низкими выходами.
Наилучшие результаты были получены при проведении реакции в среде ацетона, ацетонитрила и изопропилового спирта. Здесь реакция замещения протекала при 50°С и выход целевого продукта составлял 60-70% (см таблицу и примеры синтеза).
Необходимо отметить, что в случае применения в качестве растворителей ацетона, диоксана, ацетонитрила реакция замещения шла уже при t=20°С.
Схема предлагаемого способа получения
Исходное соединение
описано в литературе (Е.С.Taylor, J.W.Barton, W.W.Paudler. Studies in purine chemistry. X. Some derivaties of 9-aminopurmes. J. Org. Chem., 1961, №12, p.4961).
Его получают действием метилата натрия на 4,6-дихлор-5-нитропиримидин в среде метанола.
Нижеследующие примеры иллюстрируют заявляемый способ получения соединения I.
4-метокси-5-нитро-6-тиоцианопиримидин (I).
Пример 1.
К раствору 1,5 г (7,9 Ммоль) 4-хлор-5-нитро-6-метоксипиримидина (III) в 30 мл ацетонитрила прибавляют 0,77 г (7,9 Ммоль) тиоцианата калия, предварительно мелко растертого, и смесь перемешивают при 20°С в течение 1 часа, после чего реакционную массу фильтруют и упаривают в вакууме. Остаток обрабатывают в экстракторе Соксклета 50 мл кипящего бензола в течение 3 часов, экстракт фильтруют и упаривают в вакууме.
Получают 1,25 г (74,5%) бледно-желтого мелкокристаллического вещества с т. пл. 51-53°С.
Найдено, %: С 33,86, H 1,96, N 26,68, S 15,46;
M212CHNOS
Вычислено, %: С 33,94, Н 1,88, N 26,43, S 15,09;
Пример 2.
К раствору 1,5 г (7,9 Ммоль) 4-хлор-5-нитро-6-метоксипиримидина (Ш) в 50 мл ацетона прибавляют 0,85 г (8,8 Ммоль) тиоцианата калия, смесь нагревают до температуры кипения и перемешивают в течение 15 минут, после чего дают ей остыть и продолжают перемешивание еще в течение 2 часов. Реакционную массу фильтруют и упаривают в вакууме. Остаток обрабатывают в экстракторе Соксклета 50 мл кипящего бензола в течение 3 часов, экстракт фильтруют и упаривают в вакууме. Получают 1,05 г (62,5%) бледно-желтого мелкокристаллического вещества с т.пл. 51-53°С.
Пример 3.
К раствору 1,5 г (7,9 Ммоль) 4-хлор-5-нитро-6-метоксипиримидина (Ш) в 30 мл диоксана прибавляют 0,85 г (8,8 Ммоль) тиоцианата калия в 15 мл воды и полученную смесь нагревают до температуры кипения и перемешивают в течение 15 минут, после чего дают ей остыть и продолжают перемешивание еще в течение 2 часов. Реакционную массу фильтруют и упаривают в вакууме. Остаток обрабатывают в экстракторе Соксклета 50 мл кипящего бензола в течение 3 часов, экстракт фильтруют и упаривают в вакууме. Получают 1,0 г (59,6%) бледно-желтого мелкокристаллического вещества с т. пл. 51-53°С.
Пример 4.
К раствору 1,5 г (7,9 Ммоль) 4-хлор-5-нитро-6-метоксипиримидина (Ш) в 50 мл изопропилового спирта прибавляют 0,9 г (9,3 Ммоль) тиоцианата калия и полученную смесь нагревают до температуры кипения и перемешивают в течение 25 минут, после чего дают ей остыть и продолжают перемешивание еще в течение 2 часов. Образующийся осадок отфильтровывают и промывают на фильтре 30 мл метанола. Фильтрат упаривают в вакууме. Остаток обрабатывают 30 мл холодной воды и получают 1,2 г (71,5%) бледно-желтого мелкокристаллического вещества с т. пл.49-51°С.
Определение LD 50.
Соединение 1.
Принимая во внимание то, что эффективность соединения I была установлена на картофеле, который используется теплокровными в качестве продукта питания, для этого соединения была определена LD50 (см. таблицу 6).
Установлено, что LD50 соединения I составляет 719 мг /кг (мыши) и, следовательно, это вещество относится к классу нетоксичных соединений для теплокровных (токсичными считаются для теплокровных вещества, имеющие LD50 500-600 мг/кг).
Определение LD50 соединения формулы 1.
LD50 определяли при однократном пероральном применении. Для этого были использованы белые беспородные мыши массой 17-19 г. Всего было использовано 42 животных. Одна доза испытывалась на 6 животных. Соединение вводили в крахмале. Выживших животных забивали через 15 суток после введения соединения I. Полученные результаты приведены в таблице 6.
| Таблица 6 | |||
| Доза мг/кг | Количество животных | LD50 мг/кг (по Керберу) | |
| Всего | Павших | ||
| 1704 | 6 | 6 | 719 |
| 1420 | 6 | 6 | |
| 1136 | 6 | 5 | |
| 852 | 6 | 4 | |
| 568 | 6 | 2 | |
| 284 | 6 | 1 | |
| 114 | 6 | 0 |
1. 4-Метокси-5-нитро-6-тиоцианопиримидин формулы I
2. Способ получения 4-метокси-5-нитро-6-тиоцианопиримидина, заключающийся в том, что 4-метокси-5 нитро-6-хлорпиримидин обрабатывают тиоцианатом щелочных металлов или аммония.