Способ прогнозирования риска возникновения, клинического течения и исхода острого алкогольного панкреатита
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к хирургии, и может быть использовано для прогнозирования клинического течения и исхода острого алкогольного панкреатита. Задача изобретения: повышение эффективности прогнозирования клинического течения и исхода острого алкогольного панкреатита. Поставленную задачу осуществляют за счет того, что из крови пациента с острым алкогольным панкреатитом выделяют ДНК и методом полимеразной цепной реакции исследуют мутации генов GSTM1 и GSTT1. При обнаружении «нулевого» генотипа GSTM1 или «нулевого» генотипа GSTT1 прогнозируют развитие деструктивной формы алкогольного панкреатита, а при обнаружении сочетания «нулевых» генотипов по генам GSTM1 и GSTT1 прогнозируют развитие тотального поражения поджелудочной железы. Способ позволяет выделить группу больных с высоким риском развития осложнений и обоснованно рекомендовать им проведение полномасштабной специализированной интенсивной терапии на ранних сроках; и определить оптимальную стратегию при лечении заболевания с точки зрения предикативной медицины и снизить или полностью исключить летальность у больных. 3 ил., 2 табл.
Реферат
Изобретение относится к медицине, а именно к хирургии, и может быть использовано для прогнозирования риска возникновения, клинического течения и исхода острого алкогольного панкреатита.
Острый панкреатит (ОП) - одно из самых сложно диагностируемых и вместе с тем широко распространенных заболеваний [1]. В течение нескольких лет он стабильно занимает второе, а по некоторым регионам - первое место в структуре заболеваний «острый живот», опережая острый аппендицит и острый холецистит [2, 3, 4]. Летальность при остром деструктивном панкреатите как в России, так и за рубежом остается неизменно высокой, не опускаясь ниже 20%, достигая при инфицированных формах 60-80% [4, 5, 6, 7, 8, 25].
В настоящее время среди различных критериев прогноза течения острого панкреатита наиболее распространены прогностические системы, основанные на изучении лабораторных параметров, характеризующих состояние пораженного органа и жизненно важных констант организма, и предполагающие в конечном счете числовое выражение тяжести состояния больного. Достаточную клиническую апробацию прошли:
1) ранние прогностические критерии Ranson;
2) индекс АРАСНЕ II;
и система стратификации тяжести острого панкреатита на основе компьютерно-томографических критериев [9, 10, 26, 27].
Наиболее известная и повсеместно применяющаяся прогностическая система предложена американским хирургом J.Ranson - она состоит из 11 критериев. Сумма баллов от 0 до 2 указывает на легкое течение панкреатита, от 3 до 5 - на панкреатит средней тяжести, сумма от 6 до 11 баллов соответствует тяжелому течению панкреонекроза. Несколько проще система прогноза Glasgow (Imrie), она состоит из восьми лабораторных показателей, девятым является возраст пациента. Недостатком этих систем является неспецифичность использованных лабораторных параметров и 48-часовая отсрочка в установлении прогноза течения острого панкреатита [11, 12].
В ведущих отечественных и зарубежных клиниках в последние годы для оценки тяжести состояния больных острым панкреатитом применяется шкала АРАСНЕ-2 (Acute physiology and chronic health evaluation) - шкала оценки острых физиологических нарушений и хронических заболеваний. Данная шкала позволяет с высокой точностью определить тяжесть состояния пациента, имеет некоторые преимущества перед системой Рансона и компьютерной томографией, заключающиеся в возможности ежедневной повторной оценки, низкой стоимости скрининга тяжести и незначительно риска, однако большое количество параметров создает неудобства при использовании этой шкалы в условиях ургентной хирургии [28, 29].
Наиболее доступна и удобна в применении прогностическая система, предложенная Санкт-Петербургским НИИ скорой помощи им. И.И.Джанелидзе. Система состоит из 2 разделов, включающих основные и дополнительные признаки тяжести заболевания. Если у пациента имеется минимум 2 основных признака или 1 основной и 2 дополнительных, то с 95% вероятностью может развиться тяжелая форма острого панкреатита (крупноочаговый либо субтотально-тотальный). Если присутствует один признак, то возможен острый панкреатит средней тяжести. Отсутствие перечисленных признаков характерно для отечной формы острого панкреатита [13, 14].
Необходимость применения балльных систем оценки тяжести состояния больных панкреатитом не вызывает сомнений, они дают возможность унифицировать больных и выработать алгоритм действий. Однако анализ результатов анкетирования, проведенного в рамках подготовки к IX Всероссийскому съезду хирургов, показал, что в 29% случаев используется система APACHE-II, шкала Ranson применяется у 27% опрошенных, остальные респонденты указали, что не применяют систем оценки тяжести и прогноза заболевания [15]. Возможно этот факт обусловлен отсутствием оценочной системы, удовлетворяющей основным требованиям - простота, доступность и объективность, а также основным недостатком всех существующих на сегодняшний день систем, который заключается в том, что ни одна из них не позволяет прогнозировать риск возникновения, возможного течения и исхода острого панкреатита до его клинико-лабораторной манифестации, то есть несоответствует основным принципам современной предиктивной медицины - медицины предупредительной.
Наиболее близким к предлагаемому является способ прогнозирования течения язвенной болезни двенадцатиперстной кишки (ДПК) на основе фармакогенетического анализа метаболизма и клинической эффективности лекарственных препаратов, предназначенных для ее лечения, а именно ингибиторов протонного насоса, разработанный Никоновым Е.Л [16]. Проведенное у больных генотипирование выявило четкую зависимость возникновения осложнений, а также непрерывно-рецидивирующего течения язвенной болезни ДПК от наличия мутаций гена CYPC19 в системе цитохрома Р450. Такие генные мутации обуславливают "быстрый" тип метаболизма ингибиторов протонных помп, что снижает их эффективность и приводит к неудовлетворительным результатам консервативного лечения язвенной болезни ДПК, склонности к ее непрерывно-рецидивирующему течению. Предлагаемый способ прогнозирования играет важную роль:
1) в определениии тактики лечения язвенной болезни ДПК;
2) в выработке показаний к оперативному лечению, выполнению органосохраняющих операций на ДПК и желудке, а также тому или иному способу хирургической коррекции кислотопродуцирующей функции желудка.
Основным недостатком, не позволяющим применить его в отношении острого алкогольного панкреатита, является различия в патогенетической сущности этих заболеваний.
Для язвенной болезни ДПК ведущим в патогенезе является повышение кислотности желудочного сока, поэтому в основе системы прогноза ее течения и исхода лежит выявление мутаций в системе цитохрома Р450, повышающих активность ферментов, метаболизирующих лекарственные препараты, предназначенные для снижения кислото-продуцирующей функции желудка, что приводит к их клинической неэффективности в связи с быстрым выведением из организма.
Для создания же прогностической системы в отношении острого алкогольного панкреатита (ОАП) необходимо выявление мутаций в генах, которые способствовали бы снижению эффективности ферментов, участвующих в обезвреживании алкоголя и, соответственно, увеличивающих его токсическое воздействие на организм, а также генов, вовлеченных в функционирование клеток самой поджелудочной железы.
Задача изобретения: повышение эффективности прогнозирования риска возникновения, клинического течения и исхода острого алкогольного панкреатита.
Поставленную задачу решают за счет того, что исследуют 5 генов на предмет мутаций, ассоциированных с развитием панкреатита и влияющих на его течение и исход: ферментов биотрансформации ксенобиотиков - GSTM1 и GSTT1, катионного трипсиногена - PRSS1, ингибитора трипсиногена - SPINK1, трансмембранного регулятора муковисцидоза - CFTR; и при наличии только "нулевого" генотипа GSTM1 прогнозируют повышение риска возникновения острого алкогольного панкреатита на 51%, а также прогнозируют тяжелое течение острого алкогольного панкреатита с развитием деструктивных его форм с риском в 50%, а при наличии "нулевого" генотипа GSTT1 - с риском в 41,6%, при сочетании "нулевого" генотипа GSTM1 и "нулевого" генотипа GSTT1 прогнозируют летальный исход в 80% случаев.
Оценивали состояние генетических систем:
1. Осуществляющих взаимодействие организма с внешней средой.
Исследовали гены ферментов биотрансформации ксенобиотиков - глутатион-S-трансферазы (GSTM1 и GSTT1), где в качестве полиморфных вариантов выявлялись их протяженные делеции. Вследствии таких делеций образуется мутантный "нулевой" аллель генов GSTM1 и GSTT1 у людей, гомозиготных по этому аллелю и имеющих, соответственно "нулевой" генотип (0/0), белковый продукт не синтезируется, то есть ферменты, за образование которых ответственны гены GSTM1 и GSTT1, отсутствуют [21].
2. Непосредственно вовлеченных в функционирование клеток поджелудочной железы.
Исследовали гены:
а) катионного трипсиногена PRSS1 и его R122H мутацию;
б) ингибитора трипсиногена (SPINK1) с мутацией N34S;
в) трансмембранного регулятора муковисцидоза (CFTR) с 8 наиболее распространенными мутациями.
Выбор исследуемых генов обусловлен тем, что:
1. Ферменты глутатионтрансферазы, экспрессирующиеся с генов GSTM1 и GSTT1, являются ферментами биотрансформации ксенобиотиков, к которым относится и этанол, их отсутствие вследствие мутаций этих генов приведет к нарушению его обезвреживания [17, 20].
2. Фермент с гена GSTM1 экспрессируется в панкреатической паренхиме, поэтому принимает участие в обезвреживании экзогенных токсинов непосредственно в поджелудочной железе, его отсутствие вследствие мутации этого гена приведет к деструкции ее ткани [18].
3. Фермент с гена GSTM1 входит в состав антиоксидантной системы, при его отсутствии вследствие мутаций нарушится резистентность клеток к перекисному окислению липидов, жиров, повреждающему действию свободных радикалов, что неблагоприятно в отношении тяжести течения и исхода острого панкреатита [19, 30].
4. Фермент с гена GSTT1 участвует в детоксикации многих поллютантов, его делеция увеличивает вероятность хромосомных повреждений при воздействии оксидов и пероксидов, промежуточных метаболитов, в том числе метаболитов этанола [19, 24].
5. Вследствие мутации гена катионного трипсиногена (PRSS1) трипсиноген становится устойчивым к аутолизу и подверженным более легкой аутоактивации, что может провоцировать развитие генетически обусловленного острого панкреатита [23, 32].
6. При мутации гена панкреатического ингибитора трипсина (SPINK1) нарушается естественный процесс блокады активированного трипсина в ткани ПЖ, что запускает процесс безудержной активации панкреатических ферментов, вызывая протеолитический некроз ткани поджелудочной железы и лизис стенок венул [33].
7. Мутации гена трансмембранного регулятора муковисцидоза (CFTR) реализуются на клеточном уровне недостаточной гидратацией, защелачиванием первичного секрета экзокринных желез и увеличением его вязкости [22, 31]. Увеличение концентрации гликопротеидов в панкреатическом секрете приводит к затруднению его экскреции по протокам и нарушению транспорта зимогенных гранул через апикальную мембрану, способствующих интрапанкреатической активации энзимов и аутолизу ткани железы [19, 31].
Для осуществления предлагаемого способа проводят молекулярно-генетический анализ образцов ДНК, полученных из 4 мл крови, обследуемых методом полимеразной цепной реакции (ПЦР). Экстракцию ДНК осуществляют по стандартной методике с обработкой протеинкиназой К (фирма "СибЭнзим") и фенолхлороформной смесью. Детекцию делеционных полиморфизмов GSTM1 и GSTT1 генов проводили методом ПЦР. Для генов PRSS1 и SPINK1 использовали ПЦР-ПДРФ-анализ с рестрикторами BstFN1 (фирма «Сибэнзим») и TspR1 (фирма «New England BioLab»). Анализ мутаций CFTR гена проводят с использованием диагностического набора фирмы «ДНК-лаборатория» на 8 наиболее распространенных мутациях: del21kb, delF508, dell507, 1677delTA, 2143delT, 2184insA, 394delTT, 3821delT. Визуализацию результатов осуществляют электрофоретически в 3% агарозном геле (для генов глутатион-S-трансферазы, PRSS1 и SPINK1) и в 7% полиакриламидном геле для гена CFTR с окраской бромистым этидием. Статистическую обработку данных проводят с помощью закона Харди-Вайнберга для аутосомных признаков критерия χ2 Пирсона.
За период с 2003 по 2005 годы было обследовано 113 человек. В группу сравнения вошли 67 здоровых донора, из них 42 мужчин и 25 женщин, средний возраст составил 30±10,4 лет. Исследуемую группу составили 46 больных хирургических отделений городской клинической больницы №7, из них мужчин было 28, женщин - 18, средний возраст обследуемых составил 42,8±7,8 года. Диагноз острого алкогольного панкреатита устанавливали на основании анамнеза, данных объективного обследования, лабораторных и инструментальных методов.
Забор крови для исследования генетической предрасположенности к панкреатиту проводили в первые сутки нахождения больного в стационаре.
В результате исследования полиморфного варианта гена катионного трипсиногена среди обследованных больных острым алкогольным панкреатитом мутантный аллель гена был зафиксирован у двух пациентов, что составило 4,35%. Оба обнаруженных варианта оказались гетерозиготами R/H, так как только один из аллелей содержал замену R122H. В группе сравнения в результате произведенной амплификации гена PRSS1 у здоровых индивидуумов ни одного случая мутации не выявлено. Анализ полученных данных позволяет сделать вывод, что мутация гена PRSS1 в популяции обследованных не является предрасполагающим фактором развития панкреатита, по крайней мере, для пациентов с алкогольной этиологией данного заболевания.
При исследовании гена GSTM1 было обнаружено, что частота его мутантных гомозиготных делеционных вариантов ("нулевого" генотипа GSTM1 0/0) значительно выше в группе больных панкреатитом по сравнению с контрольной группой здоровых доноров. Как видно из таблицы 1, в группе больных мутантный "нулевой" генотип был выявлен у 24 человек, что составило 52,1%, в то время как в группе здоровых частота нулевого генотипа GSTM1 была зафиксирована лишь у 20,3% обследованных. Различие частот по критерию Пирсона составило χ2=12,55, что является статистически значимым при р<0,001. Такие результаты свидетельствуют о том, что риск развития острого алкогольного панкреатита при наличии «нулевого» генотипа GSTM1 составляет 52,1%.
| Таблица 1Распределение частот генотипов и аллелей генов GSTM1 и GSTT1 в обследованных группах | ||||||
| Ген | Характеристика группы | Частота аллелей (%) | Частота генотипов (%) | |||
| + | 0 | +/+ | +/0 | 0/0 ("нулевой" генотип) | ||
| GSTM1 | Здоровые доноры | 54,9 | 45,1 | 30,1 | 49,6 | 20,3 |
| Больные острым алкогольным панкреатитом | 28,45 | 71,55 | 7,9 | 41,1 | 52,1 | |
| Примечания: «+» - обычный (нормальный) аллель гена; «0» - делеционный («нулевой») аллель гена |
При исследовании распределения частот гомозиготного делеционного варианта гена GSTT1 ("нулевого" генотипа GSTT1 0/0) среди здоровых доноров и больных ОАП достоверных различий получено не было, что свидетельствует об отсутствии взаимосвязи генотипа «нулевого» аллеля GSTT1 с риском развития панкреатита (Таблица 2).
| Таблица 2Распределение частот генотипов и аллелей генов GSTT1 у здоровых доноров и больных ОАП | ||||||
| Ген | Характеристика группы | Частота аллелей (%) | Частота генотипов (%) | |||
| + | 0 | +/+ | +/0 | 0/0 ("нулевой генотип") | ||
| Здоровые доноры | 58,7 | 41,3 | 34,8 | 47.8 | 17,4 | |
| Больные ОАП 57,1 | 42,9 | 34,7 | 44,9 | 20,4 | ||
| Примечания: «+» - обычный (нормальный) аллель гена; «0» - делеционный («нулевой») аллель гена |
Возможно это связано с тем, что фермент этого класса экспрессируется в эритроцитах и печени, а не непосредственно в ткани поджелудочной железы, его значение при панкреатите возможно лишь косвенное.
В группе больных в результате исследования полиморфного варианта гена ингибитора трипсина мутантный аллель не был зафиксирован ни у одного больного, в соответствии с чем можно заключить, что мутации этого гена не ассоциированы с риском развития ОАП.
Из 49 пациентов группы больных острым панкреатитом алкогольной этиологии «мажорная» мутация ΔF508 CFTR в гетерозиготе была выделена у двух пациентов, что составило 4,08%, что указывает на отсутствие значимости этой мутации в патогенезе алкогольной формы ОП.
Необходимо отметить, что в группе сравнения при амплификационном анализе генов SPINK1 и CFRT ни одного случая мутаций выявлено не было.
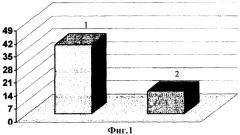
Сравнительная оценка тяжести состояния в группе больных острым алкогольным панкреатитом показала, что из 49 пациентов деструктивные формы заболевания развились у 12 пациентов, что составило 24,5%, отечная форма заболевания была зарегистрирована у 37 (75,5%) пациентов, что говорит о преимущественном развитии у больных с острым алкогольным панкреатитом отечной формы этого заболевания. Тяжесть состояния больных ОАП представлена на фиг.1, где 1 - 75,5% больные с отечной формой этого заболевания, 2 - 24,5% больные с деструктивной формой заболевания.
У большинства больных с развившимися деструктивными формами генотипирование показало наличие мутаций, оказавших неблагоприятное воздействие на течение и исход заболевания:
1. У 6 (50%) больных с деструктивным панкреатитом были выявлены «нулевые» генотипы GSTM1.
2. Гомозиготный делеционный вариант гена GSTT1 верифицирован у 5 (41,6%) пациентов.
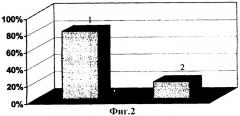
3. У трех (25%) из 12 больных панкреонекрозом алкогольной этиологии обнаружены полиморфные делеционные варианты сразу двух генов - GSTT1 и GSTM1 («нулевые» генотипы). Эти больные отличались наиболее тяжелым течением ОАП с развитием тотального поражения поджелудочной железы и забрюшинной клетчатки, выраженной клиникой эндотоксикоза и летальным исходом в 80% случаев. Исход деструктивного панкреатита при сочетании «нулевых» генотипов GSTM1 и GSTT1 представлен на фиг.2, где 1 - 80% больных с летальным исходом, 2 - 20% больные, лечение которых закончилось выздоровлением. Тогда как среди больных отечной формой алкогольного панкреатита сочетания мутантных генов биотрансформации ксенобиотиков выявлено не было.
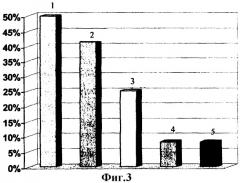
4. У двух больных с тотальным поражением поджелудочной железы было зафиксировано по одной мутации генов катионного трипсиногена и регулятора муковисцидоза, частота данных мутаций составила по 8,33%. Частота генетических мутаций у больных с деструктивным панкреатитом представлена на фиг.3, где 1 - 50% больные с генотипом GSTM1 0/0, 2 - 41,6% больные с генотипом GSTT1 0/0, 3 - больные с генотипом GSTM1 0/0+GSTT1 0/0, 4 - 8,3% больные с выявленной мутацией гена катионного трипсиногена (PRSS1), 5 - 8,3% больные с выявленной мутацией гена регулятора муковисцидоза (CFTR).
Анализ полученных результатов показал, что роль «главного» гена предрасположенности в возникновении ОАП принадлежит гену GSTM1, который участвует в биотрансформации ксенобиотиков и экспрессируется непосредственно в паренхиме поджелудочной железы, так как при выявлении «нулевого» генотипа GSTM1 прогнозируют повышение риска возникновения ОАП на 51% (Таблица 1). Для прогноза тяжести и исхода главным является выявление «нулевого» генотипа GSTM1, который позволят прогнозировать тяжелое течение ОАП с развитием деструктивных его форм с риском в 50%, и «нулевого» генотипа GSTT1 - с риском в 41,6%, сочетание «нулевого» генотипа GSTM1 и «нулевого» генотипа GSTT1 позволяет прогнозировать летальный исход в 80% случаев. Определенное влияние на тяжесть течения острого алкогольного панкреатита оказывают мутации генов катионного трипсиногена (PRSS1) и трансмембранного регуляторного белка муковисцидоза (CFTR), но, учитывая меньший процент их ассоциации с развитием деструктивных форм по сравнению с мутациями генов биотрансформации ксенобиотиков, их выявление является менее значимым.
Пример 1
Больной И., 42 года, 11.11.05 г доставлен бригадой скорой помощи в панкреатологический центр г.Красноярска с диагнозом: острый панкреатит.
Жалобы при поступлении: на боли в эпигастрии и левом подреберье опоясывающего характера, тошноту, рвоту.
Из анамнеза известно, что заболел около 8 суток назад после длительного употребления алкоголя.
Объективно: состояние тяжелое, кожные покровы бледные с «мраморным» оттенком, изо рта запах алкоголя. Дыхание ослаблено, хрипов нет. ЧДД=20 в минуту. Тоны сердца приглушены, ритмичные. Пульс=90 уд. в мин, АД=90/60 мм рт.ст. Язык сухой, обложен белым налетом. Живот в акте дыхания не участвует, при пальпации напряжен и резко болезненный в верхних отделах. Симптомы Воскресенского, Мейо-Робсона положительные. Симптомы раздражения брюшины положительные. Диурез 1200 мл/сутки.
УЗИ от 11.11.05: увеличение дорсо-вентральных размеров поджелудочной железы, неоднородность эхоструктуры, контуры поджелудочной железы размыты, снижена эхонегативность парапанкреатической клетчатки.
R-граммы органов грудной клетки и живота от 11.11.05 без особенностей.
В анализах крови: Hb=160 г/л, Эр.=5,3×1012/л, L=21×109/л; билирубин общий=58 мкмоль/л, прямой=24 мкмоль/л, непрямой=34 мкмоль/л. Амилаза крови 21 мг/с×л, мочевина 9,2 ммоль/л. Сахар крови=5,8 ммоль/л. АлАТ=1,3 ммоль/л, АсАТ=0,8 ммоль/л. Параметры гемокоагуляции в пределах нормы. Алкоголь в крови- 0,3‰, в моче 0,2‰.
Диастаза в моче: 150 ед.
Диагноз при поступлении: острый алкогольный панкреатит средней степени тяжести.
При генотипировании: выявлено сочетание гомозиготного делеционного варианта гена GSTM1 и гомозиготного делеционного варианта гена GSTT1, что говорит о высоком риске тяжелого течения заболевания у данного пациента и возможном неблагоприятном исходе. Учитывая полученные результаты, с 11.11.05 для дальнейшего лечения больной переведен в отделение реанимации и интенсивной терапии.
Лечение: проведена консервативная терапия, включающая обезболивание анальгином, назначение сандостатина 100 мг/сут, контрикала 40-60 т.ед./сут, спазмолитиков и холинолитиков, кваматела 40 мг/сут, цефабола 3 г/сут, инфузионная терапия в объеме до 7,5 л/сут, под контролем ЦВД и диуреза. Мониторное наблюдение, лабораторный мониториг. Несмотря на проводимое лечение состояние больного ухудшилось. Усилились боли в животе, снизилось артериальное давление, принято решение об оперативном лечении.
16.11.05 операция: Верхнесрединная лапоротомия, абдоминизация поджелудочной железы, вскрытие парапанкреатической и параколической забрюшинной клетчатки. Дренирование и марсупиализация сальниковой сумки. Назоинтестинальная интубация тонкой кишки. Санация и дренирование брюшной полости.
DS: Тотальный смешанный панкреонекроз. Парапанкреатит, параколит, разлитой ферментативный перитонит.
В послеоперационном периоде проводилась традиционная терапия, включающая коррекцию гемодинамических, водно-электролитных нарушений, спазмолитическую, антисекреторную, цитостатическую терапию, назначение блокаторов Н2-рецепторов, антибиотикотерапию, санацию гнойных затеков через установленные дренажи.
17.11.05 произведена санационная мини-лапаротомия: При ревизии мезоколон резко инфильтрирован, поперечно-ободочная кишка рыхло спаяна с нижним краем желудка, тупо и остро отделена. С техническими трудностями сальниковая сумка вскрыта. В сальниковой сумке в области хвоста поджелудочной желез, малого сальника, мезоколон и селезеночного угла толстой кишки множественные секвестры до 3-5 см. Хвост поджелудочной железы представлен отдельно лежащими некротизированными сегментами. При удалении хвоста определяется каудальная часть протока. Проток в пределах здоровых тканей прошит и перевязан. Секвестры удалены. В левой подвздошной области произведена мини-лапоротомия, без захода в брюшную полость, вскрыт забрюшинный затек, идущий вдоль левого параколического клетчаточного пространства, там же удалены отдельно лежащие секвестры. Затек вверху, в области селезеночного угла сообщен с полостью сальниковой сумки через мини-лопоротомические раны. Произведено проточное дренирование 4 трубчатыми дренажами и 2 резиновыми выпускниками.
DS: Состояние после тотального смешанного панкреонекроза. Продолжающийся гнойный парапанкреатит, флегмона забрюшинной клетчатки с поражением левого параколического пространства. Некроз хвоста поджелудочной железы. Несмотря на интенсивную полномасштабную терапию, проводимую в послеоперационном периоде, состояние пациента прогрессивно ухудшалось. 21.11.05 констатирована смерть.
Приведенный пример доказывает диагностическую и прогностическую значимость генотипирования у больных острым панкреатитом. Своевременное использование предлагаемого способа, разработка в сооответствии с полученными результатами профилактических мер до клинико-лабораторной манифестации этого заболевания, позволила бы снизить риск возникновения острого алкогольного панкреатита у данного пациента. Выявление сочетания гомозиготного делеционного варианта гена GSTM1 и гомозиготного делеционного варианта гена GSTT1 дало возможность прогнозировать высокий риск тяжелого течения заболевания у данного пациента и, учитывая длительный анамнез злоупотребления алкоголем, позднее обращение пациента, его неблагоприятный исход.
Пример 2
Больной Ф., 46 лет, доставлен 18.12.05 бригадой скорой помощи в панкреатологический центр г.Красноярска с диагнозом острый панкреатит.
Жалобы при поступлении: на боли в эпигастрии и левом подреберье опоясывающего характера, тошноту, рвоту.
Заболел 18.12.05 около 4 утра после трехдневного злоупотребления алкоголем. В анамнезе острый панкреатит, отечная форма в 2002 году.
Объективно: состояние средней степени тяжести, активен. Одышки и цианоза нет, ЧДД 20 в мин. Дыхание в легких везикулярное, проводится по всем полям. Тоны сердца ритмичные, ЧСС 86 в мин, АД - 166/107 мм рт.ст.
Язык сухой, обложен бурым налетом. Живот умеренно вздут, мягкий при пальпации. Определяется болезненность в эпигастрии и левом подреберье. Печень и желчный пузырь не пальпируются. Симптомы Воскресенского, Мейо-Робсона положительные. Симптомы раздражения брюшины отрицательные. Стул и мочеиспускание без особенностей.
По УЗИ от 18.12.05 - признаки острого панкреатита. R-граммы органов грудной клетки и живота от 18.12.05 без особенностей.
В анализах крови: Hb=154 г/л, Эр.=4,3×l012/л, L=15,1×10%, нейтрофилы - 83%, палочек - 6%, амилаза 48 мг/с×л, билирубин - общий=20,5 мкмоль/л, прямой=6,5 мкмоль/л, непрямой=14 мкмоль/л, нейтрофилы - 83%, палочек - 6%, сахар крови=4,2 ммоль/л. АлАТ=0,6 ммоль/л, АсАТ=0,8 ммоль/л. Параметры гемокоагуляции в пределах нормы. Алкоголь в крови - 0,6‰, в моче 0,4‰.
Диастаза в моче: 144 ед.
При генотипировании выявлен гомозиготный делеционный вариант гена GSTM1, что говорит о высоком риске тяжелого течения заболевания у данного пациента и возможном неблагоприятном исходе. Учитывая полученные результаты, с 19.12.05 для дальнейшего лечения больной переведен в отделение реанимации и интенсивной терапии.
Лечение: проведена консервативная терапия, включающая инфузионную терапию в объеме до 7 л/сут под контролем ЦВД и диуреза, обезболивание анальгином, назначение сандостатина 120 мг/сут, контрикала 40-60 т.ед./сут, спазмолитиков и холинолитиков, кваматела 40 мг/сут, цефабола 3 г/сут под контролем ЦВД и диуреза. Мониторное наблюдение, лабораторный мониториг. Несмотря на проводимое лечение состояние больного ухудшилось. Усилились боли в животе, снизилось артериальное давление, принято решение об оперативном лечении.
24.12.05 произведена операция: Верхнесрединная лапаротомия, абдоминизация поджелудочной железы, марсупиализация сальниковой сумки, санация и дренирование брюшной полости.
DS: Субтотальный жировой панкреонекроз, разлитой ферментативный перитонит.
В послеоперационном периоде проводилась традиционная терапия, включающая коррекцию гемодинамических, водно-электролитных нарушений, спазмолитическую, антисекреторную, цитостатическую терапию, назначение блокаторов Н2-рецепторов, антибиотикотерапию, санацию гнойных затеков через установленные дренажи.
Ранних послеоперационных осложнений не зафиксировано. В позднем послеоперационном периоде сформировался абсцесс забрюшинной клетчатки, что потребовало повторного оперативного вмешательства.
1.03.05 г: операция: релапаротомия, дренирование абсцесса забрюшинной клетчатки, секвестрэктомия.
В дальнейшем течение послеоперационного периода без осложнений. Выписан из стационара на 32 сутки. Выздоровление.
Приведенный пример указывает на прогностическую и диагностическую значимость предлагаемого способа: выявление гомозиготного делеционного варианта гена GSTM1 у пациента с ОАП доказывает, что он ассоциирован с риском его возникновения. Выявление гомозиготного делеционного варианта гена GSTM1 ("нулевого" генотипа) дало возможность прогнозировать высокий риск тяжелого течения заболевания у данного пациента, в связи с чем он своевременно был переведен в отделение реанимации и интенсивной терапии, где ему проводилась полномасштабное лечение, что привело, учитывая раннее обращение пациента, к его выздоровлению.
Предлагаемый способ позволяет:
1. Прогнозировать риск развития острого алкогольного панкреатита до его клинико-лабораторной манифестации, что дает возможность своевременно разработать меры по его профилактике.
2. Выделить группу больных с высоким риском развития осложнений и обоснованно рекомендовать им проведение полномасштабной специализированной терапии на ранних сроках.
3. В будущем определить оптимальную стратегию при лечении заболевания с точки зрения предиктивной медицины и снизить, или полностью ликвидировать, летальность у больных.
Литература
1. Ларвин М. Неотложные состояния. Острый панкреатит. // Лечащий врач. - 1998. - №1. - С.24-27.
2. Багненко С.Ф. Протоколы диагностики и лечения острого панкреатита на разных стадиях заболевания. / С.Ф.Багненко, А.Д.Толстой, В.Р.Гольцов // Неотложная и специализированная хирургическая помощь: матер. 1 конгр. моск. хирургов. - М., 2005. - С.84-85.
3. Гостищев В.К. Панкреонекроз и его осложнения, основные принципы хирургической тактики. / В.К.Гостищев, В.А.Глушко // Хирургия. - 2003. - №3. - С.50-54.
4. Деструктивный панкреатит в свете современных представлений о сепсисе. / B.C.Савельев, Б.Р.Гельфанд, В.А.Гологорский и др. // Анналы хирургии. - 1999. - №5. - С.26-29.
5. Байчоров Э.Х. Результаты применения детоксикационной терапии у пациентов с распространенным инфицированным панкреонекрозом. / Э.Х.Байчоров, Г.А.Денисенко // Неотложная и специализированная хирургическая помощь: матер. 1 конгр. моск. хирургов. - М., 2005. - С.85-86.
6. Панкреонекроз в новом тысячелетии. / Ю.А.Нестеренко, С.В.Михайлусов, В.В.Лаптев и др. // Неотложная и специализированная хирургическая помощь: матер. 1 конгр. моск. хирургов. - М., 2005. - С.106-107.
7. Проблема диагностики и лечения больных с гнойно-некротическими осложнениям острого панкреатита. / Б.С.Брискин, Г.С.Рыбаков, О.Х.Халидов и др. // Хирургия органов гепатопанкреатобилиарной зоны: матер. междунар. конф. хирургов, посвящ. 80-летию В.В.Виноградова. - М., 2000. - С.76-79.
8. Современное лечение деструктивного панкреатита и его осложнений. / С.А.Дадвани, А.М.Шулутко, П.С.Ветшев и др. // Анналы хирургии. - 2000. - №6. - С.39-42.
9. Котельникова Л.П. Интегральная шкала Balthazar-Ranson в оценке тяжести острого панкреатита. / Л.П.Котельникова, А.М.Дмитриева, О.А.Шушакова // Неотложная и специализированная хирургическая помощь: матер. 1 конгр. моск. хирургов. - М., 2005. - С.98-99.
10. Черданцев Д.В. Коррекция синдрома системной воспалительной реакции при остром панкреатите (экспериментально-клиническое исследование): автореф. дис... д-ра мед. наук / Д.В.Черданцев. - Красноярск, 2002. - 59 с.
11. Панцирев Ю.М., Мыльников А.Г., Федоров Е.Д. и др. Острый билиарный панкреатит: возможности диагностики и лечения. // Рос.журн. гастроэнтерологии, гепатологии, колопроктологии. - 1999. - №2. - С.73-80.
12. Панцирев Ю.М., Мыльников А.Г., Царев И.В. и др. Хирургическая тактика и оперативные методы лечения деструктивного панкреатита. // Вестн. РГМУ. - 2000. - №3 (13). - С.62-67.
13. Багненко С.В., Рухляда Н.В., Краснорогов В.Б. и др. Оценка методов «Хирургической детоксикации» при лечении тяжелого острого панкреатита на ранней стадии заболевания. // Анн. хирург. гепатологии. - 2002. - №1. - С.183.
14. Багненко С.Ф., Рухляда Н.В., Толстой А.Д. и др. Лечение острого панкреатита на ранней стадии заболевания: НИИ Скорой помощи им. И.И.Джанелидзе. - СПб, 2002. - 24 с.
15. Мартьянов С.Г. Острый панкреатит в свете доказательной медицины. // Панкреатит острый и хронический: Матер., междунар. конгр. хирургов. - Петрозаводск, 2002. - T.1. - С.144-146.
16. Никонов Е.Л. Клинико-патогенетические особенности различных видов антисекреторной терапии у больных кислото-зависимыми заболеваниями: автореф. дис... д-ра мед. наук. / Е.Л Никонов. - Москва, 2004. - 43 с.
17. Геном человека и гены «предрасположенности» (введение в предиктивную медицину) / А.С.Баранов, Е.В.Баранова, Т.Э.Иващенко, М.В.Асеев. - СПб.: Интермедика, 2000. - 271 с.
18. Влияние генетических и внешнесредовых факторов на формирование алкогольной болезни печени. / З.А.Шангареева, Т.В.Викторова // Мед. генетика. - 2004. - №5. - С.210-219.
19. Баранов B.C. Геномика и молекулярная медицина. / B.C.Баранов // Молекуляр. биология. - 2004. - №1. - С.110-117.
20. Анализ полиморфизма генов, участвующих в метаболизме этанола, у лиц с алкогольной болезнью печени. / З.А.Шангареева, Т.В.Викторова, Х.М.Насыров и др. // Мед. генетика. - 2003. - №11. - С.485-490.
21. Гармонов С.Ю. Аналитические методы исследования генетического полиморфизма организма человека. / С.Ю.Гармонов, М.И.Евгеньев, И.Е.Зыкова // Вопр. биол. и фармац. химии. - 2004. - №1. - С.3-19.
22. Капранов Н.И. Муковисцидоз: достижения и проблемы на современном этапе. / Н.И.Капранов, Н.Ю.Каширская, Н.В.Петрова // Мед. генетика. - 2004. - №9. - С.398-412.
23. Маев И.В. Роль мутации гена катионического трипсиногена (PRSS1-гена) в патогенезе хронического панкреатита. / И.В.Маев, Ю.А.Кучерявый // Клинич. медицина. - 2004. - №10. - С.12-16.
24. Маев И.В. Наследственные болезни поджелудочной железы. / И.В.Маев // Клинич. перспективы гастроэнтерологии, гепатологии. - 2002. - №4. - С.20-27.
25. Watanabe S. Acute pancreatitis: overview of medical aspects. / S.Watanabe // Pancreas. - 1998. - V.16, №3. - Р.307-311.
26. Bradley E.L. A clinical based classification system for acute pancreatitis. / E.L.Bradley // Arch. Surg. - 1993. - V.128. - P.586-590.
27. Ranson H.C. Prognosis signs and the role of operative managment in acute pancreatitis. / H.C.Ranson, R.M.Rifkind, D.F.Roses // Surg. Gynecol. Obstet. - 1975. - V.139. - P.29-32.
28. Knaus W.A. et al. APACHE II: A severity of disease classification system. // Crit. Care Med. - 1985. - V.13. - P.818-829.
29. Knaus W.A., Draper E.A., Wagner D.P. et al. APACHE II: A severity of disease classification system. // Crit. Care Med. - 1995. - V.13. - P.818-829.
30. Genetic polymorphism of N-acetyltransferases, glutathione S-transferase M1 and NAD (P) H: quinone oxidoreductase in relation to malignant and benign pancreatic disease risk. The International Pancreatic Disease Study Group / H.Bartsch, C.Malaveille, A.B.Lowenfels et al. // Eur. J. Cancer Prev. - 1998. - V.7, №3. - Р.215-223.
31. Mutations of the cystic fibrosis gene in patients with chronic pancreatitis. / N.Sharer, M.Schwarz, G.Malone et al. // Eng. J. Med. - 1998. - V.339. - P.645-652.
32. Gorry M.C. Multiple mutations in the cationic trypsinogen gene are associated with hereditary pancreatitis. / M.C.Gorry, D.Gabbaizadeh, W.Furey // Gastroenterology. - 1997. - V.113. - P.1063-1068.
33. CFTR, PRSS1 and SPINK1 Mutations in the Development of Pancreatitis in Brazilian Patients. / A.L.F.Bernardino, D.R.Guarita, B.M.Carlos et al. // J.Pancreas. - 2003. - V.4, №5. - P.169-177.
Способ прогнозирования клинического течения и исхода острого алкогольного панкреатита в деструктивную форму, характеризующийся тем, что осуществляют исследование генотипа пациента методом полимеразной цепной реакции, исследуют мутации генов GSTM1 и GSTT1, при обнаружении «нулевого» генотипа GSTM1 или «нулевого» генотипа GSTT1 прогнозируют развитие деструктивной формы алкогольного панкреатита, а при обнаружении сочетания «нулевых» генотипов по генам GSTM1 и GSTT1 прогнозируют развитие тотального поражения поджелудочной железы.