Способ лечения острого деструктивного панкреатита
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к хирургической гастроэнтерологии и интенсивной терапии, и может быть использовано для лечения острого деструктивного панкреатита. Для этого на фоне проведения традиционной интенсивной терапии панкреатита перед оперативным вмешательством дополнительно осуществляют внутримышечное введение галавита. При этом в стадии ферментной токсемии галавит вводят по 200 мг 1-2 раза в сутки. Затем в первые сутки после операции - по 300 мг в день однократно. В последующие дни - по 100 мг в день до исчезновения симптомов системной воспалительной реакции и нормализации уровня цитокинов в крови. После чего лечение продолжают введением галавита 1 раз в 72 часа по 100 мг. Способ обеспечивает эффективное лечение, снижение осложнений, летальности, количества повторных санаций, уменьшение количества повторных операций и продолжительности пребывания больных в стационаре за счет коррекции процессов SIRS и CAPS у данной категории больных. 7 табл., 5 ил.
Реферат
Изобретение относится к медицине, в частности к хирургической гастроэнтерологии и интенсивной терапии, и связано с лечением острого деструктивного панкреатита (ОДП) и панкреонекроза как его клинического проявления.
Острый панкреатит (ОП) в течение нескольких лет стабильно занимает второе, а по некоторым регионам - первое место в структуре неотложной хирургической патологии, опережая острый аппендицит и острый холецистит. Наиболее часто причиной заболевания является злоупотребление алкоголем и желчнокаменная болезнь, у 10-30% больных этиология острого панкреатита остается невыясненной. Панкреонекроз сопровождается высокой частотой развития шока на ранних стадиях заболевания, полиорганной недостаточностью и гнойно-некротическими осложнениями. Некроз ткани поджелудочной железы и вторичное инфицирование очагов деструкции вызывают синдром системной воспалительной реакции (SIRS - systemic inflammatory response syndrome), определяющий тяжесть и прогноз заболевания. Ведущую роль в развитии гнойно-септических осложнений и генерализации инфекции, по мнению ряда авторов, играет вторичный иммунодефицит. Причины иммуносупрессии при деструктивном панкреатите разнообразны, ряд авторов указывают, что непосредственное участие в этом процессе принимают панкреатогенные токсины, нарушения механизмов гуморальной регуляции иммунитета и возникающий синдром компенсаторного противовоспалительного ответа (CAPS - compensatory anti-inflammatory response syndrome) [Панкреонекроз и панкреатогенный сепсис. Состояние проблемы / B.C.Савельев, М.И.Филимонов, Б.Р.Гельфанд, С.З.Бурневич // Анналы хирургии. - 2003. - №1. - С.12-19, или Сыновец О.А. Модуляция цитокинового каскада как один из патогенетических механизмов формирования острого экспериментального панкреатита / О.А.Сыновец // Рос.журн. гастроэнтерологии, гепатологии, колопроктологии. - 2000. - К6. - С.37-41., или Bone R.C. Sepsis, SIRS and CARS / R.C. Bone // Crit. Care Med. - 1996. - V.24. - P.1125-1129].
Таким образом, иммунологические нарушения занимают одно из ведущих мест в патогенезе панкреатита. Однако до настоящего времени не разработаны пути иммунокоррекции при этом заболевании.
Ближайшим аналогом предлагаемого способа можно считать современный традиционный комплекс лечения, включающий оперативное вмешательство, коррекцию гемодинамических, водно-электролитных нарушений, спазмолитическую, антисекреторную, цитостатическую и антибиотикотерапию (см., например, Лечение острого панкреатита на ранней стадии заболевания: Учеб. пособие / С. Петерб. НИИ скорой помощи им. И.И.Джанелидзе / С.Ф.Багненко, Н.В.Рухляда, А.Д.Толстой и др. - СПб., 2002 - 24 с., или Панкреонекроз и панкреатогенный сепсис. Состояние проблемы / B.C. Савельев, М.И.Филимонов, Б.Р.Гельфанд, С.З.Бурневич // Анналы хирургии. - 2003. - №1. - С.12-19., или Watanabe S. Acute pancreatitis: overview of medical aspects / S. Watanabe // Pancreas. - 1998. - V.16, №3. - Р.307-311.). В тоже время эти комплексные методы лечения не учитывают роль SIRS и CAPS в развитии заболевания, что часто приводит к неблагоприятным исходам лечения.
Задача изобретения: предложить патогенетически обоснованную иммунокоррекцию системных нарушений у больных ОДП с помощью отечественного препарата «Галавит».
Для этого на фоне проведения традиционного лечения использовано внутримышечное введение галавита, дозу и режим введения которого определяли в зависимости от стадии заболевания и этапов лечения. В стадию ферментной токсемии в дозе 200 мг 1-2 раза в сутки. В первые сутки после операции - 300 мг однократно. В последующие дни - по 100 мг в сутки до исчезновения симптомов системной воспалительной реакции (гипертермии, тахикардии, тахипноэ) и нормализации уровня цитокинов в крови, после чего продолжали введение 1 раз в 72 часа по 100 мг.
Работа носила клинический характер, была выполнена на кафедре общей хирургии Красноярской государственной медицинской академии, расположенной на базе центра хирургической панкреатологии г. Красноярска, включала результаты исследований, проведенных у 52 больных панкреонекрозом, из них 32 мужчины (61,5%) и 20 женщин (38,5%). Возраст больных колебался от 30 до 58 лет.
У 39 больных (75%) в момент поступления были выявлены признаки синдрома системной воспалительной реакции по шкале признаков R. Bone (1991). У 13 больных (25%) клинические проявления SIRS развились в хирургическом отделении.
В зависимости от задач исследований больные были разделены на две группы, равнозначные по половому, возрастному показателям, давности начала заболевания, этиологии, клинико-морфологическим формам заболевания и тяжести состояния пациентов. Распределение больных по группам представлено в таблице 1.
У большинства больных преобладала средняя степень тяжести заболевания (76,9%), тяжелая степень зафиксирована у 23,1%. Группу сравнения составили 22 больных деструктивным панкреатитом, получавших традиционную терапию, включающую коррекцию гемодинамических, водноэлектролитных нарушений, спазмолитическую, антисекреторную, цитостатическую терапию, блокаторы Н2-рецепторов, антибиотикотерапию. В случае необходимости осуществляли инотропную стимуляцию и аппаратную поддержку дыхательной деятельности.
Объем и состав инфузионной терапии зависел от исходного состояния центральной и периферической гемодинамики, степени нарушения водно-электролитного баланса и компенсаторных возможностей миокарда. В среднем, при средней степени тяжести объем инфузии составлял 50 мл/кг, при тяжелом панкреатите достигал 70 мл/кг.
Все больные были подвергнуты хирургическому лечению. Сроки выполнения ранних операций колебались от 12 до 72 часов с момента поступления в стационар, поздние оперативные вмешательства производились на 10-14 сутки. Показаниями к операции в ранние сроки заболевания были неэффективность консервативной терапии в течение первых 3-х суток с момента госпитализации, проявляющаяся в прогрессировании тяжести заболевания, появление симптомов перитонита, сочетание панкреатита и деструктивного холецистита, нарастающая механическая желтуха без возможности разрешения эндоскопическими способами декомпрессии желчевыводящих путей. В случае успешной консервативной терапии удавалось добиться стабилизации состояния пациентов, локализовать очаг воспаления и выполнить оперативное лечение в отсроченном периоде по поводу гнойных осложнении.
В первой группе больных панкреонекрозом на фоне проведения традиционной интенсивной терапии и оперативного вмешательства исследовали изменения показателей иммунного статуса, цитокинового спектра, уровня оксида азота и активность процессов апоптоза иммунокомпетентных клеток.
У пациентов второй группы в комплекс традиционной инфузионной терапии включали иммуномодулирующую терапию препаратом галавит. Препарат вводили внутримышечно, дозу подбирали индивидуально, основываясь на выраженности иммунных нарушений. В стадию ферментной токсемии вводили 200 мг препарата 1-2 раза в сутки, в первые сутки после операции дозу увеличивали до 300 мг однократно. В остальные дни галавит вводили по 100 мг в сутки до нормализации уровня цитокинов, после чего продолжали введение один раз в 72 часа по 100 мг.
Распределение больных по группам представлены в табл.1.
Все больные подверглись оперативному лечению. Выбор метода и сроков оперативного вмешательства зависели от характера патологического процесса (табл.2).
Иммуномодулятор «Галавит», выпускаемый ЗАО «ЦСМ «Медикор», г. Москва, представляет собой 5-амино-1,2,3,4-тетрагидрофталазин-1,4-диона натриевую соль. Препарат обладает способностью восстанавливать эффекторные механизмы иммунитета за счет опосредованного действия через презентативную функцию макрофагов, регуляцию синтеза IL-1, IL-6, фактора некроза опухоли, IL-2, естественных киллеров (NK-клеток) путем обратимого ингибирования синтеза гиперактивированными макрофагами РНК и ДНК провоспалительных цитокинов на 6-8 часов или стимулирования их при исходной недостаточности. При этом галавит способен восстанавливать угнетенную фагоцитарную функцию макрофагов и нейтрофилов и, следовательно, противоинфекционную защиту. Имеются сообщения также о детоксикационном действии препарата.
Результаты применения иммунокорригирующей терапии галавитом у больных панкреонекрозом.
Как правило, инфицирование очагов некробиоза ткани ПЖ вторично, развивается на 2-3 неделе заболевания и вызывается, в основном, условно-патогенными возбудителями, что возможно только в иммунокомпрометированном организме. При инфекции, вызванной условно-патогенными возбудителями, иммунное распознавание патогена и его эрадикация осуществляется с участием клеточного звена иммунитета. Доказано, что основной причиной вторичного инфицирования является транслокация бактерий из просвета кишечника и анергия клеточных эффекторов, поэтому от активации этих эффекторов зависят процессы выздоровления.
Изменения в иммунной системе, зафиксированные у больных 1 группы, получавших традиционную терапию, доказывают неспособность иммунитета противостоять микробной атаке уже на ранних сроках развития панкреонекроза (табл.3, 4). В условиях напряжения биологических систем адаптации в ответ на воздействие инфекционных агентов синтез цитокинов активируется, что вызывает временное или постоянное нарушение регуляции продукции некоторых цитокинов, в частности IL-2, IL-6, и фактора некроза опухоли.
В настоящее время нет исследований, посвященных изучению эффективности применения галавита при лечении больных острым панкреатитом. Нет стандартизированных схем его использования на различных стадиях развития острого деструктивного панкреатита, не изучено его влияние на продукцию провоспалительных цитокинов, выраженность системной воспалительной реакции и развитие вторичного иммунодефицита при панкреонекрозе.
Эффективность применения галавита изучена у 30 больных острым деструктивным панкреатитом, которые составили 2-ю группу. У всех пациентов исследуемой группы в момент поступления присутствовали признаки системной воспалительной реакции, у 73,3% пациентов состояние соответствовало средней степени тяжести, у 26,7% - тяжелой.
Все больные 2-й группы были подвергнуты оперативному лечению, показания к операции и методики выполнения были аналогичными первой группе. В ранние сроки после госпитализации операции из лапаротомного доступа были выполнены 12 больным (40%), лапароскопическим способом оперировано 10 (33,3%) больных. Десять больных оперированы в стадии формирования гнойных осложнений, из них восемь - с помощью набора «Мини-ассистент», двое - традиционным способом по причине разлитого гнойного перитонита вследствие вскрытия абсцесса сальниковой сумки в брюшную полость.
Изучение иммунного статуса больных, которым проводилась иммунокоррекция галавитом, показало, что, как и в группе сравнения, у пациентов 2-й группы в первые сутки после операции не было существенных нарушений основных показателей иммунограммы. На 7 сутки наблюдения происходило достоверное повышение процентного содержания фракции CD2+ (64,5±3,7%) по сравнению с исходными показателями. На протяжении всего периода исследования фагоцитарный индекс возрастал, достигая на 14 сутки нормальных значений, тогда как у пациентов 1-й группы указанный в эти сроки показатель оставался пониженным (табл.5).
На 14 сутки лечения у больных 2-й группы восстанавливались значения процентного и абсолютного содержания общего количества лимфоцитов крови, фракций CD2+, CD4+ и иммунорегуляторного индекса. Концентрация иммуноглобулинов Ig A, Ig G, Ig M соответствовала норме и достоверно отличалась от первоначальных показателей. Наблюдалось более существенное снижение, относительно исходных цифр, уровня циркулирующих иммунных комплексов (26,4±1,7 у.е.), в то время как в группе больных, получавших традиционную терапию, происходило достоверное увеличение ЦИК.
В пользу эффективности предложенной схемы иммунокорригирующей терапии с применением препарата галавит свидетельствует нормализация уровня АБОК на 14 сутки наблюдения у больных исследуемой группы.
Исследование цитокиновой регуляции на фоне терапии галавитом выявило принципиальные отличия в динамике изменений основных показателей по сравнению с данными 1 группы (табл.6).
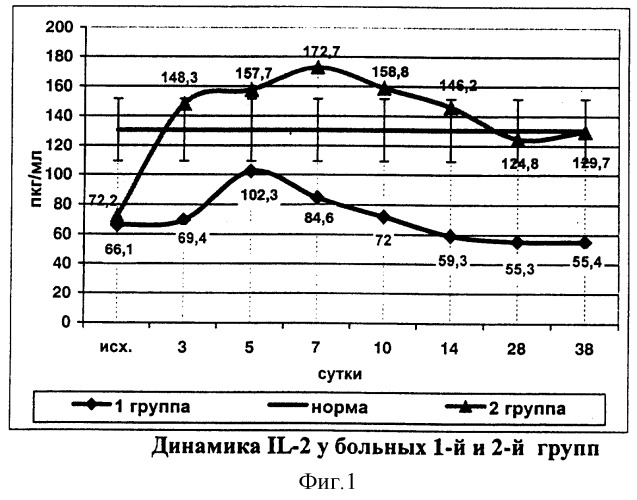
На фоне проводимой терапии уже на 3 сутки отмечалось повышение концентрации IL-2 до нормальных цифр (148,3±5,4 пг/мл). Тенденция к повышению показателя сохранялась до 7 суток наблюдения, в эти сроки зафиксирована максимальная концентрация IL-2 (172,1±2,6 пг/мл). В последующие сутки происходило снижение показателя и до конца наблюдения значения указанного цитокина находились в пределах нормы.
В группе сравнения уровень IL-2, после достижения нормальных значений к 5 суткам, прогрессивно снижался до критически низких цифр (фиг.1). Этот факт подтверждает целесообразность раннего применения иммунокорригирующей терапии для лечения больных панкреонекрозом.
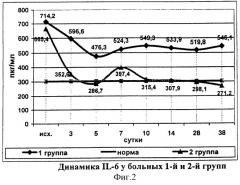
Применение галавита в комплексе с базовой традиционной терапией у больных 2-й группы позволило уже на третьи сутки снизить концентрацию IL-6 в 1,9 раза, а на 5 сутки данный показатель достигал нормальных значений (286,7±8,2 пг/мл). Далее после умеренного увеличения концентрации исследуемого цитокина на 7 сутки (397,4±4,5 пг/мл) уровень IL-6 колебался в пределах нормы до конца наблюдения, в отличие от 1-й группы, в которой уровень IL-6 был повышенным на протяжении всего периода наблюдения, а начиная со второй недели заболевания имел тенденцию к увеличению (фиг.2).
На 7 сутки наблюдения концентрация IL-2 и IL-6 у больных исследуемой группы превышала нормальные значения на 31,9% и 31,1% соответственно, что свидетельствует о положительном влиянии применяемого способа лечения на развитие адекватного иммунного ответа в стадию формирования перипанкреатического инфильтрата и в определенной степени способствует предупреждению развития инфицирования очагов воспаления.
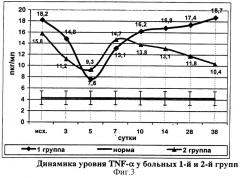
При поступлении концентрация TNF-α у больных 2-й группы, как и в группе сравнения, в несколько раз превышала нормальные значения. На третьи сутки уровень TNF-α у пациентов исследуемой группы был достоверно ниже, чем в группе сравнения, на 5 сутки достигал верхней границы нормы (9,3±2,2 пг/мл), но при этом достоверно не отличался от аналогичных показателей группы сравнения. На 7 сутки концентрация TNF-α вновь возрастала и приближалась к первоначальному уровню (14,7±1,6 пг/мл), после этого на протяжении остального периода наблюдения у больных 2-й группы прослеживалась стойкая тенденция к снижению уровня фактора некроза опухоли, тогда как в группе сравнения отмечалось возрастание показателя (фиг.3).
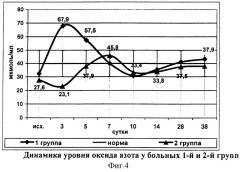
Исходно концентрация оксида азота у больных 2-й группы составляла 27,6±1,3 мкмоль/мл и достоверно не отличалась от показателей группы сравнения (фиг.4).
На третьи сутки регистрировалось достоверное снижение показателя до 23,1±1,4 мкмоль/мл, в отличие от больных 1 группы, у которых в этот период наблюдалось значительное увеличение уровня оксида азота. На 7 сутки содержание оксида азота у больных исследуемой группы увеличивалось до максимального уровня (45,8±2,6 мкмоль/мл), однако уже на 10 сутки показатель снижался до нижней границы нормы и оставался в этих пределах до окончания наблюдения.
Обращает на себя внимание существенная разница уровня оксида азота в ранние сроки развития панкреонекроза между пациентами группы сравнения исследуемой группы. Установлено, что чрезмерное повышение концентрации оксида азота в первые несколько суток заболевания увеличивает риск развития гнойно-некротических осложнений на 2-3 неделях наблюдения.
У больных 2-й группы, благодаря положительному влиянию галавита на метаболические и иммунорегуляторные процессы, не происходило критического увеличения концентрации NO на третьи сутки наблюдения. Вероятно, стабилизация концентрации оксида азота на ранней стадии заболевания способствует снижению индукции синтеза провоспалительных цитокинов, предупреждая тем самым чрезмерный выброс противовоспалительных цитокинов и, следовательно, развитие истощения и декомпенсации иммунной системы организма.
Активация нитроксидергической системы на 7 сутки является результатом направленного действия провоспалительных цитокинов для обеспечения адекватной антимикробной защиты. Уменьшение же концентрации оксида азота в эти сроки у больных 1-й группы свидетельствует о снижении способности организма противостоять микробной агрессии.
Необходимо отметить, что максимальные значения уровня оксида азота и TNF-α наблюдались в одни и те же сроки, что, вероятно, обусловлено стимулирующим влиянием иммуномоделирующей терапии галавитом на механизмы антимикробной защиты и клеточное звено иммунитета в ответ на микробную атаку. Клинически именно на второй неделе происходит присоединение вторичной инфекции и формирование инфицированного панкреонекроза.
Положительное влияние иммунокорригирующей терапии было зарегистрировано и при исследовании динамики апоптоза иммунокомпетентных клеток периферической крови.
На протяжении первых 5 суток наблюдался низкий процент апоптоза ИКК, на 7 сутки происходило его умеренное увеличение (до 6%), после чего показатель достоверно снижался до 4%, в дальнейшем уровень апоптоза ИКК имел тенденцию к снижению и к концу наблюдения регистрировались минимальные значения (фиг.5).
Таким образом, предложенный метод лечения острого деструктивного панкреатита обладает направленным иммунорегулирующим воздействием, предотвращая избыточную продукцию медиаторов воспаления на раннем этапе развития заболевания и стимулируя их синтез в позднем периоде. Это способствует снижению патологических эффектов системной воспалительной реакции, устранению дисбаланса провоспалительных цитокинов и предупреждает развитие в последующем иммунодепрессивного состояния. Нормализация уровня эндогенного IL-2 способствует своевременной стимуляции клеточного звена иммунитета. Стабилизация уровня оксида азота в ранние сроки развития заболевания способствует снижению частоты как ранних, так и поздних осложнений.
Анализ частоты развития осложнений у пациентов 2-й группы выявил достоверное снижение общего количества как ранних, так и поздних осложнений по сравнению с больными, получавшими традиционную терапию (табл.7).
В группе сравнения отмечено относительно равное количество ранних и поздних осложнений, но при этом преобладали цифры ранней летальности. Кроме того, в этой группе зафиксировано наибольшее количество повторных санаций (50%). Релапаротомия потребовалась в четырех случаях, такое же количество санаций было необходимо у пациентов, оперированных набором инструментов «Мини-ассистент», а после выполнения в первые двое суток лапароскопических вмешательств трем пациентам (13,6%) спустя 10-14 суток выполнялись повторные операции по поводу продолжающегося панкреонекроза и развития гнойных осложнений.
Во 2-й группе больных применяемый метод лечения позволял стабилизировать состояние больных на раннем этапе лечения, уменьшить проявления SIRS, что обусловливало достоверное снижение как ранних, так и поздних осложнений. Ранняя стабилизация нитроксидергической системы и уровня провоспалительных цитокинов способствовало достоверному снижению проявлений системного воспаления и гнойных осложнений по сравнению с группой сравнения, сохранению адекватного иммунного ответа на всех периодах, у больных 2-ой группы в три раза реже развивался панкреатогенный шок, на 30% реже - дыхательная и на 40% - печеночно-почечная недостаточность.
На фоне лечения у больных 2-й группы только в 3-х случаях панкреонекроз осложнился развитием флегмоны забрюшинного пространства, в 2-х - гнойным перитонитом, у 4-х пациентов в позднем послеоперационном периоде сформировался абсцесс сальниковой сумки. Летальность в исследуемой группе составила 16,7%, что на 15,1% ниже, чем в группе сравнения.
Помимо снижения показателей осложнений и летальности в пользу эффективности предложенного метода лечения свидетельствует достоверное уменьшение количества повторных операций у больных 2-й группы. Так, из 30 больных данной группы, повторные оперативные вмешательства были выполнены в 26,6%, что на 27,7% ниже аналогичных показателей группы сравнения.
Снижение частоты развития осложнений в раннем и позднем периоде заболевания позволили сократить длительность пребывания больных 2-й группы в стационаре в среднем на 8 суток.
Клинические примеры
Клинический пример №1 (ранняя операция)
Больная X., 56 лет, номер истории болезни 4067, поступила в центр хирургической панкреатологии города Красноярска 25 мая 2005 года с диагнозом острый панкреатит. Доставлена врачом «Скорой помощи». В приемном покое обследована. Из анамнеза выяснено, что больная употребляла в течение 5 дней суррогаты алкоголя в дозе не менее 500 миллилитров в сутки. На 6 сутки после употребления алкоголя появились интенсивные тупые боли в эпигастральной области, в динамике боли усилились, приняли опоясывающий характер, появилась тошнота, несколько раз больную вырвало, рвота не принесла облегчения. При объективном обследовании кожа бледная, влажная, холодная на ощупь, частота дыхательных движений 20 в минуту, частота сердечных сокращений 90 в минуту, артериальное давление 90/60 мм рт. ст. Язык сухой, живот не вздут, верхняя половина отстает в дыхании, при пальпации напряженный, болезненный в мезогастральной и эпигастральной областях. Положительные симптомы Керте, Чухриенко, симптомы раздражения брюшины сомнительные. Перистальтика вялая, газы не отходят, стула не было.
Результаты лабораторных исследований - в общем анализе крови Нв 160 г/л, лейкоциты 12,6×109/л, билирубин 35,0 мкмоль/л, амилаза 92 г/ч·л, мочевина 8,7 ммоль/л. IL-2 98,3 пг/мл, IL-6 512,1 пг/мл, TNF-α 8,4 пг/мл, концентрация оксида азота 46,7 мкмоль/мл. Общий анализ мочи - без особенностей.
Результаты инструментальных методов обследования - ЭКГ- метаболические изменения в миокарде. По данным УЗИ - поджелудочная железа увеличена в размерах, структура гипоэхогенная, в полости сальниковой сумки до 200 миллилитров жидкости. Заключение - острый панкреатит, оментобурсит. На ФГС - в просвете большое количество слизи, желчи, в антральном отделе - масса острых плоских эрозий.
На основании полученных данных установлен диагноз - тяжелый острый панкреатит алкогольной этиологии, оментобурсит.
Больной назначено консервативное лечение - внутривенные инфузии солевых растворов, глюкозоновокаиновой смеси со спазмолитиками в общем объеме 2500 миллилитров в сутки. Сандостатин по 100 миллиграммов 2 раза в сутки подкожно. Ципрофлоксацин по 1 грамму 2 раза в сутки внутривенно. Галавит по 200 миллиграммов 2 раза в сутки внутримышечно.
Несмотря на проводимое лечение, состояние больной ухудшилось, появились симптомы перитонита. Принято решение о выполнении операции из видеолапароскопического доступа. Под эндотрахеальным наркозом проведена операция. Во время оперативного вмешательства из брюшной полости извлечено до 3 литров геморрагического выпота, на париетальной брюшине обнаружены бляшки стеатонекроза. Рассечена желудочно-ободочная связка, в сальниковой сумке до 300 миллилитров выпота, осушен. Тело и головка железы темно-вишневого цвета с подкапсульными кровоизлияниями, парапанкреатическая клетчатка имбибирована экссудатом. Произведена абдоминизация поджелудочной железы, санация, дренирование сальниковой сумки и свободной брюшной полости. Послеоперационный диагноз - субтотальный алкогольный геморрагический панкреонекроз, парапанкреатит, оментобурсит, разлитой ферментативный перитонит.
В послеоперационном периоде находилась на лечении в реаниматологическом отделении. Получала инфузионную терапию, секретолитики, антибиотики, симптоматическое лечение. С противовоспалительной и иммуномодулирующей целью в первые сутки после операции однократно введено 300 миллиграммов галавита. Затем до исчезновения симптомов системной воспалительной реакции и нормализации уровня провоспалительных цитокинов и оксида азота - по 100 миллиграммов галавита в день, а далее - по 100 миллиграммов галавита один раз в три дня.
Течение послеоперационного периода было гладким. Инфицирования очагов некроза поджелудочной железы и забрюшинной клетчатки не произошло. Дренажи из брюшной полости удалены на 5 сутки после операции, из сальниковой сумки - на 10 сутки после операции. Повторных оперативных вмешательств не потребовалось. Заживление послеоперационных швов первичным натяжением, выписана в удовлетворительном состоянии через 15 суток после операции.
Клинический пример №2 (поздняя операция)
Больная Р., 50 лет, номер истории болезни 3123, поступила в центр хирургической панкреатологии города Красноярска 22 февраля 2005 года с диагнозом постхолецистэктомический синдром, острый панкреатит. Доставлена врачом «Скорой помощи». В приемном покое обследована. Из анамнеза выяснено, что боли появились после употребления жирной пищи. В динамике боли усилились, приняли опоясывающий характер, самостоятельно принимала спазмолитики - без эффекта. Из анамнеза выяснено, что в 2000 году была оперирована по поводу желчнокаменной болезни, произведена холецистэктомия из минидоступа. После операции не реже 2 раз в год появляются интенсивные боли в животе, по поводу чего лечится в стационаре. При объективном обследовании кожа теплая, влажная, частота дыхательных движений 16 в минуту, частота сердечных сокращений 80 в минуту, артериальное давление 120/80 мм рт. ст. Язык суховат, живот не вздут, верхняя половина отстает в дыхании, при пальпации напряженный, болезненный в мезогастральной и эпигастральной областях. Положительные симптомы Керте, Чухриенко, симптомов раздражения брюшины нет. Перистальтика выслушивается, газы отходят, стула не было.
Результаты лабораторных исследований - в общем анализе крови Нв 125 г/л, лейкоциты 10,6×109/л, билирубин 25,0 мкмоль/л, амилаза 43 г/ч·л, мочевина 5,6 ммоль/л. IL-2 135,2 пг/мл, IL-6 217,1 пг/мл, TNF-α 4,2 пг/мл, концентрация оксида азота 21,4 мкмоль/мл. Общий анализ мочи - без особенностей.
Результаты инструментальных методов обследования - ЭКГ - признаки гипертрофии левого желудочка. По данным УЗИ - поджелудочная железа обычных размеров, эхоструктура неоднородная. Заключение - диффузные изменения в поджелудочной железе. На ФГС - атрофический гастрит.
На основании полученных данных установлен диагноз - постхолецистэктомический синдром, острый панкреатит легкой степени тяжести.
Больной назначено консервативное лечение - внутривенные инфузии глюкозоновокаиновой смеси со спазмолитиками в общем объеме 800 миллилитров в сутки. Сандостатин по 100 миллиграммов 1 раз в сутки подкожно.
На вторые сутки пребывания в стационаре выполнена ретроградная холангиопанкреатография, установлен диагноз - стенозирующий папиллит, выполнена эндоскопическая папиллосфинктеротомия.
После операции состояние больной резко ухудшилось. Усилились боли, появилась тошнота, несколько раз вырвало. Возникла одышка, увеличилась частота сердечных сокращений, снизилось артериальное давление. Больная переведена в реаниматологическое отделение. Усилено консервативное лечение, с иммуномодулирующей и противовоспалительной целью назначен галавит. В течение первых 2 суток нахождения в реаниматологическом отделении вводилось по 200 миллиграммов галавита один раз в сутки внутримышечно. Затем по 100 миллиграммов один раз в сутки на протяжении 7 дней.
Через 7 суток выполнена компьютерная томография органов брюшной полости. Установлено наличие жидкостного образования в параколической клетчатке справа. Полость пунктирована под контролем УЗИ, из полости получен гной. Принято решение выполнить операции из мини-доступа.
Через семь суток больная была оперирована по поводу субтотального панкреонекроза, флегмоны ретродуоденальной и параколической клетчатки справа. Произведена абдоминизация поджелудочной железе, оментобурсостомия, люмборетроперитонеостомия, илеоретроперитонеостомия, роточное дренирование сальниковой сумки и забрюшинной клетчатки.
В первые сутки после операции кроме традиционной терапии однократно внутримышечно введено 300 миллиграммов галавита, затем до нормализации уровня цитокинов и исчезновения симптонов системной воспалительной реакции - по 100 миллиграммов галавита внутримышечно один раз в сутки, далее - по 100 миллиграммов галавита один раз в три дня.
Течение послеоперационного периода было гладким. На фоне применения галавита полости быстро очистились, повторных операций не потребовалось. Замена дренажей на более тонкие произведена через 7 суток после операции, удаление дренажей - через 14 суток после операции. Повторных оперативных вмешательств не потребовалось. Выписана в удовлетворительном состоянии через 20 суток после операции.
Таким образом, наиболее низкие показатели осложнений, летальности, количества повторных санаций и продолжительность пребывания больных в стационаре зафиксированы в группе больных, получавших иммунокорригирующую терапию с применением галавита. Это позволяет сделать вывод о целесообразности включения в комплекс лечебных мероприятий больных панкреонекрозом иммунокорригирующей терапии направленного действия для купирования процессов SIRS и CAPS. При этом согласно проведенным исследованиям иммунокоррекцию галавитом необходимо начинать на ранних стадиях развития заболевания.
Способ лечения острого деструктивного панкреатита, включающий оперативное вмешательство и проведение традиционной интенсивной терапии панкреатита, отличающийся тем, что дополнительно осуществляют внутримышечное введение галавита, при этом в стадии ферментной токсемии галавит вводят по 200 мг 1-2 раза в сутки, затем в первые сутки после операции - по 300 мг в день однократно, а в последующие дни - по 100 мг в день до исчезновения симптомов системной воспалительной реакции и нормализации уровня цитокинов в крови, после чего лечение продолжают введением галавита 1 раз в 72 ч по 100 мг.