Способ прекондиционирования миокарда
Иллюстрации
Показать всеОсуществляют воздействие на миокард ультразвуковыми колебаниями с частотой 100-300 кГц и энергетической экспозицией 250-750 Дж/см2. Способ обеспечивает малоинвазивность, позволяет избежать значимых побочных эффектов, обеспечивает возможность профилактического прекондиционирования миокарда в амбулаторных условиях. 2 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится к медицине, а именно к кардиологии, и может быть использовано для прекондиционирования миокарда.
Ишемическая болезнь сердца (ИБС), в частности ее наиболее тяжелая клиническая форма - инфаркт миокарда - являются ведущей причиной смертности и инвалидизации в большинстве промышленно развитых стран мира. В связи с этим поиск профилактических воздействий, способных ослаблять выраженность ишемического повреждения миокарда, остается одной из важнейших задач современной кардиологии. Актуальной проблемой является также уменьшение ятрогенного ишемического повреждения миокарда при глобальной ишемии, инициируемой кардиоплегией и подключением аппарата искусственного кровообращения (АИК) в кардиохирургии. Комплекс профилактических мероприятий, направленных на повышение устойчивости миокарда к ишемическому повреждению и уменьшение его последствий, получил название прекондиционирования (ПК).
Известен способ ишемического ПК, который применяется в кардиохирургической практике с целью ослабления последствий ишемического и реперфузионного повреждения миокарда, вызванного необходимостью остановки сердца в ходе кардиоплегии. Способ заключается в создании одного или двух эпизодов ишемии миокарда, выполненных с помощью кратковременных (1-5 минут) наложений зажима на аорту перед продолжительным пережатием аорты. В частности, в нескольких исследованиях был получен достоверный защитный эффект ПК, выполненного в виде 2 эпизодов 2-минутной ишемии миокарда с последующей 3-минутной реперфузией (1. Wu Z.К., Tarkka M.R., Pehkonen E., Kaukinen L, Honkonen E.L., Kaukinen S. Beneficial effects of ischemic preconditioning on right ventricular function after coronary artery bypass grafting. Ann Thorac Surg 2000; 70(5): 551-557; 2. Wu Z.К., Tarkka M.R., Eloranta J., Pehkonen E., Laurikka J., Kaukinen L., Honkonen E.L., Vuolle M., Kaukinen S. Effect of ischaemic preconditioning, cardiopulmonary bypass and myocardial ischaemic/reperfusion on free radical generation in CABG patients. Cardiovasc Surg 2001; 9(4): 362-368). Кардиопротективный эффект ишемического ПК проявлялся, в частности, в меньшей сывороточной концентрации тропонина I в послеоперационном периоде и больших значениях фракции изгнания левого и правого желудочка и сердечного индекса. В результате ишемического ПК сокращалось время искусственной вентиляции легких в послеоперационном периоде, и требовалась меньшая инотропная поддержка.
К недостаткам способа ишемического ПК следует отнести необходимость обеспечения оперативного доступа к сердцу, что является высокоинвазивной процедурой и ограничивает использование данного способа только кардиохирургической практикой. Кроме того, окклюзия аорты или коронарной артерии, поврежденной атеросклеротическим процессом, может способствовать развитию атероэмболических осложнений как со стороны сердца, так и со стороны отдаленных органов.
Известен способ ПК миокарда с помощью фармакологических препаратов. Такой подход получил название фармакологического ПК. Известны кардиопротективные свойства аденозина и агонистов аденозиновых рецепторов. Выделяют три варианта применения аденозина для защиты миокарда в кардиохирургии (VintenJohansen J., Zhao Z.Q., Corvera J.S., Morris C.D., Budde J.M., Thourani V.H., Guyton R.A. Adenosine in myocardial protection in on-pump and off-pump cardiac surgery. Ann Thorac Surg 2003; 75: S691-S699): профилактический (внутривенная инфузия до подключения АИК), в ходе кардиоплегии (обогащение аденозином кардиоплегического раствора), а также в ходе реперфузии (введение перед снятием зажима с аорты или немедленно после него). Сочетание аденозин-обогащенной кардиоплегии с дополнительным введением аденозина в момент реперфузии приводит к меньшей частоте электрической дефибрилляции и меньшим уровням интерлейкина-6 в сыворотке.
Хорошие результаты были получены и при профилактическом использовании глюкозо-инсулино-калиевой смеси, а также ингаляционных анестетиков. Так, у пациентов, проходящих аорто-коронарное шунтирование, выполненная перед кардиоплегией ингаляция изофлюрана приводила к значимому уменьшению повреждения миокарда, оцененному по концентрации тропонина I и активности MB фракции креатинфосфокиназы (Belhomme D., Peynet J., Louzy M. Evidence for preconditioning by isoflurane in coronary artery bypass graft surgery. Circulation 1999; 100(19): II340-II344).
Преимущество данного подхода заключается в том, что для его реализации не требуется создания ишемических эпизодов, а следовательно, исключается возможность любых отрицательных последствий ятрогенно вызванной ишемии.
Клиническое профилактическое использование многих препаратов, используемых для фармакологического ПК в эксперименте (например, аденозина, опиоидных пептидов, катехоламинов), затрудняется вследствие неустойчивости эффекта и быстрого формирования толерантности к ним. В частности, инфузия агонистов А1 аденозиновых рецепторов вызывает у кроликов наступление тахифилаксии в отношении кардиопротективного эффекта аденозина уже через 3 дня (Tsuchida A., Thompson R., Olsson R.A., Downey J.M. The anti-infarct effect of an adenosine A1-selective agonist is diminished after prolonged infusion as is the cardio-protective effect of ischemic preconditioning in rabbit heart. J Mol Cell Cardiol 1994; 26(3); 303-311). Помимо этого, побочные и токсические эффекты фармакологических препаратов нередко делают их использование для повышения устойчивости миокарда к ишемии в клинике рискованным и неоправданным.
Технический результат, достигаемый настоящим изобретением, заключается в уменьшении инвазивности воздействия, а также в отсутствии значимых побочных эффектов, что обеспечивает возможность использования предлагаемого способа в амбулаторных условиях, а также, по ряду показаний, и его внебольничного использования пациентами без участия медицинского персонала.
Сущность изобретения заключается в достижении указанного технического результата в способе прекондиционирования миокарда, предусматривающем воздействие на миокард ультразвуковыми колебаниями с частотой 100-300 кГц и энергетической экспозицией 250-750 Дж/см2.
Излучатель ультразвуковых колебаний целесообразно размещать на поверхности грудной клетки в проекции сердца. Такое размещение излучателя обеспечивает возможность профилактического использования предлагаемого способа в амбулаторных условиях, а также, по ряду показаний, и его внебольничного использования пациентами без участия медицинского персонала.
При использовании способа в кардиохирургической клинике воздействие осуществляют интраоперационно непосредственно на поверхность сердца.
Заявленные параметры ультразвукового (УЗ) воздействия - частота от 100 до 300 кГц (длина волны от 5 до 30 мм) и энергетическая экспозиция от 250 до 750 Дж/см2 были выбраны, исходя из следующих экспериментальных данных. В соответствии с результатами наших экспериментов УЗ-воздействие с частотой менее 100 кГц и энергетической экспозицией менее 250 Дж/см2 не обеспечивает повышения устойчивости миокарда к ишемическому повреждению. По-видимому, эффект УЗ-излучения с указанными характеристиками является подпороговым и не сопровождается активацией внутриклеточных механизмов, ответственных за реализацию ПК. С другой стороны, выбор верхнего предела диктовался необходимостью избежать значимых побочных эффектов УЗ, как-то: повышения температуры миокарда и лежащих на пути воздействия анатомических структур более, чем на 1,0-1,5°С, появления нарушений ритма сердца и повышения конечно-диастолического давления в левом желудочке.
Используемые режимы УЗ-воздействия укладываются в рамки низкочастотного малоинтенсивного терапевтического УЗ. Процедура воздействия на сердце терапевтическим УЗ малоинвазивна, т.к. не требует обеспечения доступа к сердцу и не связана с какими-либо хирургическими манипуляциями.
Малая инвазивность воздействия УЗ обеспечивает возможность использования предлагаемого способа в амбулаторных условиях, а также, по ряду показаний, и его внебольничного использования пациентами без участия медицинского персонала.
Экспериментально показано отсутствие значимых побочных эффектов при использовании предложенных режимов воздействия УЗ, что свидетельствует об относительной безопасности данного способа.
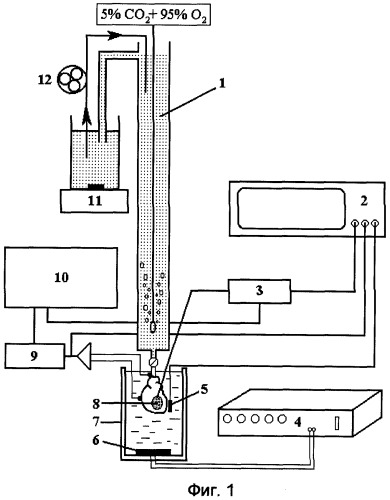
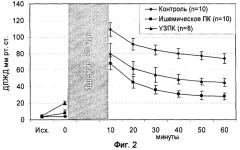
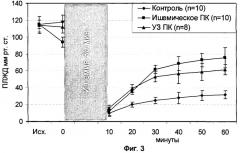
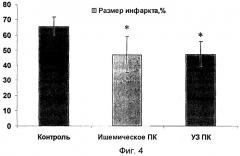
На фиг.1 представлена блок-схема экспериментальной установки; на фиг.2 графически представлены изменения диастолического давления в левом желудочке (ДЛЖД) в экспериментальных группах; на фиг.3 - изменения пульсового давления в левом желудочке (ПЛЖД); на фиг.4 - размеры инфаркта.
Для выполнения ПК у пациентов с ИБС, имеющих высокий риск развития инфаркта миокарда, в частности, у пациентов со стенокардией покоя и напряжения, а также с нестабильной стенокардией, излучатель УЗ-колебаний размещают на поверхности грудной клетки в проекции сердца. Для этого целесообразно использовать естественное анатомическое «окно», в котором передняя поверхность сердца непосредственно прилегает к грудной клетке. При этом границы озвучиваемой области можно принять следующими: верхняя - на уровне IV ребра между левой стернальной и парастернальной линией, левая - в пятом межреберьи по левой медиоклавикулярной линии, правая - на левой стернальной линии, нижняя - на уровне появления печеночной тупости. Излучатель УЗ при этом может иметь диаметр, приблизительно равный 50 мм. Конфигурация излучателя может иметь слегка вогнутую форму для обеспечения лучшего контакта с поверхностью грудной клетки. Воздействие на миокард УЗ-колебаниями с частотой 100-300 кГц и энергетической экспозицией 250-750 Дж/см2 выполняют ежедневно с целью поддержания эффекта ПК.
При способе прекондиционирования миокарда в условиях выполнения кардиохирургической операции воздействие ультразвуком указанных параметров осуществляют интраоперационно непосредственно на поверхность сердца.
Для подтверждения возможности выполнения технического результата заявленного способа были проведены исследования на модели перфузии изолированного сердца крысы по Лангендорфу. Все эксперименты были проведены в соответствии с «Руководством по уходу и использованию лабораторных животных» (публикация Национального Института Здоровья, США №85-23) и были одобрены этическим комитетом Санкт-Петербургского государственного медицинского университета им. акад. И.П.Павлова.
Материал исследования. Эксперименты выполнялись на крысах-самцах линии Wistar массой 220-300 г (питомник «Рапполово»), содержавшихся в условиях 12/12 часового светового режима и получавших стандартный корм и питьевую воду ad libitum.
Методика перфузии изолированного сердца. Исследования проводили на экспериментальной установке, блок-схема которой представлена на фиг.1. В установку входили: перфузионная колонка 1, персональный компьютер 2, датчик и усилитель сигнала давления 3, генератор низкочастотных сигналов ГЗ-123 4, термодатчик 5, излучатель УЗ 6, термостатируемый сосуд 7, полиэтиленовый баллон в полости левого желудочка 8, усилитель электрокардиосигнала 9, чернильно-пишущий прибор 10, магнитная мешалка 11, роликовый насос 12.
Животных наркотизировали уретаном (1200 мг/кг, внутрибрюшинно). Грудную клетку вскрывали широким чрездиафрагмальным билатеральным доступом, быстро вырезали сердце и помещали его в ледяной (˜4°С) раствор Кребса-Хенселейта с гепарином, содержащий (в mM): глюкозы 11, NaCl 118, KCl 4,7, CaCl2 1,5, MgSO4 1,2, KH2PO4 1,2, NaHCO3 25. После остановки сердца его присоединяли к аппарату Лангендорфа и осуществляли ретроградную перфузию через канюлю, введенную в аорту, раствором Кребса-Хенселейта под постоянным давлением гидростатического столба 80 мм рт.ст. Температура перфузионного раствора, подаваемого через колонку 1 и насыщенного газовой смесью, содержащей 95% O2 и 5% CO2, поддерживали равной 37,0±0,5°С. рН раствора поддерживали на уровне 7,4. После завершения подготовки препарата изолированного сердца его помещали в стеклянный термостатированный сосуд 7 объемом ˜400 мл, заполненный раствором Кребса-Хенселейта. На дно сосуда 7 помещали гидроизолированный цилиндрический пьезокерамический излучатель УЗ 6 диаметром 40 мм и высотой 15 мм. Излучатель УЗ 6 возбуждался подаваемым с генератора ГЗ-123 4 синусоидальным напряжением частотой 180-210 кГц, являющейся резонансной для данного излучателя УЗ. Для измерения температуры миокарда в ходе воздействия УЗ использовали миниатюрный термодатчик 5. Регистрацию нарушений ритма осуществляли с помощью усилителя электрокардиосигнала 9. С целью поддержания постоянного уровня гидростатического давления в колонке 1, раствор Кребса-Хенселейта, перемешиваемый магнитной мешалкой 11, непрерывно подавался в колонку с помощью роликового перфузионного насоса 12. Глобальную ишемию воспроизводили путем временной остановки поступления перфузата к сердцу.
Регистрация показателей в ходе эксперимента. Давление в левом желудочке регистрировали с помощью полиэтиленового баллона 8, введенного в полость желудочка через митральное кольцо и соединенного с датчиком и усилителем сигнала давления 3. Давление в левом желудочке и электрокардиосигнап непрерывно регистрировали на чернильно-пишущем приборе 10 и на персональном компьютере 2 с помощью программного обеспечения PhysExp 2.0. По кривой давления в левом желудочке программным методом вычислялись следующие показатели: систолическое (СЛЖД) и диастолическое (ДЛЖД) давление в левом желудочке, а также пульсовое давление (ПЛЖД), представляющее собой разность СЛЖД и ДЛЖД.
Протокол экспериментов. Для исследования кардиопротективных эффектов воздействия УЗ были осуществлены следующие три группы экспериментов:
1. Контроль (n=15). После подготовки препарата изолированного сердца осуществляли перфузию в течение 20 минут (период стабилизации), затем сердце дополнительно перфузировали в течение 30 минут для достижения сопоставимого интервала времени с группами 2 и 3, после чего осуществляли глобальную ишемию в течение 30 минут и реперфузию в течение 60 минут.
2. Ишемическое ПК (n=7). После 20-минутной стабилизации осуществляли три цикла кратковременной глобальной ишемии-реперфузии в режиме: 5 минут ишемии/5 минут реперфузии, после чего воспроизводили глобальную ишемию и реперфузию в соответствии с протоколом в группе 1. Данная группа была включена в исследование для сравнения кардиопротективной эффективности исследуемого нового способа с известным «золотым стандартом» кардиопротекции - ишемическим ПК миокарда.
3. Ультразвуковое ПК (n=10). После 20-минутной стабилизации осуществляли воздействие УЗ-колебаниями с частотой 100-300 кГц и энергетической экспозицией 250-750 Дж/см2, после чего в течение 15 минут проводили перфузию без воздействия УЗ. Далее воспроизводили глобальную ишемию и реперфузию в соответствии с протоколом в группе 1.
Регистрацию показателей функции сердца (СЛЖД, ДЛЖД, ПЛЖД) осуществляли в конце периода стабилизации (исходно) перед 30-минутной глобальной ишемией, а также на 10, 20, 30, 40, 50 и 60 минуте реперфузии.
Методика оценки размера инфаркта. После завершения 60-минутной реперфузии осуществлялась оценка размера инфаркта с помощью окраски сердца трифенилтетразолием хлоридом (ТТС) (МР Biomed., США). Для этого сердце разрезали в поперечном направлении на пять срезов одинаковой толщины (2 мм), после чего срезы на 15 минут помещали в 1%-ный раствор ТТС при температуре инкубации 37°С. После инкубации с ТТС поверхности срезов фотографировали цифровой камерой Olimpus 2020, соединенной с микрофотографическим устройством микроскопа МБС-10 (ЛОМО, Санкт-Петербург), и рассчитывали общие площади срезов и площади зон инфаркта (ТТС-негативные участки) с помощью программы Photoshop CS. Данные по размеру инфаркта в данном срезе представляли в виде отношения площади зоны инфаркта к общей площади среза (в процентах). Общий размер инфаркта для данного сердца вычисляли путем суммирования полученных по пяти срезам значений и вычисления среднего арифметического.
Статистическая обработка. Статистическая достоверность различий функциональных данных в каждой временной точке, а также размеров инфаркта оценивалась с помощью программного пакета SPSS (ANOVA, тест Шеффе). Все данные выражались в виде «среднее ± стандартное отклонение». Значения Р менее чем 0,05 рассматривались в качестве достоверных.
Диастолическое давление в левом желудочке. Динамика изменения ДЛЖД в различных группах на протяжении всего эксперимента представлена на фиг.2. Показатели ДЛЖД в группах исходно не отличались. Перед 30-минутной глобальной ишемией (точка 0) имеется тенденция к росту данного показателя в группах с ишемическим и УЗ ПК. Эти значения выше в группе с УЗ ПК. Более высокие значения диастолического давления в реперфузионном периоде характерны для контрольной группы. Показатели ДЛЖД в группе УЗ ПК и ишемического ПК являются наименьшими. Это демонстрирует повышение устойчивости миокарда к ишемии, проявляющееся в уменьшении диастолической дисфункции миокарда.
Пульсовое давление в левом желудочке. Динамика изменения ПЛЖД в группах на протяжении всего эксперимента представлена на фиг.3. Показатели давления в группах исходно не отличались. В группе ишемического ПК после действия кратковременных эпизодов ишемии-реперфузии имеется тенденция к снижению пульсового давления по сравнению с группой УЗ ПК. В группе УЗ ПК показатели ПЛЖД не изменяются после действия УЗ. В реперфузионном периоде увеличение значений давления имело место в опытах с ишемическим ПК и УЗ ПК. Эти данные демонстрируют повышение устойчивости миокарда к ишемии, проявляющееся в уменьшении сократительной дисфункции миокарда.
Размер инфаркта. Определение размера инфаркта является «золотым стандартом» в подобных экспериментах, направленных на изучение воздействий, повышающих устойчивость миокарда к ишемии. Как видно из фиг.4, размер инфаркта в группах с ишемическим и УЗ ПК (46,8±12,0 и 47,1±8,51% соответственно) был ниже, чем в контрольной группе (65,4±6,23%, Р<0,05). При этом значения размера инфаркта в группах с ишемическим и ультразвуковым ПК достоверно не отличались, что указывает на одинаковую степень защиты миокарда, возникающую в результате этих воздействий. Согласно экспериментальным данным, наиболее выраженный кардиопротективный эффект достигался при импульсном режиме воздействия УЗ-колебаний с заявленными параметрами.
Использование способа обеспечивает повышение устойчивости миокарда к ишемическому повреждению. Способ является малоинвазивным и не вызывает значимых побочных эффектов.
1. Способ прекондиционирования миокарда, заключающийся в том, что на миокард воздействуют ультразвуковыми колебаниями с частотой 100-300 кГц и энергетической экспозицией 250-750 Дж/см2.
2. Способ по п.1, отличающийся тем, что излучатель ультразвуковых колебаний размещают на поверхности грудной клетки в проекции сердца.
3. Способ по п.1, отличающийся тем, что интраоперационно воздействие осуществляют непосредственно на поверхность сердца.