Способ лечения или предупреждения ожирения
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к производству лекарственных средств и способу лечения ожирения. Для производства лекарственных средств используют амилин или агонисты амилина определенной химической структуры. Кроме того, предложен способ лечения ожирения с использованием конкретного агониста амилина 25,28,29Pro-h-амилина в разработанных для него дозах и режимах введения. Изобретение обеспечивает расширение арсенала лекарственных средств для лечения ожирения. 5 н. и 6 з.п. ф-лы, 8 табл.
Реферат
Настоящая заявка является заявкой в частичное продолжение патентной заявки США №08/870762, поданной 6 июня 1997 г., содержание которой полностью включено в настоящее описание в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к способам лечения ожирения. Более конкретно, изобретение относится к использованию амилина или агониста амилина при лечении ожирения.
Предпосылки создания изобретения
Амилин
В настоящее время имеются обзоры, посвященные структуре и биологическому действию амилина. (См., например. Rink et al., Trends in Pharmaceutical Sciences, 14:113-118 (1993); Gaeta and Rink, Med. Chem. Res., 3:483-490 (1994); and Pittner et al., J. Cell Biochem; 553:19-28 (1994)). Амилин представляет собой гормон белковой природы, состоящий из 37 аминокислот. Он был выделен, очищен и охарактеризован как основной компонент амилоидных отложений в панкреатических островках умерших людей с диабетом II типа (Cooper et al., Proc. Natl. Acad. Sci. USA, 84: 8628-8632 (1987)). Молекула амилина имеет две важных посттрансляционные модификации: С-конец ее амидирован (например, 37-й аминокислотный остаток представлен тирозинамидом), и цистеины в положении 2 и 7 сшиты поперечными связями с образованием N-концевой петли (через цистиновый остаток). Последовательность в открытой рамке считывания гена человеческого амилина демонстрирует наличие сигнала для протеолитического расщепления в области сайта двухосновных аминокислот Lys-Arg, расположенного перед N-концевым кодоном для Lys, и при Gly, расположенным перед Lys-Arg протеолитическим сигналом в С-концевом положении, что характерно для последовательности, распознаваемой протеинамидазным ферментом ПАМ (РАМ)) (Cooper et al., Biochem. Biophys. Acta, 1014:247-258 (1989)). Амилин описан и заявлен в патенте США №5367052, выданном 22 ноября 1994 г.
Было показано, что при диабете I типа имеется дефицит амилина, в связи с чем было предложено перейти на комбинированное лечение, включающее инсулин, как предпочтительный способ лечения всех форм диабета в сравнении с применением только одного инсулина. Использование амилина и других амилиновых агонистов при лечении сахарного диабета является объектом изобретения в патенте США №5175145, выданном 29 декабря 1992 г. Фармацевтические композиции, содержащие амилин и амилин плюс инсулин, описаны и заявлены в патенте США №5124314, выданном 23 июня 1992 г.
Отмечалось, что действие амилина при его избытке имитирует ключевые признаки диабета II типа, и поэтому блокада амилина была предложена в качестве новой терапевтической стратегии. В патенте США №5266561, выданном 30 ноября 1993 года, раскрывается, что амилин вызывает снижение как базового, так и инсулинстимулированного включения меченой глюкозы в гликоген скелетной мышцы. Последний эффект был раскрыт также в контексте пептида, связанного с геном кальцитонина (КГСП (CGRP)) (см. также Leighton and Cooper, Nature, 335:632-635 (1988)). Имеются также данные о том, что амилин снижает инсулинстимулированное поступление глюкозы в скелетную мышцу и снижает содержание гликогена (Young et al., Amer. J. Physiol., 259:45746-1 (1990)). Раскрывается также лечение диабета II типа и инсулин-резистентности амилиновыми агонистами.
Последовательность амилина примерно на 50% гомологична последовательности КГСП, белков, состоящих также из 37 аминокислот, которые, будучи широко распространены в качестве нейротрансмиттеров, характеризуются многообразной мощной биологической активностью, включая вазодилатацию. Амилин и КГСП имеют 2Cys-7Cys дисульфидный мостик и С-концевой остаток в виде амида аминокислоты, оба из которых важны для проявления полной биологической активности (Cooper et al., Proc. Natl. Acad. Sci. USA, 857763-7766 (1988)). Как сообщалось, амилин, может быть одним из членов семейства родственных пептидов, включающих КГСП, инсулин, инсулинподобные ростовые факторы и релаксины, и которые характеризуются общими генетическими корнями (Cooper et al., Prog. Growth Factor Research, 1:99-105 (1989)).
Амилин синтезируется в основном в панкреатических бета - клетках и затем секретируется в ответ на пищевые раздражители, такие как глюкоза и аргинин. Исследования на линиях клонированных опухолевых бета-клеток (Moore et al., Biochem, Biophys. Res. Commun., 179 (1) (1991)) показали, что пищевые средства, усиливающие секрецию, такие как глюкоза и аргинин, стимулируют высвобождение амилина и инсулина. Коэффициент молярного отношения амилин:инсулин в секретируемых белках варьирует в препаратах от примерно 0,01 до 0,4, но, по всей видимости, не варьирует в значительной мере в ответ на острые стимулы в пределах любого одного препарата. Однако, в ходе продолжительной стимуляции повышенными уровнями глюкозы коэффициент отношения амилин:инсулин может прогрессивно возрастать (Gedulin et al., Biochem. Biophys. Res. Commun., 180(1), 782-789 (1991)). Таким образом, амилин и инсулин не всегда секретируются с постоянной скоростью.
Было показано, что некоторые действия амилина имеют сходство с некоторыми неметаболическими функциями КГСП и кальцитонина; однако метаболические функции амилина, обнаруженные в процессе изучения указанного нового идентифицированного белка, по всей видимости, отражают его преимущественную биологическую роль. При этом, по меньшей мере, некоторые из этих метаболических функций имитируются КГСП, хотя и в дозах, которые обладают выраженным вазодилатационным эффектом (см. также Leighton et al., Nature, 335:632-635 (1988)); Molina et al., Diabetes, 39:260-265 (1990)).
Первым обнаруженным действием амилина было снижение стимулируемого инсулином включения глюкозы в гликоген скелетной мышцы крысы (Leighton et al., Nature, 335:632-635 (1988)), при этом мышца становится "инсулинрезистентной".
Последующая работа с камбаловидной мышцей крысы ex-vivo и in vitro указывает на то, что амилин снижает гликогенсинтазную активность, ускоряет превращение гликогенфосфорилазы из неактивной b формы в активную а форму, способствует итоговой потере гликогена (в присутствии или в отсутствие инсулина), повышает уровень глюкоза-6-фосфатазы и может повышать общий выход лактазы (см., например, Deems et al., Biochem. Biophys. Res. Commun., 181 (I):116-120 (1991); Young et al., FEBS Letts, 281 (1,2):149-151 (1991)). Амилин, по всей видимости, не влияет на транспорт глюкозы per se (см., например, Pittner et al., FEBS Letts, 365 (I):98-100 (1995)). Изучение зависимости доза-ответ на амилине и инсулине показывает, что амилин действует в скелетной мышце как неконкурентный или функциональный антагонист инсулина (Young et al., Am. J. Physiol, 263 (2):Е274-Е281 (1992)). Нет доказательств того, что амилин препятствует связыванию инсулина с его рецепторами или последующей активации инсулинового рецептора тирозинкиназой (Follet et al., Clinical Research. 39 (1):39А (1991); Koopmans et al., Diabetologia, 34:218-224 (1991)).
Считается, что амилин действует с вовлечением рецепторов, имеющихся на плазменных мембранах. Изучение амилина и КГСП, а также влияния селективных антагонистов позволяет предположить, что амилин действует через свой собственный рецептор (Beaumont et al., Br. J. Pharmacol, 115 (5):713-715 (1995); Wang et al., FEBS Letts., 219; 195-198 (1991b)), что не совпадает с выводом других исследователей о том, что амилин может действовать в основном на рецепторах КГСП (например, Chantry et al., Biochem. J., 277:139-143 (1991); Galeazza et al., Peptides, 12:585-591 (1991); Zhu et al., Biochem. Biophys. Res. Commun., 177 (2):771-776 (1991)). Рецепторы амилина и их использование в методах скрининга и тестирования соединений - агонистов и антагонистов амилина - описаны в Патенте США №5264372, выданном 23 ноября 1993 г.
Хотя известно, что амилин проявляет выраженное воздействие на энергетический метаболизм в печени in vivo, отсутствует общее согласие по вопросу о том, как он действует в изолированных гепатоцитах или перфузированной печени. Имеющиеся данные не поддерживают представление о том, что амилин способствует гликогенолизу в печени, иными словами, он не действует подобно глюкагону (например, Stephens et al., Diabetes, 40:395-400 (1991)); Gomez-Foix et al., Biochem. J., 276:607-610 (1991)). Было высказано предположение о том, что амилин может воздействовать на печень, способствуя превращению лактата в гликоген и повышая количество глюкозы, способной высвободиться под действием глюкагона (см. Roden et al., Diabetologia, 35:116-120 (1992)). Таким образом, амилин может действовать в печени как анаболический партнер инсулина, в отличие от механизма его функционирования в мышце, носящем катаболический характер.
В жировых клетках действие амилина, в отличие от мышц, не сказывается заметным образом на инсулин-стимулированном поглощении глюкозы, включении глюкозы в триглицерид, образовании CO2 (Cooper et al., Proc. Natl. Acad. Sci., 85:7763-7766 (1988)), стимулируемом эпинефрином липолизе или ингибировании липолиза инсулином (Lupien and Young, "Diabetes Nutrition and Metabolism - Clinical and Experimental", Vol.6(1), pages 1318 (February 1993)). Амилин, таким образом, проявляет тканеспецифические действия, при этом отмечается прямое воздействие его на скелетную мышцу, выраженное опосредованное воздействие (через снабжение субстратом) и, возможно, прямое воздействие на печень, тогда как адипоциты остаются, по всей видимости, слепыми к наличию или отсутствию амилина.
Имеются данные о том, что амилин может проявлять выраженный эффект на секрецию инсулина. Эксперименты на интактных крысах (Young et al., Mol. Cell. Endocrinol., 84:R1-R5 (1992)) указывают на то, что амилин ингибирует секрецию инсулина. Другие исследователи, однако, не смогли обнаружить эффект амилина на изолированных (3-клетках, на изолированных панкреатических островках или на уровне целого животного (см. Broderick et al., Biochem. Biophys. Res. Commun., 177:932-938 (1991)).
Амилин или агонисты амилина оказывают мощное ингибирующее воздействие на опустошение желудка у крыс (Young et al., Diabetologia 38 (6): 642-648 (1995)), у собак (Brown et al., Diabetes 43 (Suppl 1): 172A (1994)) и у людей (Macdonald et al., Diabetologia 38 (Suppl 1):A32 (abstract 118) (1995)). По имеющимся сообщениям, опустошение желудка ускоряется у амилиндефицитных ВВ крыс с диабетом I типа (Young et al., Diabetologia, supra; Nowak et al., J. Lab. Clin. Med., 123 (1):110-6 (1994)) и у крыс, принимавших селективный антагонист амилина AC 187 (Gedulin et al., Diabetologia, 38(Suppl 1):A244 (1995)). Действие амилина на опустошение желудка является, скорее всего, физиологическим (оперативным на уровне нормально циркулирующих концентраций).
Неметаболическое действие амилина включает вазодилататорный эффект, который может быть опосредован взаимодействием с сосудистыми рецепторами КГСП. Имеющиеся данные тестирования in vivo позволяют предположить, что амилин является в 100-1000 раз менее мощным вазодилататором, чем КГСП (Brain et al., Eur. J. Pharmacol., 183:2221 (1990); Wang et al., FEBS Letts., 291:195-198 (1991)). В литературе имеется публикация, касающаяся действия амилина на регионарную гемодинамику, включая почечный кровоток, у находящихся в сознании крыс (Gardiner et al., Diabetes, 40:948-951 (1991)). Указанные авторы отмечают, что инфузия крысиного амилина сопровождается более выраженной дилатацией почечных сосудов и меньшей мезентериальной вазоконстрикцией, чем при введении человеческого α-КГСП. В этом контексте указанные авторы полагают, что в свете усиления почечной гиперемии в большей степени, чем это делает α-КГСП, крысиный амилин может вызывать менее выраженную стимуляцию системы ренин-ангиотензин и, в этой связи, меньшую степень вторичной ангиотензин-11-опосредованной вазоконстрикции. Однако, они также отмечают, что в ходе совместной инфузии человеческого α-8-37-КГСП и крысиного амилина не имеет места маскирование ренальной и мезентериальной вазоконстрикции, что определяется в основном несбалансированным вазоконстрикторным эффектом ангиотензина II, и отмечают, что обнаруженный эффект аналогичен тому, что наблюдалось при совместной инфузии человеческого α-КГСП и человеческого α-8-37-КГСП (id. at 951).
Было показано, что амилин оказывает воздействие и на изолированные остеокласты, которые он приводит к переходу в состояние покоящихся клеток, и in vivo, где, как было обнаружено, он снижает плазменный уровень кальция, примерно на 20% у крыс, а также у кроликов и у людей с болезнью Педжета (см., например, Zaidi et al., Trends in Endocrinol. and Metab., 4:255-259 (1993)). На основании доступных данных можно предположить, что амилин представляет собой в 10-30 раз менее мощное средство, чем кальцитонин, оказывающий такое же действие. Были приведены интересные данные о том, что амилин, по всей видимости, повышает образование цАМФ остеокластами, но не повышает уровень Са2+ в цитозоле, тогда как кальцитонин осуществляет все эти эффекты (Alam et al., Biochem. Biophys. Res. Commun., 179 (I):134-139 (1991)). Было сделано предположение, хотя это еще не установлено, что кальцитонин может действовать через рецепторы двух типов, а амилин может взаимодействовать с одним из них.
Неожиданно, в свете полученных ранее данных о дилатации почечных сосудов и ряда других свойств, было обнаружено, что амилин при его подкожном введении заметно повышает активность ренина в плазме интактных крыс, причем по механизму, который не оказывает воздействия на давление крови. Последний аспект важен, поскольку снижение давления является мощным стимулом для высвобождения ренина. Антагонисты амилина, такие как антагонисты рецептора амилина, включающие те из них, которые являются селективными относительно рецепторов КГСП и/или кальцитонина, могут использоваться для блокирования амилин-провоцированного повышения активности ренина в плазме. Использование антагонистов амилина для лечения расстройств, связанных с ренином, описаны и заявлены в патенте США №5376638, выданном 27 декабря 1994 г.
Было показано, что у нормальных людей уровень амилина при голодании составляет от 1 до 10 пМ, а после приема пищи или после введения глюкозы он колеблется от 5 до 20 пМ (например, Koda et al., The Lancet, 339:1179-1180 (1992)). При ожирении у инсулин-резистентных индивидуумов уровень амилина после приема пищи может подняться до более высоких значений, достигая примерно 50 пМ. Целям сравнения могут служить следующие данные по уровню инсулина у здоровых людей при голодании и после приема пищи, которые составляют от 20 до 50 пМ и от 100 до 300 пМ соответственно, при этом они могут достичь в 3-4 раза более высоких значений у инсулинрезистентных людей. При диабете I типа, для которого характерно разрушение бета - клеток, содержание амилина находится на уровне или ниже обнаруживаемого количества и не растет в ответ на введение глюкозы (Koda et al., The Lancet, 339:1179-1180 (1992)). У нормальных мышей и крыс, как было показано, базальный уровень составляет от 30 до 100 пМ, тогда как у некоторых инсулин-резистентных диабетических штаммов грызунов этот показатель может достичь значения 600 пМ (например, Huang et al., Hypertension, 19:1-101-1-109 (1991)).
Показано, что при инъецировании в мозг или при периферальном введении амилин подавляет всасывание пищи (например, Chance et al.. Brain Res., 539:352-354 (1991)) and Chance et al., Brain Res., 607:185-188 (1993)), оказывая воздействие, которое сближает его с КГСП и кальцитонином. Эффективные концентрации в клетках, которые опосредуют указанное действие, не известны. Использование амилина и агонистов амилина для лечения анорексии описано и заявлено в патенте США №5656590, выданном 12 августа 1997 г. Композиции, включающие агонист холецистокинина и агонист амилина или гибридную молекулу, для использования с целью снижения всасывания пищи или контроля аппетита или веса тела раскрыты и заявлены в патенте США №5739106, выданном 14 апреля 1998 г.
Ожирение
Ожирение представляет собой хроническое заболевание, широко распространенное в современном обществе, последствия которого имеют отношение не только к социальным бедам, но также к снижению продолжительности жизни и многочисленным медицинским проблемам, включая также неблагоприятное психологическое развитие, репродуктивные нарушения, такие как полицистоз яичника, дерматологические заболевания, такие как инфекции, варикозное расширение вен, акантоз (acanthosis nigricans) и экзема, а также затрудненную двигательную активность, сахарный диабет, инсулин-резистентность, гипертензию, гиперхолестеринемию, холелитиаз, остеоартрит, ортопедические нарушения, тромбоэмболическую болезнь, рак и коронарную болезнь сердца (Rissanen et al., British Medical Journal, 301:835-837 (1990)).
Ожирение, и в особенности ожирение верхней части тела, представляет собой распространенную и весьма серьезную проблему здравоохранения Соединенных Штатов и во всем мире. В соответствии с последними статистическими данными, более 25% населения США и 27% населения Канады имеют избыточный вес (Kuczmarski, Amer. J. of Clin. Nut. 55:4953-5023 (1992); Reeder et al., Can. Med. Ass. J., 23:226-233 (1992)). Ожирение верхней части тела является сильнейшим фактором риска развития сахарного диабета II типа, а также серьезным фактором развития сердечно-сосудистых заболеваний и рака. Последние оценки стоимости медицинских убытков, связанных с ожирением, составляют во всем мире 150000000000 дол. США. Проблема становится настолько серьезной, что хирурги общей практики выступили с инициативой бороться с безудержным ростом тучности в американском обществе.
В значительной мере индуцированную ожирением патологию можно рассматривать в тесной связи с дислипидемией, гипертензией и инсулин-резистентностью. Во многих исследованиях было показано, что снижение степени ожирения при применении диеты и физической тренировки резко ослабляет указанные факторы риска. Но, к сожалению, такие способы лечения зачастую не приводят к успеху, при этом процент неудач достигает 95%. Эту ситуацию можно объяснить тем, что рассматриваемое состояние тесно связано с генетически наследуемыми факторами, которые способствуют повышению аппетита, предпочтению высококалорийной пищи, сниженной физической активности и повышенному липогенному метаболизму. Это указывает на то, что люди, унаследовавшие такие генетические черты, будут проявлять склонность к ожирению, независимо от их усилий по борьбе с таким состоянием. В этой связи имеется необходимость в разработке нового фармакологического средства, которое было бы способно корректировать указанный недостаток и давало в руки возможность успешно лечить тучных пациентов, независимо от их наследственного отягощения.
Существующие способы лечения ожирения включают стандартные диеты и физические упражнения, очень низкокалорийные диеты, поведенческую терапию, фармакотерапию, включающую средства, подавляющие аппетит, термогенные средства, ингибиторы всасывания пищи, механические устройства, такие как фиксация челюсти, стягивание талии и хирургическое вмешательство (Jung and Chong, Clinical Endocrinology, 35:11-20 (1991); Bray, Am. J. Clin. Nutr., 55:538S-544S (1992)). Имеется сообщение об эффективности снижения веса тела у подростков при использовании модифицированного способа голодания на фоне приема небольшого количества белка (Lee et al., Clin. Pediatr., 31:234-236 (April 1992)). Ограничение количества калорий как средство лечения ожирения вызывает катаболизм запасных белков организма и приводит к отрицательному азотному балансу. В этой связи получили популярность диеты с добавками белка, как средств, способствующих потере азота при ограничении поступления калорий в организм. Поскольку такие диеты приводят лишь к умеренному воздействию на азотный метаболизм, имеется потребность в более эффективном способе сохранения нужной тенденции изменения веса тела и запасов белка в организме. Кроме того, в целях усовершенствования лечения ожирения, желательно, чтобы такой режим приводил также к ускоренному снижению уровня жиров в организме. Различные подходы к решению этой проблемы описаны в работе Вайнтрауба и Брея (Weintraub and Bray, Med. Clinics N. Amer., 73:237 (1989)); Bray, Nutrition Reviews, 49:33 (1991)).
В свете высокого процента в нашем обществе и в контексте тех серьезных обсуждавшихся выше последствий, которые связаны с проблемой ожирения, следует ожидать, что любое терапевтическое средство, потенциально способное при его использовании снижать вес тела, будет иметь выраженный эффект на здоровье таких людей. Имеется потребность в таком лекарственном средстве, которое будет снижать общий вес тела тучных людей в направлении идеального для них веса и будет способствовать поддержанию такого сниженного уровня.
Краткое описание сущности изобретения
Авторами было обнаружено, что амилин и агонисты амилина, например аналог агониста амилин - 25,28,29Pro-h-амилин (обозначаемый так же, как "прамлинтад" и описанный ранее как "АС-0137"), могут быть использованы для лечения ожирения у людей.
Настоящее изобретение относится к новым способам лечения или профилактики ожирения у людей, включающим введение амилина или агониста амилина, например аналога агониста амилина - 25,25,29Pro-h-амилина. Амилин или агонист амилина могут быть введены сами по себе или в сочетании с другим средством снижения ожирения. В одном своем аспекте настоящее изобретение относится к способу лечения ожирения у человека, включающему введение указанному субъекту эффективного количества амилина или такого же количества агониста амилина. Под термином "лечение" подразумевается ведение и уход за пациентом с целью борьбы с заболеванием, состоянием или расстройством, и он включает введение амилина или агониста амилина для предупреждения появления симптомов или осложнений, для облегчения симптомов или осложнений или для устранения болезненного состояния или расстройства. Лечение ожирения в этой связи включает ингибирование прибавления веса и индукцию снижения веса у пациентов при наличии такой необходимости. Кроме того, лечение ожирения в контексте настоящего описания включает регулирование веса с косметической целью у людей, что означает регулирование веса для улучшения внешнего вида человека.
Термин "амилин" в контексте настоящего описания включает соединения, такие как определены в патенте США №5234906, выданном 10 августа 1993 года под названием "Гипергликемические композиции", общее содержание которого приведено в настоящем описании в качестве ссылки. Так, например, он содержит описание пептидного гормона человека, обозначаемого как амилин, который секретируется бета-клетками поджелудочной железы и различных его видов. "Агонист амилина" представляет собой термин, известный в технике, который относится к соединению, имитирующему действие амилина. Агонист амилина может быть соединением пептидным или не пептидным и включает аналоги агониста амилина.
Термин "аналог агониста амилина" относится к производным амилина, которые действуют как агонисты амилина, при этом они обычно, как в настоящее время считается, действуют посредством связывания или с помощью другого непосредственного или опосредованного взаимодействия с амилиновым рецептором или другим рецептором, или рецепторами, с которыми сам амилин может взаимодействовать с проявлением биологической реакции. Полезные аналоги агониста амилина включают те из них, которые были идентифицированы в международной заявке WPI Acc. №93-182488/22, озаглавленной "New Amylin Agonist Peptides Used for Treatment and Prevention of Hypoglycemia and Diabetes Mellitus" ("Новые пептидные агонисты амилина, используемые для лечения и профилактики гипогликемии и сахарного диабета"), общее содержание которой также включено в настоящее описание в качестве ссылки.
В предпочтительном варианте реализации настоящего изобретения агонист амилина представляет собой аналог агониста амилина, предпочтительно, 25,25,29Pro-h-амилин. 25,25,29Pro-h-амилин и другие аналоги агониста амилина описаны и заявлены в Патенте США №5686411, выданном 11 ноября 1997 года, общее содержание которого также включено в настоящее описание в качестве ссылки.
В другом аспекте настоящее изобретение относится к новым методам снижения индуцированного инсулином прибавления веса у людей, принимающих инсулин, включающим введение терапевтически эффективного количества амилина или агониста амилина. В одном варианте реализации изобретения указанный субъект имеет сахарный диабет, например сахарный диабет I типа или II типа. В предпочтительном варианте реализации изобретения агонист амилина представляет собой 25,28,29Pro-h-амилин.
Подробное описание изобретения
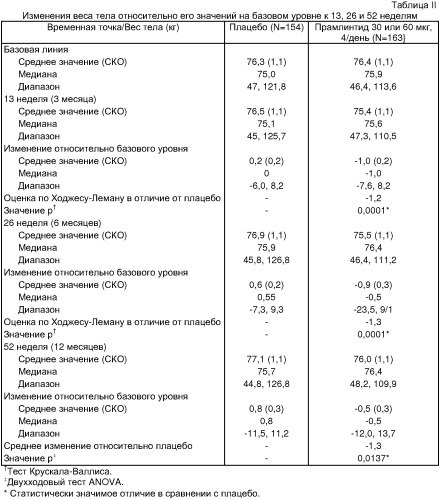
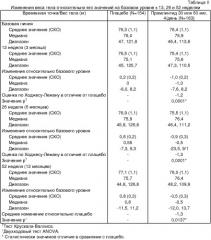
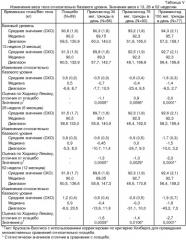
В исследовании, описанном в Примере 1, было показано, что введение агониста амилина 25,28,29Pro-h-амилина (прамлинтида) больным диабетом, применяющим инсулин (II типа), приводит к снижению веса тела через 4 недели и достигает статистической значимости в двух группах дозирования, а именно принимающих 60 мкг трижды в день и 60 мкг четыре раза в день. В исследовании, описанном в Примере 2, показано, что введение прамлинтида (30 мкг или 60 мкг четыре раза в день) при диабете I типа приводит к статистически значимому снижению веса тела, в сравнении с группой приема плацебо, к моменту 13, 26 и 52 недели. В исследовании, описанном в Примере 3, показано, что введение прамлинтида (30, 75 или 150 мкг три раза в день) пациентам с диабетом II типа, которые нуждаются в инсулине, приводит к статистически значимому снижению веса тела, в сравнении с группой приема плацебо, к моменту 13, 26 и 52 недели. Указанные результаты резко контрастируют с данными по лечению одним инсулином у пациентов с диабетом I типа или II типа, которое обычно связано с прибавлением веса.
Аналоги агониста амилина, используемые в настоящем изобретении, включают аналоги агониста амилина, описанные и заявленные в вышеуказанном Патенте США №5686411. Агонисты амилина включают следующие аналоги агониста амилина:
1. Аналог агониста амилина, имеющий аминокислотную последовательность;
1A1-X-Asn-Thr-5Ala-Thr-Y-Ala-Thr-10Gln-Arg-Leu-
B1-Asn-15Phe-Leu-C1-D1-E1-20F1-G1-Asn-H1-Gly-25Pro-I1-
Leu-Pro-J1-30Thr-K1-Val-Gly-Ser-35Asn-Thr-Tyr-Z,
где
A1 обозначает Lys, Ala, Ser или водород;
B1 обозначает Ala, Ser или Thr;
C1 обозначает Val, Leu или Ile;
D1 обозначает His или Arg;
E1 обозначает Ser или Thr;
F1 обозначает Ser, Thr, Gln или Asn;
G1 обозначает Asn, Gln или His;
H1 обозначает Phe, Leu или Tyr;
I1 обозначает Ile, Val, Ala или Leu;
J1 обозначает Ser, Pro или Thr;
K1 обозначает Asn, Asp или Gln;
X и Y выбирают независимо из остатков, имеющих боковые цепи, химически связанные друг с другом с образованием внутримолекулярной связи, при этом указанные внутримолекулярные связи включают дисульфидную, лактамную или тиоэфирную связь; и Z обозначает амино, алкиламино, диалкиламино, циклоалкиламино, ариламино, аралкиламино, алкилокси, арилокси или аралкилокси; при условии, что когда A1 обозначает Lys, B1 обозначает Ala, C1 обозначает Val, D1 обозначает Arg, E1 обозначает Ser, F1 обозначает Ser, G1 обозначает Asn, H1 обозначает Leu, I1 обозначает Val, J1 обозначает Pro, и K1 обозначает Asn, то один или более из A1-K1 обозначает D-аминокислоту, и Z выбирают из группы, состоящей из алкиламино, диалкиламино, циклоалкиламино, ариламино, аралкиламино, алкилокси, арилокси или аралкилокси.
2. Аналог агониста амилина, имеющий аминокислотную последовательность:
1A1-X-Asn-Thr-5Ala-Thr-Y-Ala-Thr-10Gln-Arg-Leu-
B1-Asn-15Phe-Leu-C1-D1-E1-20F1-G1-Asn-H1-Gly-25Pro-I1-
Leu-J1-Pro-30Thr-K1-Val-Gly-Ser-35Asn-Thr-Tyr-Z,
где
A1 обозначает Lys, Ala, Ser или водород;
B1 обозначает Ala, Ser или Thr;
C1 обозначает Val, Leu или Ile;
D1 обозначает His или Arg;
E1 обозначает Ser или Thr;
F1 обозначает Ser, Thr, Gln или Asn;
G1 обозначает Asn, Gln или His;
H1 обозначает Phe, Leu или Tyr;
I1 обозначает Ile, Val, Ala или Leu;
J1 обозначает Ser, Pro, Leu, Ile или Thr;
K1 обозначает Asn, Asp или Gln;
X и Y выбирают независимо из остатков, имеющих боковые цепи, химически связанные друг с другом с образованием внутримолекулярной связи, при этом указанная внутримолекулярная связь включает дисульфидную, лактамную или тиоэфирную связь; и Z обозначает амино, алкиламино, диалкиламино, циклоалкиламино, ариламино, аралкиламино, алкилокси, арилокси или аралкилокси; и при условии, что когда
(a) A1 обозначает Lys, B1 обозначает Ala, C1 обозначает Val,
D1 обозначает Arg, E1 обозначает Ser, F1 обозначает Ser,
G1 обозначает Asn, H1 обозначает Leu, I1 обозначает Val,
J1 обозначает Pro, и K1 обозначает Asn, или
(б) A1 обозначает Lys, B1 обозначает Ala, C1 обозначает Val,
D1 обозначает His, E1 обозначает Ser, F1 обозначает Asn,
G1 обозначает Asn, H1 обозначает Leu, I1 обозначает Val,
J1 обозначает Ser, и K1 обозначает Asn;
то один или более из A1-K1 обозначает D-аминокислоту, и Z выбирают из группы, состоящей из алкиламино, диалкиламино, циклоалкиламино, ариламино, аралкиламино, алкилокси, арилокси или аралкилокси.
3. Аналог агониста амилина, имеющий аминокислотную последовательность:
1A1-X-Asn-Thr-5Ala-Thr-Y-Ala-Thr-10Gln-Arg-Leu-
B1-Asn-15Phe-Leu-C1-D1-E1-20F1-G1-Asn-H1-Gly-25I1-J1-
Leu-Pro-Pro-30Thr-K1-Val-Gly-Ser-35Asn-Thr-Tyr-Z,
где
A1 обозначает Lys, Ala, Ser или водород;
B1 обозначает Ala, Ser или Thr;
C1 обозначает Val, Leu или Ile;
D1 обозначает His или Arg;
E1 обозначает Ser или Thr;
F1 обозначает Ser, Thr, Gln или Asn;
G1 обозначает Asn, Gln или His;
H1 обозначает Phe, Leu или Tyr;
I1 обозначает Ala или Pro;
J1 обозначает Ile, Val, Ala или Leu;
K1 обозначает Asn, Asp или Gln;
X и Y выбирают независимо из остатков, имеющих боковые цепи, химически связанные друг с другом с образованием внутримолекулярной связи, при этом указанная внутримолекулярная связь включают дисульфидную, лактамную или тиоэфирную связь; и Z обозначает амино, алкиламино, диалкиламино, циклоалкиламино, ариламино, аралкиламино, алкилокси, арилокси или аралкилокси; и при условии, что когда A1 обозначает Lys, B1 обозначает Ala, C1 обозначает Val, D1 обозначает Arg, E1 обозначает Ser, F1 обозначает Ser, G1 обозначает Asn, H1 обозначает Leu, I1 обозначает Pro, J1 обозначает Val, и K1 обозначает Asn, то один или более из A1-K1 обозначает D-аминокислоту, и Z выбирают из группы, состоящей из алкиламино, диалкиламино, циклоалкиламино, ариламино, аралкиламино, алкилокси, арилокси или аралкилокси.
4. Аналог агониста амилина, имеющий аминокислотную последовательность:
1A1-X-Asn-Thr-5Ala-Thr-Y-Ala-Thr-10Gln-Arg-Leu-
B1-Asn-15Phe-Leu-C1-D1-E1-20F1-G1-Asn-H1-Gly-25Pro-I1-
Leu-Pro-Pro-30Thr-J1-Val-Gly-Ser-35Asn-Thr-Tyr-Z,
где
A1 обозначает Lys, Ala, Ser или водород;
B1 обозначает Ala, Ser или Thr;
C1 обозначает Val, Leu или Ile;
D1 обозначает His или Arg;
E1 обозначает Ser или Thr;
F1 обозначает Ser, Thr, Gln или Asn;
G1 обозначает Asn, Gin или His;
H1 обозначает Phe, Leu или Tyr;
I1 обозначает Ile, Val, Ala или Leu;
J1 обозначает Asn, Asp, или Gln;
X и Y представляют собой независимо выбранные остатки, имеющие боковые цепи, которые химически связаны друг с другом с образованием внутримолекулярной связи, при этом указанная внутримолекулярная связь включает дисульфидную связь, лактамную или тиоэфирную связь; и Z обозначает амино, алкиламино, диалкиламино, циклоалкиламино, ариламино, аралкиламино, алкилокси, арилокси или аралкилокси; и при условии, что когда A1 обозначает Lys, B1 обозначает Ala, C1 обозначает Val, D1 обозначает Arg, Ei обозначает Ser, F1 обозначает Ser, G1 обозначает Asn, H1 обозначает Leu, I1 обозначает Val, и J1 обозначает Asn, то один или более из A1-K1 обозначает D-аминокислоту, и Z выбирают из группы, состоящей из алкиламино, диалкиламино, циклоалкиламино, ариламино, аралкиламино, алкилокси, арилокси или аралкилокси.
Предпочтительные аналоги агониста амилина включают:
25,28,29Pro-h-амилин, 18Arg25,28,29Pro-h-амилин и 18Arg25,28,Pro-h-амилин.
Активность соединений в качестве агонистов амилина может быть подтверждена и количественно определена при проведении различных скрининговых тестов, которые включают тест по связыванию с рецептором прилегающего ядра, описанный ниже в Примере 1, с последующим тестом на камбаловидной мышце, описанном далее в Примере 8, тест по опустошению желудка, описанный в Примере 9 или 10, или тест, основанный на способности индуцировать гипокальциемию или снижать у млекопитающих возникающую после приема пищи гипергликемию, как приведено в настоящем описании.
Тест по связыванию с рецептором или конкурентный тест, который определяет способность соединения специфически связываться с мембранно-связанными рецепторами амилина, описан и заявлен в Патенте США №5264372, выданном 23 ноября 1993 года, полное раскрытие которого включено в настоящее описание в качестве ссылки. Тест по связыванию с рецептором приведен также в настоящем описании, далее в Примере 7. Предпочтительным источником для получения мембранных препаратов, используемых в тесте, является базальное вещество переднего мозга, которое включает мембраны из прилегающих ядер и окружающих регионов. Тестируемые соединения конкурируют за связывание с указанными рецепторными препаратами с 125I амилином крысы (Bolton Hunter). Конкурентные кривые, в которых количество связанного (В) соединения наносится на график как функция log концентрации лиганда, далее подвергают компьютерному анализу нелинейной регрессии в 4-параметровом логистическом уравнении (программа Inplot; Graph-PAD Software, San Diego, California) или программы ALLFIT of DeLean et. al. (ALLFIT, Version 2.7 (NIH, Bethesda, MD 20892)). Munson and Rodbard, Anal. Biochem. 107:220-239 (1980).
Тест на биологическую активность агонистов амилина в камбаловидной мышце может быть проведен с использованием описанных ранее методов (Leighton, В. and Cooper, Nature, 335:632-635 (1988); Cooper, et. al., Proc. Natl. Acad. Sci. USA 85:7763-7766 (1988)), в которых активность агониста амилина оценивают по измерению ингибирования инсулин-стимулируемого синтеза гликогена. Тест на камбаловидной мышце описан также в Примере 8 ниже.
Методы измерения скорости опустошения желудка описаны, например, в работе Янга с соавторами (Young et. al., Diabetologia, 38 (6). 642-648 (1995)). В рамках метода с использованием фенолового красного, который описан далее в Примере 9, находящиеся в сознании крысы получают через зонд неокрашенный гель, содержащий метилцеллюлозу и феноловый красный индикатор. Через двадцать минут после введения зонда животных анестезируют с использованием галотана, обнажают желудок и, зафиксировав его на пилорическом сфинктере и сфинктере нижнего пищевода, вынимают и опустошают в щелочной раствор. Содержимое кишечника может быть оценено по интенсивности окраски фенолового красного в щелочном растворе, которую измеряют по поглощению при длине волны 560 нМ. По методу, включающему использование тритированной глюкозы, который описан ниже в Примере 10, находящимся в сознании крысам вводят зондом тритированную глюкозу в воде. Крыс осторожно придерживают за хвост, кончик которого анестезируют с помощью лидокаина. Для определения уровня трития в плазме ее, отделяя от хвостовой крови, отбирают в различные временные точки и анализируют на бета-счетчике. Исследуемые соединения обычно вводят за одну минуту до зондирования.
Действие амилина или агонистов амилина на вес тела может быть идентифицировано, оценено или отслежено при использовании методов, описанных ниже в Примерах 1-3, или с помощью других известных в технике эквивалентных методов для определения воздействия соединения на вес тела. Предпочтительные соединения агонистов амилина проявляют активность в тесте по связыванию с рецептором, на порядок меньшую, чем примерно 1-5 нМ, предпочтительно меньше, чем примерно 1 нМ, и более предпочтительно меньше, чем примерно 50 пМ. В тесте с камбаловидной мышцей предпочтительные соединения агониста амилина демонстрируют значение ЭК50 на порядок меньше, чем примерно 1-10 микромолей. В тесте по опустошению желудка предпочтительные соединения агониста демонстрируют значения ЭК50 на порядок меньше, чем 100 мкг/крысу.
Амилин и пептидные агонисты амилина могут быть получены с помощью стандартной техники твердофазного пептидного синтеза и предпочтительно с использованием автоматизированного или полуавтоматизированного устройства для синтеза пептидов. В типичном случае, с использованием указанной техники α-N-карбамоил-защищенную аминокислоту и аминокислоту, прикрепленную к растущей пептидной цепи на смоле, связывают при комнатной температуре в инертном растворителе, таком как диметилформамид, N-метилпирролидинон или метиленхлорид, в присутствии связывающих агентов, таких как дициклогексилкарбодиимид и 1-гидроксибензотриазол, в присутствии основания, такого как диизопропилэтиламин. α-2N-карбамоил-защищающую группу удаляют от полученного продукта пептид-смола с использованием реагента, такого как трифторуксусная кислота или пиперидин, и реакцию связывания повторяют со следующей желательной N-защищенной аминокислотой, добавляемой к пептидной цепи. Подходящие N-защищенные группы хорошо известны в те