Способ установления уремического генеза полиневропатии
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к неврологии, и может быть использовано в комплексе с клинической картиной заболевания для установления уремического генеза полиневропатии. Сущность способа: плазму крови исследуют методом клиновидной дегидратации, при этом каплю плазмы предварительно высушивают на предметном стекле и затем анализируют структуру полученной фации под микроскопом. При наличии сочетания двух признаков - трещин под углом или праллельных краю, а также морщин периферической зоне фации - делается заключение о том, что полиневропатия имеет уремический генез. Применение способа позволяет установить уремический генез полиневропатии у больных с хронической почечной недостаточностью. Способ быстрый и простой в исполнении. 3 ил.
Реферат
Изобретение относится к медицине, а именно к неврологии, и может использоваться для установления генеза полиневропатии у урологических больных, а также для дифференциальной диагностики в спорных случаях.
Полиневропатии (ПНП) - это одна из сложных форм патологического процесса, где до сих пор не выделен доминирующий фактор этиологии заболевания и не разработана обобщающая теория патогенеза. Полиневропатии - не единая болезнь, а группа болезней различной этиологии (1, 4, 8). Это заболевание относится к числу наиболее распространенных. Оно занимает четвертое место среди других причин временной нетрудоспособности - (1, 8).
Большинство периферических нервов выполняют смешанные функции и включают двигательные, чувствительные и вегетативные волокна. В соответствии с этим различают преимущественно двигательные, чувствительные или вегетативные полиневропатии (6, 8).
В зависимости от преимущественного поражения тех или иных структур периферического нерва выделяют паренхиматозные формы полиневропатии: аксонопатии, миелинопатии, интерстициальные полиневропатии с поражением соединительных оболочек и генерализованные (8, 13).
Одним из видов полинейропатии является уремическая.
В настоящее время известен практически один способ установления уремического генеза поленевропатии, при котором требуется одновременное выполнение следующих трех условий: наличие полиневропатии; наличие хронической почечной недостаточности (ХПН); отсутствие других заболеваний, приводящих к развитию полиневропатии (5).
Распространенность уремической полиневропатии в связи с развитием технологий диализа в последние годы имеет тенденцию к уменьшению. Определенную роль играет также субклиническая уремическая полиневропатия, предрасполагающая к повреждению нервных стволов под воздействием любых дополнительных неблагоприятных факторов.
Патогенез полиневропатий при почечной недостаточности не вполне ясен. Уровень креатинина и мочевины в сыворотке крови слабо коррелирует с выраженностью клинических проявлений. В то же время существуют определенные параллели между тяжестью почечной недостаточности и степенью поражения периферической нервной системы. Так, при сохранности фильтрующей способности почек выше 12 мл/мин полиневропатия не развивается (14).
В настоящее время доминирует теория "средних молекул", согласно которой патологическое воздействие обусловлено аккумуляцией нейротоксичных молекул с весом 300-2000 Дальтон, которые возможно постепенно удалить из крови при диализе, и этим объясняют терапевтическое действие диализа в отношении проявлений полиневропатий (15), или удалить полностью при наличии трансплантата почки (14). Однако до сих пор не выделено конкретных токсических веществ, уровень концентрации которых в крови и тканях коррелирует со степенью выраженности полиневропатий (16). В качестве потенциальных токсических агентов называют полиамины, дериваты фенола, миоинозитол, паратгормон (17). Вероятно, эти токсические вещества действуют и на ферменты (в частности, транскетолазу, пиридоксальфосфаткиназу), необходимые для нормального функционирования нервов.
Равным образом в биологических жидкостях у больных с уремией обнаружен ингибитор Na-K-АТФазы, препятствующий элиминации натрия из клеток и снижающий трансмембранный потенциал покоя, в результате чего замедляются деполяризация и проведение импульса.
Впрочем, в последнее время патогенетическое значение ингибиторов, как и "средних молекул", в патогенезе поражения периферических нервов при уремии подвергается сомнению (17), но бесспорно, что только совокупная элиминация различных задерживающих при уремии в крови больных субстанций способна предупреждать и облегчать ее течение (17). Так, M.Sobh и соавт. (1998) добились улучшения нейромышечной функции у 22 больных на гемодиализе, увеличив KT/V до 1,3-1,6 и повысив потребление белка и калорий. Кардинальным решением проблемы является своевременная трансплантация почки, причем улучшение нервной проводимости наступает еще до восстановления выделительной функции трансплантата вследствие способности последнего метаболизировать токсические субстанции (17).
Клиника синдрома представлена прогрессирующим нарушением чувствительности, чаще развивающимся подостро в сроки от нескольких недель до нескольких месяцев и характеризующимся болью, парестезиями, гипералгезией, дизестезиями, онемением в конечностях, а иногда и в периоральной области. Нарушения обычно начинаются в дистальных отделах и распространяются проксимально, чаще поражаются нижние конечности. Объективно отмечают снижение вибрационного и суставно-мышечного чувств; двигательные нарушения отсутствуют, хотя у многих пациентов наблюдают некоторую мышечную слабость и гипотонию. Сухожильные рефлексы снижены или выпадают (8, 13). При электронейромиографии выявляют нарушение проведения по чувствительным нервам (2, 8, 13).
Уремическая полиневропатия является частым осложнением у пациентов, страдающих ХПН (5). Однако, если у урологического больного обнаружена полиневропатия, не обязательно, что это уремическая полиневропатия, вполне возможно имеется сопутствующее заболевание, например сахарный диабет, с развитием ПНП. Уточнение происхождения полиневропатии актуально для решения вопросов, связанных с прогнозированием исхода, коррекцией лечения основного заболевания и полиневропатии. В ситуации, когда пациенту поставлен диагноз уремической полинеропатий - это открывает широкие возможности для более адекватного проведения лечения основного заболевания, в особенности гемодиализа.
Таким образом, на сегодняшний день практически существует только один способ установления уремического генеза полиневропатии, который является достаточно сложным, продолжительным и трудоемким.
В задачу предлагаемого изобретения положена разработка простого, доступного и быстрого способа установления уремического генеза ПНП.
Поставленная задача в способе установления уремического генеза ПНП достигается тем, что плазму крови исследуют методом клиновидной дегидратации, при этом каплю плазмы предварительно высушивают на предметном стекле в течение 18-24 часов при комнатной температуре и минимальном движении воздуха, затем анализируют структуру полученной фации под микроскопом, и при наличии сочетание двух признаков - трещин, расположенных под углом или параллельных краю фации, а также морщин в периферической зоне фации - делают заключение о том, что полиневропатия имеет уремический генез.
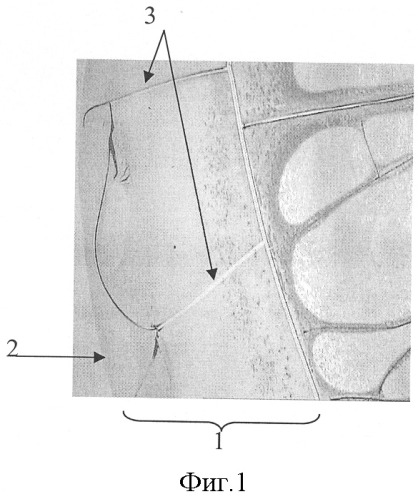
На фиг.1 представлена микрофотография (увеличение ×40) фации плазмы крови в норме, где отражены две зоны - периферическая и центральная, в периферической зоне располагаются радиальные трещины.
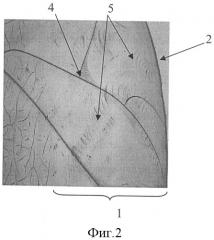
На фиг.2 представлена микрофотография (увеличение ×40) фации плазмы крови больного ХПН с уремической ПНП, где продемонстрированы трещины, параллельные краю и расположенные под углом к краю фации, а также морщины в периферической зоне фации.
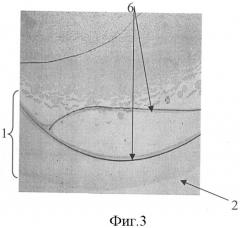
На фиг.3 представлена микрофотография (увеличение ×40) фации плазмы крови больной ХПН без уремической полиневропатии, где показаны трещины, параллельные краю фации, и отсутствуют морщины в периферической зоне фации.
На фиг.1-3 обозначено:
1 - периферическая зона фации плазмы крови,
2 - край фации,
3 - радиальные трещины,
4 - трещины, расположенные под углом и параллельные краю фации,
5 - морщины,
6 - трещины, параллельные краю фации.
Интересен метод клиновидной дегидратации, позволяющий делать видимой молекулярную организацию биологических жидкостей путем перевода ее на макроуровень (12). После высыхания капли в стандартных условиях на твердой подложке количество солей увеличивается от периферии к центру, а количество органических веществ - от центра к периферии (11). Плазма крови оказалась гораздо более сложным объектом изучения вследствие большой вариабельности ее состава и свойств. Кроме выявления зональных структур в диагностике имеет значение форма, количество и размеры трещин, а также выявление патологических структур в высохшей пленке - фации - плазмы крови (9). Предложен способ оценки состояния гомеостаза (10), в котором по параметрам зональных структур высушенной капли биологической жидкости определяют состояние гомеостаза как нормальное или патологическое, а также как устойчивое или неустойчивое. Но какая конкретно патология может быть диагностирована, не указывается. И с точки зрения установления генеза и дифференциальной диагностики ПНП этот метод не использовался.
Исследование проводилось на базе отделения диализа и гравитационной хирургии крови Нижегородской областной клинической больницы им. Н.А.Семашко. Обследовано 63 пациента, страдающих ХПН (33 мужчин и 30 женщин) в возрасте от 19 до 71 года (47,1±1,5 лет). Из общего числа больных 22 пациента находились на додиализной стадии ХПН с длительностью уремии от 1 до 4 лет; 28 пациентов получали программный гемодиализ (ПГД), длительность которого составляла от 1 до 15 лет; 13 пациентов имели аллотрансплантат почки (давность трансплантации составляла от 1 года до 15 лет).
Комплекс исследований включал неврологическое обследование и электрофизилогические методы: электронейромиографию (ЭНМГ) и игольчатую электромиографию (ЭМГ). Клиническое обследование включало сбор анамнеза, неврологический осмотр.
Электронейромиографические показатели регистрировались на аппарате «MBN-нейромиограф» (Россия). Электронейромиографическое исследование осуществлялось при помощи стимулирующего поверхностного пластинчатого электрода (катод располагался дистальнее, анод проксимальнее), а отведение стандартным набором монополярных, пластинчатых электродов диаметром 5 мм.
Использовался постоянный прямоугольный ток частотой 1 Гц, длительностью 200 мс, и сила тока подбиралась супрамаксимальная.
Исследовались следующие нервы.
1) Моторные порции срединных нервов, малоберцовые нервы;
Оценивались: амплитуда моторного ответа (М-ответ), форма М-ответа, длительность М-ответа, площадь М-ответа - комбинированный показатель, латентность М-ответа, скорость проведения импульса (СПИ), резидуальная латентность (РЛ).
2) Сенсорные порции срединных нервов и икроножные нервы исследовались по антидромной методике (дистальное наложение отводящих электродов и стимуляция аналогично исследованию СПИ по двигательным волокнам);
Оценивались: амплитуда потенциала действия (ПД), форма ПД, длительность ПД, площадь ПД, латентность ПД, СПИ по сенсорным волокнам.
3) Симпатические порции срединных и большеберцовых нервов;
Оценивались: амплитуда вызванного кожного симпатического потенциала (ВКСП), форма ВКСП, терминальная латентность ВКСП. Эти показатели отражали состояние преимущественно постганглионарных симпатических волокон периферических нервов.
Игольчатая электромиография проводилась концентрическими биполярными игольчатыми электродами площадью сечения 0,07 мм.
Регистрирующий игольчатый электрод вводился в двигательную точку передней большеберцовой мышцы справа.
Анализировалась спонтанная активность в покое: активность введения, активность концевой пластинки, потенциалы фибрилляций (ПФ), положительные острые волны (ПОВ), потенциалы фасцикуляций; а также параметры потенциалов двигательных единиц (ПДЕ).
Потенциал двигательной единицы характеризовали следующие основные параметры: амплитуда потенциала двигательной единицы; длительность, фазность.
При обработке результатов электронейромиографического и электромиографического исследований использовались нормативные показатели, разработанные в Отделе нервно-мышечной патологии человека с Российским миастеническим центром НИИ общей патологии и патофизиологии РАМН.
Неврологический осмотр выявил проявления полиневропатии с наличием характерных жалоб (жжение и покалывание в стопах, неприятные стягивающие ощущения в ногах, синдром «беспокойных ног», кожный зуд, сегментарные расстройства чувствительности, такие как дизестезии в дистальных отделах конечностей), а также изменениями в неврологическом статусе (снижение сухожильных рефлексов, симметричная гипестезия по периферическому типу, снижение мышечно-суставного чувства и вибрационной чувствительноси) у (36) 57% обследованных пациентов с уремией.
В то же время у 58 (92%) больных хронической почечной недостаточностью регистрируются статистически достоверные изменения ЭНМГ и ЭМГ показателей.
Необходимо отметить, что статистически значимые изменения ЭНМГ показателей были зафиксированы с сенсорных и симпатических порций срединных нервов, икроножных, малоберцовых и симпатических порций большеберцовых нервов.
Всем больным до лечения проводилось исследование плазмы крови методом клиновидной дегидратации.
При сопоставлении результатов клинического, ЭНМГ обследования и структуры фации плазмы крови оказалось, что у 37 (90%) из 39 (100%) больных ХПН, которым клинически и электронейромиографически был поставлен диагноз уремической ПНП, при этом отсутствовала сопутствующая патология (которая могла привести к развитию ПНП), выявлялось сочетание двух признаков - трещин параллельных краю фации или расположенных под углом, а также морщин в периферической зоне фации. У 9 (15%) из 58 (100%) больных с ПНП был сахарный диабет и 5 (8%) пациентов без ПНП из 63 (100%), сочетания данных признаков не отмечалось. Следует указать, что трещины, расположенные под углом и параллельные краю, - это один патологический признак разной степени выраженности (в норме трещины расположены радиально). На фиг.2 представлена микрофотография фации плазмы крови больного Ч. (увеличение х40), трещины, параллельные краю и расположенные под углом (указаны стрелкой 4), морщины в периферической зоне фации (указаны стрелками 5).
Необходимое оборудование для исследования плазмы крови методом клиновидной дегидратации:
1) предметные стекла,
2) пипеточный микродозатор,
3) световой микроскоп.
Предлагаемый способ осуществляют следующим образом: у больных с клиническими признаками ПНП забирают кровь из локтевой вены натощак, центрифугируют ее в течение 10 минут при 1500 об/мин, плазму в количестве 0,01 мл с помощью пипеточного микродозатора наносят на чистое предметное стекло и высушивают при комнатной температуре в закрытом шкафу. Через 18-24 часа полученную фацию рассматривают под микроскопом в проходящем свете на малом увеличении. При наличии сочетания двух признаков - трещин параллельных краю фации или расположенных под углом, а также морщин в периферической зоне фации - делается заключение о том, что ПНП имеет уремический генез.
Способ может применяться для установления генеза полиневропатии у больных хронической почечной недостаточностью. При своей простоте и дешевизне способ имеет чувствительность 100%, специфичность 97%.
Как указывалось выше, уремическая ПНП имеет токсический механизм развития. В крови циркулируют нейротоксичные молекулы, которые в норме отсутствуют. Авторами метода клиновидной дегидратации показано, что морщины в периферической зоне фации плазмы крови являются маркерами интоксикации (9). Обнаружение их у урологических больных закономерно, так как одним из синдромов, сопровождающих процесс хронической почечной недостаточности, является интоксикация. Нами установлено, что присутствие морщин в периферической зоне фации плазмы крови коррелирует с концентрацией альбумина (по методу гамма r=0,42, p=0,034). Альбумин является одним из основных белков плазмы крови человека. Одна из важнейших функций альбуминов - транспортная, причем он может переносить различные метаболиты и токсины. Образование морщин может быть также обусловлено присутствием в плазме «средних молекул», которые являются продуктами деградации белков (3).
Трещины, параллельные краю или располагающиеся под углом, в периферической зоне фации плазмы крови являются признаком нарушений липидного обмена (7). У больных с ХПН нарушены все виды обмена веществ, в том числе и липидный (7). В группе обследованных нами больных наличие вышеописанного признака коррелировало с концентрацией общего холестерина в плазме крови (по методу гамма r=0,6, p=0,04).
У пациентов с хронической почечной недостаточностью без неврологической симптоматики в фации плазмы, крови в 20% случаев присутствовали трещины под углом и параллельные краю, и 20% случаев - морщины в периферической зоне фации, но сочетания этих признаков было отмечено только у одного человека.
В качестве иллюстрации заявляемой диагностической технологии приводим примеры, подтверждающие практическое применение данной методики.
Клинический пример №1.
Больной Ч-ов, 26 лет, № истории болезни 0515847. Поступил в ОКБ им. Н.А.Семашко 15.03.05 с диагнозом: хронический гломерулонефрит, терминальная стадия хронической почечной недостаточности, корригируемая программным гемодиализом.
Наследственность в отношении неврологической патологии со стороны периферической нервной системы не прослеживается, сопутствующие заболевания отсутствуют.
При поступлении предъявлял жалобы на чувство онемения, «ползания мурашек» в дистальных отделах нижних конечностей, а также слабость в мышцах ног, особенно голени, затруднение при ходьбе.
Считает себя больным около трех лет.
В неврологическом статусе: снижена сила в мышцах голеней до 4 баллов, сухожильные рефлексы d = s, с ног торпидны, гипестезия по типу удлиненных перчаток и гольф.
В анализе крови обращает на себя внимание повышеный уровень сывороточного креатинина до 900 мкм/л, мочевины до 37 ммоль/л.
При исследовании вибрационной чувствительности: снижение с рук до 20 дБ и с ног до 25 дБ при всех частотах.
По данным ЭНМГ исследования: амплитуда М-ответов при исследовании срединных нервов составляла 6,2 мВ, ТЛ 3,2 мс, длительность 6,4 мс, площадь 22,3 мкВс, РЛ 2,2 мс; амплитуда М-ответов с малоберцовых нервов равнялась 3,2 мВ, длительность 4,6 мс, площадь 16,3 мкВс. С малоберцовых нервов ТЛ 3,72 мс, РЛ 2,9 мс, СРВ по ДВ с срединных нервов 55,1 м/с, СРВ по ДВ с малоберцовых нервов 43,2 м/с. Показатели амплитуды ПД с срединных нервов составляли 0,0061 мВ, длительности ПД 1,8 мс, площади ПД 0,0035 мкВс; ТЛ 2,9 мс, СРВ по СВ 53,2 м/с. Амплитуда ПД с икроножных нервов была 0,0055 мВ, длительность ПД 1,51 мс, площадь ПД 0,0033 мкВс; СРВ по СВ и ТЛ равнялись соответственно 46,1 м/с и 3,3 мс. Амплитуда ВКСП, зарегистрированная с ладоней, составляла 148 мкВ, ТЛ 2,33 с; при регистрации со стоп 125 мкВ, а ТЛ 2,16 секунды. С передней большеберцовой мышцы спонтанная активность регистрировалась с наличием 6 потенциалов фибрилляций, 5 потенциалов фасцикуляций, 5 положительных острых волн. Потенциалы двигательных единиц преобладали полифазные 35%, с увеличенной средней амплитудой 860 мкВ, длительностью 12,6 мс.
На основании клинической картины и результатов электронейромиографического исследования поставлен диагноз: уремическая моторно-сенсорно-вегетативная полиневропатия.
При исследовании плазмы крови методом клиновидной дегидратации выявлялось сочетание двух признаков - трещин под углом и параллельных краю, а также морщин в периферической зоне фации. На фиг.2 (увеличение ×40) представлены трещины, параллельные краю и расположенные под углом (указаны стрелкой 4), морщины в периферической зоне фации (указаны стрелками 5).
Данный клинический пример иллюстрирует ситуацию, когда больному поставлен диагноз уремическая полиневропатия, и при исследовании плазмы крови методом клиновидной дегидратации выявлены оба патологических признака, указывающих на уремический генез полиневропатии.
Клинический пример №2.
Больная А-юк, 32 года, № истории болезни 0515885. Поступил в ОКБ им. Н.А.Семашко 24.04.05 с диагнозом: хронический гломерулонефрит, хроническая почечная недостаточность 2а стадии.
Наследственность в отношении неврологической патологии со стороны периферической нервной системы не прослеживается, сопутствующие заболевания отсутствуют.
При поступлении жалоб неврологического характера не предъявляла.
Считает себя больной около года.
В неврологическом статусе без изменений.
В анализе крови обращает на себя внимание повышенный уровень сывороточного креатинина до 250 мкм/л, мочевины до 15 ммоль/л.
По данным ЭНМГ исследования: амплитуда М-ответов при исследовании срединных нервов составляла 6,3 мВ, ТЛ 3,2 мс, длительность 6,4 мс, площадь 22,3 мкВс, РЛ 2,2 мс; амплитуда М-ответов с малоберцовых нервов равнялась 3,8 мВ, длительность 4,6 мс, площадь 16,4 мкВс. С малоберцовых нервов ТЛ 3,72 мс, РЛ 2,81 мс, СРВ по ДВ с срединных нервов 55,2 м/с, СРВ по ДВ с малоберцовых нервов 43,3 м/с. Показатели амплитуды ПД с срединных нервов составляли 0,0061 мВ, длительности ПД 1,8 мс, площади ПД 0,003 5 мкВс; ТЛ 2,9 мс, СРВ по СВ 53,2 м/с. Амплитуда ПД с икроножных нервов была 0,0063 мВ, длительность ПД 1,51 мс, площадь ПД 0,0032 мкВс; СРВ по СВ и ТЛ равнялись соответственно 46,1 м/с и 3,3 мс. Амплитуда ВКСП, зарегистрированная с ладоней, составляла 364 мкВ, ТЛ 1,36 с; при регистрации со стоп 255 мкВ, а ТЛ 1,18 секунды. С передней большеберцовой мышцы спонтанная активность не регистрировалась. Параметры потенциалов двигательных единиц были в пределах нормы.
На основании клинической картины и результатов электронейромиографического исследования признаков поражения периферической нервной системы не обнаружено.
При исследовании плазмы крови методом клиновидной дегидратации трещины, параллельные краю в периферической зоне фации, присутствовали. Морщин в периферической зоне фации не выявлялось. На фиг.3 представлена микрофотография фации (увеличение ×40), где показаны трещины, параллельные краю фации (указаны стрелками 6), и отсутствуют морщины в периферической зоне фации.
Данный клинический пример иллюстрирует ситуацию, когда при отсутствии клинических проявлений полиневропатии и нормальной ЭНМГ картине морщин в периферической зоне фации не отмечено, хотя параллельные краю трещины присутствовали.
Источники информации
1. Антонов И.П. Классификация заболеваний периферической нервной системы и формулировка диагноза // Журнал невропатологии и психиатрии им С.С.Корсакова. - 1985. - №4. - С.481-487.
2. Гехт Б.М., Касаткина Л.Ф., Самойлов М.И., Санадзе А.Г. Электромиография в диагностике нервно-мышечных заболеваний. - Издательство Таганрогского государственного радиотехнического университета. - 1997. - 370 с.
3. Грызунов Ю.А., Добрецов Г.Е. Альбумин сыворотки крови в клинической медицине. - М.: ИРИУС, 1994. - 226 с.
4. Жиронкина Н.П. Полиневропатии // Международный медицинский журнал. - 1998. - Т.4. - №2. - С.60-63.
5. Крупин В.Н., Белова А.Н. Нейроурология: Руководство для врачей. - Москва, 2005. - 464 с.
6. Манелис Э.С. К этиологии и патогенезу полиневритов: Обзор литературы // Журнал невропатологии и психиатрии имени С.С.Корсакова. - 1986. - Т.86, выпуск 11. - С.1720-1726.
7. Потехина Ю.П., Шатохина С.Н., Зубеева Г.Н., Мотылев И.М. Исследование морфологической картины сыворотки крови больных ишемической болезнью сердца // Альманах «Геронтология и гериатрия». - Вып.3. - Москва, 2004. - С.219-221.
8. Трошин В.Д., Бурцев Е.М. Основы неврологии: Руководство. - Н.Новгород: изд-во НГМА, 1998. - 345 с.
9. Шабалин В.Н., Шатохина С.Н. Морфология биологических жидкостей человека. - М.: Хризостом, 2001. - 304 с.
10. Шабалин В.Н., Шатохина С.Н., Шабалин В.В. Способ оценки состояния гомеостаза. - Патент РФ №2147124 С1.
11. Шабалин В.Н., Шатохина С.Н. Клиническая кристаллография: становление, проблемы, перспективы // Кристаллографические методы исследования в медицине: Сб. науч. тр. I Всеросс. научно-практ. конф. - М., 1997. - С.3-9.
12. Шатохина С.Н., Шабалин В.Н. Ранняя диагностика уролитиаза, определение степени его активности и состава камнеобразующих солей мочи (система Литос) // Урология и нефрология. - 1998, №1. - С.19-23.
13. Эсбери А.К., Джиллиата Р.У. Заболевания периферической нервной системы. - Москва: Медицина, 1987. - 203 с.
14. Dupont P, Hunt I, Goldberg L, Warrens A. Colchicine myoneuropathy in a renal transplant patient // Transpl Int. 2002 Jul; 15 (7): 374-6. Epub 2002 Jun 20. Department of Renal Medicine, Hammersmith Hospital, Du Cane Road, London W12 0NN, UK.
15. Guiheneuc P. Peripheral neuropathies of chronic renal insufficiency. Review // Nephrologie. 1997; 18(5): 165-73.
16. Jedras M, Zakrzewska-Pmewska B, Wardyn K, Switalski M.Uremic neuropathy - I. Is uremic neuropathy related to patient age, duration of nephropathy and dialysis treatment? // Pol Arch MedWewn. 1998 Jun; 99(6): 452-61.
17. Torazza MC, Salomone M, Albanesi T, Deabate MC, Zina A, Triolo G. Uremic pruritus // Minerva Urol Nefrol. 1997 Sep; 49 (3): 125-32.
Способ установления уремического генеза полиневропатии у больных с хронической почечной недостаточностью, отличающийся тем, что плазму крови исследуют методом клиновидной дегидратации, при этом каплю плазмы предварительно высушивают на предметном стекле в течение 18-24 ч при комнатной температуре и минимальном движении воздуха, затем анализируют структуру полученной фации под микроскопом, и при наличии сочетания двух признаков - трещин, расположенных под углом или параллельных краю фации, а также морщин в периферической зоне фации делают заключение о том, что полиневропатия имеет уремический генез.