Способ криосохранения клеток морских беспозвоночных
Иллюстрации
Показать всеИзобретение относится к области медицины, биотехнологии. Способ включает обработку эмбриональных клеток морских беспозвоночных криопротекторной смесью, включающей липиды, сахара, антиоксиданты и солевой раствор. В качестве липидов используют липидные экстракты морских гидробионтов с низкими температурами фазовых переходов, которые предварительно обрабатывают ультразвуком. Криопротекторную смесь используют при определенном соотношении компонентов в мас.%. Кроме того, в криопротекторную смесь дополнительно может быть введено 5-10% диметилсульфоксида (ДМСО). Способ позволяет повысить степень сохранности клеток морских беспозвоночных без нарушения их функциональной активности после замораживания-оттаивания за счет сохранения целостности и стабильности их клеточных мембран и обеспечивает возможность количественной оценки сохранности клеток. 1 з.п. ф-лы, 2 ил., 2 табл.
Реферат
Изобретение относится к биотехнологии, в частности к способам криосохранения биологического материала, а именно клеток морских беспозвоночных животных, и может быть использовано в криобиологии, клеточной биологии и морской биотехнологии для сохранения клеток морских беспозвоночных.
Проблема криосохранения клеток морских беспозвоночных животных очень актуальна. В условиях усиливающегося антропогенного воздействия на Мировой океан и населяющих его животных необходимо сохранение генофонда морских организмов. Криоконсервация зародышевых клеток и эмбрионов - один из перспективных путей сохранения генофонда промысловых, а также редких и исчезающих видов животных и растений. Развитие методов криоконсервации морских беспозвоночных позволит снять географические ограничения и зависимость от сезона размножения, что может открыть путь для создания новых биотехнологий.
Если замораживание спермиев является рутинной процедурой для многих видов, то замораживание ооцитов и эмбрионов на сегодняшний день остается проблематичным. Обычные криопротекторы, используемые при замораживании клеток млекопитающих, являются неэффективными для данных объектов. Возможно, это связано с тем, что морские беспозвоночные являются пойкилотермными животными, а их тепловая акклимация происходит в достаточно широком диапазоне температур. Морские беспозвоночные не способны быстро приспосабливать вязкость липидного матрикса мембран к резким изменениям температуры (Sanina N.M., Kostetsky E.Ya. Thermotropic behavior of major phospholipids from marine invertebrates: changes with warm acclimation and seasonal acclimatization. Comp. Biochem. Physiol. 2002. 133В: 143-153). Особый жирнокислотный состав клеточных мембран морских животных и растений, в которых преобладают ненасыщенные жирные кислоты, требует принципиально новых криопротекторов.
Известны способы криосохранения клеток, эмбрионов и личинок морских беспозвоночных путем введения в криопротекторную смесь различных биологически активных веществ: моно- и дисахаридов (Crowe J.H., Crowe L.M.. Preservation of Membranes in Anhydrobiotic Organisms: The Role of Trehalose. Science, 1984, V.223: 701-703), антифризных белков (Theede H., Schneppenheim, Beress L.. Antifreeze Glycoproteins in Mytilus edulis. Marine Biology, 1976, V.36: 183-189; Rubinsky В., Arav A., Devries A.L. Cryopreservation of Oocytes Using Directional Cooling and Antifreeze Glycoproteins. Cryo-Letters, 1991, V.12: 93-106; Arav A., Rubinsky В., Fletcher G., Seren E. Cryogenic Protection of Oocytes with Antifreeze Proteins, Molecular Reproduction and Development, 1993, V.36: 488-493), липидов (Simpson A.M., Swan M.A., White I.G. Action of phosphatidylcholine in protecting ram sperm from cold shock. Gamete Res., 1986, V.15: 43-56; Graham J.K., Foote R.H. Effects of several lipids, fatty acyd chain length, and degree of unsaturation on the motility of bull spermatozoa after cold shock and freezing. Cryobiology, 1987, V.24: 42-52; Odintsova N.A., Kiselev K.V., Sanina N.M., Kostetsky E.Y. Cryopreservation of primary cell cultures of marine invertebrates. Cryo-Letters, 2001, V.22: 299-310; Odintsova NA, Ageenko NV, Kiselev KV, Sanina NM, Kostetsky EY. Analysis of marine hydrobiont lipid extracts as possible cryoprotective agents. Int. J. Refrigeration, 2006. 29: 387-395). Известно также и введение антиоксидантов в состав криопротекторных смесей, например альфа-токоферола (витамин E) при замораживании незрелых гемопоэтических клеток (Matthes G, Hubner U, Granz M, Schutt M, Hackensellner НА. Antioxidants increase the cryoresistance of GM-CFC. 1987. Folia Haematol Int Mag Klin Morphol Blutforsch. 114(4): 482-483), аскорбата - при замораживании мышиных эмбрионов (Lane M, Maybach JM, Gardner DK. Addition of ascorbate during cryopreservation stimulates subsequent embryo development. 2002. Human Reproduction 17 (10); 2686-2693), эхинохрома - нафтахиноидного пигмента из морских ежей при замораживании личинок устрицы и морских ежей (Naidenko TKh. Cryopreservation of Crassostrea gigas oocytes, embryos and larvae using antioxidant echinochrome A and antifreeze protein AFP1. 1997. Cryo-Letters 18: 375-382).
Однако в вышеуказанных способах отмечен лишь незначительный эффект используемых криопротекторов на биологическую активность замораживаемых клеток и личинок.
Известен способ криосохранения личинок морских беспозвоночных путем использования смеси диметилсульфоксида (ДМСО), трегалозы и антиоксидантов, в частности эхинохрома (область тестированных концентраций: 1-100 мкг/мл) для клеток устрицы и морских ежей (Найденко Т.Х., Кольцова Е.А. Использование антиоксиданта эхинохрома А при криоконсервации эмбрионов и личинок морских ежей. Биология моря 1998, Т.24, N 3, С.198-201).
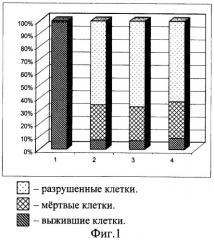
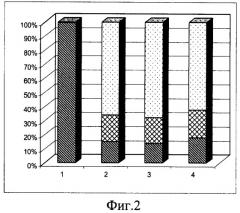
Недостатком данного способа является только качественная оценка жизнеспособности, подвижности и развития эмбрионов и личинок морских беспозвоночных, во многом отражающая субъективный подход исследования. В результате невозможно оценить степень сохранности эмбрионов и личинок морских беспозвоночных после размораживания. Кроме того, проведенные нами количественные эксперименты по замораживанию эмбриональных клеток морских беспозвоночных с использованием этой же криопротекторной смеси показали, что положительный эффект эхинохрома отсутствует или крайне незначителен по сравнению с клетками, замороженными просто в присутствии ДМСО, что видно на графиках жизнеспособности клеток, представленных на фиг.1 и 2. На фиг.1 представлены данные по жизнеспособности клеток моллюсков, а на фиг.2 - иглокожих, где 1) незамороженные клетки; 2) замороженные в присутствии 5% ДМСО; 3) в присутствии ДМСО+1% эхинохрома (природного); 4) замороженные в присутствии ДМСО+1% эхинохрома (синтетического). Количество жизнеспособных клеток после замораживания-оттаивания в присутствии используемых в данном эксперименте криопротекторов практически одинаково: около 5% живых клеток мидии, замороженных в присутствии только ДМСО (фиг.1, столбик 2) и то же количество в случае использования в качестве криопротекторов смеси ДМСО и эхинохрома, как синтетического, так и природного (фиг.1, столбики 3 и 4). Количество живых клеток морского ежа после замораживания в присутствии только ДМСО (фиг.2, столбик 2) было около 10%, тогда как количество живых клеток, замороженных в присутствии ДМСО и эхинохрома, варьировало от 9 до 11% (фиг.2, столбики 3 и 4).
Наиболее близким по количеству существенных признаков и достигаемому техническому результату к изобретению является способ криосохранения личинок моллюсков, включающий их обработку криопротекторной смесью, содержащей 0,1-10 М (0.3-30%) водный раствор полисахаридов, в частности сахара, глюкозы или трегалозы, и/или криопротекторы, такие как ДМСО или глицерин (5-15%), а также холестерин (0,25-1,5 мг/мл). (WO 91/01636, МПК А01N 1/02, G01N 33/50, 1991).
Водный раствор полисахаридов находится в контакте с холестерином, который используется как субстрат и наносится на поверхность криовиал, пробирок и т.д. Личинки, замороженные в этой криопротекторной смеси, после размораживания в течение первой недели отставали в развитии от контрольных незамороженных личинок, а через 35 суток контрольные и размороженные личинки имели одинаковые размерные характеристики.
Недостатком метода является то, что он апробирован только на личинках моллюсков и полностью отсутствуют данные о доле выживших личинок после замораживания-оттаивания. По биологическому материалу, полученному после размораживания, практически невозможно произвести количественную оценку эффективности данного криопротектора, и, как следствие, невозможно говорить о степени сохранности клеток личинок.
Задача изобретения - повышение степени сохранности клеток морских беспозвоночных без нарушения их функциональной активности после замораживания-оттаивания за счет сохранения целостности и стабильности их клеточных мембран и возможность количественной оценки сохранности клеток.
Поставленная задача решается тем, что в известном способе криосохранения биологического материала, включающем обработку биологического материала криопротекторной смесью, содержащей раствор сахаров и липиды, согласно изобретению в качестве биологического материала берут эмбриональные клетки морских беспозвоночных, а в качестве липидов используют липидные экстракты морских гидробионтов с низкими температурами фазовых переходов, которые предварительно обрабатывают ультразвуком. Для приготовления криопротекторной смеси используют солевой раствор, в который дополнительно вводят антиоксиданты. Криопротекторную смесь используют при следующем соотношении компонентов в мас.%:
| Раствор сахаров | 1,0-10,0 |
| Липидные экстракты | 0,08-0,15 |
| Антиоксиданты | 0,3-1,0 |
| Солевой раствор | остальное |
В криопротекторную смесь дополнительно может быть введено 5-10% диметилсульфоксида (ДМСО).
Достижение заявленного технического результата обеспечивается использованием в качестве объекта исследования эмбриональных клеток морских беспозвоночных, полученных путем диссоциации личинок разных стадий развития. Использование в качестве модельной системы клеток, а не целых эмбрионов и личинок, позволяет быстро (в течение суток) и количественно оценить эффект различных криопротекторов на целостность и функциональную активность клеток. В способе могут быть использованы, в частности, эмбриональные клетки моллюсков и морских ежей различных видов.
В качестве липидных экстрактов используют липидные экстракты морских гидробионтов с низкими температурами фазовых переходов кристалл - жидкий кристалл, в частности липидные экстракты мидии, зеленой водоросли ульвы или бурой водоросли саргассум, для которых характерно большое количество липидов с ненасыщенными жирными кислотами. Большая часть термограмм этих липидных экстрактов локализована при температуре ниже 0°С, что, вероятно, и обуславливает особое поведение этих липидов при криоконсервации и обеспечивает достижение заявленного технического результата.
Однако при введении в криопротекторную смесь более 0,15% липидного экстракта могут проявиться токсические эффекты, связанные с присутствием в липидных экстрактах метанола и хлороформа, с помощью которых выделяют липиды, а при использовании менее 0,08% липидного экстракта эффективность применения данной криопротекторной смеси начинает снижаться и не обеспечивает повышение степени сохранности клеток.
Липидные экстракты морских гидробионтов с низкими температурами фазовых переходов целесообразно предварительно обрабатывать ультразвуком (22 кГц, 1-2 мин). Это позволяет получить стабильную микроэмульсию. Ее стабильность, которую контролируют по размеру эмульгированных частиц (например, на счетчике частиц фирмы Malvern, Англия), сохраняется в течение 3-4 дней.
Введение в криопротекторную смесь липидных экстрактов в виде эмульсии способствует восстановлению области разрушения, а также препятствует повреждению мембраны во время замораживания-оттаивания, обеспечивая тем самым достижение заявленного технического результата - повышение степени сохранности эмбриональных клеток без нарушения их функциональной активности.
Следует заметить, липидные экстракты морских гидробионтов с низкими температурами фазовых переходов, введенные в состав криопротекторной смеси, выполняют функцию, отличную от той, которую выполняет липид в прототипе. В прототипе холестерин (липид) используется как субстрат, который наносится на поверхность криовиал, пробирок и т.д. В заявляемом техническом решении липидные экстракты являются существенным компонентом криопротекторной смеси и способствуют повышению степени сохранности клеток.
Для приготовления криопротекторной смеси в качестве солевого раствора может использоваться питательная среда (с осмотичностью, равной морской воде), или искусственная морская вода, или стерилизованная природная морская вода.
В криопротекторную смесь вводят 1,0-10,0% раствора сахара, в частности трегалозы, которая выполняет роль мембранного стабилизатора. На практике обычно используют 0,1-10 М раствор сахара. Введение менее 1,0% трегалозы не способствует повышению степени сохранности эмбриональных клеток морских беспозвоночных, а добавление в криопротекторную смесь более 10,0% трегалозы приводит к снижению жизнеспособности клеток морских беспозвоночных после замораживания.
В качестве дополнительного компонента криопротекторной смеси вводят 0,3-1,0% антиоксидантов (природных или синтетических, таких как α-токоферол, аскорбиновая кислота или эхинохром). Введение в криопротекторную смесь антиоксидантов, по-видимому, предотвращает окислительный стресс при замораживании стволовых клеток, эмбрионов и личинок. Добавление антиоксидантов в концентрации менее 0,3% не способствует увеличению жизнеспособности клеток после замораживания-оттаивания по сравнению с криопротекторными смесями без антиоксидантов, а при концентрации более 1% может наблюдаться токсичный эффект антиоксидантов.
Введение в состав криопротекторной смеси 5-10% ДМСО, наиболее часто используемого криопротектора при криосохранении биологического материала, также позволяет достичь заявляемый технический результат. Однако его использование не является предпочтительным, поскольку при положительных температурах он проявляет токсичный эффект.
В результате патентного поиска обнаружены источники информации, использующие по отдельности каждый из компонентов заявляемой криопротекторной смеси, что отмечено в описании. Однако применение в качестве криопротекторов комбинации трех важнейших компонентов позволило значительно снизить потери биологической активности клеток морских беспозвоночных за счет синергетического действия всех компонентов используемой криопротекторной смеси. Каждый из компонентов влияет на целостность клеточных мембран. Однако нами было обнаружено, что при этом наблюдается не суммарный эффект всех трех криопротекторов, а их кумулятивный эффект. Антиоксиданты (α-токоферол, аскорбиновая кислота и эхинохром) были эффективны только при использовании их вместе с липидными экстрактами.
Способ осуществляется следующим образом.
Эмбриональные клетки морских беспозвоночных получают способами, известными из уровня техники. Так, в частности, морских ежей (Strongylocentrotus intermedius, St. nudus и Echinorachnius mirabilis) индуцируют к нересту электрическим шоком или инъекциями в полость животных 0,5 М раствора KCl. Оплодотворенные яйцеклетки выращивают до нужной стадии развития, личинки диссоциируют на клетки с помощью 0,125% р-ра коллагеназы в течение - 30-120 минут при комнатной температуре. Затем клеточную суспензию (10-30×106 клеток/мл) переносят в полипропиленовые криовиалы и добавляют криопротекторную смесь. Далее криовиалы выдерживают в течение 20 минут на ледяной бане, после чего их помещают в глицерин-спиртовую баню лабораторной установки для замораживания при температуре -25-30°С (примерная скорость замораживания 5-6°/мин). Через 15-20 минут замороженные пробы переносят в контейнер с жидким азотом. Оттаивание проводят на водяной бане при интенсивном перемешивании при температуре 20-22°С. В качестве контроля используют незамороженные клетки. Эффективность способа оценивают с помощью известной методики определения жизнеспособности путем прямого подсчета числа клеток в камере Горяева в присутствии витального красителя трипанового синего, а физиологическую активность клеток оценивают по уровню синтеза РНК (Odintsova N.A., Belogortseva N.I., Ermak A.V., Molchanova V.I., Luk'yanov P.A. Adhesive and growth properties of lectin from the ascidian Didemnum ternatanum on cultivated marine inverte invertebrate cells. Biochem. Biophys. Acta. 1999. V.1448: 381-389).
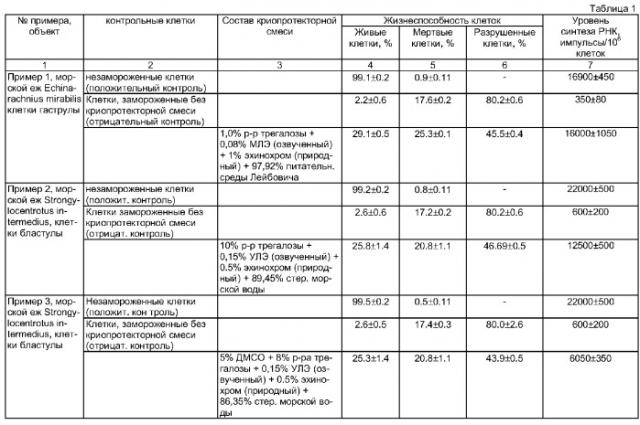
Пример 1.
Нерест плоских морских ежей Echinarachnius mirabilis, индуцируют электрическим шоком. Искусственно оплодотворенные яйцеклетки выращивают до стадии гаструлы (24 ч после оплодотворения при 17°С) и диссоциируют на клетки обработкой 0,1%-ным раствором коллагеназы в течение 20-30 мин при 15 С. Полученную клеточную суспензию промывают дважды в стерильной морской воде, содержащей пенициллин 500 ед./мл и гентамицин 40 мкг/мл.
В полипропиленовые криовиалы (2 мл) помещают по 0,33 мл суспензии диссоциированных клеток (10-15×106 клеток/мл) и добавляют 0,67 мл криопротекторной смеси, состав которой указан в таблице. В состав криопротекторной смеси вводят в качестве антиоксиданта природный эхинохром, в качестве липидного экстракта используют липидный экстракт из тканей мидии Crenomytilus grayanus (предварительно обработанный ультразвуком) - МЛЭ, а в качестве солевого раствора - питательную среду Лейбовича. Таким образом, криопротекторная смесь включает 1% трегалозы, 0,08% МЛЭ, 1% эхинохрома и 97,92% питательной среды Лейбовича.
Смесь замораживают, как описано выше. Затем клетки размораживают на водяной бане при интенсивном перемешивании при температуре 20-22°С. Количественную степень сохранности клеток ведут по оценке жизнеспособности клеток и уровню синтеза РНК. В качестве контроля используются незамороженные клетки, а также клетки, замороженные без добавления криопротекторной смеси.
Результаты определения жизнеспособности диссоциированных клеток гаструлы плоского морского ежа и синтеза в них РНК после криозамораживания в различных криопротекторных смесях представлены в таблице 1. Жизнеспособность клеток, замороженных в предлагаемой в данном примере криопротекторной смеси, почти в 14 раз выше, чем жизнеспособность клеток, замороженных без криопротекторов, а уровень синтеза РНК почти достигает уровня синтеза РНК клеток до замораживания (в расчете на 1 миллион живых клеток).
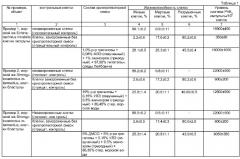
Пример 2.
Берут морских ежей Strongylocentrotus intermedius. Нерест морских ежей индуцируют инъекциями в полость животных 0,2-0,4 мл 0,5 М раствора KCl. Искусственно оплодотворенные яйцеклетки выращивают до стадии бластулы, помещая их на 12 часов в сосуды со стерильной морской водой при 17°С. Бластулы диссоциируют на клетки обработкой 0,1%-ным раствором коллагеназы в течение 20-30 мин при 15 С. Полученную клеточную суспензию промывают дважды в стерильной морской воде, содержащей пенициллин 500 ед./мл и гентамицин 40 мкг/мл.
В полипропиленовые криовиалы (2 мл) помещают по 0,33 мл суспензии диссоциированных клеток (10-15×106 клеток/мл) и добавляют 0,67 мл криопротекторной смеси. Состав криопротекторной смеси включает 0.5% природного эхинохрома; 0,15% липидного экстракта из тканей зеленой водоросли Ulva fenestrat (УЛЭ), предварительно обработанного ультразвуком; 10% трегалозы; остальное процентное содержание составляет солевой раствор, в качестве которого используют стерилизованную морскую природную воду. Смесь замораживают, как описано выше. Затем клетки размораживают на водяной бане при интенсивном перемешивании при температуре 20-22°С. Количественную степень сохранности клеток ведут по оценке жизнеспособности клеток и уровню синтеза РНК. В качестве контроля используются незамороженные клетки, а также клетки, замороженные без добавления криопротекторной смеси.
В Таблице 1 представлены результаты определения жизнеспособности диссоциированных клеток бластулы морского ежа и синтеза в них РНК после криозамораживания. Клетки бластулы менее устойчивы к различным повреждающим воздействиям, поэтому разница в жизнеспособности этих клеток, замороженных в присутствии предлагаемой криопротекторной смеси, меньше в 8 раз по сравнению с жизнеспособностью клеток, замороженных без криопротекторов, а уровень синтеза РНК не достигает уровня синтеза РНК клеток до замораживания - он примерно составляет 60% от такового, но в 20 раз превышает этот показатель у клеток, замороженных без криопротекторов.
Пример 3.
Берут эмбрионы морских ежей S. intermedius со стадии бластулы, как описано в примере 2. Все последующие процедуры такие же, как в примере 2, за исключением того, что состав криопротекторной смеси состоит из: 0.5% природного эхинохрома; 0,15% липидного экстракта из тканей зеленой водоросли Ulva fenestrata, предварительно обработанного ультразвуком (УЛЭ); 8% раствора трегалозы; остальное процентное содержание составляет солевой раствор, в качестве которого используют стерилизованную морскую природную воду, в которой присутствует диметилсульфоксид (ДМСО) в количестве 5%.
Количественную степень сохранности клеток ведут по оценке жизнеспособности клеток и уровню синтеза РНК. В качестве контроля используются незамороженные клетки, а также клетки, замороженные без добавления криопротекторной смеси.
В Таблице 1 представлены результаты определения жизнеспособности клеток морского ежа после криозамораживания. Так же, как и в предыдущем примере, жизнеспособность этих клеток, замороженных в присутствии предлагаемой криопротекторной смеси, в 8 раз выше, чем жизнеспособность клеток, замороженных без криопротекторов. Однако уровень синтеза РНК меньше, чем в клетках, замороженных в подобной смеси, но без ДМСО примерно в два раза, но он в 10 раз превышает этот показатель у клеток, замороженных без криопротекторов.
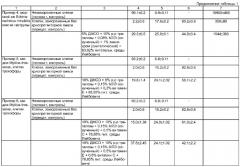
Пример 4.
Нерест плоских морских ежей Echinarachnius mirabilis индуцируют электрическим шоком. Искусственно оплодотворенные яйцеклетки выращивают до стадии гаструлы (24 ч после оплодотворения при 17°С) и диссоциируют на клетки, как описано в примере 1. Все последующие процедуры, такие же, как в примере 1, за исключением того, что состав криопротекторной смеси состоит из: 1% синтетического эхинохрома; 0,08% липидного экстракта из тканей мидии С. grayanus (МЛЭ), (предварительно обработанного ультразвуком); 10% трегалозы; остальное процентное содержание составляет солевой раствор, в качестве которого используют модифицированную питательную среду Лейбовича (Odintsova et al., 1999. V.1448: 381-389), в которой присутствует диметилсульфоксид (5% ДМСО).
Количественную степень сохранности клеток ведут по оценке жизнеспособности клеток и уровню синтеза РНК. В качестве контроля используются незамороженные клетки, а также клетки, замороженные без добавления криопротекторной смеси.
В Таблице 1 представлены результаты определения жизнеспособности диссоциированных клеток гаструлы плоского морского ежа и синтеза в них РНК после криозамораживания.
Клетки гаструлы более устойчивы к различным повреждающим воздействиям, поэтому разница в жизнеспособности этих клеток, замороженных в присутствии предлагаемой криопротекторной смеси, меньше - в 1.5 раза по сравнению с клетками, замороженными просто в растворе, содержащем ДМСО и трегалозу, но уровень синтеза РНК в их клетках увеличивался более чем в 7 раз (из расчета на 1 миллион живых клеток). Эти данные, так же как и в Примере 1, доказывают кумулятивный эффект используемых компонентов криопротекторных смесей, таких как мембранный стабилизатор (10% трегалоза), экзогенный липидный экстракт (0,08% МЛЭ) и антиоксидант (1% природный эхинохром) в присутствие ДМСО.
Жизнеспособность клеток гаструлы плоского морского ежа, замороженных в присутствии заявляемой криопротекторной смеси, почти в 14 раз выше, чем жизнеспособность клеток, замороженных без криопротекторов, а уровень синтеза РНК почти достигает уровня синтеза РНК клеток до замораживания и примерно равен таковому в клетках, замороженных в подобной криопротекторной смеси, но в присутствии природного эхинохрома.
Пример 5
Берут половозрелые мидии Mytilus trossulus. Нерест индуцируют термическим шоком (от 10 до 20°С). Искусственно оплодотворенные яйцеклетки выращивают до стадии трохофоры (24 ч после оплодотворения при 17°С) и диссоциируют на клетки, как указано в примере 1. Все последующие процедуры аналогичны примерам 1-4. Состав криопротекторной смеси: альфа-токоферол (витамин Е) - 0,3%, 0,15% липидного экстракта из тканей мидии (МЛЭ), предварительно обработанного ультразвуком; 10% трегалозы; остальное процентное содержание составляет солевой раствор, в качестве которого используют модифицированную питательную среду Лейбовича, в которой присутствует диметилсульфоксид (10% ДМСО).
Количественную степень сохранности клеток ведут по оценке жизнеспособности клеток и уровню синтеза РНК. В качестве контроля используются незамороженные клетки, а также клетки, замороженные без добавления криопротекторной смеси.
В Таблице 1 представлены результаты определения жизнеспособности клеток трохофоры мидии после криозамораживания. Несмотря на то что клетки моллюсков более чувствительны к разрушениям после замораживания-оттаивания, жизнеспособность эмбриональных клеток мидии, замороженных в присутствии предлагаемой криопротекторной смеси, увеличивалась в 7,3 раза по сравнению с клетками, замороженными просто в растворе, содержащем 10% ДМСО и трегалозу.
Пример 6
Выполняют аналогично Примеру 5 за исключением того, что в состав криопротекторной смеси в качестве антиоксиданта вводят смесь витаминов Е и С - по 0,5%.
Количественную степень сохранности клеток ведут по оценке жизнеспособности клеток и уровню синтеза РНК. В качестве контроля используются незамороженные клетки, а также клетки, замороженные без добавления криопротекторной смеси.
В Таблице 1 представлены результаты определения жизнеспособности клеток трохофоры мидии после криозамораживания. Обращает на себя внимание тот факт, что самый лучший криозащитный эффект наблюдается при использовании в качестве антиоксидантов смеси двух витаминов - витамина Е и С.
Как видно из результатов, представленных в таблице 1, что заявляемый способ криосохранения клеток морских беспозвоночных позволяет очень быстро получить клетки морских беспозвоночных, обладающих высокой функциональной активностью после замораживания-оттаивания.
Пример 7
Берут морских ежей Strongylocentrotus intermedius. Нерест морских ежей индуцируют инъекциями в полость животных 0,2-0,4 мл 0,5 М раствора KCl. Искусственно оплодотворенные яйцеклетки выращивают до стадии бластулы, помещая их на 12 часов в сосуды со стерильной морской водой при 17°С. Бластулы диссоциируют на клетки обработкой 0,1%-ным раствором коллагеназы в течение 20-30 мин при 15 С. Полученную клеточную суспензию промывают дважды в стерильной морской воде, содержащей пенициллин 500 ед./мл и гентамицин 40 мкг/мл.
В полипропиленовые криовиалы (2 мл) помещают по 0,33 мл суспензии диссоциированных клеток (10-15×106 клеток/мл) и добавляют 0,67 мл криопротекторной смеси. Для более наглядного доказательства проявления синергетического эффекта в данном примере использованы криопротекторы различного состава, который приведен в таблице (Примеры 7б-7д).
Смесь замораживают, как описано выше. Затем клетки размораживают на водяной бане при интенсивном перемешивании (20-24°С).
Количественную степень сохранности клеток ведут по оценке жизнеспособности клеток и уровню синтеза РНК. В качестве контроля используются незамороженные клетки и клетки, замороженные без криопротектора.
В Таблице 2 представлены результаты влияния состава компонентов криопротекторной смеси на жизнеспособность диссоциированных клеток бластулы морского ежа и синтез в них РНК после криозамораживания.
Жизнеспособность клеток бластулы морских ежей, замороженных в присутствии заявляемой криопротекторной смеси, увеличивалась в 1,75 раза по сравнению с клетками, замороженными просто в растворе, содержащем 10% ДМСО и трегалозу, а уровень синтеза РНК в их клетках увеличивался более чем в 4 раза. Применение в качестве криопротекторов комбинации трех важнейших компонентов позволило значительно снизить потери биологической активности клеток морских беспозвоночных за счет синергетического действия всех компонентов используемой криопротекторной смеси. Каждый из компонентов влияет на целостность клеточных мембран. Однако нами было обнаружено, что при этом наблюдается не суммарный эффект всех трех криопротекторов, а их кумулятивный эффект. Обращает на себя внимание, что для клеток морских ежей кумулятивный эффект используемых компонентов криопротекторных смесей был высоким как в отсутствие, так и в присутствии диметилсульфоксида (ДМСО).
| Таблица 2 | ||||||
| № примера, объект | контрольные клетки | Состав криопротекторной смеси | Жизнеспособность клеток | Уровень синтеза РНК, импульсы/106 клеток | ||
| Живые клетки, % | Мертвые клетки, % | Разрушенные клетки, % | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Пример 7. морской еж Strongylocentrotus intermedius клетки бластулы | незамороженные клетки (положительный контроль) | 99.2±0.2 | 0.8±0.11 | - | 22000±500 | |
| 7а | клетки замороженные без криопротекторной смеси (отрицательный контроль) | 2.6±0.6 | 17.2±0.2 | 80.2±0.6 | 600±200 | |
| 7б | 10% ДМСО + 90% искусств, морской воды | 9.6±0.6 | 17.8±0.97 | 72.6±2.15 | 1800±200 | |
| 7в | 10% ДМСО + 1% трегалозы + 89% искусств, морской воды | 16.5±1.2 | 21.9±1.1 | 61.6±1.8 | 2100±200 | |
| 7г | 10% ДМСО + 1% трегалозы + 0,15% МЛЭ + 88,85% искусств, морской воды | 20.4±0.5 | 18.0±0.1 | 61.6±0.6 | 5000±200 | |
| 7д, согласно изобретению | 10% ДМСО + 1% трегалозы + 0,15% МЛЭ + 0,3% эхинохрома + 88,55% искусств, морской воды | 29.1±0.5 | 25.9±0.1 | 45.0±0.4 | 9700±300 |
1. Способ криосохранения биологического материала, включающий обработку биологического материала криопротекторной смесью, содержащей раствор сахаров и липидов, отличающийся тем, что в качестве биологического материала берут эмбриональные клетки морских беспозвоночных, в качестве липидов используют липидные экстракты морских гидробионтов с низкими температурами фазовых переходов, предварительно обработанные ультразвуком, а в качестве раствора используют солевой раствор, в который дополнительно вводят антиоксиданты, при следующем соотношении компонентов, мас.%:
| Трегалоза | 1,0-10,0 |
| Липидные экстракты | 0,08-0,15 |
| Антиоксиданты | 0,3-1,0 |
| Солевой раствор | Остальное |
2. Способ по п.1, отличающийся тем, что в криопротекторную смесь в состав солевого раствора вводят 5-10% диметилсульфоксида.