Антагонист casr
Иллюстрации
Показать всеИзобретение относится к новому соединению, представленному следующей формулой (1), его фармацевтически приемлемым солям или оптически активным формам:
где каждый символ является таким, как определено в формуле изобретения. Соединение обладает антагонистическим действием в отношении кальций-чувствительного рецептора. Изобретение относится также к терапевтическому лекарственному средству для лечения остеопороза на основе этого соединения, к способу лечения остеопороза, антагонисту кальциевого рецептора и к способствующему выделению РТН агенту. 5 н. и 28 з.п. ф-лы, 66 табл.
Реферат
Область техники
Настоящее изобретение относится к соединению, обладающему антагонистическим действием в отношении кальций-чувствительного рецептора (CaSR, далее упоминаемый для простоты как кальциевый рецептор), фармацевтической композиции, содержащей соединение, в частности антагонисту кальциевого рецептора, и терапевтическому агенту для лечения остеопороза.
Уровень техники
Кальциевые рецепторы распознают внеклеточную концентрацию Ca2+ и увеличивают внутриклеточное содержание Ca2+, подавляя, таким образом, продуцирование паратиреоидного гормона (РТН), вовлеченного в контроль метаболизма Ca2+ и костного метаболизма.
Концентрация кальция в сыворотке крови здорового млекопитающего жестко поддерживается на уровне примерно 9-10 мг/100 мл (приблизительно 2,5 мМ), который упоминается как гомеостаз кальция живых организмов. Когда данная величина падает до уровня, составляющего не более 50%, наступает тетания, и наоборот, когда она превышает на 50% данный уровень, сознание затуманивается, оба случая представляют угрозу для жизни. Для поддержания кальциевого гомеостаза двенадцатиперстная кишка выступает в роли органа поглощения Ca2+, кости выступают в качестве органа хранения Ca2+, а почки действуют в качестве органа выведения Ca2+. Такая кинетика Ca2+ контролируется различными гормонами, обычно упоминаемыми как «кальций-контролирующий гормон». Иллюстративные гормоны включают активный витамин D [1α, 25(OH)2D3], PTH, кальцитонин, паратиреоидный гормон-связанный белок (PTH-связанный белок (PTHrP)) и тому подобное.
Кости играют важную роль не только в качестве поддерживающего каркаса и двигательного органа тела, но также в качестве органа хранения Ca2+, который представляет собой составляющих их компонент. Для выполнения данных функций костные ткани повторяют его образование (остеогенез) и поглощение (костная ресорбция) на протяжении всей жизни. В остеогенезе главную роль играют остеобласты, образующиеся из мезенхимальных клеток, а в костной резорбции главную роль играют остеокласты, образующиеся из гематопоэтических клеток. Механизм остеогенеза включает образование остеоида посредством костного органического матрикса (костные матриксные белки, такие как коллаген типа I и тому подобное), продуцируемого остеобластом, присутствующим на остеогенезной поверхности, с последующим кальцинированием. С другой стороны, механизм костной ресорбции включает адгезию остеокласта к поверхности кости, внутриклеточную абсорбцию Ca2+ посредством секреции протеазной кислоты и ионного транспорта и выделение абсорбированного Ca2+ к стороне костного мозга, высвобождая, таким образом, Ca2+ в кровь. Недостающая часть кости, абсорбированная остеокластом, восстанавливается за счет остеогенеза посредством остеобласта. Такой ряд явлений называется ремоделированием костей, и посредством ремоделирования старая кость заменяется на новую, поддерживая, таким образом, прочность всех костей, в то время как поддерживается кальциевый гомеостаз.
РТН представляет собой гормон, который играет ключевую роль в поддержании кальциевого гомеостаза. Когда концентрация Ca2+ в крови понижается, немедленно промотируется секреция РТН из околощитовидной железы, который в кости действует на остеобласт (активация остеокласта с помощью остеобласта, продуцирование костного органического матрикса, разложение фермента и тому подобное) для промотирования остеокластной ресорбции костей, при этом Ca2+ переносится из костей в кровь. В почке РТН промотирует ресорбцию Ca2+ в периферических скрученных канальцах и активирует 25(OH) витамин D3 в проксимальных канальцах, промотируя таким образом продуцирование активного витамина D3 [1α, 25(OH)2D3], функцией которого является промотирование ресорбции Ca2+ из кишечника. Он также подавляет ресорбцию фосфора. Как отмечалось выше, РТН непосредственно и косвенно повышает концентрацию Ca2+ в крови.
Когда концентрация Ca2+ в крови увеличивается, кальциевый рецептор ощущает это, немедленно подавляя секрецию РТН из околощитовидной железы, чтобы снизить количество Ca2+, поставляемого в кровь [Brown, E.М., Homeostatic mechanisms regulating extracellular и intracellular calcium metabolism in the parathyroids, p.19, (1994), Raven press, New York]. Секреция PTH также подавляется активным витамином D [1α, 25(OH)2D3].
Поскольку РТН представляет собой гормон, принимающий на себя важную роль в контролировании метаболизма Ca2+ и костного метаболизма, предпринимались попытки использовать РТН при лечении остеопороза. В 1982 г. Tam и др. установили, что продолжительное введение бычьего PTH (1-84) крысам с удаленной щитовидной/околощитовидной железой, приводит к промотированию как остеогенеза, так и костной ресорбции бедренной губчатой кости, приводя к снижению чистой костной массы, тогда как его подкожное периодическое введение не приводит к промотированию резорбции костей, а к промотированию только остеогенеза, вызывая увеличение костной массы [Endocrinology, 110, 506-512 (1982)]. В дальнейшем, Uzawa и др., сравнили действие продолжительного введения и периодического введения РТН в отношении эпифизарной длинной кости и метафизарной губчатой кости у молодых крыс. В результате было выяснено, что продолжительное введение РТН приводит к значительному увеличению костной массы метафизарной губчатой кости, высоко подверженной действию эндохондрального окостенения, тем не менее связанному с аномальными открытиями, такими как гиперплазия эпифизарного плоского хряща, фиброзный остит и тому подобное, и к заметному промотированию костной ресорбции и снижению костной массы, сопровождающемуся разжижением трубчатой кости, в эпифизарной губчатой кости, где эффект был небольшим [Bone, 16, 477-484 (1995)]. Кроме того, сообщалось, что периодическое введение РТН приводит к заметному увеличению костной массы и костной перекладины как в эпифизарной, так и в метафизарной губчатых костях без увеличения остеокласта или уменьшения трубчатой кости.
Более того, Scutt и др., сообщали, что для остеобластов, полученных из свода черепа цыпленка, короткое время обработки (10-20 мин) с использованием РТН промотирует рост клеток по сравнению с продолжительной обработкой (18 часов) [Calcif. Tissue Int., 55, 208-215 (1994)]. Это позволяет предположить, что некоторые из воздействий РТН на остеобласты являются временными и что проявление действия при обработке в течение чрезвычайно короткого промежутка времени может быть связано с тем фактом, что продолжительное введение и периодическое введение РТН in vivo оказывают различное действие на костные ткани.
Ishizuya и др. дополнительно прояснили при исследовании действия РТН на дифференциацию остеобластов с использованием экспериментальных систем in vitro, что действие РТН меняется в зависимости от времени обработки. Они сообщали, что продолжительное действие РТН на остеобласты, полученные из свода черепа крысы, приводит к сильному ингибированию дифференциации остеобластов и почти полному ингибированию остеогенеза in vitro, тогда как повторное воздействие РТН в течение первых 6 часов 48-часового цикла приводит к значительному промотированию дифференциации остеобластов и промотированию остеогенеза in vitro.
Предполагается, что РТН не только предотвращает снижение костной массы на модели остеопороза, но также оказывает восстанавливающее действие на костную массу даже на животных, уже страдающих от заметного снижения костной массы. Wronski и др. периодически вводили PTH (1-34) человека крысе SD в возрасте 90 дней, которой 4 недели назад была проведена овариэктомия и у которой наблюдалось заметное уменьшение губчатых костей, в течение 15 недель, начиная от 4 недель после овариэктомии. В результате промотирование остеогенеза и ингибирование ресорбции костей наблюдались в течение периода от 5 недели до 10 недели после начала введения, что проявлялось в увеличении костной массы примерно в два раза по сравнению с костной массой крыс из фиктивной оперированной группы [Endocrinology, 132, 823-831 (1993)]. Авторы также сообщали, что в данном эксперименте эстроген и бисфосфонат предотвращали уменьшение костной массы, вызванное овариэктомией, но в отличие от РТН они не приводили к повышению костной массы. Авторы подробно проанализировали трубчатую кость в данной экспериментальной системе и выявили образцы, показывающие промотированный остеогенез и увеличение костной массы на надкостничной и эндостальной стороне при периодическом введении PTH (1-34) человека, на основании чего они выяснили, что увеличение спонгиозной кости благодаря РТН не сопровождается уменьшением трубчатой кости [Bone, 15, 51-58 (1994)].
Кроме того, Mosekilde et al. сообщали, что периодическое введение РТН (1-34) человека или РТН (1-84) человека вызывает не только увеличение костной массы, но и доза-зависимое увеличение прочности на сжатие и прочности на изгиб, которые являются показателями для костного вещества, спонгиозной кости [Endocrinology, 129, 421-428 (1991)] и трубчатой кости [J. Bone Miner. Res., 8, 1097-1101 (1993)] костей позвоночника крысы. Как обсуждалось выше, поскольку РТН оказывает очевидное повышающее массу костей действие на экспериментальных животных, проводятся различные исследования, касающиеся ограничительных условий, ожидаемых в реальных клинических применениях.
Mizoguchi исследовал, наблюдается или не наблюдается в действительности фармакологическое действие при периодическом введении РТН, даже когда РТН содержится в крови, что рассматривается как один из факторов, ответственных за остеопороз, и сделал вывод, что костная масса увеличивалась обычным образом [Journal of Japanese Society of Bone Morphometry, vol. 5, pp. 33 - 39 (1995)]. Takao и др. исследовали частоту введения РТН и сообщили, что введение один раз в неделю на протяжении 12 недель здоровой крысе почти не промотирует ресорбцию костей, но увеличивает костную массу доза-зависимым образом [Japanese Journal of Bone Metabolism, vol. 12 (Suppl.), p. S343 (1994)], выдвигая предположение о возможной клинической эффективности низкой частоты введения. Вышеуказанные достижения позволили предположить возможность использования РТН для создания сильного и перспективного терапевтического лекарственного средства для лечения постменопаузного остеопороза или постовариэктомического остеопороза, которое увеличивает костную массу и снижает процент перелома костей.
Данные результаты четко показывают, что периодическое введение РТН могло бы дать возможность лечения остеопороза. С другой стороны, для РТН проблемой является необходимость инъекции в качестве пути введения, что болезненно для многих пациентов. Однако можно ожидать в значительной мере, что перорально вводимый фармацевтический агент, который мог бы периодически увеличивать концентрацию РТН в крови и который основан на новом механизме действия в отличие от вышеуказанного РТН и общепринятого кальцитонина, станет терапевтическим лекарственным средством для лечения остеопороза.
Кальциевый рецептор представляет собой связанный с G-белком рецептор, который клонирован в качестве молекулы, необходимой для контролирования секреции РТН, и который проникает через клеточную мембрану 7 раз. Кальциевый рецептор человека состоит из 1078 аминокислот и имеет 93%-ную аминокислотную гомологию с бычьим кальциевым рецептором. Кальциевый рецептор человека состоит из большой N-концевой внеклеточной области, состоящей из 612 аминокислот, области проникновения через клеточную мембрану, состоящей из 250 аминокислот, и С-концевой внутриклеточной области, состоящей из 216 аминокислот.
Установлено, что экспрессия кальциевого рецептора происходит в околощитовидной железе, почках, щитовидных С-клетках, мозге и тому подобном, а также в костях (клетки костного мозга).
Когда кальциевый рецептор связан с лигандом, таким как Ca2+ и тому подобное, он активирует фосфолипазу С в сочетании с G-белком, вызывает продуцирование инозитолтрифосфата и повышение внутриклеточной концентрации Ca2+ и в результате подавляет секрецию РТН [Nature, 366, 575-580 (1993)].
Как отмечено выше, фармацевтический агент, который ингибирует активацию кальциевого рецептора, или фармацевтический агент, который является антагонистом кальциевого рецептора, прекращает подавление секреции РТН в клетках околощитовидной железы и промотирует секрецию РТН. Предполагается, что если антагонистическое действие может повышать концентрацию РТН в крови периодически и дискретно, то его антагонист, как ожидается, будет демонстрировать то же действие, которое обеспечивается при периодическом введении РТН, и тем самым может быть обеспечен фармацевтический агент, чрезвычайно эффективный для лечения остеопороза.
Напротив, цитохром (цитохром Р450, далее Р450) представляет собой белок, имеющий молекулярную массу примерно 50000, который содержит протогем. И его физические функции могут изменяться в широком диапазоне. Например, он обладает функцией фермента, катализирующего различные реакции метаболизма лекарственных средств. CYP2D6, принадлежащий к семейству P450 (CYP), является важным ферментом человека для метаболизма лекарственных средств и вовлечен в метаболизм множества соединений. Когда вводится лекарственное средство, ингибирующее метаболическую функцию CYP2D6, лекарственное средство накапливается в теле и может оказывать сильное влияние. Соответственно, в качестве лекарственного средства желательно соединение, обладающее слабым ингибирующим действием в отношении метаболической функции CYP2D6.
Ранее сообщалось о различных соединениях, полезных в качестве антагонистов CaSR.
Конкретно, например, отмечено соединение, представленное следующей формулой:
где A представляет собой арил и т.д., D представляет собой C или N, каждый из X1 и X5 представляет собой водород, циано и т.д. и каждый из X2, X3 и X4 представляет собой водород, галоген, C1-4 алкил и т.д. (WO 02/38106).
Дополнительно отмечено соединение, представленное следующей формулой:
где A представляет собой арил и т.д., D представляет собой C или N, каждый из X1 и X5 представляет собой водород, циано и т.д., X2 представляет собой водород и т.д. и каждый из X3 и X4 представляет собой водород, C1-4 алкил и т.д. (WO 02/34204).
Кроме того, отмечено соединение, представленное следующей формулой:
где A представляет собой C или N, D представляет собой C или N, X представляет собой циано, нитро и т.д., Y представляет собой хлор, фтор и т.д. и Ar представляет собой фенил, нафтил и т.д. (WO 02/07673).
В дополнение описано соединение, представленное следующей формулой:
где X представляет собой циано, нитро и т.д., Y представляет собой хлор, фтор и т.д. и Ar представляет собой фенил, нафтил и т.д. (JP 2002-536330-T, WO 00/45816, EP 1148876-A, US 6417215),
и соединение, представленное следующей формулой:
где каждый из X1, X2, X3, X4 и X5 представляет собой H, галоген и тому подобное, Y1 представляет собой ковалентную связь или незамещенный или замещенный алкилен и т.д., Y2 представляет собой незамещенный или замещенный метилен, Y3 представляет собой ковалентную связь, О и т.д., каждый из R3 и R4 независимо представляет собой метил, этил и т.д., R5 представляет собой арил, конденсированный арил и т.д., R7 представляет собой H, OH и т.д., R8 представляет собой H, C1-4 алкил и т.д., A и B независимо представляют собой связь, CH2 и т.д., G представляет собой ковалентную связь, CHR6 (R6 представляет собой H и т.д.) и т.д. (JP 2002-510671-T, WO 99/51569, EP 1070048-A, US 6395919).
В качестве антагониста CaSR описано соединение, представленное следующей формулой:
где X имеет следующую формулу:
где каждый из X1, X2, X3 и X4 независимо представляет собой CN, NO2 и т.д., затем W представляет собой R1, SO2R1 и т.д., R2 представляет собой H, C1-4 алкил и т.д., и тому подобное, Y1 представляет собой ковалентную связь, или незамещенный или замещенный алкилен и т.д., Y2 представляет собой незамещенный или замещенный метилен, Y3 представляет собой ковалентную связь, O и т.д., R3 и R4 независимо представляют собой метил, этил и т.д., R5 представляет собой гетероарил, конденсированный гетероарил и т.д., R7 представляет собой H, OH и т.д., R8 представляет собой H, C1-4 алкил и т.д., A и B, каждый независимо, представляет собой связь, CH2 и т.д., и G представляет собой ковалентную связь, CHR6 (R6 представляет собой H и т.д.) и т.д. (JP 2002-510636-T, WO 99/51241, EP 1069901-A, US 2002052509-A).
В качестве антагониста CaSR описаны следующие соединения: соединение, представленное следующей формулой:
где Y1 представляет собой ковалентную связь, алкилен и т.д., Y2 представляет собой незамещенный или замещенный метилен, C1-4 алкил и т.д., Z представляет собой ковалентную связь, O и т.д., R3 и R4 каждый из независимо представляет собой метил, этил и т.д., R5 представляет собой фенил, нафтил и т.д., G представляет собой ковалентную связь или C-R6 где R6 представляет собой H, OH и т.д., R7 представляет собой H, OH и т.д., R8 представляет собой H, C1-4 алкил и т.д., фрагмент A-B представляет собой CH2CH2, ковалентную связь и т.д. и X имеет следующую формулу:
где W представляет собой R1, SO2R1, где R1 представляет собой водород, C1-4 алкил и т.д., и тому подобное, каждый из X1, X2, X3 и X4 независимо представляет собой CN, NO2 и т.д., R2 представляет собой водород, C1-4 алкил и т.д., и тому подобное (JP 2001-523223-T, WO 98/45255, EP 973730-A, US 6294531),
соединение, представленное следующей формулой:
где R1 представляет собой арил и т.д., R2 представляет собой гидроксильную группу и т.д., каждый из R3 и R4 представляет собой низший алкил и т.д., R5 представляет собой замещенный нафтил, замещенный фенил и т.д., Y1 представляет собой алкилен и т.д., Y2 представляет собой алкилен, Y3 представляет собой алкилен и Z представляет собой кислород и т.д. (JP 2001-501584-T, WO 97/37967, EP 901459-A, US 6022894),
соединение, представленное следующей формулой:
где X представляет собой нитро и т.д., Y представляет собой водород и т.д., Q представляет собой C1-4 алкил и т.д., Ar представляет собой фенил, нафтил и т.д., m равно 0-2 и n равно 1-3 (JP 2002-522499-T, WO 00/09132, EP 1112073-A),
и соединение, представленное следующей формулой:
где X представляет собой циано и т.д., Y представляет собой хлор и т.д., Q представляет собой водород и т.д., W представляет собой кислород и т.д., D представляет собой водород и т.д. и n равно 2-4 (JP 2002-522532-T, WO 00/09491, EP 1104411-A).
Maxine Gowen et al. вводили соединение, обладающее CaSR антагонистическим действием, названное NPS-2143,
перорально крысам OVX и измеряли его концентрацию в крови и плотность костей, исследуя таким образом влияние NPS-2143 на остеогенез, и сообщили о полученных результатах (The Journal of Clinical Investigation, vol. 105, pp. 1595-1604 (2000)).
В соответствии с этим сообщением NPS-2143 существенно промотирует высвобождение PTH, но он не продемонстрировал какого-либо прямого действия на остеобласты и остеокласты in vitro и уменьшение костной массы или увеличение костной массы от него не зависело. Одной из причин, на которую указывали в этой связи, является слишком длинный период полувыведения NPS-2143 в крови. То есть, когда крысиный PTH (1-34) вводили крысе OVX в дозе 5 мкг/кг, концентрация PTH в крови достигала максимума в 175 пг/мл в течение 30 минут и возвращалась к первоначальному уровню в течение 2 часов, но когда NPS-2143 вводили в дозе 100 мкмоль/кг, концентрация PTH в крови достигала примерно 115 пг/мл в течение 30 минут и продолжала повышаться, демонстрируя уровень в 140 пг/мл даже через 4 часа (The Journal of Clinical Investigation, vol. 105, p.1595-1604 (2000), особенно стр. 1598, фиг. 3).
В то же время концентрация в крови самого NPS-2143 поддерживалась на уровне не менее 100 нг/мл даже через 8 часов после введения. Прошло 24 часа, пока концентрация достигла уровня в 10 нг/мл или стала ниже обнаруживаемого уровня.
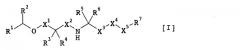
Указанная выше ссылка на Maxine Gowen et al. показывает, что антагонист кальциевого рецептора, имеющий слишком длинный период полувыведения в крови, приводит к тем же результатам, как при непрерывном введении PTH, где нельзя ожидать увеличения костной массы. Таким образом, большинство из обычных антагонистов кальциевого рецептора постоянно повышает концентрацию РТН в крови и не способно обеспечить достаточное остеогенез-промотирующее действие. Среди традиционных антагонистов кальциевого рецептора описано соединение, представленное следующей формулой [I]:
где R1 представляет собой необязательно замещенную арильную группу и т.д., R2 представляет собой C1-6 алкильную группу, C3-7 циклоалкильную группу и т.д., R3 представляет собой гидроксильную группу и т.д., R4 представляет собой атом водород и т.д., R5 и R6 представляют собой C1-6 алкильную группу и т.д., R7 представляет собой необязательно замещенную арильную группу и т.д., X1 представляет собой простую связь, C1-6 алкилен и т.д., X2 представляет собой необязательно замещенный C1-6 алкилен, X3 представляет собой простую связь или необязательно замещенный C1-6 алкилен и X4 и X5 связаны, образуя простую связь, метилен и т.д., которое обладает превосходным антагонистическим действием в отношении кальциевого рецептора, которое можно вводить перорально и периодически и которое может повышать концентрацию РТН в крови периодически и дискретно (WO 02/14259). При сравнении активности соединения, раскрытого в данной публикации, и соединения по настоящему изобретению неожиданно было установлено, что соединение по настоящему изобретению обладает более высокой активностью и меньшим ингибирующим действием в отношении метаболического фермента CYP2D6.
Однако имеется не так много сообщений о таких эффективных соединениях и желательно проводить дальнейшие исследования в данной области.
Сущность изобретения
Задача настоящего изобретения заключается в разработке соединения, обладающего превосходным антагонистическим действием в отношении кальциевого рецептора, которое можно было бы вводить перорально и периодически и которое могло бы повышать концентрацию РТН в крови периодически и дискретно. Также задача настоящего изобретения заключается в разработке фармацевтической композиции для перорального введения, которая содержит данное соединение и является эффективной в качестве терапевтического лекарственного средства при заболеваниях, сопровождающихся аномальным кальциевым гомеостазом, таких как остеопороз, гипопаратиреоидизм, остеосаркома, периодонтит, хрупкость костей, остеоартрит, хронический ревматоидный артрит, болезнь Педжета, синдром гуморальной гиперкальцемии, аутосомная доминантная гиперкальцемия и тому подобное, в частности в качестве лекарственного средства для лечения остеопороза.
Недавно сообщалось, что увеличение концентрации кальция в крови вызывает повышение допамина в мозге и затем улучшает состояние при болезни Паркинсона и слабоумии. Также ожидается, что соединение по настоящему изобретению может представлять собой лекарственное средство при болезни Паркинсона и слабоумии, поскольку оно увеличивает концентрацию РТН в крови и, следовательно, повышает концентрацию кальция в крови.
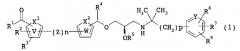
Для решения вышеуказанных проблем авторы настоящего изобретения провели интенсивные исследования, в результате которых установили, что соединение, представленное следующей формулой (1), обладает превосходным действием в качестве антагониста кальциевого рецептора, и его можно вводить перорально и периодически, что привело к созданию настоящего изобретения. Неожиданно оказалось, что соединение, представленное следующей формулой (1), повышает концентрацию РТН в крови периодически и дискретно, и в большой степени можно ожидать, что оно найдет практическое применение в качестве превосходного терапевтического лекарственного средства для лечения остеопороза.
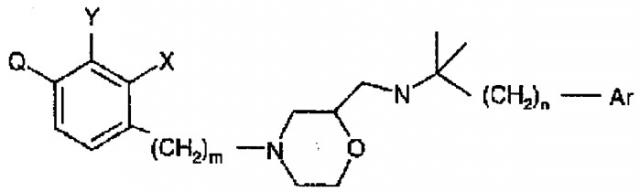
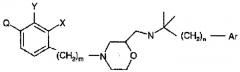
Соединение, представленное следующей формулой (1), по настоящему изобретению отличается тем, что атом углерода, смежный с атомом кислорода, имеет структуру
где каждый символ является таким, как определено ниже. Как это ясно из последующих экспериментальных примеров, имеющее такую структуру соединение по настоящему изобретению является превосходным по своему антагонистическому действию в отношении кальциевого антагониста, и также обладает дискретным и временным продуцирующим РТН действием. Соответственно, при введении соединения по настоящему изобретению может обеспечиваться воздействие, аналогичное воздействию при периодическом введении РТН, которое рассматривается как чрезвычайно эффективное для лечения остеопороза. В дополнение, как показано ниже в экспериментальных примерах, соединение по настоящему изобретению обладает слабым ингибирующим действием на метаболическую функцию P450, особенно CYP2D6, что является желательным для фармацевтического продукта. Показано, что действие соединения по настоящему изобретению, вызывающее секрецию РТН, оказывается даже при более низкой дозе, чем для известного ранее соединения. Соединение по настоящему изобретению усовершенствовано в отношении таких свойств, как поглощение и растворимость. Также очевидно, что соединение по настоящему изобретению обладает слабым побочным действием.
Настоящее изобретение относится к соединению, представленному следующей формулой (1), антагонисту кальциевого рецептора и лекарственному средству для лечения остеопороза, включающему данное соединение в качестве активного ингредиента. Более конкретно, настоящее изобретение относится к следующим пунктам [1] - [44].
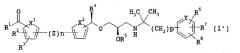
[1] Соединение, представленное следующей формулой (1), его фармацевтически приемлемая соль или оптически активная форма (далее иногда совокупно называемые сокращенно как соединение (1)):
где n равно 0 или 1,
p представляет собой целое число от 1 до 3,
R1 представляет собой гидроксильную группу, C1-6 алкоксильную группу или RA,
где RA представляет собой RC-OC(=O)O-C1-4алкилен-O- или OH-NH-,
где RC представляет собой C1-6 алкильную группу или C3-6 циклоалкильную группу,
R2 и R3 являются одинаковыми или разными, и каждый представляет собой атом водорода, гидроксильную группу, атом галогена, аминогруппу, C1-7 ациламиногруппу, галоген-C1-6 алкильную группу, карбоксильную группу, C1-6 алкоксикарбонильную группу, C1-6 алкоксильную группу, галоген-C1-6 алкоксильную группу, C1-6 алкильную группу, гидрокси-C1-6 алкильную группу, C1-7 ациламино-C1-6 алкильную группу, C2-6 алкенильную группу, аралкильную группу, фенильную группу, C1-6 алкиламиногруппу, ди(C1-6 алкил)аминогруппу, C1-6 алкокси-C1-6 алкильную группу, меркаптогруппу, цианогруппу, нитрогруппу, морфолиногруппу, пиперидиногруппу или пирролидиногруппу, или R2 и R3 объединены с образованием этиленоксигруппы,
X1 представляет собой -C=C-, -C=N-, атом кислорода или атом серы,
Z представляет собой -S-, -SO-, -SO2-, -(CH2)m1-O-, -O-(CH2)m1-, -(CH2)m2-NH-, -NH-(CH2)m2-, -(CH2)m3-N(CH3)-, -N(CH3)-(CH2)m3-, C1-4 алкиленовую группу, -SO2-N(CH3)-, -N(CH3)-SO2-, -NHCO-, -CONH- или C2-4 алкениленовую группу,
где каждый из m1, m2 и m3 представляет собой целое число от 0 до 2,
X2 представляет собой -C=C-, атом кислорода или атом серы,
R4 представляет собой C1-6 алкильную группу или C3-6 циклоалкильную группу,
R5 представляет собой атом водорода или RB,
где RB представляет собой C1-7 ацильную группу, необязательно замещенную карбоксильной группой,
Y представляет собой атом углерода или атом азота и
R6, R7 и R8 являются одинаковыми или разными, и каждый из них представляет собой атом водорода, атом галогена, C1-6 алкильную группу, C1-6 алкоксильную группу, галоген-C1-6 алкильную группу, галоген-C1-6 алкоксильную группу, карбоксильную группу, гидроксильную группу, цианогруппу, нитрогруппу, фенильную группу, C3-6 циклоалкильную группу, ди(C1-6 алкил)аминокарбонильную группу или гидрокси-C1-6 алкильную группу, или смежные R6 и R7 объединены с образованием -CH=CH-CH=CH-, -C(OH)=CH-CH=CH-, -CH=C(OH)-CH=CH-, -O-(CH2)k1-O-, -O-(CH2)k2- или -(CH2)k3-,
где k1 представляет собой целое число от 1 до 4, k2 представляет собой целое число от 2 до 5, k3 представляет собой целое число от 3 до 6,
при условии, что когда оба R2 и R3 представляют собой атомы водорода и n равно 1, то Z должен представлять собой группу, отличающуюся от -SO2-N(CH3)-, где атом серы связан с кольцом V и атом азота связан с кольцом W.
[2] Соединение по вышеуказанному пункту [1], имеющее строение, представленное следующей формулой (1'):
где каждый символ является таким, как определено выше в пункте [1], или его фармацевтически приемлемая соль.
[3] Соединение по вышеуказанным пунктам [1] или [2], где n равно 1, или его фармацевтически приемлемая соль или оптически активная форма.
[4] Соединение по вышеуказанному пункту [3], где
n равно 1,
p равно 1,
R1 представляет собой гидроксильную группу или C1-6 алкоксильную группу,
R2 и R3 являются одинаковыми или разными, и каждый представляет собой атом водорода, гидроксильную группу, атом галогена, аминогруппу, C1-7 ациламиногруппу, трифторметильную группу, C1-6 алкоксикарбонильную группу, C1-6 алкоксильную группу, C1-6 алкильную группу, гидрокси-С1-6 алкильную группу, C2-6 алкенильную группу, фенильную группу, бензильную группу, ди(C1-6алкил)аминогруппу или нитрогруппу
или R2 и R3 объединены с образованием этиленоксигруппы,
X1 представляет собой -C=C- или -C=N-,
X2 представляет собой -C=C-,
Z представляет собой -S-, -SO-, -SO2-, -(CH2)m1-O-, -O-(CH2)m1-, -(CH2)m2-NH-, -NH-(CH2)m2-, -(CH2)m3-N(CH3)-, -N(CH3)-(CH2)m3-, C1-4 алкиленовую группу или C2-4 алкениленовую группу,
где каждый из m1, m2 и m3 представляет собой целое число от 0 до 2,
R4 представляет собой C1-6 алкильную группу или C3-6 циклоалкильную группу,
R5 представляет собой атом водорода,
Y представляет собой атом углерода или атом азота и
R6, R7 и R8 являются одинаковыми или разными, и каждый из них представляет собой атом водорода, атом галогена, C1-6 алкильную группу или C1-6 алкоксильную группу, или смежные R6 и R7 объединены с образованием -CH=CH-CH=CH-,
его фармацевтически приемлемая соль или оптически активная форма.
[5] Соединение по вышеуказанному пункту [4], где
n равно 1,
p равно 1,
R1 представляет собой гидроксильную группу или C1-6 алкоксильную группу,
R2 и R3 являются одинаковыми или разными, и каждый из них представляет собой атом водорода, атом галогена, C1-6 алкоксильную группу или C1-6 алкильную группу,
X1 представляет собой -C=C-,
Z представляет собой -S-, -SO-, -SO2-, -(CH2)m1-O-, -O-(CH2)m1-, -CH2-NH-, -NH-CH2-, -N(CH3)-, метилен или винилен,
где m1 равно 0 или 1,
X2 представляет собой -C=C-,
R4 представляет собой метильную группу или циклопропильную группу,
R5 представляет собой атом водорода,
Y представляет собой атом углерода или атом азота и
R6, R7 и R8 являются одинаковыми или разными, и каждый из них представляет собой атом водорода, атом галогена или C1-6 алкильную группу, или смежные R6 и R7 объединены с образованием -CH=CH-CH=CH-,
его фармацевтически приемлемая соль или оптически активная форма.
[6] Соединение по вышеуказанному пункту [3], которое выбирают из группы, состоящей из
4-[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]бензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]-3-метоксибензойной кислоты,
метил-4-[2-[1-[(2R)-3-[[1-(нафталин-2-ил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]бензоата,
4-[2-[1-[(2R)-3-[[1-(нафталин-2-ил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]бензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(хинолин-3-ил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]бензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(4-хлор-2-фторфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]бензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]бензойной кислоты,
3-[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]бензойной кислоты,
4-[2-[2-[1-[(2R)-3-[[1-(нафталин-2-ил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенил]винил]бензойной кислоты,
3-[2-[1-[(2R)-3-[[1-(нафталин-2-ил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенилтио]бензойной кислоты,
4-[2-[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенил]винил]бензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]-3,5-диметилбензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(4-хлор-2-фторфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]-3,5-диметилбензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(нафталин-2-ил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]бензил]бензойной кислоты,
3-[2-[1-[(2R)-3-[[1-(нафталин-2-ил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]бензил]бензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(нафталин-2-ил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенилтио]бензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(нафталин-2-ил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенилсульфинил]бензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(нафталин-2-ил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенилсульфонил]бензойной кислоты,
4-[[2-[1-[(2R)-3-[[1-(нафталин-2-ил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фениламино]метил]бензойной кислоты,
2-[[2-[1-[(2R)-3-[[1-(нафталин-2-ил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]метил]бензойной кислоты,
3-[[2-[1-[(2R)-3-[[1-(нафталин-2-ил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]метил]бензойной кислоты,
4-[[2-[1-[(2R)-3-[[1-(нафталин-2-ил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]метил]бензойной кислоты,
3-[[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]метил]бензойной кислоты,
4-[[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]метил]бензойной кислоты,
3-фтор-4-[[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]метил]бензойной кислоты,
4-[[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]метил]-3-метилбензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]-3,5-диметоксибензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]-3-нитробензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]-2-нитробензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]-3-хлорбензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(3-фтор-4-метилфенил)-2-метилпропан-2-ил]амино]-2-гидроксипропокси]этил]фенокси]-2-хлорбензойной кислоты,
4-[2-[1-[(2R)-3-[[1-(3-фтор-4-метил