Фотохромные оксазиновые соединения и способы их производства
Иллюстрации
Показать всеИзобретение относится к новым оксазиновым соединениям формулы I:
где Х означает углерод;
R1 и R2 означают водород;
n означает 0; и
А и А' независимо друг от друга означают:
(a) линейный или разветвленный (С1-С12)алкил, (С3-С12)циклоалкил;
(b) незамещенные или монозамещенные арильные группы.
Изобретение также относится к способу получения фотохромных оксазиновых соединений формулы (I).
Технический результат - получение новых соединений, а также способ их получения, применимых в качестве фотохромных соединений.
3 н. и 7 з.п. ф-лы, 1 табл.
Реферат
Область изобретения
Данное изобретение относится к оксазиновым соединениям. В частности, изобретение предоставляет оксазиновые соединения и способы их производства, эти соединения применимы в качестве фотохромных соединений.
Предпосылки создания изобретения
Синтезированы и предложены для применения различные классы соединений, в которых обратимое изменение цвета или потемнение вызывается солнечным светом. Например, известно, что отличной выносливостью обладают спирооксазиновые и хроменовые соединения. Дополнительно известны фотохромные 2,2-дизамещенные [2H-1,4]нафтооксазиновые соединения, такие как предложены в патенте Соединенных Штатов № 5801243. Указанные соединения имеют лучшую выносливость, чем хроменовые соединения, но имеют недостатки в том, что способы их получения чрезвычайно ограничены. Таким образом, существует потребность в дополнительных фотохромных оксазиновых соединениях, которые преодолевают недостатки известных соединений.
Описание изобретения и его предпочтительных выполнений
Данное изобретение предоставляет оксазиновые соединения, содержащие ароматические, гетероароматические или алифатические заместители в положении 2 оксазиновой части. Дополнительно предложен способ получения соединений с отличными выходами в одном реакторе.
В одном воплощении изобретение предоставляет соединение, соответствующее формуле:
где Х означает азот или углерод;
R1 и R2 независимо друг от друга означают водород, гидроксигруппу, нитрогруппу, цианогруппу, аллил, линейный или разветвленный (С1-С20)алкил, (С3-С20)циклоалкил, (С1-С20)алкоксигруппу, (С1-С20)алкилацетиленил, фенилацетиленил, (С1-С20)алкенил, фенилвинил, галоген, галогено(С1-С20)алкил, галогено(С3-С20)циклоалкил, галогено(С1-С20)алкоксигруппу, замещенную по меньшей мере одним атомом галогена, где галоген означает фтор, хлор, бром или йод, незамещенный арил, арил, замещенный (С1-С6)алкилом или (С1-С6)алкоксигруппой или арилоксигруппа, и предпочтительно фенил или нафтил, незамещенный гетероарил или гетероарил, замещенный (С1-С6)алкилом или (С1-С6)алкоксигруппой, и предпочтительно фурил, тиенил, пиррил, индолил или пиридил, арилалкил или незамещенный гетероарилалкил или гетероарилалкил, замещенный (С1-С6)алкилом или (С1-С6)алкоксигруппой, замещенное или незамещенное гетероциклическое кольцо, -N(R1)R2 или CON(R1)R2, где R1 и R2 независимо друг от друга означают водород, (С1-С20)алкил, (С3-С20)циклоалкил, незамещенный фенил или фенил, замещенный (С1-С6)алкилом или (С1-С6)алкоксигруппой, или -OCOR, или -COOR, или -COR, где R означает водород, (С1-С20)алкил, (С3-С20)циклоалкил или замещенный или незамещенный арил или гетероарил;
n означает целое число от 0 до 4; и
А и А' независимо друг от друга означают:
(а) линейный или разветвленный (С1-С12)алкил, (С3-С12)циклоалкил, арил(С1-С6)алкил, гетероарил(С1-С6)алкил, (С1-С6)алкокси(С1-С6)алкил, (С1-С12)алкоксигруппу, галогено(С1-С12)алкил, (С1-С12)галогеноалкоксигруппу или (С1-С12)алкилтиогруппу, где каждый арил предпочтительно означает фенил или нафтил, а каждый гетероарил может означать фурил, тиенил, пиррил, индолил, бензофурил, бензотиенил, пиридил, дибензофурил, дибензотиенил или карбазолил;
(b) незамещенные или моно-, ди- или тризамещенные арильные группы, такие как фенил или нафтил;
(с) незамещенные или моно-, ди- или тризамещенные гетероароматические группы, такие как фурил, тиенил, пиррил, индолил, бензофурил, бензотиенил, пиридил, дибензофурил, дибензотиенил, карбазолил;
(d) группу одной из формул:
где В означает водород, (С1-С12)алкил, незамещенный или моно- или дизамещенный арил, такой как фенил и нафтил,
где каждый из указанных заместителей арильных или гетероароматических групп в (b), (c) и (d) означают нитрогруппу, аминогруппу, цианогруппу, гидроксигруппу, эпоксигруппу, винил, аллил, гидроксиэтоксигруппу, метоксиэтоксигруппу, гидроксиэтоксиэтоксигруппу, метоксиэтоксиэтоксигруппу, фтор, хлор, бром или йод, (С1-С12)алкил, (С1-С12)алкоксигруппу, (С1-С12)алкиларил, арил, арилоксигруппу, арил(С1-С12)алкил, арил(С1-С12)алкоксигруппу, (С1-С12)алкоксиарил, галогено(С1-С12)алкил, галогеноарил, цикло(С3-С12)алкил, цикло(С1-С12)алкоксигруппу, арилоксиарил, арилокси(С1-С12)алкил, арилокси(С1-С12)алкоксигруппу, акрилоксигруппу, метакрилоксигруппу или гетероциклический азотсодержащий заметитель, включая, но не ограничивая N-(C1-C12)алкилпиперазиногруппу, N-арилпиперазиногруппу, азиридиногруппу, индолиногруппу, пирролидиногруппу, пирролиногруппу, пиперидиногруппу, (С1-С4)алкилпиперидиногруппу, ди(С1-С4)алкилпиперидиногруппу, 4-пиперидинопиперидиногруппу, морфолиногруппу, 2,6-ди(С1-С4)алкилморфолиногруппу, тиоморфолиногруппу, тиазолидиногруппу, тетрагидрохинолиногруппу, пиррил или -N(R1)R2 или CON(R1)R2, где R1 и R2 независимо друг от друга означают водород, (С1-С12)алкил, (С3-С12)циклоалкил, фенил, моно- или дизамещенный фенил, -COR, -OCOR или -COOR, где R означает водород, (С1-С12)алкил, (С3-С12)циклоалкил, галогено(С1-С6)алкил, незамещенный, моно- или дизамещенный фенил или незамещенный, моно- или дизамещенный нафтил, незамещенный, моно- или дизамещенный фурил или тиенил;
(е) незамещенный или монозамещенный пиразолил, пиридил, имидазолил, пиразолинил, имидазолинил или акридинил, где заместителями независимо друг от друга являются (С1-С6)алкил, (С1-С6)алкоксигруппа, фтор, хлор, фенил; или
(f) группу, представленную одной из формул:
где С и D независимо друг от друга означают углерод, кислород, (С1-С12)алкилазот или (С1-С12)ацилазот, и R3 и R4 независимо друг от друга означают водород или (С1-С12)алкил.
В воплощениях, в которых выбран галоген, он предпочтительно является фтором, хлором или бромом.
В предпочтительном воплощении Х означает углерод или азот,
R1 и R2 независимо друг от друга означают водород, нитрогруппу, цианогруппу, аллил, фтор, хлор, бром, трифторметил, трихлорметил, пирролидиногруппу, пиперидиногруппу, морфолиногруппу, фенил, бензил, линейный или разветвленный (С1-С6)алкил,(С1-С6)алкоксигруппу или -OCOR, или -COOR, где R означает водород, (С1-С6)алкил или (С3-С6)циклоалкил;
n означает целое число от 0 до 2; и
А и А' независимо друг от друга означают:
(а) линейный или разветвленный (С1-С6)алкил, (С3-С6)циклоалкил, арил(С1-С4)алкил, гетероарил(С1-С4)алкил или (С1-С6)алкокси(С1-С6)алкил;
(b) незамещенный или моно- или дизамещенный арил, такой как фенил или нафтил, предпочтительно замещенный в одном или в обоих из мета- или параположений;
(с) незамещенные или монозамещенные гетероароматические группы, такие как фурил, тиенил, пиррил, индолил, бензофурил, бензотиенил, пиридил, дибензофурил, дибензотиенил или карбазолил;
где каждый из указанных заместителей арильных или гетероароматических групп в (b) и (c) независимо является нитрогруппой, аминогруппой, цианогруппой, гидроксигруппой, эпоксигруппой, гидроксиэтоксигруппой, метоксиэтоксигруппой, гидроксиэтоксиэтоксигруппой, метоксиэтоксиэтоксигруппой, фтором, хлором, бромом или йодом, винилом, аллилом, трифторметилом, фенилом, (С1-С6)алкилом, (С1-С6)алкоксигруппой, цикло(С3-С6)алкилом, цикло(С1-С6)алкоксигруппой, (С1-С6)алкиламиногруппой, ди(С1-С6)алкиламиногруппой, диариламиногруппой, фенилацетиленилом, фенилвинилом, гетероциклическим азотсодержащим заметителем, включая, но не ограничивая, N-(С1-С6)алкилпиперазиногруппу, N-арилпиперазиногруппу, азиридиногруппу, индолиногруппу, пирролидиногруппу, пирролиногруппу, пиперидиногруппу, (С1-С4)алкилпиперидиногруппу, ди(С1-С4)алкилпиперидиногруппу, 4-пиперидинопиперидиногруппу, морфолиногруппу, 2,6-ди(С1-С4)алкилморфолиногруппу, тиоморфолиногруппу, тиазолидиногруппу, тетрагидрохинолиногруппу, пиррил или -N(R1)R2 или CON(R1)R2, где R1 и R2 независимо друг от друга означают водород, (С1-С6)алкил, (С3-С6)циклоалкил, фенил или -COR, -OCOR или -COOR, где R означает водород, (С1-С6)алкил, (С3-С6)циклоалкил или фенил.
Более предпочтительно Х означает углерод или азот; R1 и R2 независимо друг от друга означают водород, нитрогруппу, цианогруппу, фтор, хлор, бром, пирролидиногруппу, пиперидиногруппу, морфолиногруппу, фенил, бензил, (С1-С4)алкил или(С1-С4)алкоксигруппу;
n означает целое число от 0 до 2; и
А и А' независимо друг от друга означают линейный или разветвленный (С1-С4)алкил, (С3-С6)циклоалкил, незамещенный или моно- или дизамещенный фенил, предпочтительно замещенный в одном или в обоих из мета- или параположений заместителями, выбранными из группы, состоящей из нитрогруппы, аминогруппы, ацила, цианогруппы, метоксигруппы, этоксигруппы, метоксиэтоксигруппы, фтора, хлора, винила, аллила, метоксикарбонила, этоксикарбонила, (С1-С4)алкила, ди(С1-С4)алкиламиногруппы, пиперазиногруппы, пиперидиногруппы, арилперидиногруппы, морфолиногруппы, пирролидиногруппы, азиридиногруппы, акрилоксигруппы, метакрилоксигруппы, фенилацетиленила и фенилвинила;
незамещенные или монозамещенные гетероароматические группы, такие как фурил, тиенил и пиррил, замещенные заместителем, выбранным из группы, состоящей из (С1-С4)алкила и фенила.
Наиболее предпочтительно изобретение предоствляет соединение, выбранное из группы, состоящей из:
2,2-дифенилфенантро(9,10)-2Н-[1,4]оксазина,
2-(параметоксифенил)-2-фенилфенантро(9,10)-2Н-[1,4]оксазина,
2-(парафторфенил)-2-(параметоксифенил)фенантро(9,10)-2Н-[1,4]оксазина,
2,2-бис(параметоксифенил)фенантро(9,10)-2Н-[1,4]оксазина,
2-(параметоксифенил)-2-(параморфолинофенил)фенантро(9,10)-2Н-[1,4]оксазина,
2-(параметоксифенил)-2-(парапиперидинофенил)фенантро(9,10)-2Н-[1,4]оксазина,
2-метил-2-фенилфенантро(9,10)-2Н-[1,4]оксазина,
2-циклопропил-2-фенилфенантро(9,10)-2Н-[1,4]оксазина,
2,2-дифенил-6,11-динитрофенантро(9,10)-2Н-[1,4]оксазина,
2-(параметоксифенил)-2-фенил-6,11-динитрофенантро(9,10)-2Н-[1,4]оксазина,
2,2-бис(параметоксифенил)-6,11-динитрофенантро(9,10)-2Н-[1,4]оксазина,
2,2-дифенилфенантролино(5,6)-2Н-[1,4]оксазина,
2-(параметоксифенил-2-фенилфенантролино(5,6)-2Н-[1,4]оксазина и
2,2-бис(параметоксифенил)фенантролино(5,6)-2Н-[1,4]оксазина.
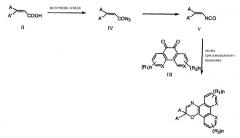
Методика гладкого синтеза для получения оксазинового соединения формулы I показана ниже в виде реакции А, где в качестве реагирующих агентов могут быть использованы дизамещенная акриловая кислота, хинон, источник азида, такой как азид натрия, азид лития, дифенилфосфорилазид ("DPPA") или триметилсилилазид ("TMSA"), органическое основание, включая не в порядке ограничения триэтиламин, диизопропиламин, диизопропилэтиламин, пиридин, пиперидин, морфолин, N-алкилморфолин, 1,8-диазабицикло[5,4,0]ундец-7-ен ("DBU"), и оксид тризамещенного мышьяка, такой как триметиларсеноксид. Дизамещенная акриловая кислота может быть подвергнута серии превращений для образования промежуточного азаилида, который может взаимодейстовать с хиноном, таким как фенантрен(9,10)-дион, фенантролин(5,6)-дион, с образованием желаемого фотохромного оксазина.
Реакция А
Ключевым промежуточным продуктом реакции является высокореакционноспособное производное изоцианата. Изоцианат может быть генерирован in situ из замещенного акрилазида, который, в свою очередь, может быть образован in situ из замещенной акриловой кислоты. Изоцианат превращают в азаилид в присутствии каталитического количества оксида тризамещенного мышьяка, включая не в порядке ограничения трифениларсеноксид. Арсенилид немедленно взаимодействует с производным хинона с образованием желаемого оксазинового соединения и регенерированного трифениларсеноксида. Генерирование изоцианата из акриловой кислоты может быть осуществлено перегруппировкой производного азида карбоновой кислоты, генерированного из кислоты с использованием различных комбинаций реагентов в различных условиях, известных в технике, включая не в порядке ограничения хлористый ацилазид натрия, хлорформиат-азид натрия, DPPA, TMSA, в присутствии органического основания, включая не в порядке ограничения триэтиламин, диизопропиламин, диизопропилэтиламин, пиридин, пиперидин, морфолин, N-алкилморфолин, DBU и подобные. Предпочтительными источниками азида являются DPPA и TMSA, метилхлорформиат-азид натрия и метилхлорформиат-азид лития.
Одним из преимуществ вышеописанного способа является то, что все промежуточные продукты могут быть генерированы in situ, без очистки. Реакция может быть проведена либо постадийно, либо, предпочтительно, в одном реакторе. В постадийной реакции, как показано на схеме реакции А, дизамещенную акриловую кислоту превращают в хлорангидрид дизамещенной акриловой кислоты обработкой хлористым ацилом, таким как тионилхлорид, ацетилхлорид или оксалилхлорид. Хлорангидрид акриловой кислоты затем обрабатывают азидом натрия или азидом лития для генерирования замещенного ацилазида или он может быть введен в реакцию с хлорформиатом, таким как метилхлорфомиат, в присутствии органического основания с образованием смешанного ангидрида, обработанного затем азидом натрия или азидом лития для генерирования замещенного ацилазида.
В качестве альтернативы азид замещенной акриловой кислоты может быть получен взаимодействием с DPPA или TMSA в присутствии органического основания. Органическим основанием может быть вторичный или третичный амин, включая не в порядке ограничения триэтиламин, диизопропиламин, диизопропилэтиламин, пиридин, пиперидин, морфолин, N-алкилморфолин, DBU и подобные. При нагревании происходит перегруппировка ацилазида с образованием производного изоцианата, соединения формулы III. Производное изоцианата может реагировать с хиноном, таким как фенантрен(9,10)-дион или фенантролин(5,6)-дион, в присутствии каталитического количества оксида тризамещенного мышьяка, такого как трифениларсеноксид, с образованием желаемого фотохромного оксазина.
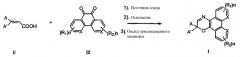
Оксазиновые соединения могут быть получены более эффективно, с высоким выходом в одном реакторе, показанном как реакция В.
Реакция В
В указанном способе реакция может быть проведена простым смешением замещенной акриловой кислоты, источника азида, предпочтительно DPPA или азида TMS, мягкого органического основания, такого как триэтиламин, диизопропиламин, диизопропилэтиламин, пиридин, пиперидин, морфолин, N-алкилморфолин, DBU, хинона, такого как фенантрен(9,10)-дион, фенантролин(5,6)-дион, и каталитического количества триариларсеноксида, такого как трифениларсеноксид, в подходящем органическом растворителе при нагревании в течение времени, достаточного для завершения реакции, обычно от примерно 1 до примерно 15 часов.
Используют эффективные в реакции количества компонентов смеси, имея в виду количество, достаточное для получения желаемого оксазинового соединения. Количество оксида тризамещенного мышьяка может составлять примерно от 1 мол. процента до 20 мол. процентов, предпочтительно примерно от 2 до 10 мол. процентов, более предпочтительно около 5 мол. процентов. Источник азида, такой как DPPA и азид TMS, предпочтительно используют (в количестве) примерно от 1 до 5 эквивалентов в расчете на дизамещенную акриловую кислоту. Количество использованного органического основания может быть от примерно 1 до примерно 100 эквивалентов, предпочтительно примерно от 1 до 10 эквивалентов, более предпочтительно от примерно 2 до примерно 6 эквивалентов. Хинон, такой как фенантрен(9,10)-дион, фенантролин(5,6)-дион, может быть использован (в количестве) примерно от 0,5 до 1,5 эквивалента, предпочтительно примерно от 0,6 до 0,8 эквивалента. Предпочтительное соотношение акриловая кислота:источник азида:основание:хинон:триариларсеноксид составляет примерно 1:1,2:5:0,7:0,05.
Применимыми органическими растворителями являются, но не в порядке ограничения, бензол, диоксан, тетрагидрофуран (ТГФ), толуол и ксилол и подобные и их смеси. Температуры реакции могут изменяться и обычно находятся в интервале от примерно 40°С до примерно 150°С. В предпочтительном воплощении растворителем является неполярный бензол или толуол и реакцию проводят в условиях от примерно 50 до примерно 110°С в течение от примерно 1 до примерно 15 часов. Более предпочтительно растворителем является толуол или бензол, и реакцию проводят при от примерно 60 до примерно 80°С (в течение) от примерно 2 до 4 часов.
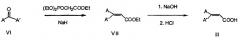
Замещенная акриловая кислота может быть получена одной из двух реакций, реакции С и D, показанные далее.
Реакция С
Реакция D
Реакция С, реакция Хорнера-Эммонса, как описано в Tetrahedron, 52(31), 10455-10472 (1996), может быть проведена, исходя из кетона V. Полученный этиловый эфир 3,3-дизамещенной акриловой кислоты формулы IV может быть гидролизован с образованием дизамещенной акриловой кислоты формулы II. А, A' имеют значения, как определено выше.
В реакции D кетон взаимодействует с ацетонитрилом в присутствии избыточного количества подходящего основания, включая не в порядке ограничения гидроксид натрия, с образованием 2,2-дизамещенного акрилонитрила формулы V. Процесс описан в J. Org. Chem., 44(25), 4640-4649 (1979). После гидролиза основанием в подходящем органическом растворителе с последующим подкислением может быть получена дизамещенная акриловая кислота формулы II.
Оксазиновые соединения изобретения могут быть использованы индивидуально или в комбинации с другими типами фотохромных соединений, включая не в порядке ограничения нафтопиран и спирооксазины, или их комбинации. Оксазины изобретения могут быть использованы в любых применениях, в которых обычно используют органические фотохромные вещества, включая не в порядке ограничения офтальмологические линзы, окна, остекление автомобилей, полимерные пленки и подобные. Оксазины могут быть использованы в органическом растворителе, которым может быть любой подходящий растворитель, включая не в порядке ограничения бензол, толуол, метилэтилкетон, ацетон, этанол, метанол, тетрагидрофуран, диоксан, этилацетат, этиленгликоль, ксилол, циклогексан, N-метилпирролидон и подобные, и их смеси.
В качестве альтернативы оксазины могут быть использованы в органической полимерной основе различными способами. Например, оксазин может быть растворен или диспергирован в материале основы и заполимеризован с другими компонентами материала основы. В качестве альтернативы оксазин может быть введен в покрытие, использованное на поверхности материала основы. В качестве еще другой альтернативы оксазин может быть впитан в или нанесен на поверхность материала основы.
Предпочтительными материалами основы являются оптически прозрачные пластмассы, включая не в порядке ограничения полимеры, сополимеры или смеси полимеров. Примерами материалов основы являются не в порядке ограничения поли(аллилкарбонат), полиэпоксиды, полиакрилаты, полиэтилен, полипропилен, поливинилхлорид, полиметакрилаты, поли(С1-С12)алкилметакрилаты, полиокси(алкилен)метакрилаты, ацетат целлюлозы, триацетат целлюлозы, бутират ацетата целлюлозы, ацетилцеллюлоза, поли(винилацетат), поли(виниловый спирт), полиуретаны, политиоуретан, полисилоксан, полиамид, полистирол и сополимеры, выбранные из группы, состоящей из акрилатов, метакрилатов, метилметакрилатов, этиленгликоль-бисметакрилата, винилацетата, винилбутираля, уретана, тиоуретана, диэтиленгликоль-бис(аллилкарбоната), диэтиленгликоль-диметилакрилата, диизопропилбензола и подобных.
Количество использованного оксазина является таким количеством, чтобы материал органической основы, на который ненесено или в который введено фотохромное соединение, получал в результате желаемую окраску. Обычно, в определенных границах, чем больше использовано оксазина, тем больше интенсивность окраски. Обычно применяют от примерно 0,001 до примерно 20 мас.% от полимерной основы.
Совместно с оксазинами изобретения для регулирования окраски могут быть использованы нефотохромные красители. Дополнительно для улучшения фотохромных свойств могут также быть использованы антиоксиданты, УФ-абсорбенты, противорадикальные агенты и подобные.
В растворе или в полимерной матрице оксазиновые соединения изобретения являются бесцветными или светложелтыми и быстро приобретают интенсивную окраску при УФ-облучении. Оксазины демонстрируют широкий диапазон цветов при активации источником ультрафиолетового излучения, от оранжевого, красновато-оранжевого, пурпурного до серо-голубого. Обеспечивается также широкий диапазон обесцвечивания в интервале от получаса до нескольких секунд в зависимости от структуры оксазинового соединения и использованных растворителя или матрицы.
Одним из частных преимуществ оксазиновых соединений данного изобретения является то, что спектр поглощения окрашенной формы активированного оксазина обычно имеет две или три полосы поглощения, покрывающих широкий интервал видимого спектра. Например, 2-(параметоксифенил)-2-(парапиперидинофенил)фенантро(9,10)-2Н-[1,4]оксазин после активирования в органическом растворе или в полимере дает серое окрашивание, которое быстро обесцвечивается. УФ-видимый спектр соединений имеет три полосы, покрывающие всю видимую область, что идеально для применения в солнцезащитных очках, линзах очков и контактных линзах.
Изобретение будет дополнительно прояснено рассмотрением следующих не ограничивающих примеров.
Примеры
Пример 1
Стадия 1.
В трехгорлую колбу объемом 100 мл загружали твердый КОН (3,30 г, 0,05 моля) и 25 мл ацетонитрила в атмосфере аргона и затем нагревали до кипения. К содержимому при перемешивании добавляли бензофенон (9,1 г, 0,05 моля) в 20 мл ацетонитрила. Через 8 часов кипячения с обратным холодильником горячий реакционный раствор выливали в 100 г колотого льда и экстрагировали дихлорметаном (3х15 мл). Объединенные органические экстракты промывали водой, сушили над безводным сульфатом натрия и фильтровали. Растворитель удаляли, остаток очищали флэш-хроматографией на силикагеле (элюент смесь простой эфир/гексан, 1:5) и получали 7,9 г бесцветного масла. Выход: 77%. (Спектр) 1Н ЯМР показывал, что продукт имел структуру, соответствующую 3,3-дифенилакрилонитрилу.
1Н ЯМР (CDCl3): δ 5,75 (c, 1H), 7,27-7,50 (м, 10Н).
Стадия 2.
Полученный на стадии 1 3,3-дифенилакрилонитрил (5,76 г, 2,81 ммоля) и гидроксид натрия (11,2 г, 280 ммолей) кипятили в смеси 180 мл этиленгликоля и 1 мл воды 3 дня. Реакционную смесь охлаждали и разбавляли 100 мл воды, подкисляли 5М соляной кислотой до рН менее 1, проводили вакуум-фильтрацию и в конце промывали водой. Твердую пасту растворяли в этилацетате и промывали разбавленной соляной кислотой. Органический слой отделяли и водный слой дважды экстрагировали этилацетатом. Объединенный этилацетатный раствор сушили над безводным сульфатом натрия и фильтровали. Растворитель удаляли в вакууме до общего объема приблизительно 40 мл. Раствор фильтровали через короткую колонку с силикагелем и промывали этилацетатом. После удаления растворителя в вакууме остаток растирали с небольшим объемом смеси гексан/этилацетат (4:1) и перекристаллизовывали из смеси этилацетат/гексан. Получали бесцветные кристаллы (5,34 г). Выход: 84,8%. (Спектр) 1Н ЯМР показывал, что продукт имел структуру, соответствующую 3,3-дифенилакриловой кислоте.
1Н ЯМР(CDCl3): δ 6,38(c, 1H), 7,24-7,35(м, 1Н), 7,40-7,46(м, 3Н).
Стадия 3.
Смесь дифенилакриловой кислоты (225 мг, 1 ммоль) со стадии 2, DPPA (95%, 348 мг, 1,2 ммоля), триэтиламина (506 мг, 5 ммолей), фенантрен-9,10-диона (146 мг, 0,7 ммоля) и трифениларсеноксида (16 мг, 0,05 ммоля) в безводном толуоле (12 мл) нагревали при 60°С на протяжении 3 часов. После хроматографирования (силикагель, элюент смесь дихлорметан/гексан, 2:1) и перекристаллизации из смеси дихлорметан/гексан получали 308 мг 2,2-дифенилфенантро(9,10)-2Н-[1,4]оксазина в виде бесцветных (слегка бледно-желтых) кристаллов. Выход: 100%.
1Н ЯМР (CDCl3): δ 7,24-7,29 (м, 6H), 7,46-7,70 (м, 8H), 8,12 (с, 1H), 8,43-8,52 (м, 1H), 8,5,3-8,62 (м, 3H).
13C ЯМР (CDCl3): δ 79,5, 122,5, 122,7, 122,8, 123,0, 125,1, 126,9, 126,9, 127,1, 127,3, 127,6, 128,4, 128,6, 129,8, 131,3, 128,0, 141,4, 155,7.
Пример 2
Стадия 1.
К перемешиваемой суспензии гидрида натрия (95%, 0,507 г, 20 ммолей) в ТГФ (15 мл) прибавляли 2-3 мл раствора триэтилфосфоноацетата (4,48 г, 20 ммолей) в ТГФ (20 мл). Добавляли несколько капель этанола для инициирования реакции, затем при охлаждении ледяной водой прибавляли по каплям за 40 минут остаток раствора триэтилфосфоноацетата. После перемешивания в течение 15 минут реакционную смесь переносили в капельную воронку и по каплям прибавляли к кипящему раствору 4-метоксибензофенона (4,38 г, 20 ммолей) в ТГФ (20 мл). После кипячения с обратным холодильником в течение 24 часов большую часть растворителя удаляли. Охлажденный остаток добавляли к насыщенному водному раствору хлорида натрия (20 мл) и экстрагировали дихлорметаном. Удаление дихлорметана давало светло-желтое масло (5,42 г), которое содержало главным образом этиловый эфир (Е)- и (Z)-3-параметоксифенил-3-фенилакриловой кислоты, что подтверждено данными 1Н ЯМР, которое было использовано непосредственно на следующей стадии без дополнительной очистки.
Стадия 2.
Масло, полученное на стадии 1, гидролизовали в растворе КОН (5,07 г) в метаноле (30 мл) при кипячении с обратным холодильником в течение 1 часа. Охлажденную реакционную смесь выливали в смесь воды со льдом, подкисляли разбавленной соляной кислотой до рН менее 1 и экстрагировали этилацетатом (3х20 мл). Объединенные органические растворы сушили над безводным сульфатом натрия. Растворитель удаляли и остаток перекристаллизовывали из смеси этилацетат/гексан. Получали белое твердое вещество. Маточный раствор хроматографировали и перекристаллизовывали. Всего получали 3,826 г желаемого продукта в виде белого твердого вещества и выделяли 0,677 г непрореагировавшего кетона. Выход: 75,3%. (Спектр) 1Н ЯМР показывал, что выделенный продукт был смесью (Е)- и (Z)-3-параметоксифенил-3-фенилакриловых кислот.
Стадия 3.
Повторяли методику стадии 3 примера 1 за исключением того, что вместо 3,3-дифенилакриловой кислоты использовали 3-параметоксифенил-3-фенилакриловую кислоту (254,5 мг, 1 ммоль), получая 290,7 мг 2-(параметоксифенил)-2-фенилфенантро(9,10)-2Н-[1,4]оксазина в виде светло-желтых кристаллов. Выход: 100%.
1Н ЯМР (CDCl3): δ 3,74 (с, 3Н), 6,84 (д, 2H, J=8,7 Гц), 7,29-7,42 (м, 5H), 7,50-7,60 (м, 3Н), 7,61-7,66 (м, 3Н), 8,07 (с, 1H), 8,42-8,62 (м, 4H).
13C ЯМР (CDCl3): δ 55,2, 79,4, 114,0, 122,5, 122,7, 122,8, 122,8, 122,9, 125,1, 125,2, 126,8, 126,9, 127,0, 127,5, 128,3, 128,6, 129,8, 131,2, 133,3, 138,0, 141,6, 155,9, 159,7.
Пример 3
Стадия 1.
К смеси анизола (11,9 г, 0,11 моля) и парафторбензоилхлорида (97%, 16,34 г, 0,1 моля) в дихлорметане (50 мл) маленькими порциями прибавляли хлорид алюминия (14,67 г, 0,11 моля) при перемешивании и охлаждении ледяной водой. После прибавления реакционную смесь перемешивали при комнатной температуре 1 час, выливали в смесь колотого льда (400 г) и соляной кислоты (20 мл) и перемешивали до исчезновения оранжевого окрашивания. Смесь затем экстрагировали дихлорметаном, сушили над сульфатом натрия, пропускали через короткую колонку с силикагелем и промывали дихлорметаном. Растворитель удаляли, остаток перекристаллизовывали из смеси дихлорметан/гексан и получали 21,96 г бесцветных кристаллов. Выход: 95,4%. (Спектр) 1Н ЯМР показывал, что продукт имел структуру, соответствующую парафторфенил-параметоксифенилкетону.
1Н ЯМР (CDCl3): δ 3,89 (с, 3Н), 6,97 (д, 2H, J=8,7 Гц), 7,13 (дд, 2H, J=8,7 Гц), 7,76-7,84 (м, 4H).
Стадия 2.
Повторяли методику стадии 2 примера 2 за исключением того, что вместо параметоксибензофенона использовали парафторфенил-параметоксифенилкетон (4,60 г, 20 ммолей) и время реакции составляло 48 часов. Полученное масло содержало главным образом этиловый эфир (Е)- и (Z)-3-парафторфенил-3-параметоксифенилакриловой кислоты и его использовали на следующей стадии без дополнительной очистки.
Стадия 3.
Масло, полученное на стадии 2, гидролизовали в смеси КОН (5,2 г) и метанола (30 мл) 80 минут. Смесь затем охлаждали, растворитель удаляли в вакууме и добавляли воду (30 мл). Проводили вакуум-фильтрацию смеси, промывали водой и фильтрат экстрагировали эфиром (15 мл). Водный слой отделяли и подкисляли 4М соляной кислотой до рН менее 1. Твердое вещество отфильтровывали и перекристаллизовывали из смеси дихлорметан/гексан, получая 4,8 г белых кристаллов. Выход: 88,1%. (Спектр) 1Н ЯМР показывал, что выделенный продукт имел структуру, соответствующую смеси (Е)- и (Z)-3-парафторфенил-параметоксифенилакриловых кислот.
Стадия 4.
Повторяли методику стадии 3 примера 1 за исключением того, что вместо 3,3-дифенилакриловой кислоты использовали 3-парафторфенил-параметоксифенилакриловую кислоту (272,3 мг, 1 ммоль), получая оксазин, 2-(парафторфенил)-2-(параметоксифенил)фенантро(9,10)-2Н-[1,4]оксазин, в виде светло-желтых кристаллов. Выход: 99,6%.
1Н ЯМР (CDCl3): δ 3,74 (с, 3Н), 6,85 (м, 2H), 7,04 (м, 2H), 7,38 (м, 2H), 7,46-7,60 (м, 3Н), 7,62-7,70 (м, 3Н), 8,02 (с, 1H), 8,43-8,47 (м, 1H), 8,54-8,63 (м, 3Н).
13C ЯМР (CDCl3): δ 55,2, 79,0, 114,0, 115,3, 115,6, 115,6, 122,6, 122,7, 122,8, 125,0, 125,0, 125,1, 126,8, 127,3, 127,6, 128,4, 128,8, 128,9, 129,5, 131,1, 132,8, 137,2, 137,2, 137,7, 155,4, 159,6, 164,1.
Пример 4
Стадия 1.
К перемешиваемой суспензии гидрида натрия (0,48 г, 20 ммолей) в сухом ТГФ (20 мл) прибавляли по каплям раствор триэтилфосфоноацетата (4,48 г, 20 ммолей) в сухом ТГФ (25 мл) в атмосфере азота при охлаждении водой со льдом. Через 40 минут раствор переносили в капельную воронку и прибавляли по каплям за 20 минут к кипящему раствору бис(параметоксифенил)кетона в сухом ТГФ (20 мл). Реакционную смесь кипятили 48 часов и затем гидролизовали насыщенным раствором хлорида натрия (40 мл). Водную фазу экстрагировали эфиром (3х70 мл). Объединенные органические экстракты сушили, фильтровали и концентрировали до получения остатка, который очищали хроматографией, элюируя смесью метиленхлорид/гексан (1:2). Получали бесцветное масло (4,23 г). Выход: 67,8%. (Спектр) 1Н ЯМР показывал, что выделенный продукт имел структуру, соответствующую этиловому эфиру 3,3-бис(параметоксифенил)акриловой кислоты.
1Н ЯМР (CDCl3): δ 1,16 (т, 3H, J=7,1 Гц), 3,81 (с, 3H), 3,84 (с, 3H), 4,07 (кв, 2H, J=7,1 Гц), 6,22 (с, 1H), 6,84 (д, 2H, J=9,1 Гц), 6,90 (д, 2H, J=9,1 Гц), 7,15 (д, 2H, J=9,1 Гц), 7,24 (д, 2H, J=9,1 Гц).
Стадия 2.
Этиловый эфир 3,3-бис(параметоксифенил)акриловой кислоты (4,23 г, 13,5 ммоля), полученный на стадии 1, гидролизовали в 22 мл метанола в присутствии КОН (3,7 г, 66 ммолей) в течение 1 часа при кипячении с обратным холодильником. Охлажденную реакционную смесь выливали в смесь воды со льдом и подкисляли разбавленной соляной кислотой до рН менее 1. Полученное твердое вещество отфильтровывали, промывали водой и перекристаллизовывали из смеси этилацетат/гексан. Получали белое твердое вещество (3,6 г). Выход: 93,78%. (Спектр) 1Н ЯМР показывал, что полученный продукт имел структуру, соответствующую 3,3-бис(параметоксифенил)акриловой кислоте.
1Н ЯМР (CDCl3): δ 3,82 (с, 3H), 3,85 (с, 3H), 6,22 (с, 1H), 6,85 (д, 2H, J=9,0 Гц), 6,91 (д, 2H, J=8,7 Гц), 7,17 (д, 2H, J=8,7 Гц), 7,24 (д, 2H, J=8,7 Гц).
Стадия 3.
Повторяли методику стадии 3 примера 1 за исключением того, что вместо 3,3-дифенилакриловой кислоты использовали 3,3-бис(параметоксифенил)акриловую кислоту (284,3 мг, 1 ммоль), получая 2,2-бис(параметоксифенил)фенантро(9,10)-2Н-[1,4]оксазин в виде светло-желтых кристаллов. Выход: 93,2%.
1Н ЯМР (CDCl3): δ 3,75 (с, 6H), 6,85 (д, 2H, J=8,7 Гц), 7,41 (д, 2H, J=9,1 Гц), 7,52-7,60 (м, 1H), 7,62-7,68 (м, 3H), 8,03 (с, 1H), 8,43-8,47 (м, 1H), 8,54-8,63 (м, 3H).
13C ЯМР (CDCl3): δ 55,2, 79,3, 113,0, 122,5, 122,7, 122,8, 122,9, 125,1, 126,8, 127,3, 127,5, 128,5, 129,8, 131,2, 133,5, 156,1, 159,7.
Пример 5
Стадия 1.
К перемешиваемой суспензии гидрида натрия (95%, 0,253 г, 10 ммолей) в диоксане (20 мл) прибавляли по каплям раствор триэтилфосфоноацетата (2,31 г, 10 ммолей) в диоксане (5 мл). После перемешивания в течение 20 минут добавляли параметоксифенил-параморфолинофенилкетон (2,28 г, 8 ммолей), кипятили с обратным холодильником 45 часов и удаляли большую часть растворителя. К холодному остатку добвляли воду и смесь экстрагировали этилацетатом. Удаление растворителя давало светло-желтое масло, которое было использовано на следующей стадии без дополнительной очистки.
Стадия 2.
Масло, полученное на стадии 1, гидролизовали в растворе КОН (2,0 г) в метаноле (15 мл) при кипячении с обратным холодильником 1,5 часа. После удаления растворителя смесь добавляли к смеси воды со льдом, проводили вакуум-фильтрацию и промывали водой. Выделяли 0,4 г непрореагировавшего кетона. Фильтрат экстрагировали эфиром, водный слой отделяли, подкисляли разбавленной соляной кислотой и экстрагировали дихлорметаном (3х20 мл). Объединенный органический раствор сушили над сульфатом натрия. Растворитель удаляли, остаток перекристаллизовывали из смеси дихлорметан/гексан и получали 1,72 г желтых кристаллов. Спектр 1Н ЯМР показывал, что выделенный продукт имел структуру, соответствующую смеси (Е)- и (Z)-3-параметоксифенил-3-параморфолинофенилакриловых кислот.
Стадия 3.
Повторяли методику стадии 3 примера 1 за исключением того, что вместо 3,3-дифенилакриловой кислоты использовали 3-параметоксифенил-3-параморфолинофенилакриловую кислоту (339,4 мг, 1 ммоль), получая 358 г 2-(параметоксифенил)-2-(параморфолинофенил)фенантро(9,10)-2Н-[1,4]оксазина в виде светло-коричневого твердого вещества. Выход: 100%.
Пример 6
Стадия 1.
К перемешиваемой суспензии гидрида натрия (95%, 0,253 г, 10 ммолей) в ТГФ (15 мл) прибавляли по каплям раствор триэтилфосфоноацетата (2,31 г, 10 ммолей) в ТГФ (5 мл). После перемешивания в течение 20 минут добавляли параметоксифенил-парапиперидинофенилкетон (2,95 г, 10 ммолей), кипятили с обратным холодильником 5 дней и большую часть растворителя удаляли. К охлажденному остатку добавляли воду и экстрагировали этилацетатом. Удаление растворителя давало светло-желтое масло, которое сразу использовали на следующей стадии без дополнительной очистки.
Стадия 2.
Масло, полученное на стадии 1, гидролизовали в растворе КОН (2,8 г) в метаноле (15 мл) при кипячении с обратным холодильником в течение 1 часа. После удаления растворителя реакционную смесь прибавляли к смеси воды со льдом, проводили вакуум-фильтрацию и промывали водой. Получали обратно 1,35 г непрореагировавшего кетона. Фильтрат экстрагировали эфиром, водный слой отделяли, подкисляли разбавленной соляной кислотой, фильтровали с отсасыванием и получали 1,18 г желтого твердого вещества. Спектр 1Н ЯМР показывал, что выделенный продукт имел структуру, соответствующую смеси (Е)- и (Z)-3-параметоксифенил-3-парапиперидинофенилакриловых кислот.
Стадия 3.
Повторяли методику стадии 3 примера 1 за исключением того, что вместо 3,3-дифенилакриловой кислоты использовали 3-параметоксифенил-3-парапиперидинофенилакриловую кислоту (337,4 мг, 1 ммоль), получая 336,8 мг желаемого фотохромного оксазина, 2-(параметоксифенил)-2-(парапиперидинофенил)фенантро(9,10)-2Н-[1,4]оксазина в виде светло-желтого твердого вещества. Выход: 96,5%.
Пример 7
Стадия 1.
Повторяли методику стадии 2 примера 2 за исключением того, что вместо параметоксибензофенона использовали ацетофенон (2,43 г, 20 ммолей) и время реакции составляло 4 дня. Полученное масло (3,78 г) использовали на следующей стадии без дополнительной очистки.
Стадия 2.
Масло, полученное на стадии 2, гидролизовали в смеси гидроксида калия (5,07 г) и метанола (30 мл) в течение 1 часа. Смесь затем охлаждали и растворитель удаляли в вакууме. К остатку добавляли воду (30 мл) и дважды экстрагировали эфиром (по 15 мл). Водный слой отделяли и подкисляли 4М соляной кислотой