Способ получения биокатализатора и биокатализатор для детоксикации фосфорорганических нейротоксичных соединений в проточных системах
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано для деструкции фосфорорганических соединений в проточных системах. Задачей предлагаемого изобретения является создание способа получения эффективного иммобилизованного биокатализатора для разложения ФОС в проточных системах и сам биокатализатор. На пористом носителе, представляющем собой криогель полимера, представляющего собой полиакриламид или его производные, поверхность которого модифицирована металл-хелатирующими лигандами и заряжена ионами двухвалентных металлов, иммобилизуют полипептид, содержащий полигистидиновую последовательность и проявляющий активность органофосфатгидролазы. Иммобилизацию пептида проводят пропуская его раствор через объем носителя. Способ экономически выгоден, биокатализатор может быть высушен, храниться в таком виде длительный период времени и регидратирован без существенных потерь активности, а также длительно использован в проточных системах. 2 н.п. ф-лы, 10 ил., 4 табл.
Реферат
Изобретение относится к биотехнологии, а именно к способам получения биокатализаторов на основе иммобилизованных ферментов, и может быть использовано для деструкции фосфорорганических соединений (ФОС) в проточных системах, в частности в различных системах очистки воды (муниципальных, сельскохозяйственных, индивидуальных пользователей и т.п.).
ФОС представляют собой эфиры ортофосфорной и алкилфосфоновых кислот, а также их производных, которые широко применяются в качестве пестицидов в сельском хозяйстве и инсектицидов в бытовых условиях, а также к их числу относятся наиболее токсичные боевые отравляющие вещества нервно-паралитического действия зоман, зарин и Vx [Kwong, T.C. Organophosphate pesticides: biochemistry and clinical toxicology. // Ther. Drug. Monit., 2002, V.24 (1), p.144-149; Юфит, С.С. Яды вокруг нас. Вызов человечеству. // М.: Классикс Стиль, 2002, 368 с.; Вредные вещества в промышленности. Справочник: Изд. 7-е. В трех томах. Т.III. Неорганические и элементоорганические соединения. Под ред. Н.В.Лазарева, И.Д.Гадаскиной: Л.: Химия, 1977, 608 с].
Ежегодное применение ФОС в объеме сотен тысяч тонн [Gold R.S., Wales M.E., Grimsley, J.K. Green solution for chemical problems. // Disarm. Technol., 2000, V.23, p.263-286] для нужд сельского хозяйства, а также низкие скорости разложения ФОС в условиях окружающей среды приводят к накоплению этих веществ и обнаружению их в почвах, грунтовых и речных водах, продуктах питания, табачных и хлопчатобумажных изделиях, домашней пыли [Obendorf S.K., Lemley A.T., Hedge A., Kline A.A., Tan К., Dokuchaeva Т. Distribution of pesticide residues within homes in central New York state. // Arch. Environ. Contam. Toxicol., 2006, V.50 (1), p.31-44; Lemley A., Hedge A., Obendorf S.K., Hong S., Kim J., Muss T.M., Varner C.J., Selected pesticide residues in house dust from farmers homes in central New York state. // Bull. Environ. Contamin. Toxicol., 2002, V.69 (2), p.155-163]. Токсичное воздействие ФОС на живые организмы может быть острым или кумулятивным, проявляющимся в различного рода расстройствах нервной системы, вплоть до развития паралича со смертельным исходом [Kwong Т.С. Organophosphate pesticides: biochemistry and clinical toxicology. // Ther. Drug. Monk., 2002, V.24 (1), p.144-149]. Также ФОС являются сильными мутагенами, вызывающими появление множественных хромосомных аберраций и развитию канцерогенеза [Hong M.S., Hong S.J., Barhoumi R., Burghardt R.C., Donnelly K.C., Wild J.R., Venkatraj V., Tiffany-Castiglioni E., Neurotoxicity induced in differentiated SK-N-SH-SY5Y human neuroblastoma cells by organophosphorus compounds. // Toxic. Appl. Pharmac., 2003, V.186 (2), p.110-118; Webster L.R., McKenzie G.H., Moriarty H.T., Organophosphate-based pesticides and genetic damage implicated in bladder cancer. // Cancer Genetics Cytogen., 2002, V.133, p.112-117]. В связи с этим эффективные и неагрессивные для человека и окружающей среды способы элиминирования угрозы любых контактов с ФОС представляют собой большой практический интерес.
Органофосфатгидролаза (ОРН) (арилдиалкилфосфатаза, параоксоназа, фосфотриэстераза, ЕС 3.1.8.1) - фермент, катализирующий гидролиз Р-O, P-F и P-S связей в триэфирах фосфорной кислоты [Ефременко Е.Н., Сергеева B.C. Органофосфатгидролаза - фермент, катализирующий деградацию фосфорсодержащих отравляющих веществ и пестицидов. // Известия АН Сер. Хим., 2001, C.1743-1749].
Принципиальная схема реакции, катализируемой ОРН, выглядит следующим образом.
где Х = О, S и F (R3 в этом случае отсутствует)
Y = О, S
Скорости ферментативного гидролиза ряда ФОС в 10-100 раз выше химического щелочного гидролиза, а продукты гидролиза либо не токсичны, либо относятся к существенно менее токсичному классу соединений. Поскольку ФОС преимущественно накапливаются в сточных промышленных и сельскохозяйственных водах, то наибольший интерес привлекают системы, в которых ФОС могут разлагаться непосредственно в протоке.
Для получения стабильной формы ОРН, которая может быть использована многократно для гидролиза ФОС, проводят иммобилизацию фермента различными способами.
Одной из главных характеристик любого способа получения биокатализатора на основе иммобилизованного фермента является количество белка, которое может быть иммобилизовано на единице носителя (на 1 г, мл, см2).
Основной характеристикой любого иммобилизованного фермента является его удельная каталитическая активность (ед/мг иммобилизованного белка). За единицу ферментативной активности принимают количество фермента, которое катализирует гидролиз 1 мкмоль субстрата за одну минуту при 25°С.
Сравнение активности ферментов, гидролизующих ФОС и иммобилизованных разными способами, как правило, проводится по параоксону как самому широко распространенному субстрату, определение продуктов гидролиза которого легко осуществимо спектрофотометрическим методом (λ=405 нм).
Определение отношения каталитической константы (kcat) к константе Михаэлиса (Km), отражающей сродство фермента к субстрату, проводится для установления каталитической эффективности действия биокатализаторов на основе иммобилизованных ферментов.
Период полуинактивации - это период времени, в течение которого иммобилизованный фермент теряет 50% своей исходной каталитической активности, является одной из важнейших характеристик биокатализаторов, и, как правило, определяется для условий его хранения и эксплуатации.
Эти основные характеристики способов получения биокатализаторов и самих биокатализаторов используются для их сравнительного анализа.
Известен способ получения биокатализатора для гидролиза ФОС на основе ОРН, иммобилизованной методом физической адсорбции на трифенилметилагарозе [Caldwell S.R., Raushel F.M. Detoxification of organophosphate pesticides using an immobilized phosphotriesterase from Pseudomonas diminuta. // Biotechnol. Bioeng., 1991, V.37, p.103-109], согласно которому к 2 мл суспензии трифенилметилагарозы в 125 мМ CHES-буфере (рН 9,0) добавляют предварительно очищенный препарат ОРН и аккуратно, чтобы не повредить носитель, перемешивают в течение как минимум 10 мин. После этого суспензию помещают в колонный реактор и промывают 30 мл 125 мМ CHES-буфера (рН 9,0). Общее время получения биокатализатора составляет 70 мин, способ позволяет максимально ввести 1,84 мг белка/мл носителя. Использование такого биокатализатора в проточном реакторе для гидролиза ФОС при скорости протока 11,5 мл/ч (удельная нагрузка на носитель 585,7 л/ч·м2) и концентрации субстрата 0,17 мМ обеспечивает максимальную активность иммобилизованного фермента, которая, согласно расчетам, сделанным на основе данных, приводимых авторами способа, составляет 6,30 ед/мг белка. Период полуинактивации этого биокатализатора при его использовании для детоксикации ФОС в проточной системе составляет 95 мин при 55°С.
Несмотря на простоту иммобилизации фермента методом адсорбции, сам способ обладает рядом существенных недостатков, которые заключаются в том, что адсорбированный фермент быстро смывается с поверхности носителя, а сам носитель, по признанию авторов, принципиально не может быть использован при скоростях протока выше 70 мл/ч из-за его деформации, к тому же носитель дорог и его применение на практике, согласно экономическим расчетам авторов, не целесообразно. К тому же высокое сродство носителя к гидрофобному субстрату, обнаруженное авторами этого способа, приводит к тому, что большая часть субстрата связывается с носителем и остается не гидролизованной.
Существует ряд способов получения биокатализаторов для гидролиза ФОС в проточных системах, основанных на ковалентной иммобилизации ОРН на различных носителях.
Известен способ получения биокатализатора путем иммобилизации ОРН на поверхности гранул пористого стекла (70-400 мкм в диаметре), которую предварительно этерефицируют при 0°С в течение 2-3 ч и последовательно обрабатывают гидразином и азотистой кислотой (в течение 1-1,5 ч) с целью получения азидных групп на поверхности стекла. Иммобилизацию белка проводят также при 0°С в течение 30 мин [Munnecke D. Properties of an immobilized pesticide-hydrolyzing enzyme. // Appl. Environ. Microbiol., 1977, V.33 (3), p.503-507]. Общее время получения биокатализатора составляет 210-300 мин. Способ позволяет вводить до 0,19 мг белка на 1 г носителя. Использование такого биокатализатора в проточном реакторе для гидролиза ФОС при скорости протока 210 мл/ч (удельная нагрузка на носитель 1190 л/ч·м2) и концентрации субстрата 21 мкМ обеспечивает максимальную активность иммобилизованного фермента, которая, согласно расчетам, сделанным на основе данных, приводимых авторами способа, составляет 0,92 ед/мг белка. Период полуинактивации этого биокатализатора при его использовании для детоксикации ФОС в периодических и непрерывных условиях в проточной системе составляет соответственно 38 и 280 сут.
Этот способ получения и биокатализатор обладают рядом существенных недостатков, основными из которых являются крайне низкое количество иммобилизуемого белка и, как следствие, очень низкая активность биокатализатора.
Известен способ, который предлагает использование для иммобилизации ОРН носителя в виде нейлоновой трубки длиной 3 м и внутренним диаметром 1,6 мм (таким образом, рабочий объем реактора - 6,03 см3), внутреннюю поверхность которой активируют глутаровым альдегидом (12,5% раствор в 0,1 М боратном буфере, рН 8,5) при 0°С в течение 30 мин и далее промывают 50 мл того же буфера в течение 30 мин [Caldwell S.R., Raushel F.M., Detoxification oforganophosphate pesticides using a nylon based Immobilized phosphotriesterase from Pseudomonas diminuta.// Appl. Biochem. Biotechnol., 1991, V.37, p.59-72]. Иммобилизацию фермента осуществляют путем пропускания раствора частично очищенного препарата ОРН (степень чистоты не указана) в замкнутом цикле через носитель со скоростью 2,5 мл/мин при 0°С в течение 4 ч. Далее носитель отмывают 150 мл раствора 50 мМ триэтаноламина (рН 9,0). Общее время получения биокатализатора составляет 470 мин, способ позволяет максимально ввести 0,036 мг белка/мл носителя. Использование такого биокатализатора в проточном реакторе для гидролиза ФОС при скорости протока 210 мл/ч (удельная нагрузка на носитель 1857 л/ч·м2) и концентрации субстрата 2 мМ обеспечивает максимальную активность иммобилизованного фермента, которая согласно расчетам, сделанным на основе данных, приводимых авторами способа, составляет 12,0 ед/мг белка. Период полуинактивации этого биокатализатора при его использовании для детоксикации ФОС не известен и из-за недостатка данных, приводимых авторами, не может быть определен.
Несмотря на достаточно высокую активность биокатализатора, получаемого согласно этому способу, сам способ характеризуется существенными недостатками, не позволяющими использовать его на практике: необходимо применение высокотоксичного сшивающего агента для активации носителя в виде растворов достаточно высокой концентрации (12,5%); процедура получения биокатализатора длительна и необходимо соблюдение постоянного низкотемпературного режима проведения процесса (0°С); ковалентная иммобилизация фермента приводит к существенной его инактивации (каталитическая эффективность действия фермента снижается в 160 раз в результате иммобилизации по сравнению с растворимой формой) и делает невозможной регенерацию биокатализатора.
Существует ряд способов получения биокатализаторов для детоксикации ФОС в проточной системе, основанных на иммобилизации ОРН за счет аффинных взаимодействий между носителем и генетически модифицированным ферментом, при этом генетическая модификация ОРН заключается во введении в структуру молекулы белка дополнительных аминокислотных последовательностей, через которые реализуется специфическая связь белка с носителем. Поскольку после генетической модификации белок имеет полную аминокислотную последовательность, отличную от аминокислотной последовательности ОРН, то принято называть такой белок не ОРН, а полипептидом со свойствами ОРН.
Известен способ получения биокатализатора на основе иммобилизованного на CF11-целлюлозе полипептида со свойствами ОРН, содержащего целлюлозосвязывающий домен на N-конце молекулы белка (CBD-OPH) [Richins R. D., Mulchandani A., Chen W. Expression, immobilization and enzymatic characterization of cellulose-binding domain-organophosphorus hydrolase fusion enzymes. // Biotech. & Bioeng., 2000, V.69 (6), p.591-596]. Согласно этому способу 30 мл целлюлозной матрицы промывают 60 мл 50 мМ фосфатно-цитратного буфера (рН 8,0), содержащего 100 мкМ CoCl2, 50 мМ NaCl и 0,1% Triton-X100, после чего инкубируют носитель с CBD-OPH в течение 30-60 мин при комнатной температуре при перемешивании на горизонтальном шейкере при 60 об/мин в том же буфере. Далее отмывают носитель от несвязавшегося фермента тем же буфером (120 мл). К биокатализатору добавляют азид натрия до концентрации 0,02%, чтобы предотвратить его микробную контаминацию. Общее время получения биокатализатора составляет 270 мин, способ позволяет максимально ввести 0,5 мг белка/мл носителя. Использование такого биокатализатора в проточном реакторе для гидролиза ФОС при скорости протока 100 мл/ч (удельная нагрузка на носитель 1273 л/ч·м2) и концентрации субстрата 2 мМ обеспечивает максимальную активность иммобилизованного фермента, которая согласно расчетам, сделанным на основе данных, приводимых авторами способа, составляет 3,0 ед/мг белка. Период полуинактивации этого биокатализатора при его использовании для детоксикации ФОС согласно данным авторов составляет 100 сут.
Несмотря на простоту способа иммобилизации, биокатализатор не может быть использован на практике, так как носитель подвержен микробной биодеградации и требует постоянного дополнительного введения в проточный реактор антимикробных веществ, которые необходимо вводить в состав вод, содержащих ФОС и подлежащих обработке. К тому же часть ФОС сорбируется целлюлозным носителем, а при скорости протока выше 100 мл/ч происходит деформация носителя, и эффективность действия биокатализатора снижается.
Согласно другому способу получения биокатализатора для детоксикации ФОС в проточных системах осуществляется иммобилизация полипептида со свойствами ОРН, представляющего собой ОРН, у которой на N-конец белковой молекулы генетически введены и последовательно соединены гексагистидиновая последовательность (His6), зеленый флуоресцирующий белок (GFP) и энтерокиназный сайт рестрикции (ЕК). Сокращенно этот полипептид обозначается как His6-GFP-EK-OPH [Wu C.-F., Cha H.J., Valdes J.J., Bentley W.E. GFP-visualized immobilized enzymes: degradation of paraoxon by organophosphorus hydrolase in a packed column. // Biotechn. & Bioeng., 2002, V.77 (2), p.212-218]. В качестве носителя используется HiTrap, представляющий собой 6%-ную агарозу, обработанную высокими концентрациями сшивающего агента (тип агента не указан). Поверхность носителя активируется остатками иминодиуксусной кислоты, далее через 1 мл HiTrap пропускают 0,5 мл 0,1 М раствор сульфата никеля, после чего носитель промывают 5 мл дистиллированной воды и уравновешивают 20 мМ Na-фосфатным буфером, содержащим 500 мМ NaCl и 0,5 мМ имидазола (рН 8,5). На носитель наносят препарат белка, прокачивая раствор His6-GFP-EK-OPH (200 мл) через колонку с носителем со скоростью 2 мл/мин, после чего носитель промывают 10 мл того же буфера. Общее время получения биокатализатора составляет 105-110 мин, способ позволяет максимально ввести 0,284 мг белка/мл носителя. Использование такого биокатализатора в проточном реакторе для гидролиза ФОС при скорости протока 120 мл/ч (удельная нагрузка на носитель 1528 л/ч·м2) и концентрации субстрата 0,05 мМ обеспечивает максимальную активность иммобилизованного фермента, которая согласно расчетам, сделанным на основе данных, приводимых авторами способа, составляет 0,059 ед/мг белка. Период полуинактивации этого биокатализатора при его использовании для детоксикации ФОС не известен и из-за недостатка данных, приводимых авторами, не может быть определен.
Подход, лежащий в основе этого способа иммобилизации фермента на носителе, состоит в образовании множественных координационных связей между заряженной ионами металлов поверхностью носителя, активированной металл-хелатирующими лигандами, и атомами азота имидазольных колец в полигистидиновой последовательности полипептида His6-GFP-EK-OPH. Такая иммобилизация фермента за счет координационных связей имеет ряд существенных преимуществ перед физической и ковалентной иммобилизацией, так как, с одной стороны, гарантирует высокую прочность связи фермента с носителем без применения сшивающих агентов, а с другой - сохраняет возможность регенерации биокатализатора за счет мягкого удаления инактивированного белка с поверхности носителя при его обработке имидазолом и последующим нанесением новой порции активного фермента.
Несмотря на очевидные преимущества этого подхода к получению биокатализаторов известный способ и биокатализатор обладают рядом недостатков, исключающих возможность их использования на практике: способ позволяет иммобилизовать только очень низкие концентрация белка, и, как следствие этого, биокатализатор обладает крайне низкой активностью и способен эффективно гидролизовать лишь невысокие концентрации ФОС (0,05 мМ). Скорости протока, при которых действие биокатализатора остается эффективным, не превышают 100 мл/ч, что в 5-8 раз ниже тех, которые требуются на практике в проточных системах для детоксикации ФОС в составе речных, сточных вод и т.д. Следует отметить также, что согласно характеристикам самого носителя, максимальная скорость протока, при которой он может быть использован, составляет всего 240 мл/ч, дальнейшее увеличение скорости протока приводит к его разрушению.
Данное техническое решение, как наиболее близкое к заявляемому по способу получения биокатализатора для гидролиза ФОС в проточных системах за счет координационной иммобилизации полипептида со свойствами ОРН на пористом носителе, поверхность которого модифицирована металл-хелатирующими лигандами, принято за прототип.
Задачей предлагаемого изобретения является получение на основе иммобилизованного полипептида со свойствами ОРН эффективного биокатализатора, предназначенного для гидролиза ФОС в проточных системах.
Поставленная задача решается тем, что на пористом носителе, представляющем собой криогель синтетического полимера взятого из ряда полиакриламид и его аналоги, полученные при полимеризации мономеров, представляющих собой различные производные акриламида (например, поли-N,N-диметилакриламид, полиоксиэтилметакрилат, поли-N,N-изопропилакриламид, поли-2-оксиэтилпропилакриламид), поверхность которого модифицирована металл-хелатирующими лигандами и заряжена ионами двухвалентных металлов, иммобилизуют полипептид, содержащий полигистидиновую последовательность и проявляющий активность органофосфатгидролазы, путем пропускания его раствора через объем носителя с последующей отмывкой носителя от несвязавшегося белка.
Заявляемый способ предлагает в качестве носителей для иммобилизации белка использовать криогели синтетических полимеров [Lozinsky V.I., Galaev I.Yu., Plieva F.M., Savina I.N., Jungvid H., Mattiasson В. Polymeric cryogels as promising materials of biotechnological interest. // Trends Biotechol., 2003, V.21, p.445-451], которые получаются в результате структурирования полимеров или полимеризации мономеров при низких температурах. Замораживание растворов полимеров или мономеров с добавлением сшивающих агентов позволяет получить монолит с трехмерной структурой, для которой характерно наличие большого количества пор размером 10-100 мкм, которые превышают размеры пор, образующиеся при обычной полимеризации [Plieva F.M., Savina I.N., Deraz S., Andersson J., Galaev I.Yu., Mattiasson В., Characterization of supermacroporous monolithic polyacrylamide based matrices designed for chromatography of bioparticles. // J.Chromatog. B, 2004, V.807 (1), p.129-137]. При этом носитель представляет собой единый монолит, а не отдельные гранулы, что снижает диффузионные проблемы при использовании носителя в колоночном реакторе. Большой размер пор, с одной стороны, позволяет увеличивать скорость потока жидкости через носитель, а с другой - образует значительную поверхность, достаточную для модификации лигандами и необходимую для проведения эффективной иммобилизации белков. Поверхность криогелей полимеров легко модифицируется с помощью различных металл-хелатирующих лигандов (иминодиуксусной кислотой, IDA; N,N,N'-трис-(карбоксиметил)-этилендиамином, TED; нитрилотриуксусной кислотой, NTA), которые могут быть «заряжены» различными ионами металлов [Efremenko E., Votchitseva Yu., Plieva F., Galaev I., Mattiasson В. Purification of His6-organophosphate hydrolase using monolithic supermacroporous polyacrylamide cryogels developed for immobilized metal affinity chromatography. // Appl. Microbiol. Biotechnol., 2006, V.70 (5), p.558-563]. Большой размер пор в структуре криогелей полимеров обеспечивает использование клеточных экстрактов, содержащих целевые белки для непосредственного нанесения на носитель и проведения иммобилизации белка без дополнительных стадий очистки [Arvidsson P., Plieva F.M., Lozinsky V.I., Galaev I.Yu., Mattiason В. Direct chromatographic capture of enzyme from crude homogenate using immobilized metal affinity chromatography on a continuous supermacroporous adsorbent. // J. Chromatog. A, 2003, V.986, p.275-290]. За счет высокоселективного взаимодействия носителя с белком, содержащим полигистидиновую последовательность, возможно одновременно проводить выделение, очистку и иммобилизацию целевого белка.
Использование полипептида, содержащего полигистидиновую последовательность на N- или С-конце молекулы и проявляющего свойства ОРН, при этом не содержащего дополнительных аминокислотных последовательностей между самим белком (ОРН) и вводимой аффинной последовательностью, гарантирует широкий рН-профиль каталитической активности иммобилизуемого фермента и его широкую субстратную специфичность [Вотчицева Ю.А., Ефременко Е.Н., Алиев Т.К., Варфоломеев С.Д. Свойства гексагистидинсодержащей органофосфатгидролазы. // Биохимия, 2006, Т.71 (2), с.216-222; Гудков Д.А., Вотчицева Ю.А., Ефременко Е.Н. Гидролиз параоксона, катализируемый органофосфатгидролазой, содержащей полигистидиновую последовательность на С-конце молекулы белка. // Вестник МГУ, сер. Химия, 2006, Т.47 (1), с.15-19].
Заявляемый способ получения биокатализатора на основе иммобилизованной ОРН осуществляется следующим образом: на пористом носителе, представляющем собой криогель полимера, полученного при полимеризации мономеров, представляющих собой различные производные акриламида (например, поли-N,N-диметилакриламид, полиоксиэтилметакрилат, поли-N,N-изопропилакриламид, поли-2- оксиэтилпропилакриламид), поверхность которого модифицирована металл-хелатирующими лигандами и заряжена ионами двухвалентных металлов, иммобилизуют полипептид, содержащий полигистидиновую последовательность и проявляющий активность органофосфатгидролазы, путем пропускания его раствора через объем носителя и последующей отмывки не связавшегося белка таким образом, что конечная концентрация компонентов в биокатализаторе составляют (мас.% по сух. веществам):
| Белок | до 0,25 |
| Нерастворимый носитель | 6,0-20,0 |
| Вода (буферный раствор) | Остальное до 100%. |
Общее время получения биокатализатора составляет не более 20 мин, способ позволяет вводить до 2,5 мг белка/мл носителя. Использование такого биокатализатора в проточном реакторе для гидролиза ФОС при скорости протока 720 мл/ч (удельная нагрузка на носитель 9167 л/ч·м2) и концентрации субстрата 2 мМ обеспечивает максимальную активность биокатализатора, которая составляет 48,5 ед/мг иммобилизованного белка. Способ позволяет совместить процесс выделения, очистки и иммобилизации целевого белка на носителе.
Способ получения биокатализатора значительно стабилизирует фермент и позволяет осуществлять высушивание и регидратацию препарата иммобилизованного фермента с сохранением его каталитической активности до 94%, а также длительно хранить его. Это новое свойство (высушивание и регидратация), являющееся существенным отличием биокатализатора, предлагаемого в данном изобретении, от известных аналогов, является результатом комбинирования его компонентов, которое ранее известно не было.
Вторым объектом изобретения является биокатализатор на основе иммобилизованного полипептида с активностью ОРН, который предназначен для детоксикации ФОС в проточных системах, получен по заявляемому способу, и катализирующий гидролиз фосфорорганических соединений в интервале рН 6,5-12,5 и при температуре до 65°С, характеризующийся тем, что обладает высокой стабильностью (период полуинактивации при эксплуатации до 175 сут и при хранении - до 570 сут).
Существенными техническими результатами заявляемого изобретения является высокая концентрация иммобилизованного белка в расчете на 1 мл носителя и высокая каталитическая активность иммобилизованного белка, непродолжительность процесса получения биокатализатора, возможность регенерации биокатализатора (как минимум 20 раз), длительная его эксплуатация для детоксикации ФОС в проточных системах (период полуинактивации до 175 сут) и высокая стабильность при хранении (период полуинактивации до 570 сут).
Ниже приводятся конкретные примеры реализации заявляемого технического решения.
Пример 1. Получение биокатализатора на основе иммобилизованного полипептида, содержащего гексагистидиновую последовательность (His6) на N-конце белка и проявляющего активность ОРН (His6-OPH), при использовании криогеля полиакриламида в качестве нерастворимого носителя
Через криогель полиакриламида (5 мл), поверхность которого модифицирована остатками иминодиуксусной кислоты в качестве металл-хелатирующего лиганда, пропускают 5 мл 0,1 М раствора ионов Со2+ со скоростью 300 мл/ч, чтобы зарядить носитель ионами металла, после чего носитель промывают 15 мл 50 мМ К-фосфатного буфера (рН 7,5), содержащего 300 мМ NaCl, со скоростью 300 мл/ч. Далее через носитель пропускают раствор, содержащий очищенный фермент His6-OPH (1 мг/мл) в 50 мМ К-фосфатном буфере (рН 7,5), содержащем 300 мМ NaCl, со скоростью 180 мл/ч. Отмывают носитель от несвязавшегося белка тем же буфером (10 мл), дополнительно содержащим 10 мМ имидазола, со скоростью 180 мл/ч. Общее время получения биокатализатора составляет 15 мин. Таким образом, состав полученного биокатализатора следующий (мас.% по сух. веществам): белок - 0,2%, носитель - 10%, буферный раствор - остальное до 100%. Способ позволяет ввести 2 мг белка/мл носителя. Использование такого биокатализатора в проточном реакторе для гидролиза ФОС при скорости протока 720 мл/ч (удельная нагрузка на носитель 9167 л/ч·м2) и концентрации субстрата 2 мМ обеспечивает максимальную активность иммобилизованного фермента, которая составляет 48,5 ед/мг белка. Период полуинактивации биокатализатора при его использовании в этих условиях составляет 175 сут.
Биокатализатор с иммобилизованным ферментом может быть высушен под вакуумом (1 мБар) при 25°С в течение 24 ч до остаточной влажности 4%. Период полуинактивации биокатализатора при хранении во влажном и высушенном состоянии при 4°С составляет соответственно 420 и 570 сут.
Пример 2. Получение биокатализатора на основе иммобилизованного полипептида, содержащего гексагистидиновую последовательность (His6) на С-конце белка и проявляющего активность ОРН (OPH-His6), при использовании криогеля полиоксиэтилметакрилата в качестве нерастворимого носителя.
Через криогель полиоксгэтилметакрилата (5 мл), поверхность которого модифицирована остатками N,N,N'-трис-(карбоксиметил)-этилендиамина в качестве металл-хелатирующего лиганда, пропускают 5 мл 0,1 М раствора ионов Ni2+ со скоростью 300 мл/ч, чтобы зарядить носитель ионами металла, после чего носитель промывают 15 мл 50 мМ К-фосфатного буфера (рН 7,5), содержащим 300 мМ NaCl, со скоростью 300 мл/ч. Далее через носитель со скоростью 180 мл/ч пропускают клеточный гомогенат, который получают после дезинтеграции клеток Е.coli, являющихся продуцентами OPH-His6, в 50 мМ К-фосфатном буфере (рН 7,5), содержащем 300 мМ NaCl, и который содержит 1 мг/мл целевого фермента. Отмывают носитель от несвязавшегося белка тем же буфером (10 мл), дополнительно содержащим 10 мМ имидазола, со скоростью 180 мл/ч. Общее время получения биокатализатора составляет 20 мин. Таким образом, состав полученного биокатализатора следующий (мас.% по сух. веществам): белок - 0,2%, носитель - 12%, буферный раствор - остальное до 100%. Способ позволяет ввести 2 мг белка/мл носителя. Использование такого биокатализатора в проточном реакторе для гидролиза ФОС при скорости протока 480 мл/ч (удельная нагрузка на носитель 6111 л/ч·м2) и концентрации субстрата 0,5 мМ обеспечивает максимальную активность иммобилизованного фермента, которая составляет 30 ед/мг белка. Период полуинактивации биокатализатора при его использовании в этих условиях составляет 162 сут.
Биокатализатор с иммобилизованным ферментом может быть высушен, как указано в Примере 1. Период полуинактивации биокатализатора при его хранении во влажном и высушенном состоянии при 4°С составляет соответственно 410 и 520 сут.
Пример 3. Получение биокатализатора на основе иммобилизованного полипептида, содержащего двенадиатигистидиновую последовательность (His12) на N-конце белка и проявляющего активность ОРН (His12-OPH), при использовании криогеля поли-N,N-диметилакриламида в качестве нерастворимого носителя.
Через криогель поли-N,N-диметилакриламида (5 мл), поверхность которого модифицирована остатками нитрилотриуксусной кислоты в качестве металл-хелатирующего лиганда, пропускают 5 мл 0,1 М раствора ионов Cu2+ со скоростью 300 мл/ч, чтобы зарядить носитель ионами металла, после чего носитель промывают 15 мл 50 мМ К-фосфатного буфера (рН 7,5), содержащим 300 мМ NaCl, со скоростью 300 мл/ч. Далее через носитель со скоростью 180 мл/ч пропускают супернатант с концентрацией His12-OPH 1 мг/мл, полученный после дезинтеграции клеток E.coli, являющихся продуцентами His12-OPH, в 50 мМ К-фосфатном буфере (рН 7,5), содержащем 300 мМ NaCl, и последующего центрифугирования полученного гомогената (20 мин, 10000 g). Отмывают носитель от несвязавшегося белка тем же буфером (10 мл), дополнительно содержащим 10 мМ имидазола, со скоростью 180 мл/ч. Общее время получения биокатализатора составляет 20 мин. Таким образом, состав полученного биокатализатора следующий (мас.% по сух. веществам): белок - 0,25%, носитель - 20%, буферный раствор - остальное до 100%. Способ позволяет ввести 2,5 мг белка/мл носителя. Использование такого биокатализатора в проточном реакторе для гидролиза ФОС при скорости протока 500 мл/ч (удельная нагрузка на носитель 6366 л/ч·м2) и концентрации субстрата 1 мМ обеспечивает максимальную активность иммобилизованного фермента, которая составляет 20 ед/мг белка. Период полуинактивации биокатализатора при его использовании в этих условиях составляет 165 сут.
Биокатализатор с иммобилизованным ферментом может быть высушен, как указано в Примере 1. Период полуинактивации биокатализатора при хранении во влажном и высушенном состоянии при 4°С составляет соответственно 360 и 500 сут.
Пример 4. Получение биокатализатора на основе иммобилизованного полипептида, содержащего гексагистидиновую последовательность (His6) на N-конце белка и проявляющего активность ОРН (His6-OPH), при использовании криогеля поли-N,N-изопропилакриламида в качестве нерастворимого носителя.
Через криогель поли-N,N-изопропилакриламида (5 мл), поверхность которого модифицирована остатками иминодиуксусной кислоты в качестве металл-хелатирующего лиганда, пропускают 5 мл 0,1 М раствора ионов Со2+ со скоростью 300 мл/ч, чтобы зарядить носитель ионами металла, после чего носитель промывают 15 мл 50 мМ К-фосфатного буфера (рН 7,5), содержащим 300 мМ NaCl, со скоростью 300 мл/ч. Далее через носитель со скоростью 180 мл/ч пропускают супернатант с концентрацией His6-OPH 1 мг/мл, полученный после дезинтеграции клеток E.coli, являющихся продуцентами His6-OPH, в 50 мМ К-фосфатном буфере (рН 7,5), содержащем 300 мМ NaCl, и последующего центрифугирования полученного гомогената (20 мин, 10000 g). Отмывают носитель от несвязавшегося белка тем же буфером (10 мл), дополнительно содержащим 10 мМ имидазола, со скоростью 180 мл/ч. Общее время получения биокатализатора составляет 20 мин. Таким образом, состав полученного биокатализатора следующий (мас.% по сух. веществам): белок - 0,21%, носитель - 6%, буферный раствор - остальное до 100%. Способ позволяет ввести 2,1 мг белка/мл носителя. Использование такого биокатализатора в проточном реакторе для гидролиза ФОС при скорости протока 630 мл/ч (удельная нагрузка на носитель 8021 л/ч·м2) и концентрации субстрата 1,2 мМ обеспечивает максимальную активность иммобилизованного фермента, которая составляет 36 ед/мг белка. Период полуинактивации биокатализатора при его использовании в этих условиях составляет 160 сут.
Биокатализатор с иммобилизованным ферментом может быть высушен, как указано в Примере 1. Период полуинактивации биокатализатора при хранении во влажном и высушенном состоянии при 4°С составляет соответственно 410 и 500 сут.
Пример 5. Получение биокптализатора на основе иммобилизованного полипептида, содержащего гексагистидиновую последовательность (His6) на N-конце белка и проявляющего активность ОРН (His6-OPH), при использовании криогеля поли-2-оксиэтилпропилакриламида в качестве нерастворимого носителя.
Через криогель поли-2-оксиэтилпропилакриламида (5 мл), поверхность которого модифицирована остатками иминодиуксусной кислоты в качестве металл-хелатирующего лиганда, пропускают 5 мл 0,1 М раствора ионов Cu2+ со скоростью 300 мл/ч, чтобы зарядить носитель ионами металла, после чего носитель промывают 15 мл 50 мМ К-фосфатного буфера (рН 7,5), содержащим 300 мМ NaCl, со скоростью 300 мл/ч. Далее через носитель со скоростью 180 мл/ч пропускают супернатант с концентрацией His6-OPH 1 мг/мл, полученный после дезинтеграции клеток Е.coli, являющихся продуцентами His6-OPH, в 50 мМ К-фосфатном буфере (рН 7,5), содержащем 300 мМ NaCl, и последующего центрифугирования полученного гомогената (20 мин, 10000 g). Отмывают носитель от несвязавшегося белка тем же буфером (10 мл), дополнительно содержащим 10 мМ имидазола, со скоростью 180 мл/ч. Общее время получения биокатализатора составляет 20 мин. Таким образом, состав полученного биокатализатора следующий (мас.% по сух. веществам): белок - 0,24%, носитель - 12%, буферный раствор - остальное до 100%. Способ позволяет ввести 2,4 мг белка/мл носителя. Использование такого биокатализатора в проточном реакторе для гидролиза ФОС при скорости протока 480 мл/ч (удельная нагрузка на носитель 6111 л/ч·м2) и концентрации субстрата 1 мМ обеспечивает максимальную активность иммобилизованного фермента, которая составляет 27 ед/мг белка. Период полуинактивации биокатализатора при его использовании в этих условиях составляет 156 сут.
Биокатализатор с иммобилизованным ферментом может быть высушен, как указано в Примере 1. Период полуинактивации биокатализатора при хранении во влажном и высушенном состоянии при 4°С составляет соответственно 400 и 510 сут.
Пример 6. Свойства биокатализатора, полученного согласно заявляемому способу.
Константы каталитической эффективности действия биокатализатора, полученного, согласно заявляемому способу, представлены в Таблице 1. Биокатализатор способен осуществлять высокоэффективный гидролиз различных ФОС.
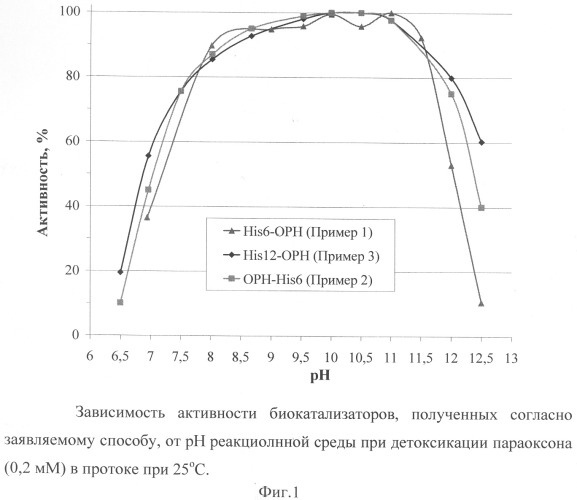
На Фиг.1 представлены рН-зависимость каталитической активности биокатализатора, полученного на основе иммобилизации полипептидов со свойствами ОРН с генетически введенными полигистидиновыми последовательностями различной длины. Диапазон рН, при котором полученный биокатализатор проявляет высокую каталитическую активность, практически не зависит от того, какой длины полигистидиновая последовательность присутствует в структуре белка.
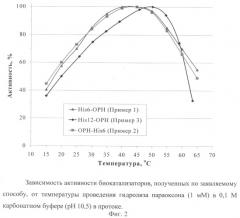
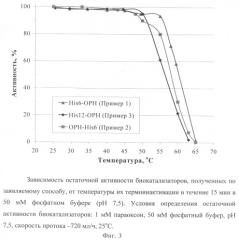
На Фиг.2 приведена зависимость активности полученного биокатализатора от температуры, а на Фиг.3 приведена зависимость остаточной активности биокатализатора от температур, при воздействии которых на биокатализатор проводилась его термоинактивация. Данные подтверждают высокую стабильность биокатализатора вне зависимости от исходных условий его получения.
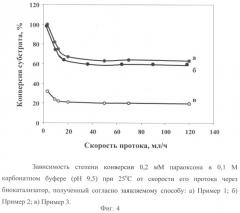
На Фиг.4 приведена зависимость степени конверсии субстрата от скорости протока, которая свидетельствует о том, что в широком интервале скоростей протока наблюдается постоянная высокая степень гидролиза субстрата под действием биокатализатора, полученного согласно заявляемому способу.
На Фиг.5 показана пористая структура макропористого биокатализатора, получаемого согласно заявляемому способу. Имеющийся у носителя размер пор, с одной стороны, не создает диффузионных ограничений потоку субстрата, а с другой - обладает достаточно высокой площадью внутренней поверхности, чтобы связывать большое количество белка.
На Фиг.6 приведены фотографии, иллюстрирующие процесс высушивания и последующую регидратацию биокатализатора. Данные операции приводят к 7-8% потерям активности биокатализатора (Таблица 2).
На Фиг.7 показана операционная стабильность биокатализатора при его использовании для дстоксикации ФОС в проточной системе, свидетельствующая