Способ переработки металлических бериллиевых отходов
Иллюстрации
Показать всеИзобретение относится к области получения соединений бериллия, а именно гидроксида бериллия, при переработке бериллийсодержащих металлических отходов. Способ переработки металлических бериллиевых отходов включает их растворение в щелочном растворе с последующим выделением кристаллического гидроксида бериллия. Щелочной раствор используют с концентрацией 300 г/дм3 и растворение ведут при температуре 85-110°С в присутствии азотнокислых солей натрия или калия, взятых в количестве 120-150% от стехиометрически необходимого по реакции образования газообразного аммиака. Продолжительность процесса 4 часа. Результат изобретения: упрощение процесса переработки металлических отходов бериллия и обеспечение пожаровзрывобезопасности. 1 ил.
Реферат
Изобретение относится к области получения соединений бериллия, а именно гидроксида бериллия, при переработке бериллийсодержащих металлических отходов.
В процессе переработки металлических бериллиевых отходов лишь незначительную часть их возвращают в пирометаллургию на переплавку. Основная часть отходов в виде сплавов самого разнообразного состава возвращается в кессонированную руднотермическую печь, где сплавляется совместно с концентратом и затем перерабатывается по известной технологической схеме для бериллийсодержащих концентратов (Г.Ф.Силина, Ю.И.Зарембо, Л.Э.Бертина. «Бериллий. Химическая технология и металлургия», Москва, 1960, с.70). Сплавление богатых металлических отходов (30-80% бериллия) с бедными рудными концентратами (1,5-2% бериллия) является весьма невыгодным из-за высокой циркуляционной нагрузки, резкого увеличения всех расходных коэффициентов реагентов на дальнейших ступенях переработки.
Известны щелочные методы получения гидроксида бериллия, в которых бериллиевый концентрат вскрывают растворами едкого натра при повышенном давлении и температуре (патент США №3615260, НКИ: 423-131, 1971, патент РФ RU 2264986 CO1F 3/02).
Наиболее близким к заявляемому объекту является способ переработки металлических бериллиевых отходов путем растворения их в щелочи с последующим выделением кристаллического гидроксида бериллия по реакции:
(М.Х.Карапетянц, С.И.Дракин. «Общая и неорганическая химия», Москва, «Химия», 1981, с.316).
Из раствора бериллата натрия путем гидролиза выделяется гидроксид бериллия по реакции:
Как видно из уравнения реакции (1), на одну молекулу растворенного бериллия выделяется одна молекула газообразного водорода, т.е. эта операция пожаровзрывоопасна. В производстве для предотвращения взрывов используется понижение концентрации выделившегося водорода ниже предела взрываемости принудительным разбавлением его воздухом вентиляции. Но при использовании этого метода происходят «хлопки», а также и выбросы щелочи из аппарата.
Недостатками указанного метода растворения металлических бериллиевых отходов являются:
1. Пожаровзрывоопасность.
2. Неуправляемость процессом с вероятностью выброса бериллия в окружающую среду.
Техническим результатом изобретения является упрощение процесса переработки металлических отходов бериллия и обеспечение пожаровзрывобезопасности.
Технический результат достигается путем растворения металлических бериллиевых отходов в щелочном растворе с последующим выделением кристалллического гидроксида бериллия. Используют щелочной раствор с концентрацией 300 г/дм3 и растворение ведут при температуре 85-110°С в присутствии азотнокислых солей натрия или калия, взятых в количестве 120-150% от стехиометрически необходимого по реакции образования газообразного аммиака. Продолжительность процесса 4 часа.
В этом случае протекает качественно новая реакция без выделения водорода
Присутствие азотнокислых солей натрия или калия, взятых в количестве, превышающем стехиометрически необходимое, позволяет обеспечить стабильность и полную безопасность проведения реакции растворения металлических отходов бериллия.
Растворение бериллиевых отходов при температуре 85-110°С проводится с целью ускорения процесса. Повышение температуры выше этого интервала при данном режиме растворения является нецелесообразным.
Были проведены сравнительные испытания по растворению металлического бериллия (стружки):
1. По прототипу (реакция 1)
2. По реакции 3 с добавлением NaNO3 меньше стехиометрически необходимого количества.
3. По реакции 3 с добавлением NaNO3 больше стехиометрически необходимого количества.
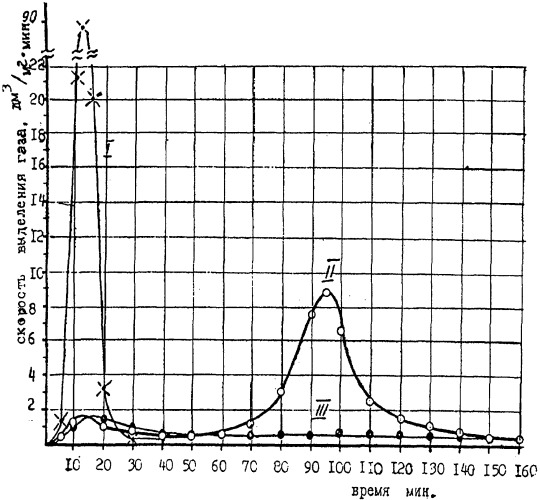
На чертеже представлены графики изменения скорости выделения газа во времени.
Пример 1. Опыты проводились в герметичном аппарате. Сначала в аппарат помещалась навеска бериллия, затем заливался рассчитанный объем насыщенного раствора NaNO3 (опыт 2 и 3). Далее заливался весь раствор NaOH с концентрацией 300 г/дм3 в заведомо избыточном количестве для данной навески бериллия. За время проведения опыта фиксировались скорость выделения газа, его количество, температура реакционной смеси в аппарате и состав газа (см. чертеж).
В опытах по прототипу (кривая 1) показано, что уже через 5 минут после загрузки щелочи скорость выделения водорода резко возрастает до 89 дм3/мин с квадратного метра свободной поверхности раствора. В этот момент происходит самопроизвольное повышение температуры с 18 до 110°С. Если аппарат принудительно не охлаждать, то реакционную массу выбрасывает из аппарата. В этом опыте выделяется 22,4 дм3 водорода на 1 моль бериллия, т.е. объем соответствует теоретически возможному (в пределах погрешности определения).
Согласно кривой 2 скорость выделения газа в первые 60 минут ˜1,3 дм3/м2 мин. Однако далее скорость реакции резко возрастает до 9 дм3/м2 мин. В этом опыте выделилось 9,6 дм3 газа на 1 моль бериллия. Таким образом, очевидно, что при проведении реакции 3 с недостатком NaNO3, последний исчерпывается раньше, чем успевает раствориться металлический бериллий, а поэтому дальнейшее взаимодействии со щелочью проходит по реакции 1, чем и объясняется всплеск выделения водорода.
При проведении опытов с добавлением NaNO3 в количестве, равном стехиометрически необходимому, наблюдались отдельные всплески выделения водорода.
Поэтому в дальнейшем для стабильности и безопасности процесса проведения реакции был взят избыток NaNO3 в количестве 120% от стехиометрически необходимого, что заведомо обеспечит спокойное течение реакции.
Кривая 3 показывает, что в случае избытка NaNO3 скорость выделения газа (аммиака) не превышает 1,3 дм3/м2 мин до полного растворения навески бериллия. В этом опыте выделилось 3,6 дм3 газообразного аммиака на 1 моль бериллия (теоретически же по реакции 3 должно выделиться 5,6 дм3).
Необходимо отметить, что раствор NaNO3 на металлический бериллий не действует. Кроме того, при 18°С и в присутствии NaNO3 щелочь с бериллием взаимодействует весьма медленно (для растворения навески в 3 г требуется несколько суток). Поэтому в опытах 2 и 3 аппарат нагревали до 85°С с целью ускорения процесса. При этой температуре полное растворения проходило за 4 ч.
Пример 2. Процесс растворения металлических бериллиевых отходов в присутствии соли азотнокислого калия проводили в условиях, аналогичных примеру 1. Происходило полное растворение при спокойном течении реакции с получением вместо водорода аммиака (уменьшение объема выделяющегося газа в 4 раза).
Таким образом, экспериментально доказано, что проведение реакции растворения отходов металлического бериллия и его сплавов в щелочном растворе в присутствии азотнокислых солей при соблюдении параметров:
- температура 85-110°С;
- концентрация NaOH - 300-г/дм3;
- количество NaNO3 - 120-150% от стехиометрически необходимого;
- продолжительность процесса - 4 часа имеет ряд преимуществ:
1. Значительно упрощается процесс проведения реакций растворения отходов металлического бериллия.
2. Обеспечивается пожаровзрывобезопасность процесса, что улучшает безопасность производства.
3. Устраняется вероятность выброса бериллия в окружающую среду.
Способ переработки металлических бериллиевых отходов, включающий их растворение в щелочном растворе с последующим выделением кристаллического гидроксида бериллия, отличающийся тем, что используют щелочной раствор с концентрацией 300 г/дм3 и растворение ведут при температуре 85-110°С в присутствии азотнокислых солей натрия или калия, взятых в количестве 120-150% от стехиометрически необходимого по реакции образования газообразного аммиака, при продолжительности процесса 4 ч.