Штамм дрожжей pichia pastoris ps106(phig), являющийся продуцентом иммунного интерферона человека, рекомбинантная плазмида phig и способ ее конструирования
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и касается штамма дрожжей Pichia pastoris PS106(pHIG) - продуцент иммунного интерферона человека, рекомбинантной плазмиде, которой трансформирован этот штамм, а также к способу конструирования такой плазмиды. Посредством представленного изобретения может быть получен рекомбинантный гамма-интерферон и может быть секретирован в культуральную среду в производственных масштабах. Преимущество изобретения заключается в разработке плазмиды, способной вырабатывать рекомбинантный гамма-интерферон для крупномасштабного производства. 3 н.п. ф-лы, 2 ил.
Реферат
Изобретение относится к биотехнологии, к генной инженерии, микробиологической промышленности и фармакологии и представляет собой дрожжевой штамм - продуцент иммунного интерферона человека, содержащий сконструированную in vitro плазмиду, которая обеспечивает синтез иммунного интерферона человека.
Иммунный интерферон, гамма-интерферон, относится к обширной группе эволюционно родственных белков, получивших название интерферонов. Образование гамма-интерферона происходит в Т-лимфоцитах и ЕК-клетках (естественных киллерах) под воздействием, соответственно, вирусов и опухолевых клеток. Гамма-интерферон активирует специфический клеточный иммунитет, стимулирует цитотоксичность макрофагов, повышает устойчивость организма к различным инфекциям. Использование интерферонов для лечения заболеваний различной этиологии имеет существенные преимущества по сравнению с традиционными антибиотиками и химиотерапевтическими препаратами за счет широкого спектра действия, обусловленного активацией иммунной системы, и из-за отсутствия побочных эффектов (Levin S., Hahn Т., Clin. Exp. Immunol., 1981, v.46, p.475-483). Кроме того, гамма-интерферон является противоопухолевым агентом, активирует антинеопластическую функцию макрофагов. Результаты первой фазы клинических испытаний показали перспективность использования иммунного интерферона при лейкемии (Ершов Ф.И. Система интерферона в норме и патологии, 1996).
Использование в качестве источника интерферонов донорской крови не дает нужных количеств препарата, а кроме того, несет опасность заражения гепатитом В, С и ВИЧ. Перспективным подходом для получения гамма-интерферона в значительных количествах является использование микроорганизмов в качестве продуцентов этого препарата. Существуют препараты рекомбинантного гамма-интерферона, полученные из бактерий Escherichia coli ("Имукин", Германия; "Мега-Д-гамма-интерферон", Германия-Ирландия; "Гаммаферон", Россия; "Ингарон", Россия; "Дельтаферон", Россия). Но Escherichia coli является условно патогенным микроорганизмом, и препараты гамма-интерферона, полученные из бактериальных клеток, могут содержать эндотоксины.
Все вышеизложенное свидетельствует о потребности в создании штаммов-продуцентов гамма-интерферона на основе других микроорганизмов. Применение непатогенных микроорганизмов, не содержащих токсических и пирогенных факторов, например дрожжей, в качестве продуцентов белков позволило бы использовать рекомбинантные белки в фармакологии.
Использование для гетерологичной экспрессии метилотрофных дрожжей Pichia pastoris представляет особый интерес. Гликопротеины, секретируемые дрожжами Pichia pastoris, не содержат маннозных остатков, связанных α1,3-связями и являющихся сильными антигенными детерминантами, что позволяет получать наряду с внутриклеточными аутентичные секреторные формы рекомбинантных белков (Montesino R. et al., Protein Expr. Purif., 1998, v.14, p.197-207).
Получение секреторного продуцента гамма-интерферона человека особенно актуально. Белок является гликопротеином и приобретает правильную конформацию только после присоединение углеводных остатков в двух потенциальных сайтах гликозилирования в процессе секреции (Rinderknecht E. et al., J. Biol. Chem., 1984, v.259, p.6790-6797). Накопление рекомбинантного белка в культуральной жидкости значительно упрощает процедуру его очистки.
В задачу, решаемую предложенными объектами изобретения, входит создание штамма дрожжей Pichia pastoris, синтезирующего гамма-интерферон человека и секретирующего его в культуральную среду, создание плазмиды, обеспечивающей синтез гамма-интерферона, которую можно было бы использовать в указанных дрожжах, а также разработка способа конструирования такой плазмиды.
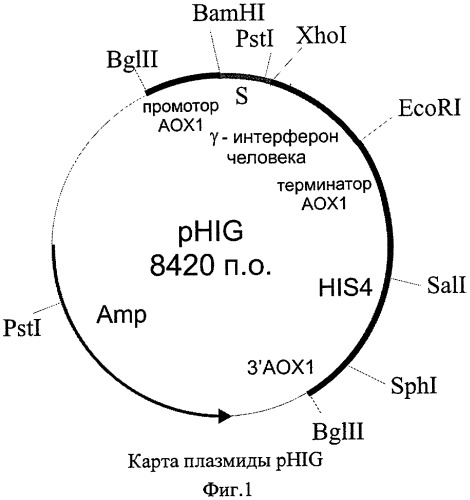
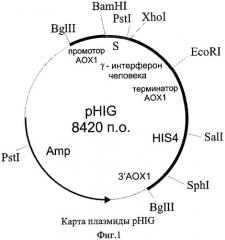
В качестве решения поставленной задачи создана рекомбинантная плазмида pHIG, обеспечивающая синтез гамма-интерферона человека трансформированными ею клетками дрожжей, имеющая размер 8,42 т.п.о., которая состоит из следующих элементов:
- фрагмента бифункционального бактериально-дрожжевого вектора рPIC9 размером 8,00 т.п.о., ограниченного сайтами рестрикции EcoRI-XhoI, включающего бактериальный ген устойчивости к ампициллину, бактериальную область инициации репликации, ген HIS4 дрожжей, фрагмент 5'-некодирующей области дрожжевого гена АОХ1 размером 0,95 т.п.о., содержащий область, обеспечивающую активацию транскрипции этого гена в присутствии метанола в качестве источника углерода в культуральной среде; фрагмент гена АОХ1 размером 0,33 т.п.о., содержащий область терминации транскрипции этого гена; фрагмент 3'-нетранслируемой области гена АОХ1 размером 0,76 т.п.о.; и препрообласть гена MFα дрожжей Saccharomyces cerevisiae размером 0,27 т.п.о., обеспечивающую секрецию рекомбинантного белка в культуральную среду;
- XhoI-EcoRI - фрагмента размером 0,42 т.п.о., содержащего кодирующую часть гена гамма-интерферона человека за исключением области, кодирующей сигнальный пептид,
содержащая уникальные сайты распознавания следующих рестриктаз: XhoI - 1,19 т.п.о.; EcoRI - 1,62 т.п.о.; Sall - 3,59 т.п.о.; Sph1 - 5,21 т.п.о.
Схема плазмиды pHIG с рестрикционной картой изображена на Фиг.1. Общий размер плазмиды pHIG - 8,42 т.п.о.
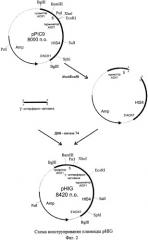
Для решения задачи также предлагается способ конструирования плазмиды pHIG, обеспечивающей синтез гамма-интерферона в клетках дрожжей. Согласно предложенному способу, осуществляют расщепление вектора рPIC9 ферментами рестрикции XhoI и EcoRI, расщепленный вектор рPIC9 лигируют с XhoI-EcoRI-фрагментом гена гамма-интерферона человека, затем полученной лигазной смесью трансформируют клетки Escherichia coli. и отбирают клоны, содержащие рекомбинантную плазмиду pHIG. Схема способа конструирования плазмиды pHIG приведена на Фиг.2.
Ген иммунного интерферона человека получают методом обратной ПЦР-реакции, матрицей для которой служит РНК, полученная из мононуклеаров периферической крови человека, индуцированных рекомбинантным интерлейкином-2 человека ("Ронколейкином"®). В качестве прямого праймера служит олигонуклеотид 5'-ccgctcgagaaaagacaggacccatatgtaaaag, содержащий сайт для рестриктазы XhoI. В качестве обратного праймера используют олигонуклеотид 5'-ggaattcttactgggatgctcttcgacctc, который содержит сайт для рестриктазы EcoRI. Синтезированный ген гамма-интерферона человека размером 0,42 т.п.о. выделяют при помощи электрофореза в 0,7% агарозном геле, обрабатывают рестриктазами XhoI и EcoRI и лигируют с плазмидой pPIC9 ("Invitrogen"), предварительно обработанной этими же рестриктазами.
Полученной лигазной смесью трансформируют клетки штамма DH5α Escherichia coli. (F'/endA1 hsdR17 (rk - mk +) supE44 thi-1 recA1 gyrA (Nalr) relA1 Δ (lacZYA-argF)U169 deoR (φ80dlacΔ(lacZ)M15), с помощью рестрикционного анализа отбирают трансформанты, содержащие плазмиду pHIG.
Плазмида pHIG получена на основе челночного бактериально-дрожжевого интегративного вектора рPIC9 (имеется в продаже ("Invitrogen")). В результате трансформации линеаризованной плазмидой и последующей гомологичной рекомбинации происходит встраивание экспрессионной кассеты в хромосому дрожжей Pichia pastoris, что обеспечивает стабильное поддержание клонированного гена гамма-интерферона. Преимуществом такой интегративной системы экспрессии является также отсутствие в геноме дрожжей интегрантов фрагментов бактериальной ДНК и генов устойчивости к антибиотикам, что предотвращает опасность горизонтального переноса этих генов. В состав плазмиды входит ген HIS4 дрожжей, что позволяет селективно отбирать трансформантов при использовании в качестве реципиентов штаммов дрожжей с мутациями в этом гене, а также препрообласть гена MFα дрожжей Saccharomyces cerevisiae, обеспечивающая секрецию рекомбинантного белка в культуральную среду.
Экспрессия гена гамма-интерферона человека в составе плазмиды pHIG находится под контролем промотора гена АОХ1, содержащего области, обеспечивающие активацию транскрипции в присутствии метанола в культуральной среде, а также область инициации транскрипции. Промотор гена АОХ1 относится к числу наиболее сильных дрожжевых промоторов. Уровень экспрессии генов, находящихся под контролем АОХ1 промотора, эффективно регулируется источниками углерода. Транскрипция гена АОХ1 полностью блокирована при выращивании дрожжей на среде с глюкозой, на среде с глицерином наблюдается только базальный уровень экспрессии гена. Использование метанола в качестве единственного источника углерода значительно усиливает экспрессию гена АОХ1 и, следовательно, генов, находящихся под контролем АОХ1 промотора. Это позволяет регулировать синтез гамма-интерферона человека в клетках дрожжей. Регулируемая экспрессия клонированного гена позволяет существенно снизить метаболическую нагрузку на клетку дрожжей.
В качестве продуцента гамма-интерферона предложен штамм PS106(pHIG). Штамм PS106(pHIG) получен при трансформации штамма дрожжей PS99 (his4 рер4::РНO85) плазмидой pHIG по изобретению. Штамм PS99 несет мутацию в гене HIS4, что позволяет селективно отбирать трансформантов, несущих плазмиду pHIG. Мутация в гене РЕР4 приводит к отсутствию активности протеаз А и В, а также карбоксипептидазы Y в клетках дрожжей, что сопровождается повышением стабильности гетерологичных рекомбинантных белков (Hisch H.H. et al. In: Walton E.F., Yarranton G.T., Eds., Molecular and Cell Biology of Yeast, 1989, p.134-200).
Штамм дрожжей Pichia pastoris PS106(pHIG) характеризуется следующими признаками.
Морфологические признаки.
Клетки округлой, слегка овальной формы, размером 5-10 мкм, часть клеток имеет на поверхности почки или соединена с дочерними клетками.
Культуральные признаки.
Клетки хорошо растут на полной органической среде YEPD - 2% пептона, 1% дрожжевого экстракта, 2% глюкозы или 1% глицерина.
Кроме того, клетки хорошо растут на минеральной среде SC: 1,34% Yeast Nitrogen Base ("Difco", США), а также на других синтетических средах для дрожжей, содержащих в качестве источника углерода глюкозу (2%) или глицерин (1%).
Клетки штамма отличаются слабым ростом на средах, содержащих в качестве источника углерода метанол (0,5%-1%).
При росте на твердых средах клетки образуют гладкие, круглые колонии с матовой поверхностью, светло-кремового цвета, край неровный.
При росте в жидких средах образуют интенсивную ровную суспензию. Культура имеет характерный запах метилотрофных дрожжей.
Физиолого-биохимические признаки.
Клетки растут в пределах от 4°С до 37°С. Оптимальной температурой выращивания является 30°С. При росте в аэробных условиях клетки незначительно закисляют среду.
Оптимум рН для роста составляет 4,5-6,5.
В качестве источника углерода клетки могут использовать многие простые соединения, такие как глюкоза, глицерин, метанол.
В качестве источника азота клетки могут использовать минеральные соли в аммонийной форме, аминокислоты, мочевину.
Клетки способны к аэробному и анаэробному росту.
Существенным признаком штамма является отсутствие потребности в гистидине.
Способ получения гена гамма-интерферона человека проиллюстрирован следующим примером.
ПРИМЕР 1.
Ген гамма-интерферона получают методом обратной полимеразной цепной реакции, используя в качестве матрицы иРНК, полученную из мононуклеаров периферической крови человека.
Мононуклеары получают при центрифугировании в градиенте плотности фиколла (d=1,077), наслаивая разведенную в два раза изотоническим раствором донорскую кровь (5 мл) на фиколл в пропорции 2:1. Центрифугируют 25 минут при 1500 об/мин и отбирают кольцо мононуклеаров, расположенное между слоями плазмы и фиколла. Дважды промывают клетки средой RPMI, содержащей L-глутамин, 10% сыворотку плодов коров и антибиотик (пенициллин и стрептомицин, по 100 ед./мл), и ресуспендируют в той же среде до концентрации около 2 млн/мл (Rubinstein P. et al., Blood Cells, 1994, v.20, p.587-600). Добавляют рекомбинантный интерлейкин-2 человека ("Ронколейкин"®) в количестве 1000 МЕ/мл суспензии и инкубируют 6 часов при 37°С и 5% CO2. Осаждают клетки центрифугированием (800 об/мин, 10 мин), дважды промывают изотоническим раствором, свободным от РНКаз, и ресуспендируют в 100 мкл раствора, содержащего 4 М гуанидин тиоционата и 0,2 М ацетата натрия (рН 4). Полученную смесь встряхивают на "Vortex" в течение 10 мин, добавляют 100 мкл смеси фенол:хлороформ:изоамиловый спирт в соотношении 25:24:1, центрифугируют 5 мин при 12000 об/мин, отбирают водную фазу и добавляют к ней равный объем изопропилового спирта. Для лучшего осаждения помещают смесь на -20°С на ночь. После центрифугирования (12000 об/мин, 5 мин) осадок промывают холодным 70% этанолом, подсушивают и растворяют в 20 мкл деионизованной воды, свободной от РНКаз.
Полученную РНК используют в качестве матрицы для синтеза гена гамма-интерферона человека при помощи обратной ПЦР с использованием Tth-полимеразы. Прямым праймером служит олигонуклеотид 5'-ccgctcgagaaaagacaggacccatatgtaaaag, содержащий сайт для рестриктазы XhoI. В качестве обратного праймера используют олигонуклеотид 5'-ggaattcttactgggatgctcttcgacctc, который содержит сайт для рестриктазы EcoRI. Проба для проведения ПЦР содержит 1 мкл матрицы (примерно 5 мкг), 30 рМ каждого праймера, 10 мкл 10-кратного раствора дезоксинуклеотидтрифосфатов (дНТФ), содержащего 1,25 мМ каждого дНТФ (дАТФ, дТТФ, дГТФ, дЦТФ), 10 мкл 10-кратного буфера (500 мМ NaCl, 500 мМ трис-HCl, рН 9,0, 100 мМ MgCl2), 5 ед. Tth-полимеразы. В пробу добавляется дистиллированная Н2О до конечного объема 50 мкл. Стадию обратной ПЦР проводят при 70°С в течение 3 мин, затем 50 мин при 42°С и 2 мин при 94°С.
Полученную кДНК гамма-интерферона человека используют как матрицу для амплификации этого гена при помощи ПЦР, которую проводят в следующем режиме: 30 с при 94°С, 30 с при 58°С и 30 с при 72°С. Повторяют этот цикл 45 раз, после чего инкубируют пробу при 72°С 5 мин. Синтезированный гамма-интерферон человека размером 0,42 т.п.о. выделяют из агарозного геля по методике, разработанной фирмой QIAGEN. Полоску геля с фрагментом ДНК помещают в пробирку и добавляют раствор QX1 (300 мкл на 100 мг геля). Пробу нагревают до 50°С, добавляют реактив QIAEX (10 мкл на 5 мкг ДНК) и инкубируют при 50°С в течение 10 минут, периодически перемешивая. Далее центрифугируют 30 секунд при 15000 об/мин, супернатант отбрасывают, осадок дважды экстрагируют растворами QX2 и QX3, удаляют супернатант центрифугированием при 15000 об/мин в течение 30 секунд. Осадок высушивают на воздухе, растворяют в 20 мкл буфера ТЕ, центрифугируют 30 секунд при 15000 об/мин, супернатант переносят в новую пробирку.
Способ получения плазмиды pHIG проиллюстрирован следующим примером.
ПРИМЕР 2.
Клетки бактерий Escherichia coli., содержащие плазмиду рPIC9, выращивают при 37°С в течение ночи в 1 л питательной среды LB (1% пептона, 0,5% дрожжевого экстракта, 1% хлористого натрия), содержащей ампициллин в концентрации 50 мг/л. Клетки собирают центрифугированием при 5000 об/мин в течение 10 минут при 4°С, суспендируют в 20 мл 25 мМ трис-хлоридного буфера (рН 8,0), содержащего 10 мМ ЭДТА и 50 мМ глюкозы, добавляют 30 мг лизоцима и инкубируют 10 минут при комнатной температуре. Далее добавляют 40 мл 0,2 М гидроокиси натрия, содержащей 1% додецилсульфата натрия, осторожно перемешивают и инкубируют в течение 10 минут при 4°С. Раствор нейтрализуют добавлением 30 мл 3 М ацетата натрия (рН 5,0) и выдерживают в течение 10 минут при 4°С. После этого центрифугируют при 14000 об/мин в течение 40 минут при 4°С. К супернатанту добавляют 0,6 объема изопропилового спирта, выдерживают 20 минут при комнатной температуре и центрифугируют при 14000 об/мин в течение 20 минут при 20°С. Полученный осадок промывают 70% этиловым спиртом, высушивают в вакууме и растворяют в 4 мл дистиллированной воды. Далее добавляют 4,2 г хлористого цезия и 0,36 мл раствора бромистого этидия (10 мг/мл). Полученный раствор выдерживают в течение 1 часа при 4°С, затем центрифугируют при 15000 об/мин в течение 15 минут. Супернатант центрифугируют при 70000 об/мин в течение 16 часов в центрифуге TL100 ("Beckman"). После центрифугирования отбирают полосу плазмидной ДНК (нижнюю из двух флюоресцирующих в ультрафиолетовом свете полос), дважды экстрагируют бромистый этидий равным объемом изоамилового спирта, разбавляют в два раза дистиллированной водой и осаждают плазмидную ДНК двумя объемами этилового спирта и 1/15 объема 3 М ацетата натрия (рН 5,0). Осадок собирают центрифугированием при 10000 об/мин в течение 10 минут, промывают 70% этиловым спиртом и растворяют в 0,5-1 мл буфера ТЕ (10 мМ трис-хлоридный буфер, рН 8,0, содержащий 1 мМ ЭДТА). Концентрацию плазмидной ДНК определяют по поглощению раствора при длине волны 260 нм. Чистоту препарата контролируют при помощи электрофореза в 0,7% агарозном геле в буфере ТВЕ (0,1 М трис-боратный буфер, рН 8,3, содержащий 1 мМ ЭДТА).
Гидролиз плазмиды рPIC9 рестриктазами XhoI и EcoRI проводят в 10 мМ трис-хлоридном буфере (рН 7,5), содержащем 50 мМ хлористого натрия, 10 мМ хлористого магния и 1 мМ дитиотреитола. К 5 мкг плазмидной ДНК в объеме 20 мкл добавляют по 5 ед. каждой рестриктазы, после чего пробу инкубируют в течение 25 часов при 37°С.
Выделение линеаризованной плазмидной ДНК из агарозного геля проводят по методике, использованной ранее для выделения гена гамма-интерферона человека. Гидролиз фрагмента ДНК, содержащего синтезированный ген гамма-интерферона человека, рестриктазами XhoI и EcoRI осуществляют в условиях, описанных для расщепления плазмиды рPIC9.
Для получения плазмиды pHIG проводят лигирование плазмиды рPIC9, гидролизованной рестриктазами XhoI и EcoRI, и XhoI/EcoRI фрагмента гена гамма-интерферона человека, синтезированного при помощи ПЦР. Для этого смешивают 0,5 мкг ДНК вектора и 0,1 мкг ДНК встройки в 10 мкл 70 мМ трис-хлоридного буфера (рН 7,6), содержащего 5 мМ дитиотреитола, 5 мМ хлористого магния, 1 мМ АТФ, добавляют 10 ед. ДНК-лигазы фага Т4 и инкубируют при 14°С в течение ночи.
Полученной лигазной смесью трансформируют клетки штамма DH5α Escherichia coli. (F'/endA1 hsdR17 (rk - mk +) supE44 thi-1 recA1 gyrA (Nalr) relA1 Δ (lacZYA-argF)U169 deoR (φ80dlacΔ(lacZ)M15). Для этого клетки Escherichia coli. выращивают в 100 мл среды LB при 37°С до достижения культурой густоты клеточной суспензии, соответствующей 0,4-0,6 ед. оптической плотности при длине волны 550 нм. Клеточную суспензию охлаждают в ледяной бане, центрифугируют при 5000 об/мин в течение 10 минут при 4°С. Клетки суспендируют в 100 мл 10 мМ хлористого натрия, собирают центрифугированием в тех же условиях. Далее клетки суспендируют в 50 мл 75 мМ хлористого кальция, выдерживают в ледяной бане в течение 40 минут, осаждают центрифугированием в тех же условиях и суспендируют в 1 мл 75 мМ хлористого кальция. К суспензии компетентных клеток добавляют глицерин до конечной концентрации 15%, разделяют на аликвоты и хранят при -70°С. Перед трансформацией суспензию компетентных клеток размораживают в ледяной бане, добавляют лигазную смесь и инкубируют в ледяной бане в течение 40 минут. Далее клетки подвергают действию теплового шока при 42°С в течение 2 минут, после чего инкубируют в 1,5 мл среды LB при 37°С в течение 1 часа. Клетки собирают центрифугированием при 5000 об/мин в течение 10 минут и высевают на чашки Петри со средой LB, содержащей 2% агара и 50 мг/л ампициллина. Чашки инкубируют при 37°С в течение 12-16 часов.
Из выросших отдельных клонов трансформантов выделяют плазмидную ДНК при помощи методики, использованной для получения плазмиды рPIC9, за исключением того, что клетки Escherichia coli. выращивают в 10 мл LB и, соответственно, объемы всех растворов уменьшают в 100 раз. Кроме того, вместо стадии центрифугирования в градиенте плотности хлористого цезия проводят обработку ДНК панкреатической РНКазой. Для этого нуклеиновые кислоты, осажденные изопропиловым спиртом, растворяют в 100 мкл буфера ТЕ, добавляют 10 мкл раствора РНКазы (1 мг/мл) и инкубируют 30 минут при 37°С.
Далее проводят гидролиз полученной плазмидной ДНК рестриктазами XhoI и EcoRI в условиях, описанных ранее для гидролиза плазмиды рPIC9. При рестрикции искомой плазмиды pHIG и последующем электрофорезе в 0,7% агарозном геле обнаруживаются фрагменты 8 и 0,42 т.п.о. Из выявленного таким образом клона препаративно выделяют плазмиду pHIG так же, как описано для плазмиды рPIC9, и гидролизуют рестриктазой BglII в 50 мМ трис-хлоридном буфере (рН 7,5), содержащем 100 мМ хлористого натрия, 10 мМ хлористого магния. BglII-фрагмент плазмиды pHIG размером 6,05 т.п.о. выделяют по описанной выше методике фирмы QIAGEN, исключая стадию нагревания, и используют его для трансформации клеток дрожжей, как описано в примере 3.
ПРИМЕР 3.
Для получения штамма дрожжей Pichia pastoris - продуцента гамма-интерферона человека, клетки дрожжей штамма PS99 трансформируют плазмидой pHIG.
Клетки дрожжей выращивают в 100 мл среды YEPD при 30°С до достижения культурой оптической плотности, соответствующей 2-4 ед. поглощения при длине волны 600 нм. Клетки дважды промывают стерильной водой, после чего суспендируют в 0,3 мл 100 мМ раствора ацетата лития и инкубируют при 30°С в течение 30 минут. К 50 мкл полученной суспензии клеток добавляют 0,1-1 мкг плазмидной ДНК, 50 мкг ДНК спермы лосося, предварительно денатурированной нагреванием (10 минут при 100°С), и 0,3 мл раствора 100 мМ ацетата лития, содержащего 40% полиэтиленгликоля 4000. Далее пробу инкубируют 30 минут при 30°С и 20 минут при 42°С, помещают на 15 секунд в ледяную баню и центрифугируют 10 секунд при 10000 об/мин. Клетки суспендируют в 1 мл стерильной воды и высевают на твердую среду SC. Клоны трансформантов вырастают через 2-3 суток. Выросшие клоны пересевают на чашки со средой SC, содержащей 2% глюкозу, отдельными колониями, затем перепечатывают на среду ММ (1,34% Yeast Nitrogen Base ("Difco", США), 0,5% метанола, 2% агара ("Difco", США)) для отбора трансформантов, отличающихся слабым ростом на среде с метанолом, что свидетельствует об интеграции чужеродного гена в локус AOXI (фенотип Met-).
Для анализа продукции гамма-интерферона человека клетками трансформантов фенотипа Met- их выращивают при 30°С в 100 мл жидкой среды BMGY (2% пептона, 1% дрожжевого экстракта, 1% глицерина, 10 мл 1 М калий-фосфатного буфера, рН 6,0, 1,34% Yeast Nitrogen Base ("Difco", США)) до стационарной фазы роста в течение 2 суток. Клетки собирают центрифугированием при 5000 об/мин в течение 10 минут, супернатант сливают и переносят всю биомассу в 100 мл жидкой среды BMMY (2% пептона, 1% дрожжевого экстракта, 0,5% метанола, 10 мл 1 М калий-фосфатного буфера, рН 6,0, 1,34% Yeast Nitrogen Base ("Difco", США)) для индукции экспрессии гамма-интерферона. Индукцию проводят при 30°С в течение 4 суток. По окончании индукции культуральную среду отделяют от клеточной биомассы центрифугированием при 5000 об/мин в течение 10 минут. В культуральной среде определяют содержание гамма-интерферона при помощи электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия и последующей гибридизации со специфическими антителами к гамма-интерферону человека. Разделение белков проводят в 15% полиакриламидном геле в стандартной системе буферов (электродный буфер: 25 мМ трис, 192 мМ глицин, 0,1% додецилсульфат натрия, рН 8,3; буфер для геля: 375 мМ трис-хлоридный буфер, рН 8,8). Параллельно проводят разделение белков контрольного штамма, выращенного в идентичных условиях. В качестве стандартов молекулярной массы используют лактатдегидрогеназу (35,0 кДа), эндонуклеазу рестрикции Bsp98I (25,0 кДа), β-лактоглобулин (18,4 кДа), лизоцим (14,4 кДа). По окончании электрофореза белки ренатурируют, выдерживая гели 15 минут в 10 мМ трис-хлоридном буфере (рН 7,5), содержащем 4 М мочевины, 20 мМ ЭДТА, и переносят на нитроцеллюлозную мембрану в 25 мМ трис-192 мМ глициновом буфере (рН 8,3), содержащем 20% метилового спирта, при 30-40 В, в течение 1,5 часов. Далее мембрану выдерживают в буфере TBST (10 мМ трис-хлоридный буфер (рН 8,0), содержащий 150 мМ хлористого натрия, 0,05% твин-20, 1% бычьего сывороточного альбумина) в течение 2 часов при 37°С. Затем помещают мембрану в тот же буфер, содержащий разведенные в 1000 раз мышиные поликлональные антитела к гамма-интерферону человека ("Протеиновый контур", Санкт-Петербург), и инкубируют 2 часа при 37°С. Далее трижды промывают мембрану буфером TBST и инкубируют 1 час при 37°С с разбавленным в 7000 раз конъюгатом видоспецифических антител к иммуноглобулинам мыши и пероксидазы хрена ("Протеиновый контур", Санкт-Петербург). После отмывки мембраны буфером PBST (58 мМ двузамещенного фосфата натрия, 17 мМ однозамещенного фосфата натрия, 68 мМ хлористого натрия, 0,1% твин-20) добавляют раствор субстратов для пероксидазы: 0,02% DAB (3,'3-диаминобензидин тетрагидрохлорид), 0,006% перекись водорода в 10 мМ трис-хлоридном буфере, рН 7,5. Параллельно окрашивают гели 0,15% раствором кумасси G250 в 25% изопропаноле и 10% уксусной кислоте и отмывают в 10% уксусной кислоте. При сравнении спектра белков двух штаммов у штамма PS106(pHIG) обнаруживают появление дополнительных белковых полос с молекулярными массами около 20 и 25 кДа, дающих четкую положительную реакцию с антителами к гамма-интерферону человека ("Протеиновый контур", Санкт-Петербург), что доказывает принадлежность секретируемых белков к гамма-интерферону человека. Присутствие двух белков, иммунологически родственных гамма-интерферону человека, может быть обусловлено разной степенью гликозилирования рекомбинантного белка.
Согласно полученным данным, клетки дрожжей штамма PS106(pHIG) синтезируют и секретируют около 15 мг гамма-интерферона человека на литр культуры дрожжей.
Суммируя вышесказанное можно заключить, что полученный штамм дрожжей Pichia pastoris PS106(pHIG) синтезирует гамма-интерферон человека и секретирует его в культуральную среду в количестве, достаточном для его очистки в лабораторном масштабе. В результате такой очистки могут быть получены препараты гибридного белка, полезные для исследования его биологических свойств и терапевтической ценности. Преимуществом данного продуцента по сравнению со штаммами-прототипами Escherichia coli. является безопасность получаемых рекомбинантных белков в отношении токсичности и пирогенности, высокий выход продукта, а также упрощенная процедура очистки, обусловленная секрецией рекомбинантного белка.
1. Рекомбинантная плазмида pHIG, обеспечивающая биосинтез гамма-интерферона человека, имеющая размер 8,42 т.п.о. и состоящая из следующих элементов:
фрагмента ДНК бифункционального бактериально-дрожжевого вектора рР1С9 размером 8 т.п.о., ограниченного сайтами рестрикции EcoRl-Xhol и включающего бактериальный ген устойчивости к ампициллину, бактериальную область инициации репликации, ген HIS4 дрожжей, фрагмент 5'-некодирующей области дрожжевого гена АОХ1 размером 0,95 т.п.о., содержащий область, обеспечивающую активацию транскрипции этого гена в присутствии метанола в качестве источника углерода в культуральной среде, фрагмент гена АОХ1 размером 0,33 т.п.о., содержащий область терминации транскрипции этого гена, фрагмент 3'-нетранслируемой области гена АОХ1, размером 0,76 т.п.о. и препрообласть гена MFα дрожжей Saccharomyces cerevisiae размером 0,27 т.п.о., обеспечивающую секрецию рекомбинантного белка в культуральную среду;
Xhol-EcoRl - фрагмента размером 0,42 т.п.о., содержащего кодирующую часть гена гамма-интерферона человека за исключением области, кодирующей сигнальный пептид.
2. Штамм дрожжей Pichia pastoris PS106(pHIG)- продуцент гамма-нтерферона человека, представляющий собой штамм Pichia pastoris PS99 (his4 рер4::РН085), трансформированный плазмидой pHIG по п.1.
3. Способ конструирования рекомбинантной плазмиды pHIG по п.1, при котором осуществляют расщепление вектора рР1С9 ферментами рестрикции Xho I и EcoRl, расщепленный вектор рР1С9 лигируют с Xhol-EcoRl - фрагментом гена гамма-интерферона человека, затем полученной лигазной смесью трансформируют клетки Escherichia coli. и отбирают клоны, содержащие рекомбинантную плазмиду pHIG.