Способ определения индивидуальной чувствительности к химиотерапии солидных опухолей человека
Иллюстрации
Показать всеИзобретение относится к области медицины и касается определения индивидуальной чувствительности к химиотерапии солидных опухолей человека. Сущность способа заключается в том, что в суспензию опухолевых клеток пациента добавляют ингибиторы активности АВС-транспортеров-верапамил и генистеин в двух разных концентрациях и азид натрия, инкубируют, затем добавляют доксорубицин в двух разных концентрациях, снова инкубируют, затем добавляют формалин и определяют значения флюоресценции в каждой пробе. Рассчитывают относительное изменение внутриклеточной флюоресценции доксорубицина после воздействия каждого из используемых ингибиторов в исследуемых концентрациях при каждой исследуемой концентрации доксорубицина. Исходя из полученных данных делают заключение об индивидуальной чувствительности опухоли к химиотерапии МЛУ-цитостатиками. Использование способа позволяет повысить точность определения, провести исследования в короткие сроки. 10 табл., 2 з.п. ф-лы.
Реферат
Изобретение относится к области фармацевтической химии, а именно к определению чувствительности к химиотерапии солидных опухолей человека, и может быть использовано в онкологической практике для подбора адекватной терапии солидных опухолей.
Важнейшей проблемой современной химиотерапии злокачественных новообразований является разработка методов индивидуального прогнозирования течения заболевания и чувствительности к терапии, в частности, на основании данных об экспрессии в опухолях разных видов лекарственной устойчивости. Множественная лекарственная устойчивость опухолей - это врожденная или приобретенная невосприимчивость клеток к противоопухолевым препаратам, различным по структуре и механизму действия (так называемым МЛУ-цитостатикам). К МЛУ-цитостатикам относят антрациклины, винкаалкалоиды, таксаны, подофилотоксины, камптотецины, актиномицин Д, митоксантрон, амскарин, топотекан и иринотекан, митрамицини, митомицин С [1]. Один из наиболее часто встречаемых механизмов лекарственной устойчивости к цитостатикам - это выброс входящих в клетку препаратов энергозависимыми насосами семейства АВС-транспортеров. К семейству АВС-транспортеров относят Pgp (Р-glycoprotein), MRP (multidrug resistance protein), BCRP (breast cancer resistance protein), но только Pgp и MRP являются признанными маркерами лекарственной устойчивости [2,3]. За исключением таксанов, обладающих сродством только к Pgp [4], остальные МЛУ-цитостатики являются универсальными субстратами для всех АВС-транспортеров.
В клетке АВС-транспортеры образуют два защитных барьера от цитостатиков: первый барьер - АВС-транспортеры, располагающиеся на плазматической мембране и определяющие сколько препарата попадет извне в клетку, то есть регулирующие тотальную внутриклеточную концентрацию цитостатиков. Второй барьер составляют обратные транспортеры, защищающие ядро, в котором локализованы мишени большинства цитостатиков, от их проникновения из цитоплазмы. В дальнейшем в зависимости от выполняемой функции мы будем называть транспортеры первого барьера как плазматические, второго - ядерные.
Экспрессию АВС-транспортеров, на основании которой прогнозируют чувствительность к химиотерапии и агрессивность течения некоторых злокачественных новообразований, в частности лейкозов, определяют с помощью метода проточной цитофлюориметрии и методами обратной полимеразной цепной реакции и иммуногистохимии. При этом именно оценка функциональной активности АВС-транспортеров методом проточной цитофлюориметрии позволяет с большей вероятностью протезировать эффективность противоопухолевой химиотерапии и течение лейкозов [5].
В случае лейкозов используется метод цитометрии в потоке для определения индивидуальной чувствительности к химиотерапии путем выявления функциональной активности АВС-транспортеров [6]. Функциональную активность транспортных белков оценивают по накоплению клетками субстрата АВС-транспортеров после воздействия специфических ингибиторов их активности (верапамила и генистеина) в сравнении с контролем. Используя ингибиторы в одной концентрации при одной концентрации субстрата, невозможно дифференцировать активность ядерных и плазматических транспортных белков и охарактеризовать выраженность экспрессии транспортной системы, что не позволяет с достаточной степенью точности определить индивидуальную чувствительность лейкозов к химиотерапии. Кроме того, проведение оценки функциональной активности АВС-транспортеров методом проточной цитофлюориметрии ограничено необходимостью работы с клеточными суспензиями. Применение даже самых "мягких" методов получения суспензии клеток из плотной ткани с использованием протеолитеческих ферментов приводит к неконтролируемому повреждению плазматической мембраны клетки, а следовательно, к искажению результатов тестирования функциональной активности транспортных белков и, в конечном итоге, к неадекватному определению чувствительности клеток к цитостатикам. Отсутствие адекватного способа приготовления клеточной суспензии из плотной ткани делают невозможным использование существующего способа определения индивидуальной чувствительности к химиотерапии с помощью метода проточной цитофлюорметрии в случае солидных опухолей.
Известен способ определения индивидуальной чувствительности к химиотерапии солидных опухолей методом обратной полимеразной цепной реакции, который выявляет строго количественно активность генов транспортных белков на уровне синтеза РНК [7]. К существенным недостаткам этого метода относится то, что он выявляет активность генов АВС-транспортеров на уровне синтеза РНК, то есть не позволяет получить информацию о наличии в клетке транспортного белка, а тем более - о его функциональной активности. Последнее является определяющим в адекватной диагностике фенотипа множественной лекарственной устойчивости, а следовательно, в прогнозе чувствительности опухоли к химиотерапии. Кроме того, адекватно определять чувствительность к химиотерапии рассматриваемым способом не позволяет отсутствие информации об активности ядерных и плазматических транспортных белков, а также об активности транспортной системы в целом. К недостаткам метода относятся также необходимость использования дорогостоящих реактивов. Таким образом, метод обратной полимеразной цепной реакции неадекватен для определения индивидуальной чувствительности к химиотерапии солидных опухолей.
Способ иммуногистохимии, суть которого заключается в выявлении присутствующего в клетке белка с помощью моноклональных антител при окрашивании гистологических срезов, является еще одним методом определения индивидуальной чувствительности к химиотерапии солидных опухолей [8]. Иммуногистохимия, как микроскопический метод, идентифицирующий в клетке белок, позволяет дифференцировать экспрессию АВС-транспортеров именно в опухолевых клетках, а также охарактеризовывать внутриклеточное распределение транспортных белков. Присутствие транспортных белков в опухоли оценивается визуально по положительной реакции окрашенных срезов ткани, то есть рассматриваемый способ оценки экспрессии АВС-транспортеров является качественным, то есть субъективным. Однако помимо субъективной ошибки присутствует и объективная ошибка, связанная с отсутствием высокоспецифичных антител к исследуемым транспортным белкам. К упомянутым недостаткам необходимо добавить следующее, имеющее принципиальное значение для адекватного определения чувствительности к химиотерапии. Метод иммуногистохимии выявляет присутствие в клетке белка, но не его функциональную активность, что не позволяет получить информацию об экспрессии реально функционирующего белка, и, в конечном итоге, адекватно определить чувствительность к химиотерапии. Невозможность выявления активности транспортной системы в целом иммуногистохимическим методом также не позволяет адекватно определять чувствительность к химиотерапии. И, наконец, оценка экспрессии АВС-транспортеров иммуногистохимическим методом включает в себя использование дорогостоящих реактивов и большие временные затраты, связанные с приготовлением гистологических препаратов. Таким образом, метод иммуногистохимии неадекватен для определения индивидуальной чувствительности к химиотерапии солидных опухолей.
Результатом описанных недостатков является то, что применение методов обратной полимерзаной цепной реакции и иммуногистохимии не позволяет выявить взаимосвязь между экспрессией АВС-транспортеров в солидных опухолях и чувствительностью к химиотерапии и агрессивностью течения заболевания [9, 10]. Такая противоречивость результатов оценки прогностической значимости экспрессии АВС-транспортеров в солидных опухолях способствовала поиску новых подходов к определению их экспрессии в опухолевых клетках.
Ввиду неадекватности методов обратной полимеразной цепной реакции и иммуногистохимии для прогнозирования эффективности химиотерапии и отсутствия адекватной методики определения функциональной активности АВС-транспортеров в солидных опухолях человека задачей данного изобретения является создание способа определения индивидуальной чувствительности к химиотерапии солидных опухолей человека, лишенного вышеуказанных недостатков и позволяющего с высокой степенью точности определять индивидуальную чувствительность к химиотерапии солидных опухолей, что позволяет проводить адекватную терапию.
Решение поставленной задачи достигается тем, что предложен способ определения индивидуальной чувствительности к химиотерапии, заключающийся в том, что готовят суспензию опухолевых клеток из образца опухолевой ткани, помещают в пробирки, добавляют в опытные пробирки ингибиторы верапамил в конечной концентрации 3,3·10-4 и 1,7·10-5 M, генистеин в конечной концентрации 3,2·10-5 и 1,6·10-6 М, и азид натрия, в конечной концентрации 5·10-3 М, инкубируют 20 мин при 37°С, затем во все пробирки добавляют доксорубицин, причем в одну половину пробирок добавляют доксорубицин в конечной концентрации 7,7·10-5 М, а во вторую половину пробирок - в конечной концентрации 7,7·10-6 М, снова инкубируют в течение 5 мин при 37°С, а затем во все пробирки добавляют формалин в конечной концентрации 10%, пробы анализируют на проточном цитофлюориметре при λ=576 нм со скоростью 500 клеток/с при значении шторки 100, определяют значение средней геометрической внутриклеточной флюоресценции для каждой пробы и индивидуальную чувствительность к химиотерапии солидных опухолей определяют по общей формуле:
KC-inh X=GmeanC-inh X/GmeanC,
где KC-inh X - относительное изменение средней геометрической внутриклеточной флюоресценции доксорубицина после воздействия одного из используемых ингибиторов в концентрации Х при концентрации доксорубицина С;
GmeanC-inh X - средняя геометрическая флюоресценция популяции клеток после воздействия одного из используемых ингибиторов в концентрации Х при концентрации доксорубицина С;
GMeanC - средняя геометрическая флюоресценция популяции клеток в контрольной пробе при концентрации доксорубицина С.
Концентрация доксорубицина С:
С1 - концентрация доксорубицина 7,7·10-5 М
С2 - концентрация доксорубицина 7,7·10-6 М
Ингибитор активности АВС-транспортеров Inh X:
Inh1.1 - верапамил в концентрации 3,3·10-4 М
Inh1.2 - верапамил в концентрации 1,7·10-5 М
Inh2.1 - генистеин в концентрации 3,2·10-5 М
Inh2.2 - генистеин в концентрации 1,6·10-6M
Inh3 - азид натрия и концентрации 5·10-3 М
Для определения индивидуальной чувствительности к химиотерапии солидных опухолей человека используют следующие критерии:
заключение о чувствительности опухоли к химиотерапии МЛУ-цитостатиками делают при значениях
1) Кc1,c2-inh1.1,1.2,2.1,2.2,3=1;
или
2) Kc1-inh1.1,1.2,2.1,2.2,3=1;
если хотя бы одно из Kc2-inh1.1, Kc2-inh1.2, Kc2-inh2.1, Kc2-inh2.2≠1 и Kc2-inh3≠1;
или
3) Kc1-inh1.1,1.2,2.1,2.2,3=1; Kc2-inh1.1,1.2,2.1,2.2=1 и Кc2-inh3≠1,
заключение о нечувствительности опухоли к терапии МЛУ-цитостатиками, кроме таксанов, делают при значениях
Kc1,c2-inh 1.1,1.2=1 и
1) если хотя бы одно из Kc1,c2-inh2.1, Kc1,c2-inh2.2≠1 и Kc1,c2-inh3≠1;
или
2) Kc1,c2-inh2.1,2.2=1 и Kc1,c2-inh3≠1,
заключение о чувствительности опухоли к терапии высокими дозами МЛУ-цитостатиков делают
если значения Kc1,c2-inh1.1, Kc1,c2-inh1.2>1 и
1) Kc1,c2-inh2.1,2.2=1 и Kc1,c2-inh3>1;
или
2) если значения Kc1,c2-inh2.1, Kc1,c2-inh2.2>1 И Kc1,c2-inh3>1,
заключение о нечувствительности опухоли к терапии МЛУ-цитостатиками делают
а) если хотя бы одно из значений Kc1,c2-inh1.1, Kc1,c2-inh1.2<1 и
1) Kc1,c2-inh1.2.2=1 и Кс1,c2-inh3<1;
или
2) если хотя бы одно из Kc1,c2-inh2.1, Kc1,c2-inh2.2<1 и Kc1,c2-inh3<1;
б) если значения Kc1,c2-inh1.1 и Kc1,c2-inh1.2>1 и
значения Kc1,c2-inh2.1, Kc1,c2-inh2.2<1 и Kc1,c2-inh3<1.
Технический результат при использовании изобретения заключается в том, что заявленный способ позволяет полно, с высокой степенью точности (80%) определять индивидуальную чувствительность опухоли к химиотерапии, а также несложен для технического выполнения. Определение функциональной активности АВС-транспортеров с использованием заявленного способа не включает в себя использование дорогостоящих реактивов, как в случае метода обратной полимеразной цепной реакции и иммуногистохимии. Определение индивидуальной чувствительности к химиотерапии заявленным способом занимает меньшее время, чем в случае иммуногистохимии. Временные затраты при использовании заявленного способа для 10 образцов составляют не более 4 часов, в то же время для метода иммуногистохимии вся процедура занимает больше суток. Таким образом, высокая точность, надежность, быстрота и дешевизна делают пригодным разработанный способ для рутинного использования в клинической практике. Основным достоинством заявленного способа является получение информации о функциональной активности АВС-транспортеров и всей транспортной системы в целом, что является необходимым условием для адекватного определения чувствительности опухоли к химиотерапии, а следовательно, для выбора и проведения адекватного лечения.
В качестве флюоресцентного зонда, по накоплению которого клетками судят о функциональной активности АВС-транспортеров, выбран доксорубицин. Этот выбор обусловлен следующими свойствами препарата. Во-первых, доксорубицин является субстратом всех известных к настоящему времени АВС-транспортеров. Во-вторых, антибиотики антрациклинового ряда, к которым относится доксорубицин, входят в группу противоопухолевых препаратов, развитие множественной лекарственной устойчивости к которым связано с активацией функции АВС-транспортеров, и соответственно по накоплению клетками доксорубицина судят об устойчивости ко всем МЛУ-цитостатикам.
Оценку функциональной активности АВС-транспортеров проводят, сравнивая количество накопленного клетками доксорубицина после воздействия ингибитора активности АВС-транспортера с контролем. Если в опухоли присутствуют АВС-транспортеры, то внутриклеточное содержание доксорубицина увеличивается. В качестве ингибиторов активности АВС-транспортеров используют специфические ингибиторы (верапамил - ингибитор активности Pgp, генистеин - ингибитор активности MRP) и азид натрия - блокатор транспортной системы в целом. Введение в панель ингибиторов азида натрия с одной стороны позволяет контролировать достоверность выявляемых ответных реакций на воздействие специфических ингибиторов (верапамила и генистеина), а с другой - определять экспрессию функционально активных АВС-транспортеров, отличных от Pgp и MRP, что дает возможность адекватно оценивать чувствительность солидных опухолей к химиотерапии. Использование ингибиторов активности АВС-транспортеров в двух концентрациях при двух концентрациях доксорубицина позволяет дифференцировать активность ядерных и плазматических транспортных белков и охарактеризовать выраженность экспрессии транспортной системы в целом, что повышает точность определения индивидуальной чувствительности к химиотерапии.
Сущность заявленного способа заключается в следующем.
Преинкубируют операционный материал опухоли в течение 40 мин в растворе Хенкса с глюкозой при 37°С для стимуляции заингибированной активности АВС-транспортеров, после чего раствор отбрасывают, а опухолевый образец разрезают при помощи скальпеля на кусочки размером 2×2×2 мм.
Суспензию опухолевых клеток получают путем механического встряхивания (достаточно 5-6 встряхиваний) 10 кусочков опухоли, взятых из ее разных участков, в 5 мл раствора Хенкса с глюкозой. Суспензию опухолевых клеток фильтруют через марлевый фильтр, осадок отбрасывают.
Раскапывают по 350 мкл суспензии опухолевых клеток в 13 пробирок. 1-ая пробирка является контрольной, по которой определяют автофлюоресценцию клеток и в нее добавляют только формалин. 2-ая и 8-ая пробирка являются контролем, по которому судят о том, как изменилось внутриклеточное накопление доксорубицина в результате воздействия ингибиторов, и в нее добавляют доксорубицин и формалин.
После раскапывания суспензии клеток в пробирки 3, 4, 5, 6, 7, 9, 10, 11, 12, 13 добавляют ингибиторы активности АВС-транспортеров: верапамил в конечной концентрации 3,3·10-4 и 1,7·10-5, генистеин в конечной концентрации 3,2·10-5 и 1,6·10-6 М, азид натрия в конечной концентрации 5·10-3 М; затем инкубируют в течение 20 мин при 37°С.
Со 2-ой по 7-ую пробирки добавляют доксорубицин в конечной концентрации 7,7·10-5 М; с 8-ой по 13-ую добавляют доксорубицин в конечной концентрации 7,7·10-6 М; после 5 мин инкубации при 37°С клетки фиксируют формалином в конечной концентрации 10%.
Далее пробы анализируют на проточном цитофлюориметре при λ=576, при значении шторки 100, со скоростью сбора клеток 500 клеток/с. Число анализируемых событий не менее 10 тысяч.
Коэффициент, используемый при определении чувствительности к химиотерапии солидных опухолей:
KС-inh X=GmeanC-inh X/GmeanC, где
KC-inh X - относительное изменение средней геометрической внутриклеточной флюоресценции доксорубицина после воздействия одного из используемых ингибиторов в концентрации Х при концентрации доксорубицина С;
GmeanC-inh X - средняя геометрическая флюоресценция популяции клеток после воздействия одного из используемых ингибиторов в концентрации Х при концентрации доксорубицина С;
GMeanC - средняя геометрическая флюоресценция популяции клеток в контрольной пробе при концентрации доксорубицина С.
Концентрация доксорубицина С может принимать следующие значения:
С1 - концентрация доксорубицина 7,7·10-5 М
С2 - концентрация доксорубицина 7,7·10-6 М
Ингибитор активности АВС-транспортеров Inh X может принимать следующие значения:
Inh1.1 - верапамил в концентрации 3,3·10-4 М
Inh1.2 - верапамил в концентрации 1,7·10-5 М
Inh2.1 - генистеин в концентрации 3,2·10-5 М
Inh2.2 - генистеин в концентрации 1,16·10-6 M
Inh3 - азид натрия в концентрации 5·10-3 M
Как видно из формулы, К может принимать значение меньшее, большее и равное единице. Изменение внутриклеточной флюоресценции в 1,3 и более раз (К≤0,8 и К≥1,3) означает присутствие в опухолевых клетках функционально активных АВС-транспортеров.
Ниже приведены варианты KС-inh X для каждой из проб, клетки которой инкубируются с ингибитором, а именно:
проба №3: Kc1-inh1.1=Gmeanc1-inh1.1/GMeanc1
проба №4: Kc1-inh1.2=Gmeanc1-inh1.2/GMeanc1
проба №5: Kc1-inh2.1=Gmeanc1-inh2.1/GMeanc1
проба №6: Kc1-inh2.2=Gmeanc1-inh2.2/GMeanc1
проба №7: Kc1-inh3=Gmeanc1-inh3/GMeanc1,
где GMeanc1 соответствует флюоресценции клеток в контрольной пробе №2;
проба №9: Kc2-inh1.1=Gmeanc2-inh1.1/GMeanc1
проба №10: Kc2-inh1.2=Gmeanc2-inh1.2/GMeanc2
проба №11: Kc2-inh2.1=Gmeanc2-inh2.1/GMeanc2
проба №12: Kc2-inh2.2=Gmeanc2-inh2.2/GMeanc2
проба №13: Kc2-inh3=Gmeanc2-inh3/GMeanc2
где GMeanc2 соответствует флюоресценции клеток в контрольной пробе №8.
Способ иллюстрируется следующими примерами.
Пример 1
А.Р.Ф. и/б 02/11499
Диагноз: немелкоклеточный рак легкого
Операционный материал опухоли преинкубируют в течение 40 мин в растворе Хенкса с глюкозой при 37°С, после чего раствор отбрасывают, а опухолевый образец разрезают при помощи скальпеля на кусочки размером 2×2×2 мм. Суспензию опухолевых клеток получают путем механического встряхивания (достаточно 5-6 встряхиваний) 10 кусочков опухоли, взятых из ее разных участков, в 5 мл раствора Хенкса с глюкозой. Суспензию опухолевых клеток фильтруют через марлевый фильтр, осадок отбрасывают. Раскапывают по 350 мкл суспензии опухолевых клеток в 13 пробирок. 1-ая пробирка является контрольной и в нее формалин не добавляют. 2-ая и 8-ая пробирка являются контролем внутриклеточного накопления доксорубицина в результате воздействия ингибиторов, и в нее добавляют доксорубицин и формалин. После раскапывания суспензии клеток в пробирки, кроме 3, 4, 5, 6, 7, 9, 10, 11, 12, 13 добавляют ингибиторы активности АВС-транспортеров: верапамил в конечной концентрации 3,3·10-4 и 1,7·10-5 М, генистеин в конечной концентрации 3,2·10-5 и 1,6·10-6 М, азид натрия в конечной концентрации 5·10-3 М: затем инкубируют в течение 20 мин при 37°С. Со 2-ой по 7-ую пробирки добавляют доксорубицин в конечной концентрации 7,7·10-5 М; с 8-ой по 13-ую добавляют доксорубицин в конечной концентрации 7,7·10-6 M; после 5 мин инкубации при 37°С клетки фиксируют формалином в конечной концентрации 10%. Далее пробы анализируют на проточном цитофлюориметре при λ=576, при значении шторки 100, со скоростью сбора клеток 500 клеток/с. Число анализируемых событий составляет не менее 10 тысяч.
В результате анализа проб на проточном цитофлюориметре были получены следующие данные о средней внутриклеточной флюоресценции доксорубицина в присутствии и отсутствии ингибиторов:
Исходя из полученных данных по приведенным ниже формулам были рассчитаны коэффициенты, по которым проводят определение чувствительности к химиотерапии солидной опухоли данного больного.
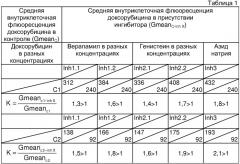
В таблице 1, приведенной ниже, сведены первичные данные о средней геометрической внутриклеточной флюоресценции доксорубицина в присутствии и отсутствии ингибиторов активности АВС-транспортеров и коэффициенты, рассчитанные исходя из них.
Как видно из таблицы 1, все значения коэффициента К для данного больного имеют значения большие 1, К>1. Верапамил и генистеин в обеих концентрациях вызывает увеличение внутриклеточной флюоресценции доксорубицина (К>1), из чего следует присутствие в опухолевых клетках активного плазматического транспортного белка Pgp и MRP. Доступность ядра для МЛУ-цитостатиков в данном случае высокая, так как в опухолевых клетках активны только плазматические транспортеры. Ответная реакция на воздействие ингибиторов активности АВС-транспортеров выявляется при обеих концентрациях доксорубицина С1 и С2 (К>1), что означает высокий уровень функциональной активности Pgp и MRP. Правильность проведенной оценки подтверждает ответная реакция на азид натрия (К>1).
Таким образом, по результатам оценки в операционном материале опухоли функциональной активности АВС-транспортеров, экспрессия которых определяет множественную лекарственную устойчивость, установлен следующий фенотип множественной лекарственной устойчивости - Pgp + MRP+, который характеризуется высоким уровнем функциональной активности транспортных белков и высокой доступностью ядра для МЛУ-цитостатиков. Солидная опухоль больного чувствительна к высоким дозам МЛУ-цитостатиков, так как в отсутствии ядерных АВС-транспортеров ядерные мишени для МЛУ-цитостатиков доступны для высоких доз цитостатиков, способных блокировать функциональную активность плазматических транспортеров. Методом выбора является высокодозная терапия МЛУ-цитостатиками.
Пример 2
В.А.С. и/б 02/11677
Диагноз: рак молочной железы
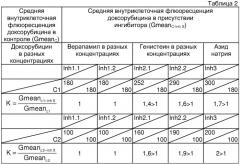
Определение чувствительности опухоли к химиотерапии и расчет коэффициентов проводили аналогично примеру 1. Для данного больного получены следующие показатели чувствительности к химиотерапии. Результаты представлены в таблице 2.
Как следует из данных таблицы 2, верапамил в обеих концентрациях не изменяет внутриклеточную флюоресценцию доксорубицина (К=1), из чего следует, что в опухоли транспортный белок Pgp не экспрессирован. Генистеин в обеих концентрациях вызывает увеличение внутриклеточной флюоресценции доксорубицина (К>1), что означает присутствие в клетках плазматического MRP. Функциональная активность MRP в опухоли высока, так как она выявляется при обеих концентрациях доксорубицина С1 и С2 (К>1). Правильность проведенной оценки подтверждает ответная реакция на азид натрия (К>1).
Таким образом, по результатам оценки в операционном материале опухоли функциональной активности АВС-транспортеров, экспрессия которых определяет множественную лекарственную устойчивость, установлен следующий фенотип множественной лекарственной устойчивости - Pgp - MRP+, который характеризуется высоким уровнем функциональной активности плазматического MRP. Опухоль не чувствительна к терапии МЛУ-цитостатиками, кроме таксанов, так как последние являются субстратами только Pgp, функциональная активность которого в опухоли не выявлена.
Пример 3
Р.И.Г. и/б 02/11451
Диагноз: рак желудка
Определение чувствительности опухоли к химиотерапии и расчет коэффициентов проводили аналогично примеру 1. Для данного больного получены следующие показатели чувствительности к химиотерапии. Результаты представлены в таблице 3.
Как следует из данных таблицы 3, верапамил в обеих концентрациях вызывает увеличение внутриклеточной флюоресценции доксорубицина (К>1), из чего следует присутствие в опухолевых клетках активного плазматического транспортного белка Pgp. Генистеин в обеих концентрациях вызывает уменьшение внутриклеточной флюоресценции доксорубицина (К<1), что означает экспрессию ядерного транспортного белка MRP, благодаря функциональной активности которого доступность ядра для цитостатиков низкая. Активность АВС-транспортеров (Pgp и MRP) в опухоли высокая, так как она выявляется при обеих концентрациях доксорубицина С1 и С2. Правильность проведенной оценки подтверждает ответная реакция на азид натрия (К<1).
Таким образом, по результатам оценки в операционном материале опухоли функциональной активности АВС-транспортеров, экспрессия которых определяет множественную лекарственную устойчивость, установлен следующий фенотип множественной лекарственной устойчивости - Pgp + MRP+, который характеризуется низкой доступностью ядра для цитостатиков и высоким уровнем функциональной активности Pgp и MRP. В данном случае солидная опухоль нечувствительна ко всем МЛУ-цитостатиком. Препаратом выбора являются цитостатики, не относящиеся к группе МЛУ-цитостатиков, так как проникновению последних в ядро и взаимодействию с ядерными мишенями препятствует активность ядерных транспортеров.
Пример 4
П.Т.Н. и/б 02/12347
Диагноз: рак молочной железы
Определение чувствительности опухоли к химиотерапии и расчет коэффициентов проводили аналогично примеру 1. Для данного больного получены следующие показатели чувствительности к химиотерапии. Результаты представлены в таблице 4.
Как видно из данных таблицы 4, верапамил и генистеин в обеих концентрациях вызывает увеличение внутриклеточной флюоресценции доксорубицина (К>1) только при
концентрации доксорубицина C2, из чего следует присутствие в опухолевых клетках конститутивного уровня экспрессии плазматических транспортных белков Pgp и MRP. Такого уровня функциональной активности АВС-транспортеров не достаточно для проявления опухолевыми клетками устойчивости к МЛУ-цитостатикам. Правильность проведенной оценки подтверждает ответная реакция на азид натрия (К>1) только при концентрации доксорубицина C2.
По результатам оценки в операционном материале опухоли функциональной активности АВС-транспортеров, экспрессия которых определяет множественную лекарственную устойчивость, не выявлен фенотип множественной лекарственной устойчивости: Pgp - MRP -. Солидная опухоль в данном случае чувствительна к МЛУ-цитостатикам, и больному рекомендована терапия МЛУ-цитостатиками.
Пример 5
С.А.Р. и/б 02/97957
Диагноз: немелкоклеточный рак легкого
Определение чувствительности опухоли к химиотерапии и расчет коэффициентов проводили аналогично примеру 1. Для данного больного получены следующие показатели чувствительности к химиотерапии. Результаты представлены в таблице 5.
Как видно из таблицы 5, верапамил в обеих концентрациях вызывает уменьшение внутриклеточной флюооресценции доксорубицина (К<1), что означает экспрессию ядерного транспортного белка Pgp, благодаря функциональной активности которого доступность ядра для цитостатиков низкая. Генистеин в обеих концентрациях не изменяет внутриклеточную флюоресценцию доксорубицина (К=1), Активность Pgp в опухоли высокая, так как она выявляется при обеих концентрациях доксорубицина С1 и С2 (К<1). Правильность проведенной оценки подтверждает ответная реакция на азид натрия (К<1).
Таким образом, по результатам оценки в операционном материале опухоли функциональной активности АВС-транспортеров, экспрессия которых определяет множественную лекарственную устойчивость, установлен следующий фенотип множественной лекарственной устойчивости - Pgp + MRP -, который характеризуется низкой доступностью ядра для цитостатиков и высоким уровнем функциональной активности Pgp. В типом случае солидная опухоль нечувствительна ко всем МЛУ-цитостатикам. Препаратом выбора являются цитостатики, не относящиеся к группе МЛУ-цитостатиков, так как проникновению последних в ядро и взаимодействию с ядерными мишенями препятствует активность ядерных транспортеров.
Пример 6
С.Н.В. и/б 02/16988
Диагноз: рак желудка
Определение чувствительности опухоли к химиотерапии и расчет коэффициентов проводили аналогично примеру 1. Для данного больного получены следующие показатели чувствительности к химиотерапии. Результаты представлены в таблице 6.
Как следует из данных таблицы 6, верапамил в одной из концентраций вызывает уменьшение внутриклеточной флюоресценции доксорубицина (К<1), из чего следует присутствие в опухолевых клетках ядерного транспортного белка Pgp, активность которого снижает доступность ядра для цитостатиков. Генистеин в обеих концентрациях вызывает уменьшение внутриклеточной флюоресценции доксорубицина (К<1), что означает экспрессию ядерного транспортного белка MRP. Активность АВС-транспортеров (Pgp и MRP) в опухоли высокая, так как она выявляется при обеих концентрациях доксорубицина C1 u С2 (К<1). Правильность проведенной оценки подтверждает ответная реакция на азид натрия (К<1).
Таким образом, по результатам оценки в операционном материале опухоли функциональной активности АВС-транспортеров, экспрессия которых определяет множественную лекарственную устойчивость, установлен следующий фенотип множественной лекарственной устойчивости - Pgp + MRP +, который характеризуется низкой доступностью ядра для цитостатиков и высоким уровнем функциональной активности Pgp и MRP. В данном случае солидная опухоль нечувствительна ко всем МЛУ-цитостатикам. Препаратом выбора являются цитостатики, не относящиеся к группе МЛУ-цитостатиков, так как проникновению последних в ядро и взаимодействию с ядерными мишенями препятствует активность ядерных транспортеров.
Пример 7
З.С.А. и/б 02/16911
Диагноз: рак молочной железы
Определение чувствительности опухоли к химиотерапии и расчет коэффициентов проводили аналогично примеру 1. Для данного больного получены следующие показатели чувствительности к химиотерапии. Результаты представлены в таблице 7.
Как видно из данных таблицы 7, верапамил и генистеин в обеих концентрациях и при обеих концентрациях доксорубицина (C1 и С2) не вызывают увеличения внутриклеточной флюоресценции доксорубицина (К=1), из чего следует отсутствие в опухолевых клетках экспрессии транспортных белков Pgp и MRP. Правильность проведенной оценки подтверждает и отсутствие реакции клеток на азид натрия (К=1).
По результатам оценки в операционном материале опухоли функциональной активности АВС-транспортеров, экспрессия которых определяет множественную лекарственную устойчивость, не выявлен фенотип множественной лекарственной устойчивости: Pgp - MRP -. Солидная опухоль в данном случае чувствительна к МЛУ-цитостатикам, и больному рекомендована терапия МЛУ-цитостатиками.
Пример 8
М.В.Н. и/б 02/16960
Диагноз: рак молочной железы
Определение чувствительности опухоли к химиотерапии и расчет коэффициентов проводили аналогично примеру 1. Для данного больного получены следующие показатели чувствительности к химиотерапии. Результаты представлены в таблице 8.
Как видно из данных таблицы 8, верапамил и генистеин в обеих концентрациях и при обеих концентрациях доксорубицина (С1 и C2) не вызывают увеличения внутриклеточной флюоресценции доксорубицина (К=1), из чего следует отсутствие в опухолевых клетках экспрессии транспортных белков Pgp и MRP. Однако воздействие на клетки данной опухоли азида натрия при концентрации доксорубицина C2 привело к увеличению внутриклеточной флюоресценции доксорубицина (К>1), из чего следует присутствие в опухолевых клетках конститутивного уровня экспрессии плазматических транспортных белков, отличных от Pgp и MRP. Такого уровня функциональной активности АВС-транспортеров не достаточно для проявления опухолевыми клетками устойчивости к МЛУ-цитостатикам.
По результатам оценки в операционном материале опухоли функциональной активности АВС-транспортеров, экспрессия которых определяет множественную лекарственную устойчивость, не выявлен фенотип множественной лекарственной устойчивости: Pgp - MRP -. Солидная опухоль в данном случае чувствительна к МЛУ-цитостатикам, и больному рекомендована терапия МЛУ-цитостатиками.
Пример 9
С.Т.В. и/б 02/16565
Диагноз: рак молочной железы
Определение чувствительности опухоли к химиотерапии и расчет коэффициентов проводили аналогично примеру 1. Для данного больного получены следующие показатели чувствительности к химиотерапии. Результаты представлены в таблице 9.
Как следует из данных таблицы 9, верапамил в обеих концентрациях не изменяет внутриклеточную флюоресценцию доксорубицина (К=1), из чего следует, что в опухоли транспортный белок Pgp не экспрессирован. Генистеин в обеих концентрациях также не изменяет внутриклеточную флюоресценцию доксорубицина (К=1), из чего следует, что и транспортный белок MRP в опухоли не экспрессирован. Однако в клетках данной опухоли при воздействии азида натрия отмечается существенное изменение внутриклеточной флюоресценции доксорубицина (К>1), из чего следует присутствие в опухолевых клетках экспрессии транспортных белков, отличных от Pgp и MRP. При этом функциональная активность таких транспортных белков в опухоли высока, так как она выявляется при обеих концентрациях доксорубицина С1 и С2 (К>1).
Таким образом, по результатам оценки в операционном материале опухоли функциональной активности АВС-транспортеров, экспрессия которых определяет множественную лекарственную устойчивость, установлен следующий фенотип множественной лекарственной устойчивости - Pgp - MRP -, но при этом данная опухоль характеризуется высоким уровнем функциональной активности транспортных белков, отличных от Pgp и MRP. Опухоль не чувствительна к терапии МЛУ-цитостатиками, кроме таксанов, так как последние являются субстратами только Pgp, функциональная активность которого в опухоли не выявлена.
Пример 10
М.А.В. и/б 02/13171
Диагноз: рак желудка
Определение чувствительности опухоли к химиотерапии и расчет коэффициентов проводили аналогично примеру 1. Для данного больного получены следующие показатели чувствительности к химиотерапии. Результаты представлены в таблице 10.
Как следует из данных таблицы 10, генистеин в обеих концентрациях не изменяет внутриклеточную флюоресценцию доксорубицина (К=1), из чего следует, что в опухоли транспортный белок MRP не экспрессирован. Верапамил же в обеих концентрациях вызывает увеличение внутриклето