Лечение и диагностика заболеваний, опосредованных макрофагами
Иллюстрации
Показать всеИзобретение относится к медицине, лечению патологических состояний, опосредованных активированными макрофагами. Предложены фармацевтическая композиция, содержащая конъюгат или комплекс общей формулы Аb-X, и ее применение при получении композиции для лечения пациента с болезненным состоянием, опосредованным активированными макрофагами. При этом группа Аb содержит лиганд, способный связываться с рецептором витамина, а группа Х содержит иммуноген, цитотоксин или соединение, способное понижать функцию макрофагов. Патологическое состояние, опосредованное активированными макрофагами, выбирают из группы, состоящей из ревматоидного артрита, язвенного колита, болезни Крона, воспаления, инфекций, остеомиелита, атеросклероза, отторжения трансплантата органа, пневмосклероза, саркоидоза, склеродермии. Изобретение позволяет связывать указанный комплекс или конъюгат с активированными макрофагами, подвергать его эндоцитозу и интернализации, что обеспечивает подавление специфической функции, непосредственный лизис активированных макрофагов, переориентацию иммунного ответа пациента на активированные макрофаги. 2 н. и 24 з.п. ф-лы, 15 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к способам лечения и мониторинга патологических состояний, опосредованных активированными макрофагами. Конкретнее, лиганды, которые связываются с активированными макрофагами, образуют комплексное соединение с визуализирующим агентом или иммуногеном, цитотоксином или агентом для изменения функции макрофагов для введения больному хозяину с целью диагностики и/или лечения заболеваний, опосредованных макрофагами.
Описание уровня техники и краткое изложение сущности изобретения
Иммунная система млекопитающих обеспечивает средство для распознавания и уничтожения инородных болезнетворных организмов. Хотя иммунная система в норме обеспечивает линию защиты против инородных болезнетворных организмов, существует множество случаев, когда иммунный ответ как таковой участвует в прогрессировании заболевания. Примерами заболеваний, вызванных или усугубленных собственным иммунным ответом хозяина, являются аутоиммунные заболевания, такие как рассеянный склероз, системная красная волчанка, псориаз, пневмосклероз и ревматоидный артрит, и заболевания, при которых иммунный ответ принимает участие в патогенезе, такие как атеросклероз, воспалительные заболевания, остеомиелит, язвенный колит, болезнь Крона и реакция «трансплантат против хозяина», приводящая к отторжению трансплантата органа.
Макрофаги в целом представляют собой первые клетки, которые встречаются с инородными болезнетворными организмами, и, соответственно, они играют важную роль в иммунном ответе. Однако в некоторых случаях активированные макрофаги могут вносить вклад в патофизиологию заболевания. Активированные макрофаги неспецифично поглощают и уничтожают инородные болезнетворные организмы внутри макрофагов в результате гидролитической и окислительной атаки, приводящей к распаду болезнетворного организма. Пептиды из распавшихся белков проявляются на клеточной поверхности макрофагов, где их могут распознать Т-клетки, и они могут непосредственно взаимодействовать с антителами на поверхности В-клеток, приводя к активации Т- и В-клеток и к дальнейшей стимуляции иммунного ответа.
Ревматоидный артрит (РА) представляет собой системное заболевание, характеризующееся хроническим воспалительным синовитом, обычно охватывающим периферические суставы. Синовиальное воспаление вызывает разрушение хряща и эрозию кости с последующим разрушением целостности сустава. Ревматоидные факторы, которые представляют собой аутоантитела, реагирующие с Fc-областью IgG, обнаруживаются у более чем двух третей пациентов с РА, указывая на то, что РА имеет аутоиммунный компонент.
РА выявляется во всем мире в количестве, достигающем 2% населения, причем у 80% пациентов с РА заболевание развивается в возрасте от 35 до 50 лет.Клинические проявления РА связаны с болью, отеком и болезненностью при пальпации в суставах, приводящими к ограничению в движениях, слабости, усталости и потере массы тела. РА представляет собой системное заболевание и, следовательно, имеет внесуставные проявления, особенно у пациентов с высокими титрами ревматоидных факторов. Указанные симптомы включают в себя ревматоидные узелки с внутренней зоной некротического материала, средней зоной макрофагов и наружной зоной гранулированной ткани, мышечную атрофию, остеопороз, пневмосклероз и ревматоидный васкулит, который может привести к изъязвлению кожи, гангрене пальцев или нервно-сосудистому заболеванию.
Ревматодиный синовит, характерный для РА, приводит к увеличению количества синовиальных выстилающих клеток, гиперплазии и гипертрофии синовиальных выстилающих клеток, микрососудистому повреждению, отеку и инфильтрации клетками, такими как Т-клетки, макрофаги и дендритные клетки. Ревматоидная синовиальная оболочка характеризуется присутствием секретируемых продуктов иммунных клеток, таких как факторы, секретируемые Т-лимфоцитами, включая IL-2, IFN-δ, IL-6, IL-10, GM-CSF и TGFα и β, и факторы, секретируемые активированными макрофагами, включая IL-1, IL-6, IL-8, IL-10, GM-CSF, CSF макрофагов и TGFβ. Оказывается, что продукция указанных цитокинов ответственна за большое число патологических изменений при РА, включая воспаление синовиальной оболочки, пролиферацию синовиальных клеток, разрушение хряща и кости и системные симптомы заболевания.
РА можно лечить с использованием различных способов, включая физиотерапию, покой и наложение шины. Терапевтические средства также применяют для лечения РА, и они включают в себя аспирин и нестероидные противовоспалительные препараты для борьбы с местным воспалением. Однако указанные средства оказывают минимальный эффект на прогрессирование заболевания и связаны с токсическими побочными эффектами. Модифицирующие заболевание антиревматические препараты, такие как α-пеницилламин и сульфасалазин, также применяют для лечения РА, но польза от этих препаратов отсрочена на недели или месяцы, и указанные препараты оказывают токсические побочные эффекты. Иммуносупрессивные и цитотоксические препараты подавляют симптомы РА у некоторых пациентов, но связаны с токсичностью. Применяли также внутрисуставное введение глюкокортикоидов, но они обеспечивают лишь преходящее облегчение. Соответственно, существует потребность в разработке новых способов лечения при сниженной токсичности, которые эффективны при лечении РА и других заболеваний, вызываемых или усугубляемых активированными макрофагами.
Фолатный рецептор (FR) представляет собой белок массой 38 кД, прикрепленный к глюкозофосфатизомеразе (GPI), который с высоким сродством (<1 нмоль) связывается с витамином - фолиевой кислотой. После связывания с рецептором быстрый эндоцитоз доставляет витамин в клетку, где он разгружается в эндосомальном отсеке при низком рН. Важно, что ковалентное соединение мелких молекул, белков и даже липосом с фолиевой кислотой не изменяет способность витамина конъюгировать с фолатным рецептором, и поэтому конъюгаты фолат-препарат могут легко входить в клетки путем эндоцитоза, опосредованного рецептором.
Ввиду того, что большинство клеток использует несвязанный восстановленный носитель фолата (RFC) для получения необходимой фолиевой кислоты, экспрессия фолатного рецептора ограничена несколькими типами клеток. За исключением почек и плаценты нормальные ткани экспрессируют низкие или не выявляемые уровни RF. Однако многие злокачественные ткани, включая раковые опухоли яичников, молочных желез, бронхов и головного мозга, экспрессируют значимо повышенные уровни рецептора. Действительно, по оценкам, 95% всех карцином яичников избыточно экспрессируют фолатный рецептор. Недавно сообщалось, что FRβ, неэпителиальная изоформа фолатного рецептора, экспрессируется на активированных (но не покоящихся) синовиальных макрофагах. Таким образом, авторы предприняли попытку использовать связанные с фолатом соединения, потенциально способные изменить функцию активированных макрофагов, для лечения опосредованных макрофагами патологических состояний. Например, они обнаружили, что связанные с фолатом иммуногены можно применять для переориентации иммунного ответа хозяина у животных с артритом на активированные макрофаги на участке воспаления с целью истощения запаса макрофагов и уменьшения артритного воспаления.
Агенты для сцинтиграфической визуализации в миллион раз чувствительнее, чем контрастные агенты для магнитно-резонансной визуализации (MRI), и их избирательность можно усилить их нацеливанием на клеточные маркеры, специфичные для поражения. Действительно, радиоизотоп 99mTc можно доставить к артритным тканям с использованием неспецифичного IgG, антител против CD4, лигандов CD11b/CD14-гликолипопептида и пептидов, связывающих Е-селектин. Предклинические исследования с такими радиовизуализирующими агентами ясно продемонстрировали ценность визуализации артритных тканей in vivo, однако избирательность современных визуализирующих агентов еще не оптимальна, и ни одно из настоящих соединений не нацелено исключительно на активированные макрофаги. Имея в виду возникновение активности фолатных рецепторов во время активации макрофагов, заявители предприняли усилия для определения того, можно ли нацеленные на фолат визуализирующие агенты, меченные 99mTc, применять для визуализации артритных поражений in vivo.
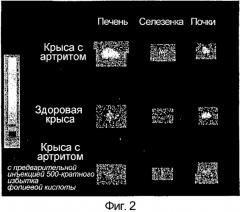
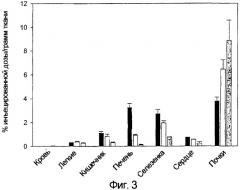
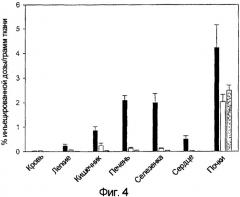
Для определения того, можно ли указанный FR с высоким сродством использовать для избирательного нацеливания препаратов на активированные макрофаги на участках воспаления, фолиевую кислоту конъюгировали с соединением, образующим хелат с 99mTc, и его распределение оценивали и в здоровых, и в патологических тканях крыс с артритом, вызванным адъювантом. Было действительно обнаружено, что связанный с фолатом комплекс 99mTc-хелат, названный ЕС20, концентрируется в конечностях больных крыс, пораженных артритом, но не в суставах здоровых крыс. Было обнаружено, что интенсивность гамма-сцинтиграфических изображений пораженных тканей в значительной степени уменьшается в присутствии избытка конкурирующей фолиевой кислоты. Кроме того, печень и селезенка животных с артритом также проявили усиленный захват ЕС20 и возросшие уровни FR, подтверждая то, что системная активация макрофагов сопровождает артрит, вызванный адъювантом. Истощение запаса макрофагов у животных с артритом снижало содержание FR в ткани и одновременно устраняло захват ЕС20. Кроме того, купферовские клетки, выделенные у крыс с артритом, вызванным адъювантом, проявляли значимо более высокую способность связывания с фолатными конъюгатами, чем купферовские клетки, полученные у здоровых крыс. Таким образом, авторы обнаружили, что ЕС20 можно использовать для оценки участия активированных макрофагов при воспалительных патологических состояниях, таких как ревматоидный артрит.
Настоящее изобретение направлено на способ лечения и мониторинга патологических состояний, опосредованных активированными макрофагами. В соответствии с одним вариантом реализации настоящего изобретения патологические состояния, опосредованные активированными макрофагами, лечат путем переориентации иммунных ответов хозяина на активированные макрофаги или изменения функции активированных макрофагов, или же непосредственным лизисом активированных макрофагов. В одном аспекте изобретения для содействия уничтожению активированных макрофагов лиганды, которые специфично связываются с активированными макрофагами, конъюгируют с иммуногеном для переориентации иммунных ответов хозяина на популяцию активированных макрофагов или их конъюгируют с цитотоксином для непосредственного лизиса макрофагов. Лиганды, которые можно применять в конъюгатах настоящего изобретения, включают в себя лиганды, которые связываются с рецепторами, специфично экспрессируемыми на активированных макрофагах, такими как фолатный рецептор, или лиганды, такие как моноклональные антитела, направленные на маркеры клеточной поверхности, специфично экспрессируемые на активированных макрофагах. В другом аспекте изобретения лиганды, которые специфично связываются с активированными макрофагами, конъюгируют с визуализирующим агентом, конъюгат вводят пациенту для диагностики и мониторинга прогрессирования заболеваний, опосредованных активированными макрофагами.
В одном варианте реализации предоставлен способ лечения или мониторинга/диагностики патологического состояния, опосредованного активированными макрофагами. Способ подразумевает этап введения пациенту, страдающему патологическим состоянием, опосредованным активированными макрофагами, эффективного количества композиции, содержащей конъюгат или комплекс общей формулы Ab-X, где группа Ab включает в себя лиганд, способный связываться с активированными макрофагами, и когда конъюгат используется для лечения патологического состояния, группа Х включает в себя иммуноген, цитотоксин или соединение, способное изменить функцию макрофага, а когда конъюгат используется для мониторинга/ диагностики патологического состояния, Х включает в себя визуализирующий агент.
Подробное описание изобретения
В соответствии с настоящим изобретением представлены способы лечения или мониторинга/диагностики патологического состояния, опосредованного активированными макрофагами. Примерами заболеваний, которые, как известно, опосредуются активированными макрофагами, являются ревматоидный артрит, язвенный колит, болезнь Крона, псориаз, остеомиелит, рассеянный склероз, атеросклероз, пневмосклероз, саркоидоз, склеродермия, отторжение трансплантата органа (GVHD) и хроническое воспаление. Мониторинг таких патологических состояний можно осуществить сначала путем введения пациенту, страдающему таким заболеванием, эффективного количества композиции, содержащей конъюгат общей формулы Ab-X, в которой группа Ab включает в себя лиганд, способный связываться с активированными макрофагами, а группа Х включает в себя визуализирующий агент, а затем путем сканирования пациента визуализирующим устройством, способным выявить визуализирующий агент. Патологические состояния, опосредованные макрофагами, можно лечить в соответствии с данным изобретением путем введения эффективного количества композиции указанной выше формулы, в которой Ab включает в себя лиганд, способный связываться с активированным макрофагом, а группа Х включает в себя иммуноген, цитотоксин или соединение, способное изменить функцию макрофага. Такие конъюгаты, нацеленные на макрофаг, при введении пациенту, страдающему патологическим состоянием, опосредованным макрофагами, работают для концентрации и ассоциации конъюгированного цитотоксина, иммуногена или цитокина с популяцией активированных макрофагов для лизиса активированных макрофагов или изменения функции макрофагов. Уничтожение или дезактивация популяции активированных макрофагов направлено на прекращение или уменьшение патогенеза, опосредованного активированными макрофагами, характерного для подвергаемого лечению патологического состояния. Конъюгат обычно вводят парентерально в виде композиции, включающей в себя конъюгат и его фармацевтически приемлемый носитель. Введение конъюгата обычно продолжают до тех пор, пока не уменьшатся или не устранятся симптомы заболевания.
В одном варианте реализации изобретения мониторинг или диагностику патологических состояний, опосредованных активированными макрофагами, проводят у пациента путем введения конъюгата Ab-X, в котором Ab включает в себя лиганд, способный связываться с активированными макрофагами, а Х включает в себя визуализирующий агент, а затем путем сканирования пациента визуализирующим устройством, способным выявить локальную концентрацию визуализирующего агента. Визуализирующие или диагностические конъюгаты, подобно указанным выше терапевтическим конъюгатам, обычно вводят в виде диагностической композиции, включающей в себя конъюгат и фармацевтически приемлемый носитель. Композицию обычно составляют для парентерального введения и вводят пациенту в количестве, эффективном для обеспечения возможности визуализации скоплений популяции активированных макрофагов. Природа компонента конъюгата в виде визуализирующего агента определяется методологией визуализации. Так, например визуализирующий агент может включать в себя хелатообразующую составляющую часть и катион металла, например радионуклид или контрастный агент для ядерно-резонансной визуализации, такой как гадолиний. Обычно визуализирующий агент, нацеленный на активированные макрофаги, вводят пациенту, и после периода времени для обеспечения возможности доставки и концентрации визуализирующего агента в клеточной популяции активированных макрофагов пациента подвергают процедуре визуализации, и возможность визуализации обеспечивают нацеленным визуализирующим агентом.
Способ согласно изобретению можно использовать и для различных видов применения и в клинической медицине, и в ветеринарии. Таким образом, животные-хозяева, пораженные заболеванием, опосредованным активированными макрофагами, могут представлять собой человека, или, в случае различных видов применения в ветеринарии, они могут представлять собой лабораторных, сельскохозяйственных, домашних или диких животных. Конъюгаты, вводимые в соответствии со способами данного изобретения, предпочтительно вводят парентерально животному или пациенту, страдающему патологическим состоянием, например внутрикожно, подкожно, внутримышечно, внутрибрюшинно или внутривенно. Альтернативно, конъюгаты можно вводить животному или пациенту другими используемыми в медицине процедурами, и эффективные дозы можно вводить в стандартных лекарственных формах или в формах пролонгированного высвобождения, таких как медленно нагнетающий инфузионный насос. Способ лечения согласно изобретению можно использовать отдельно или в комбинации с другими способами лечения, признанными пригодными для лечения патологических состояний, опосредованных макрофагами.
В конъюгатах лиганда общей формулы Ab-X, в соответствии с настоящим изобретением, группа Ab представляет собой лиганд, способный связываться с активированными макрофагами. Можно использовать любую из широкого числа составляющих частей, связывающихся с макрофагами. Приемлемые лиганды включают в себя, в частности, лиганды, связывающиеся с фолатными рецепторами, и антитела или фрагменты антител, способные распознавать и специфично связываться с поверхностными фрагментами, уникально или предпочтительно экспрессируемыми или присутствующими в/на активированных макрофагах. В одном варианте реализации лиганд, связывающийся с активированными макрофагами, представляет собой фолиевую кислоту, аналог фолиевой кислоты или другие молекулы, связывающиеся с фолатными рецепторами. Активированные макрофаги экспрессируют фолатный рецептор, сцепленный с 38 LD GPI, который с субнаномолярным сродством (т.е. <1 нмоль) связывает фолат и соединения - производные фолата. В другом варианте реализации лиганд, связывающийся с активированными макрофагами, представляет собой специфическое моноклональное или поликлональное антитело или Fab-фрагменты или scFv (т.е. одноцепочечную вариабельную область) антител, способных специфически связываться с активированными макрофагами.
Нацеленные на активированные макрофаги конъюгаты, используемые для диагностики и мониторинга патологических состояний, опосредованных активированными макрофагами, формируются для нацеливания и, следовательно, концентрирования визуализирующего агента на участке скопления активированных макрофагов у пораженного заболеванием пациента. В таких конъюгатах формулы Ab-X, Ab представляет собой лиганд, способный связываться с активированными макрофагами, а Х включает в себя визуализирующий агент. В одном варианте реализации визуализирующий агент содержит хелатообразующий агент и катион металла, обычно или радионуклид, или усилитель ядерно-магнитно-резонансной визуализации, или контрастный агент, такой как гадолиний. Такие конъюгаты, в которых группа Ab представляет собой фолиевую кислоту, аналоги фолиевой кислоты или другой лиганд, связывающийся с рецептором фолиевой кислоты, подробно описаны в патенте США №5688488, описание которого включено сюда в качестве ссылки. В каждом из указанных патентов, а также родственных патентов США №№5416016 и 5108921, включенных сюда в качестве ссылки, описаны способы и примеры получения конъюгатов хелатов, которые можно использовать в соответствии с настоящим изобретением. Настоящие визуализирующие агенты, нацеленные на макрофаги, можно получить и использовать, следуя общим последовательностям операций, описанным в указанных предшествующих патентах. Однако настоящий способ диагностики основан частично на открытии того, что конъюгаты, нацеленные на фолат, можно использовать для концентрирования конъюгированных визуализирующих агентов в местах скопления популяций активированных макрофагов и внутри их, обеспечивая возможность мониторинга и диагностики патологических состояний, характеризуемых концентрацией активированных макрофагов на участке поражения.
В соответствии с одним вариантом реализации настоящего изобретения предоставляется способ лечения патологических состояний, опосредованных активированными макрофагами, введением пациенту, страдающему таким патологическим состоянием, эффективного количества композиции, содержащей конъюгат общей формулы Ab-X, в которой Ab представляет собой определенную выше группу, а группа Х включает в себя цитотоксин, иммуноген или соединение, способное изменить функцию макрофага. Иллюстративные цитотоксичекие составляющие, которые можно использовать для формирования конъюгатов для применения в соответствии с настоящим способом, включают в себя клодронат, антракс, экзотоксин Pseudomonas, обычно модифицированные таким образом, чтобы указанные цитотоксические составляющие не связывались с нормальными клетками и другими токсинами или цитотоксическими агентами, включая такие признанные в данной области химиотерапевтические агенты, как адренокортикоиды, алкилирующие агенты, антиандрогены, антиэстрогены, андрогены, эстрогены, антиметаболиты, такие как цитозин арабинозид, аналоги пурина, аналоги пиримидина и метотрексат, бусулфан, карбоплатин, хлорамбуцил, цисплатин и другие соединения платины, тамоксифен, таксол, циклофосфамид, растительные алкалоиды, преднизон, гидроксимочевина, тенипозид и блеомицин, азотистый иприт, нитросоединения мочевины, винкристин, винбластин, воспалительные и провоспалительные агенты и им подобные. Такие токсины или цитотоксические компоненты можно непосредственно конъюгировать с составляющей частью, связывающейся с активированными макрофагами, например фолатом или другими лигандами, связывающимися с фолатными рецепторами, или их можно составить в липосомы, которые сами являются мишенями как конъюгаты агентов, связывающихся с макрофагами, обычно ковалентными связями с составляющими фосфолипидами. Аналогичным образом, когда группа Х содержит соединение, способное изменять функцию макрофагов, например цитокин, такой как IL-10 или IL-11, цитокин может ковалентно связываться непосредственно с нацеливающей составляющей частью Ab, например лигандом, связывающимся с фолатными рецепторами, или антителом или фрагментом антитела, или изменяющий функцию макрофагов цитокин может инкапсулироваться в липосому, которая сама нацелена на активированные макрофаги свисающими нацеленными на макрофаги составляющими частями Ab, ковалентно связанными с одним или более фосфолипидными компонентами липосом.
В другом варианте реализации конъюгаты лиганд-иммуноген можно вводить в комбинации с цитотоксическим соединением. Соединения, перечисленные в предшествующем абзаце, относятся к соединениям, подходящим для указанной цели.
В другом варианте реализации способа лечения настоящего изобретения группа Х в конъюгате Ab-X, нацеленном на активированные макрофаги, включает в себя иммуноген, причем конъюгаты лиганд-иммуноген эффективны в качестве метки для популяции активированных макрофагов, ответственных за патогенез заболевания у пациента, страдающего данным заболеванием, для специфического устранения эндогенным иммунным ответом или совместно введенными антителами. Использование конъюгатов лиганд-иммуноген в способе лечения в соответствии с данным изобретением направлено на усиление опосредованного иммунным ответом устранения популяции активированных макрофагов. Это можно осуществить посредством эндогенного иммунного ответа или пассивного иммунного ответа, осуществляемого совместно вводимыми антителами. Эндогенный иммунный ответ может включать в себя гуморальный ответ, клеточно-опосредованный иммунный ответ и любой другой иммунный ответ, присущий животному-хозяину, включая опосредованный комплементом клеточный лизис, антителозависимую клеточно-опосредованную цитотоксичность (ADCC), опсонизацию антител, ведущую к фагоцитозу, образование рецепторных кластеров после связывания антител, приводящее к передаче сигналов апоптоза, антипролиферацию или дифференцировку и прямое распознавание иммунными клетками доставленного антигена/гаптена. Предусмотрено также, что эндогенный иммунный ответ будет использовать секрецию цитокинов, которые регулируют такие процессы, как размножение и миграция иммунных клеток. Эндогенный иммунный ответ может включать в себя участие таких типов иммунных клеток, как В-клетки, Т-клетки, включая Т-клетки-хелперы и цитотоксические Т-клетки, макрофаги, естественные клетки-киллеры, нейтрофилы, лимфокинактивированные клетки-киллеры (ЛАК) и им подобные.
В другом варианте реализации конъюгат лиганд-иммуноген может быть интернализирован, и иммуноген может быть разрушен и представлен на клеточной поверхности макрофагов иммунными клетками с тем, чтобы вызвать иммунный ответ, направленный против макрофагов, представляющих разрушенный иммуноген.
Гуморальный ответ может представлять собой ответ, вызванный такими процессами, как проводимая по обычной схеме вакцинация или активная иммунизация природным антигеном или неприродным антигеном или гаптеном, например флюоресцеином изотиоцианатом (FITC), причем неприродный антиген вызывает новый иммунитет. Активная иммунизация включает в себя множественные инъекции неприродного антигена или гаптена по схеме вне планируемой схемы обычной вакцинации с тем, чтобы вызвать новый иммунитет. Гуморальный ответ может также быть результатом врожденного иммунитета, когда животное-хозяин имеет природный ранее существующий иммунитет, такой как иммунитет к группам α-галактозила. Альтернативно, пассивный иммунитет можно создать путем введения животному-хозяину антител, таких как природные антитела, взятые из сыворотки, или моноклональные антитела, которые могут представлять или не представлять собой антитела, созданные методами генной инженерии, включая гуманизированные антитела. Использование определенного количества реагента антитела для развития пассивного иммунитета и применение конъюгата лиганд-иммуноген, при котором пассивно введенные антитела направлены на иммуноген, обеспечило бы преимущество стандартного набора реагентов для использования в случаях, когда титр ранее существовавших антител пациента к другим потенциальным антигенам нельзя использовать для лечения. Пассивно введенные антитела можно «совместно вводить» с конъюгатом лиганд-иммуноген, и совместное введение определяется как введение антител во время, предшествующее введению конъюгата лиганд-иммуноген, в одно и то же время с указанным введением или после указанного введения. Предусмотрено, что ранее существовавшие антитела, индуцированные антитела или пассивно введенные антитела будут переориентированы на активированные макрофаги предпочтительным связыванием конъюгатов лиганда-иммуногена с клеточными популяциями активированных макрофагов, и такие патогенные клетки уничтожаются под действием комплемент-опосредованного лизиса, ADCC, антителозависимого фагоцитоза или кластеризации рецепторов антителами. В цитотоксическом процессе могут также участвовать другие типы иммуных ответов, такие как клеточноопосредованный иммунитет, а также вторичные ответы, которые возникают, когда привлеченные представляющие антиген клетки фагоцитируют активированные макрофаги и представляют антигены таких клеток иммунной системе для элиминации других активированных макрофагов, представляющих такие антигены.
Приемлемые иммуногены для использования при получении конъюгатов, применяемых в способе лечения настоящего изобретения, представляют собой иммуногены, которые способны вызвать продукцию антител у животного-хозяина или которые ранее вызвали продукцию антител у животного-хозяина, приводящую к ранее существовавшему иммунитету, или которые составляют часть врожденной иммунной системы. Альтернативно, антитела, направленные против иммуногена, можно вводить животному-хозяину для создания пассивного иммунитета. Подходящие иммуногены для использования в изобретении включают в себя антигены или антигенные пептиды, против которых развился ранее существующий иммунитет посредством проводимых по схеме вакцинаций или предшествующего врожденного контакта с таким агентами, как вирус полиомиелита, антигены столбняка, тифа, краснухи, кори, эпидемического паротита, коклюша, туберкулеза и групп α-галактозила. В таких случаях конъюгаты лиганд-иммуноген будут использоваться для переориентации ранее приобретенного гуморального или клеточного иммунитета на популяцию активированных макрофагов у животного-хозяина для элиминации таких клеток. Другие подходящие иммуногены включают в себя антигены или антигенные пептиды, в отношении которых у животного-хозяина развился новый иммунитет посредством иммунизации против неприродного антигена или гаптена, например флуоресцеина изотиоцианата (FITC) или динитрофенила, и антигенов, против которых существует врожденный иммунитет, например суперантигенов и мурамилдипептида. Предусмотрено также, что пептиды, ограниченные главным комплексом гистосовместимости I (MHC I), могут быть связаны с лигандом для использования в переориентации клеточного иммунитета на макрофаги и в лизисе макрофагов под действием Т-клеток.
Связывающиеся с макрофагами лиганды и иммуногены, цитотоксические агенты, цитокины или визуализирующие агенты, что может иметь место при формировании конъюгатов для использования в соответствии с настоящим изобретением, можно конъюгировать с использованием любого способа формирования комплекса, признанного в данной области. Это может включать в себя ковалентную, ионную или водородную связь лиганда с иммуногеном либо непосредственно, либо косвенно, посредством связывающей группы, такой как двухвалентный линкер. Конъюгат обычно формируется ковалентной связью лиганда с прицельным объектом посредством формирования амидных, сложноэфирных или имино-связей между кислотой, альдегидом, гидрокси, амино или гидразогруппами на соответствующих компонентах комплекса. Альтернативно, как указано выше, комплекс лиганда может представлять собой комплекс, включающий в себя липосому, в котором прицельный объект (то есть, визуализирующий агент или иммуноген, цитотоксический агент или агент, изменяющий функцию макрофагов) содержится внутри липосомы, которая сама ковалентно связана с лигандом, связывающимся с активированными макрофагами.
В одном варианте реализации изобретения лиганд представляет собой фолиевую кислоту, аналог фолиевой кислоты или любую другую молекулу, связывающуюся с фолатными рецепторами, и лиганд фолата конъюгируется с прицельным объектом в результате процедуры, в которой используется трифторуксусный ангидрид для получения γ-сложных эфиров фолиевой кислоты посредством птероилазидного промежуточного соединения. Данная процедура приводит к синтезу лиганда фолата, конъюгированного с прицельным объектом только посредством γ-карбокси-группы групп глутаминовой кислоты фолата. Альтернативно, аналоги фолиевой кислоты можно соединить посредством α-карбокси-фрагмента группы глутаминовой кислоты или групп как α, так и γ-карбоновой кислоты.
Конъюгаты, используемые в соответствии с данным изобретением и имеющие формулу Ab-X, используются в одном аспекте данного изобретения для составления терапевтических или диагностических композиций, включающих в себя эффективные количества конъюгата и его приемлемого носителя. Обычно такие композиции составляют для парентерального применения. Количество конъюгата, эффективное для применения в соответствии с изобретением, зависит от многих параметров, включая природу подвергаемого лечению или диагностике заболевания, молекулярную массу конъюгата, путь его введения и его тканевого распределения и возможность совместного применения других терапевтических или диагностических агентов. Эффективное количество, которое предстоит ввести пациенту, обычно определяется площадью поверхности тела, массой тела пациента и оценкой врачом состояния пациента. Эффективное количество может колебаться в пределах примерно от 1 нг/кг до 1 мг/кг, чаще примерно от 1 до 500 мкг/кг, а наиболее часто - примерно от 1 до 100 мкг/кг.
При использовании для мониторинга или диагностики процедуры визуализации обычно проводят приблизительно через 1-6 ч после введения визуализирующего агента, нацеленного на активированные макрофаги.
Можно использовать любые схемы введения конъюгатов лиганда. Например, конъюгаты лиганда можно вводить в виде однократных доз. Или их можно разделить и ввести по схеме многократного суточного введения. Кроме того, можно применять скользящую схему, например от 1 до 3 д/нед, в качестве альтернативы ежедневному лечению, и с целью уточнения, такую прерывистую или скользящую схему считают эквивалентной ежедневному лечению и входящей в объем притязаний данного изобретения. В одном варианте реализации изобретения пациента лечат множественными инъекциями конъюгата лиганда, в котором прицельный объект представляет собой иммуноген или цитотоксический агент для элиминации популяции патогенных активированных макрофагов. В одном варианте реализации пациента лечат, например, многократными инъекциями конъюгата лиганда через интервалы, например 12-72 ч или через интервалы 48-72 ч. Дополнительные инъекции конъюгата лиганда можно вводить пациенту через интервалы, длящиеся дни и месяцы после первоначальных инъекций, и дополнительные инъекции предотвращают рецидив заболевания. Альтернативно, конъюгаты лиганда можно вводить профилактически для предотвращения возникновения заболевания у пациентов, которые, как известно, предрасположены к развитию патологических состояний, опосредованных активированными макрофагами. В одном варианте реализации можно использовать более чем один тип конъюгата лиганда, например животного-хозяина можно предварительно иммунизировать флуоресцеин-изотиоцианатом и динитрофенилом, а затем лечить флуоресцеин-изотиоцианатом и динитрофенилом, связанными с одними и теми же или другими лигандами, нацеленными на активированные макрофаги, в протоколе совместного введения.
Конъюгаты лиганда вводят в соответствии с данным изобретением парентерально, а чаще - путем внурибрюшинных инъекций, подкожных инъекций, внутримышечных инъекций, внутривенных инъекций или внутриоболочечных инъекций. Конъюгаты лиганда можно также доставлять пациенту с помощью осмотического насоса. Примеры лекарственных форм для парентерального введения включают в себя водные растворы конъюгата, например раствор в изотоническом солевом растворе, 5% глюкозе или других хорошо известных фармацевтически приемлемых жидких носителях, таких как спирты, гликоли, сложные эфиры и амиды. Композиции для парентерального введения для применения в соответствии с данным изобретением могут быть в форме растворимого лиофилизата, содержащего одну или более доз конъюгата лиганда. В другом аспекте изобретения конъюгаты лиганда можно составлять в виде одной из любого количества лекарственных форм пролонгированного высвобождения, известных в данной области, таких, например, как биодеградируемые углеводородные матриксы, описанные в патентах США №№4713249, 5266333 и 5417982, описания которых включены сюда в качестве ссылки.
Пример 1
Материалы
ЕС20 (связанный с фолатом комплекс 99mTc хелата), ЕС28 (такой же комплекс 99mTc хелата без фолата) и фолат-флуоресцеино-изотиоцианат (фолат-FITC) были переданы в дар компанией Endocyte, Inc. (West Lafayette, IN). Подвергнутые термическому лизису Mycoplasma butericum закупали в компании BD Biosciences (Sparks, MD). Фолиевую кислоту, легкое минеральное масло, клодронат, коллагеназу-А и стрептавидин-R-фикоэритрин получали в компании Sigma Chemical Co. (St. Louis, MO), и модифицированную Дульбекко среду Игла (DMEM) получали у Gibco-BRL (Gathersberg, MD). 3Н-фолиевую кислоту получали от American Radiolebeled Chemicals, Inc. (St. Louis, MO), и мембраны Microcon