Способ промотирования активной конформации гликозилированного рекомбинантного белка, способ получения активного гликозилированного белка и способ получения композиции указанного белка для введения потребителю и/или пациенту или потребления потребителем и/или пациентом
Иллюстрации
Показать всеИзобретение относится к области медицины и биотехнологии и может быть использовано в фармацевтической промышленности. Долю наиболее активной конформации гликозилированного рекомбинантного белка, секретированного клеткой млекопитающего, увеличивают путем контактирования его с реагентом для сопряженного окисления-восстановления. Данный способ промотирования наиболее активной конформации белка используют в способе получения гликозилированного рекомбинантного белка в наиболее активной конформации. Конфигурационный изомер белка, полученный указанным способом получения гликозилированного рекомбинантного белка в наиболее активной конформации, используют в способе получения композиции белка для введения потребителю и/или пациенту или потребления потребителем и/или пациентом. Применение заявленного изобретения позволяет повысить активность гликозилированного белка, полученного методом рекомбинантных ДНК с помощью клетки млекопитающего. 3 н. и 24 з.п. ф-лы, 8 ил., 2 табл.
Реферат
Данная заявка притязает на льготы предварительной заявки США 60/271033, поданной 23 февраля 2001 года, описание которой включено в его полном объеме путем ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ДАННОЕ ИЗОБРЕТЕНИЕ
Данное изобретение относится к области медицины и биотехнологии, в частности к области обработки и получения белков с желательной биологически активной конформацией, а также к составлению рецептур и фармацевтическим композициям.
УРОВЕНЬ ТЕХНИКИ
Высокие уровни экспрессии многих белков эукариотического происхождения были достигнуты в прокариотических экспрессионных хозяевах. Такие эукариотические белки часто неправильно укладываются и накапливаются в виде нерастворимых телец включения в прокариотическом хозяине. Для получения биологически активного белка белки, заключенные в тельцах включения, должны быть развернуты и повторно уложены при жестких условиях, включающих в себя хаотропные агенты и восстановление тиолов.
Экспрессия белков эукариотического происхождения в эукариотических хозяевах позволяет избежать этих проблем. При условии, что экспрессирующий вектор был сконструирован правильно (например, с секреторными сигнальными пептидами и т.д.), линии эукариотических клеток склонны правильно процессировать и секретировать внеклеточные эукариотические белки в виде растворимых продуктов.
Однако в то время как экспрессионные системы и векторы были улучшены для максимизации уровней экспрессии в эукариотических клетках, не весь рекомбинантный белок, экспрессируемый и секретируемый из этих хозяев, находится в желательной, наиболее активной конформации. Данное изобретение предназначено для преодоления таких проблем экспрессии и максимизации выходов биологически активного белка.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение основывается частично на открытии, что не весь препарат рекомбинантного белка, который экспрессируется эукариотическими клетками-хозяевами, уложен в нативную третичную конформацию. Кроме того, было обнаружено, что районы или домены рекомбинантных белков могут быть правильно уложены, тогда как другие районы или домены могут иметь нежелательные конформации. Таким образом, в одном аспекте данное изобретение обеспечивает способ контактирования препарата рекомбинантного белка, который содержит смесь по меньшей мере двух изомеров рекомбинантного белка с реагентом для сопряженного окисления-восстановления в течение времени, достаточного для увеличения относительной доли желательного конформационного изомера, и определения относительной доли желательного конформационного изомера в этой смеси. В другом аспекте данное изобретение описывает контактирование препарата рекомбинантного белка, который был продуцирован клетками млекопитающего с реагентом для сопряженного окисления-восстановления при рН от приблизительно 7 до приблизительно 11 и выделение фракции этого препарата рекомбинантного белка с желательной конформацией. Предпочтительными рекомбинантными белками являются гликозилированные рекомбинантные белки, такие как, например, белки, продуцируемые эукариотическими клетками. Данное изобретение относится также к способам приготовления препаратов в стерильной дозированной форме и композициям, получаемым способами данного изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
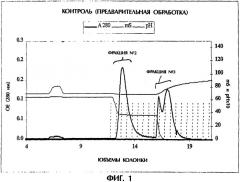
Фигура 1. Гидрофобная хроматография (HIC) TNFR:Fc. Этот препарат TNFR:Fc элюируется во время HIC в виде трех отдельных пиков, собираемых во фракцию №2 и фракцию №3, как указано.
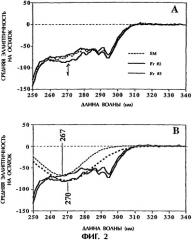
Фигура 2. Анализ кругового дихроизма фракций №2 и №3. Измерения кругового дихроизма в ближней УФ-области спектра, выраженные в виде средней эллиптичности на остаток, показаны на фигуре 2. Фигура 2А представляет спектральные данные; линия для фракции №3 является наиболее близкой к указанному стрелкой отрицательному сдвигу при приблизительно 270 нм, приписываемому вкладу дисульфидных связей, а линией для фракции №2 является более темная сплошная линия. Фигура 2В представляет данные в виде сглаженной кривой для фракции №2 (мелкий пунктир) и фракции №3 (более крупный пунктир).
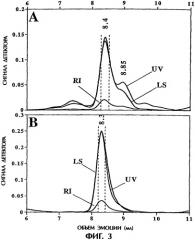
Фигура 3. Определение молекулярной массы в режиме on-line методом гель-фильтрационной хроматографии (SEC), с последовательной детекцией в ультрафиолете (UV), по рассеянию света (LS) и показателю преломления (RI) (On-line SEC/UV7LS/RI). Фигура ЗА представляет фракцию №3, а фигура 3В - фракцию №2. Вертикальные пунктирные линии указывают срезы, которые оценивались для определения молекулярной массы в районе, окружающем основной пик.
Фигура 4. Дифференциальный сканирующий калориметрический анализ фракций №2 и №3. Фигура 4А представляет нескорректированные данные, а фигура 4В представляет скорректированные в отношении фона данные. Термические переходы плавления отмечены вертикальными пунктирными линиями. Стрелки указывают сдвиг энтальпии. Горизонтальные пунктирные линии на фигуре 4В используют в качестве опорно-фонового уровня.
Фигура 5. Корреляция фракции №2 и связывающей активности. Шесть различных препаратов TNFR:Fc (обозначаемых A-F) из шести различных клеточных линий испытывали на корреляцию между увеличением доли фракции №2 в процентах (темные ромбы) и увеличением единиц связывания TNF-альфа в процентах (светлые ромбы).
Фигура 6. Влияние изменения концентрации цистеина на превращение фракции №3 во фракцию №2. Пробы белка обрабатывали различными концентрациями цистеина (0,25-5,0 мМ) и изменения во фракции №3 оценивали с использованием HIC. Четыре разные партии TNFR:Fc обрабатывали в течение 18 часов при указанной на оси х концентрации цистеина. Процент фракции №3 в каждой партии, превратившейся во фракцию №2, показан на оси у.
Фигура 7. Влияние концентрации цистеина на долю фракции №3. Пробы белка из четырех разных партий обрабатывали различными концентрациями цистеина (0-50 мМ) и полученный уровень фракции №3 оценивали с использованием HIC.
Фигура 8. Влияние температуры на дисульфидный обмен. Фракции белка обрабатывали при комнатной температуре или при 4°С в присутствии или в отсутствие меди в течение различных периодов времени. Фигура 8А представляет изменения во фракции №3 по результатам HIC после 6 часов, а фигура 8В представляет изменения во фракции №3 по результатам HIC после 18 часов.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Данное изобретение обеспечивает способы увеличения выхода активных рекомбинантных белков. В частности, данное изобретение включает в себя промотирование желательной конформации белка в препаратах рекомбинантного белка. Важным моментом является то, что данное изобретение обеспечивает мягкие способы изменения структуры белка без необходимости применения жестких хаотропных обработок (таких как, например, сильные денатурирующие агенты, такие как ДСН, гуанидинийхлорид или мочевина). Использование способов данного изобретения на препаратах рекомбинантного белка приводит к более высокому проценту, или большей относительной фракции, рекомбинантного белка в препарате с желательной конформацией. Желательной конформацией для рекомбинантного белка является трехмерная структура белка, которая наиболее сходна со структурой и/или дублирует функцию природного домена этого белка. Такие мягкие способы являются особенно полезными, когда рекомбинантный белок предназначен для использования in vivo в качестве лекарственного средства или биопрепарата.
Вообще, когда рекомбинантный белок содержит домен рецепторного белка, желательная конформация будет иметь более высокую аффинность связывания (и, следовательно, более низкую константу диссоциации) в отношении родственного лиганда данного рецептора. Например, желательная конформация TNF-связывающей молекулы будет иметь более высокую аффинность связывания и меньшую константу диссоциации в отношении TNF (например, TNF-альфа).
Кроме того, желательная конформация рекомбинантного белка предпочтительно является более термостабильной, чем нежелательная конформация (при измерении в условиях того же самого раствора). Термостабильность может быть измерена любым из способов, таких как, например, переход в точке плавления (Tm). Желательная конформация рекомбинантного белка может иметь или может не иметь отличное расположение дисульфидных связей, хотя предпочтительно эта конформация содержит нативные дисульфидные связи. Желательная конформация рекомбинантного белка может иметь другие характеристики третичной структуры. Например, желательная конформация может быть мономером, димером, тримером, тетрамером или некой другой формой белка более высокого порядка. Для целей данного изобретения «конформацией» белка является его трехмерная структура. Две различные структуры полипептида с одной и той же первичной аминокислотной последовательностью являются «конформерами» друг друга, когда они имеют различные конформации, соответствующие минимумам энергии, и они отличаются друг от друга только тем, как их атомы ориентированы в пространстве. Конформеры могут быть взаимопревращающимися (что касается свободы вращения вокруг связей за исключением разрыва связей). Две различные структуры полипептида с одной и той же первичной аминокислотной последовательностью являются «конфигурационными изомерами», когда они имеют различные конформации, соответствующие минимумам энергии, они отличаются друг от друга тем, как их атомы ориентированы в пространстве, и они являются невзаимопревращающимися без разрыва ковалентной связи. В практике данного изобретения конфигурационные изомеры могут быть взаимопревращаемыми, например, посредством разрыва и при необходимости повторного образования дисульфидных связей.
Таким образом, данное изобретение предусматривает контактирование гликозилированного рекомбинантного белка, который содержит смесь по меньшей мере двух конфигурационных изомеров этого рекомбинантного белка, с реагентом для сопряженного окисления-восстановления в течение периода времени, достаточного для увеличения относительной доли желательного конфигурационного изомера, и определение относительной доли желательного конфигурационного изомера в данной смеси. В другом аспекте данное изобретение предусматривает контактирование препарата рекомбинантного белка, который был продуцирован клетками млекопитающего, с реагентом для сопряженного окисления-восстановления при рН от около 7 до около 11 и выделение фракции препарата этого рекомбинантного белка с желательной конформацией. Предпочтительными рекомбинантными белками являются гликозилированные рекомбинантные белки, такие как, например, белки, продуцируемые эукариотическими клетками.
Данное изобретение может быть использовано для обработки почти любого белка для промотирования желательной конформации. Под термином «белок» подразумевают обычно полипептид из по меньшей мере 10 аминокислот, более предпочтительно по меньшей мере приблизительно 25 аминокислот, еще более предпочтительно по меньшей мере приблизительно 75 аминокислот и наиболее предпочтительно по меньшей мере из приблизительно 100 аминокислот. Способы данного изобретения находят особенное применение в обработке белков, которые имеют по меньшей мере приблизительно 3 остатка цистеина, более предпочтительно по меньшей мере приблизительно 8 остатков цистеина, еще более предпочтительно по меньшей мере приблизительно 15 остатков цистеина, даже еще более предпочтительно по меньшей мере приблизительно 30 и еще более предпочтительно по меньшей мере приблизительно 50-150 остатков цистеина.
Обычно способы данного изобретения применимы для улучшения способов получения рекомбинантных белков. Рекомбинантными белками являются белки, получаемые способом генетической инженерии. Термин «генетическая инженерия» относится к любому способу рекомбинантых ДНК или РНК, используемому для создания клетки-хозяина, которая экспрессирует ген при повышенных уровнях, при пониженных уровнях и/или продуцирует мутантную форму данного гена. Другими словами, эта клетка была трансфицирована, трансформирована или трансдуцирована рекомбинантной полинуклеотидной молекулой и посредством этого изменена таким образом, чтобы заставить эту клетку изменить экспрессию желательного белка. Способ и векторы для генетически сконструированных клеток и/или клеточных линий для экспрессии представляющего интерес белка хорошо известны специалистам в данной области; например, многочисленные способы иллюстрируются в Current Protocols in Molecular Biology, Ausubel et al., eds. (Wiley & Sons, New York, 1988 и ежеквартальные обновления) и Sambrook et al., Molecular Cloning: A Laboratory Manual, (Cold Spring Laboratory Press, 1989). Способы генетической инженерии включают в себя, но не ограничиваются ими, экспрессионные векторы, нацеленную гомологичную рекомбинацию и активацию генов (см., например, Патент США № 5272071, выданный Chapel) и транс-активацию генов сконструированными факторами транскрипции (см., например, Segal et al., 1999, Proc. Natl. Acad. Sci. USA 96(6): 2758-63).
Данное изобретение находит особенное применение в улучшении продуцирования белков, которые являются гликозилированными. Конкретно белки, которые секретируются системами на основе клеток грибов (например, дрожжей, нитчатых грибов) и системами на основе клеток млекопитающих, будут гликозилированными. Предпочтительно эти белки секретируются продукционными клетками млекопитающих, адаптированными к росту в клеточной культуре. Примерами таких клеток, обычно используемых в промышленности, являются клетки СНО, VERO, BHK, HeLa, СV1 (в том числе Cos), MDCK, 293, ЗТЗ, линии клеток миеломы (в частности, мышиной), PC 12 и WI38. Особенно предпочтительными клетками-хозяевами являются клетки яичника китайского хомячка (СНО), которые широко используются для получения нескольких сложных рекомбинантных белков, например, цитокинов, факторов свертывания и антител (Brasel et al., 1996, Blood 88:2004-2012; Kaufinan et al., 1988, J Biol Chem 263:6352-6362; McKinnon et al., 1991, J Mol Endocrinol 6:231-239; Wood et al., 1990, J Immunol 145:3011-3016). Недостаточная по дигидрофолатредуктазе (DHFR) мутантная клеточная линия (Uriaub et al., 1980, Proc Natl Acad Sci USA 77:4216-4220), DXB11 и DG-44 являются предпочтительными линиями клеток-хозяев СНО, так как эффективная DHFR-селектируемая и амплифицируемая система экспрессии делает возможным экспрессию высокого уровня рекомбинантного белка в этих клетках (Kaufinan R.J., 1990 Meth En2ymol 185:527-566). Кроме того, с этими клетками легко обращаться в виде прикрепленных или суспензионных культур, и они проявляют относительно хорошую генетическую стабильность. Клетки СНО и экспрессируемые в них рекомбинантные белки были основательно охарактеризованы и одобрены для применения в клиническом производстве регулирующими ведомствами.
Было обнаружено, что данное изобретение является мягким и эффективным способом для улучшения способа получения белков, которые могут принимать множественные конформации и/или содержат более одного домена. «Домен» является непрерывным районом полипептидной цепи, который принимает определенную третичную структуру и/или имеет определенную активность, которая может быть локализована в этом районе полипептидной цепи. Например, один домен белка может иметь аффинность связывания в отношении одного лиганда и один домен белка может иметь аффинность связывания в отношении другого лиганда. В смысле термостабильности доменом может называться единица кооперативного разворачивания белка. Такие белки, которые содержат более чем один домен, могут встречаться в природе в виде одного белка или могут быть генетически сконструированы в виде слитого белка. Кроме того, домены полипептида могут иметь суб домены.
В одном аспекте способы данного изобретения могут быть использованы на препаратах рекомбинантных белков, в которых по меньшей мере один домен белка имеет стабильную конформацию и по меньшей мере один домен белка имеет нестабильную конформацию. Термины «стабильная» и «нестабильная» используются в виде сравнительных терминов. Домен белка со стабильной конформацией будет иметь, например, более высокую температуру плавления (Tm), чем нестабильный домен этого белка при измерении в одном и том же растворе. Домен является стабильным в сравнении с другим доменом, когда различие в Tm составляет по меньшей мере приблизительно 2°С, более предпочтительно приблизительно 4°С, еще более предпочтительно приблизительно 7°С, даже еще более предпочтительно приблизительно 10°С, еще более предпочтительно приблизительно 15°С, еще более предпочтительно приблизительно 20°С, даже еще более предпочтительно приблизительно 25°С и наиболее предпочтительно приблизительно 30°С при измерении в одном и том же растворе.
Данное изобретение также обычно применимо к белкам, которые имеют Fc-домен и другой домен (например, антителам и Fc-слитым белкам). Например, в одном из неограничительных воплощений, иллюстрированных ниже, относящихся к TNFR:Fc, Tm для Fc-части этой молекулы равны 69,1 и 83,4°С, тогда как Tm для TNFR-части этой молекулы находится в диапазоне от 52,5°С (в более желательной конформации) до Tm 49,7°С (в менее желательной конформации).
Особенно предпочтительными белками являются лекарственные средства на основе белков, также известные как биопрепараты. Предпочтительно эти белки экспрессируются в виде внеклеточных продуктов. Белки, которые могут быть получены с использованием способов данного изобретения, включают в себя, но не ограничиваются ими, flt3-лиганд (описанный в WO 94/28391, который включен здесь в его полном виде путем отсылки), СD40-лиганд (описанный в US6087329, который включен здесь в его полном виде путем отсылки), эритропоэтин, тромбопоэтин, кальцитонин, Fas-лиганд, лиганд для рецептора активатора NF-каппа В (RANKL), родственный фактору некроза опухолей (TNF) индуцирующий апоптоз лиганд (TRAIL, описанный в WO 97/01633, включенном здесь во всей полноте путем отсылки), полученный из стромы тимуса лимфопоэтин, гранулоцитарный колониестимулирующий фактор, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF, описанный в Австралийском патенте № 588819, который включен здесь в полном виде путем отсылки), фактор роста тучных клеток, фактор роста стволовых клеток, эпидермальный фактор роста, RANTES (цитокин подсемейства С-С, продуцируемый Т-клетками), гормон роста, инсулин, инсулинотропин, инсулин-подобные факторы роста, паращитовидный гормон, интерфероны, факторы роста нервов, глюкагон, интерлейкины 1-18, колониестимулирующие факторы, лимфотоксин-р, фактор некроза опухолей (TNF), ингибиторный фактор лейкоза, онкостатин-М и различные лиганды для молекул поверхности клеток ELK и Hek (такие как лиганды для eph-родственных киназ (протеинтирозинкиназ) или LERK.S). Описания белков, которые могут быть очищены в соответствии со способами данного изобретения, могут быть найдены, например, в Human Cytokines: Handbook for Basic and Clinical Research, Vol. II (Aggarwal and Gutterman, eds. Blackwell Sciences, Cambridge, MA, 1998); Growth Factors: A Practical Approach (McKay and Leigh, eds., Oxford University Press Inc., New York, 1993); и The Cytokines Handbook (A.W. Thompson, ed.. Academic Press, San Diego, CA, 1991).
Препараты рецепторов, в частности растворимых форм этих рецепторов, для любого из вышеупомянутых белков могут быть также улучшены с использованием способов данного изобретения, в том числе для обеих форм TNFR (обозначаемых р55 и р75), рецепторов типов I и II интерлейкина-1 (как описано в ЕР 0460846, US 4968607 и US 5767064, которые включены здесь в их полном виде путем отсылки), рецептора интерлейкина-2, рецептора интерлейкина-4 (как описано в ЕР 0367566 и US 5856296, которые включены здесь в их полном виде путем отсылки), рецептора интерлейкина-15, рецептора интерлейкина-17, рецептора интерлейкина-18, рецептора гранулоцитарно-макрофагального колониестимулирующего фактора, рецептора гранулоцитарного колониестимулирующего фактора, рецепторов для онкостатина-М и ингибиторного фактора лейкоза, рецептора активатора NF-каппа В (RANK, описанного в US 6271349, включенном здесь в его полном виде путем отсылки), рецепторов для TRAIL (в том числе рецепторов 1, 2, 3 и 4 TRAIL) и рецепторов, которые содержат домены смерти, таких как Fas-рецептор или апопотоз-индуцирующий рецептор (AIR).
Другие белки, способ получения которых может быть улучшен с использованием способов данного изобретения, включают в себя кластер антигенов дифференцировки (обозначаемых как CD-белки), например, описанных в Leukocyte Typing VI (Proceedings of VIth International Workshop and Conference; Kixhimoto, Kikutani et al., eds.; Kobe, Japan, 1996), или CD-молекулы, раскрытые на последующих симпозиумах. Примеры таких молекул включают в себя CD27, CD30, CD39, CD40 и лиганды к ним (CD27-лиганд, CDЗ0-лиганд и CD40-лиганд). Некоторые из них являются членами семейства рецепторов TNF, которое включает в себя также 41ВВ и 0Х40; эти лиганды являются часто членами семейства TNF (например, лиганд 41ВВ и лиганд 0Х40); соответственно, члены семейств TNF и TNFR могут быть также получены с использованием данного изобретения.
Белки, которые являются ферментативно активными, могут быть также получены в соответствии с данным изобретением. Примеры включают в себя члены семейства металлопротеиназ-дезинтегринов (разрушающих интегрины), различные киназы, глюкоцереброзидазу, супероксиддисмутазу, тканевый активатор плазминогена, фактор VIII, фактор IX, аполипопротеин Е, аполипопротеин A-I, антагонист IL-2, альфа-1-антитрипсин, TNF-α-превращающий фермент и многочисленные другие ферменты. Лиганды для ферментативно активных белков могут также экспрессироваться с использованием данного изобретения.
Композиции и способы данного изобретения применимы также для получения других типов рекомбинантных белков, в том числе молекул иммуноглобулинов или их частей и химерных антител (например, антител, имеющих константную область человека, сопряженную с антигенсвязывающим участком мыши) или их фрагментов. Известны многочисленные способы, при помощи которых можно манипулировать с ДНК, кодирующей молекулы иммуноглобулинов, для получения ДНК, способных кодировать рекомбинантные белки, такие как одноцепочечные антитела, антитела с повышенной аффинностью или другие полипептиды на основе антител (см., например, Larrick et al., 1989, Biotechnology 7:934-938; Reichmann et al., 1988, Nature 332:323-327; Roberts et al., 1987, Nature 328:731-734; Verhoeyen et al., 1988, Science 239:1534-1536; Chaudhary et al., 1989, Nature 339:394-397). Препараты полностью человеческих антител (такие как препараты, получаемые с использованием трансгенных животных, и при необходимости затем модифицированные in vitro), а также гуманизированные антитела могут быть также использованы в данном изобретении. Термин гуманизированное антитело включает в себя также одноцепочечные антитела См., например, Cabilly et al., U.S. Pat. No. 4816567; Cabilly et al., European Patent No. 0125023 Bl; Boss et al., U.S. Pat. No. 4816397; Boss et al., European Patent No. 0120694 Bl; Neuberger, M.S. et al., WO 86/1533; Neuberger, M.S. et al., European Patent No. 0194276 B1; Winter, U.S. Patent No. 5225539; Winter, European Patent No. 0239400 Bl; Queen et al., European Patent No. 0451216 Bl и Padlan, E.A. et al., EP 0519596 Al. Способ данного изобретения может быть также использован во время получения конъюгатов, содержащих антитело и цитотоксическое или люминесцентное вещество. Такие вещества включают в себя: производные майтанзина (такие как DM1); энтеротоксины (такие как стафилококковый энтеротоксин); изотопы иода (такие как иод-125); изотопы технеция (такие как Тс-99т); цианиновые флуорохромы (такие как Су5.5.18); и инактивирующие рибосомы белки (такие как буганин, гелонин или сапорин-86).
Примеры антител или конъюгатов антитело/цитотоксин или антитело/люминофор, предусматриваемые данным изобретением, включают в себя такие антитела и конъюгаты, которые узнают любой вышеупомянутый белок или комбинацию вышеупомянутых белков и/или следующие антигены: CD2, CD3, CD4, CD8, CDlla, CD14, CD18, CD20, CD22, CD23, CD25, CD33, CD40, CD44, CD52, CD80 (В7.1), CD86 (В7.2), CD147, IL-ld. IL-lβ, IL-4, IL-5, IL-8, IL-10, рецептор IL-2, рецептор IL-4, рецептор IL-6, рецептор IL-13, субъединицы рецептора IL-18, PDGF-p, VEGF, TGF, TGF-p2, TGF-pl, рецептор EGF, рецептор VEGF, С 5-комплемент, IgE, опухолевый антиген СА125, опухолевый антиген MUC1, антиген РЕМ, LCG (который является продуктом гена, который экспрессируется при раке легкого), HER-2, ассоциированный с опухолью гликопротеин TAG-72, антиген SK-1, ассоциированные с опухолью эпитопы, которые присутствуют в повышенных количествах в сыворотках пациентов с раком толстой кишки и/или поджелудочной железы, ассоциированные с раком эпитопы или белки, экспрессируемые на раковых клетках молочной железы, толстой кишки, на плоских клетках, раковых клетках предстательной железы, поджелудочной железы, легкого и/или почки и/или на клетках меланомы, глиомы или нейробластомы, некротическом ядре опухоли, интегрин альфа 4 бета 7, интегрин VLA-4, интегрины В2, рецепторы TRAIL 1, 2, 3 и 4, RANK, лиганд RANK, TNF-α, молекулу адгезии VAP-1, молекулу адгезии эпителиальных клеток (ЕрСАМ), молекулу (фактор) межклеточной адгезии 3 (ICAM-3), адгезин лейкоинтегрин, гликопротеин тромбоцитов gp IIb/IIIa, тяжелую цепь миозина сердца, паращитовидный гормон, rNAPc2 (который является ингибитором тканевого фактора Vila), MHC I, раково-эмбриональный антиген (СЕА), альфа-фетопротеин (AFP), фактор некроза опухолей (TNF), CTLA-4 (который является ассоциированным с цитотоксическими Т-лимфоцитами антигеном), рецептор Fc-γ-1, HLA-DR 10 бета, антиген HLA-DR, L-селектин, IFN-y, респираторно-синцитиальный вирус, вирус иммунодефицита человека (ВИЧ), вирус гепатита В (HBV), Streptococcus mutans и Staphylococcus aureus.
С использованием способов данного изобретения могут быть получены препараты различных слитых белков. Примеры таких слитых белков включают в себя белки, экспрессируемые в виде слитых с частью молекулы иммуноглобулина белков, белки, экспрессируемые в виде слитых компонентом типа «застежки-молнии» (zipper) белков, и новые полифункциональные белки, такие как слитые белки цитокина и фактора роста (т.е. GM-CSF и IL-3, MGF и IL-3). В WO 93/08207 и WO 96/40918 описано получение различных растворимых олигомерных форм молекулы, называемой CD40L, включающей в себя слитый с иммуноглобулином белок и слитый с «застежкой-молнией» белок соответственно; обсуждаемые здесь способы применимы и к другим белкам. Любая из вышеупомянутых молекул может быть экспрессирована в виде слитого белка, включающего в себя, но не ограничивающегося ими, внеклеточный домен клеточной рецепторной молекулы, фермент, гормон, цитокин, часть молекулы иммуноглобулина, домен «застежки-молнии» и эпитоп.
Препаратом рекомбинантного белка может быть супернатант клеточной культуры, экстракт клеток, но предпочтительно частично очищенная фракция из них. Под «частично очищенной» имеют в виду, что были проведены некоторая процедура или некоторые процедуры фракционирования, но присутствуют дополнительные виды полипептидов (по меньшей мере 10%), иные, чем желательный белок или желательная конформация белка. Одним из преимуществ способов данного изобретения является то, что препарат рекомбинантного белка может быть с довольно высокой концентрацией. Предпочтительные диапазоны концентраций составляют 0,1-20 мг/мл, более предпочтительно от 0,5 до 15 мг/мл и еще более предпочтительно от 1 до 10 мг/мл.
Препарат рекомбинантного белка может быть первоначально получен культивированием рекомбинантных клеток-хозяев в условиях культивирования, подходящих для экспрессии данного полипептида. Полипептид может также экспрессироваться в виде продукта трансгенных животных, например в виде компонента молока трансгенных коров, коз, свиней или овец, которые характеризуются соматическими или зародышевыми клетками, содержащими нуклеотидную последовательность, кодирующую данный полипептид. Затем полученный экспрессированный полипептид может быть очищен или частично очищен из такой культуры или ее компонента (например, из культуральной среды или экстрактов клеток или жидкой среды организма) с использованием известных способов. Процедуры фракционирования могут включать в себя, но не ограничиваются ими, одну или несколько стадий фильтрования, центрифугирования, осаждения, разделения фаз, аффинной очистки, гель-фильтрационной хроматографии, ионообменной хроматографии, гидрофобной хроматографии (HIC; с использованием таких смол, как простой фениловый эфир, бутиловый эфир или пропиловый эфир), ВЭЖХ или какой-либо комбинации вышеперечисленного.
Например, очистка полипептида может включать в себя аффинную колонку, содержащую агенты, которые будут связываться с этим полипептидом; одну или несколько колоночных стадий с использованием таких аффинных смол, как конканавалин А-агароза, гепарин-toyopearl® или Cibacron blue ЗОА-Sepharose®; одну или несколько стадий, включающих в себя элюцию; и/или иммуноаффинную хроматографию.
Полипептид может экспрессироваться в форме, которая облегчает очистку. Например, он может экспрессироваться в виде слитого полипептида, такого как слитый полипептид с мальтозусвязывающим полипептидом, глутатион-8-трансферазой (GST) или тиоредоксином (TRX). Наборы для экспрессии и очистки таких слитых полипептидов являются коммерчески доступными от New England BioLab (Beverly, Mass.), Pharmacia (Piscataway, N.J.) и InVitrogen соответственно. Полипептид может быть помечен эпитопом и затем очищен с использованием специфического антитела, направленного на такой эпитоп.Один такой эпитоп (FLAG®) является коммерчески доступным от Kodak (New Haven, Conn.). Можно также использовать аффинную колонку, содержащую полипептидсвязывающий полипептид, например моноклональное антитело к данному рекомбинантному белку, для аффинной очистки экспрессированных полипептидов. Другими типами аффинной очистки может быть белок А- или белок G-колонка, аффинные агенты которой связываются с белками, содержащими Fc-домены. Полипептиды могут быть удалены с аффинной колонки с использованием общепринятых способов, например, в высокосолевом буфере для элюции, и затем диализованы против низкосолевого буфера для применения или изменением рН или других компонентов в зависимости от используемого аффинного матрикса, или могут быть конкурентно удалены с использованием природного субстрата аффинного компонента. В одном воплощении данного изобретения, иллюстрированном ниже, препарат рекомбинантного белка частично очищали посредством белок А-аффинной колонки.
Некоторые или все из предыдущих стадий очистки в различных комбинациях могут быть использованы для получения подходящего препарата рекомбинантного белка для использования в способах данного изобретения и/или для дополнительной очистки рекомбинантного полипептида после контактирования препарата рекомбинантного белка с реагентом для сопряженного окисления-восстановления. Полипептид, который является по существу свободным от других полипептидов млекопитающих, определяется как «изолированный полипептид».
Полипептид может быть также получен известным общепринятым химическим синтезом. Способы конструирования полипептидов посредством синтетических способов известны специалистам в данной области. Синтетически сконструированные полипептидные последовательности могут быть гликозилированы in vitro.
Желательная степень конечной очистки зависит от предполагаемого применения данного полипептида. Например, относительно высокая степень чистоты желательна, когда полипептид должен вводиться in vivo. В подобном случае полипептид очищают таким образом, чтобы никакие полипептидные полосы, соответствующие другим полипептидам, не детектировались при анализе электрофорезом в ДСН-полиакриламидном геле (ДСН-ПААГ). Специалисту в подходящей области будет понятно, что множественные полосы, соответствующие данному полипептиду, могут быть визуализированы при электрофорезе в ДСН-ПААГ вследствие дифференциального гликозилирования, дифференциального посттрансляционного процессинга и т.п. Более предпочтительно полипептид данного изобретения очищают до существенной гомогенности, как следует из единственной полипептидной полосы при анализе электрофорезом в ДСН-ПААГ. Эта полипептидная полоса может быть визуализирована окрашиванием серебром, Кумасси голубым и/или (если полипептид является радиоактивно меченым) авторадиграфией.
Под "контактированием" имеют в виду подвергание действию, и/или экспонирование действию в растворе. Белок или полипептид также может быть подвергнут контактированию, когда он связан с твердым носителем (например, аффинной колонкой или хроматографическим матриксом). Предпочтительно этот раствор является забуференным. Для максимизации выхода белка с желательной конформацией рН раствора выбирают защищающим стабильность данного белка и оптимальным для дисульфидного обмена. В практике данного изобретения рН раствора предпочтительно не является сильно кислым. Так, предпочтительные диапазоны рН являются большими, чем рН 5, предпочтительно от около рН 6 до около рН 11, более предпочтительно от приблизительно рН 7 до приблизительно рН 10 и еще более предпочтительно от приблизительно рН 7,6 до приблизительно рН 9,6. В одном неограничительном воплощении данного изобретения с использованием TNFR:Fc, который иллюстрируется ниже, было обнаружено, что оптимальный рН должен быть около рН 8,6. Однако оптимальный рН для конкретного воплощения данного изобретения может быть легко определен экспериментально специалистами в данной области.
Реагент для сопряженного окисления-восстановления является источником восстанавливающих агентов. Предпочтительными восстанавливающими агентами являются свободные тиолы (SH). Реагент для сопряженного окисления-восстановления предпочтительно включает соединение из группы, состоящей из восстановленного и окисленного глутатиона, дитиотреитола (ДТТ), 2-меркаптоэтанола, дитионитробензоата, цистеина и цистина. Для облегчения применения и экономии может быть использован восстановленный глутатион и/или восстановленный цистеин.
Реагент для сопряженного окисления-восстановления присутствует в концентрации, достаточной для увеличения относительной доли желательной конформации. Оптимальная концентрация реагента для сопряженного окисления-восстановления зависит от концентрации белка и числа дисульфидных связей в данном белке. Например, было обнаружено с использованием белка (TNFR:Fc) с 29 дисульфидными связями в концентрации 2 мг/мл (приблизительно 14 мкМ белок или 400 мкМ дисульфид), что реагент для сопряженного окисления-восстановления с 2 мМ восстановленным тиолом работал хорошо, увеличивая относительную долю желательной конформации. Это соответствует отношению приблизительно 35 свободных тиолов на 1 дисульфидную связь. Однако было также обнаружено, что отношения от 20 до 400 свободных тиолов на дисульфид также хорошо работали. Конечно, количество тиола, используемого для конкретной концентрации, может несколько варьировать в зависимости от восстанавливающей способности данного тиола и может быть легко определено специалистом в данной области.
Таким образом, обычно концентрация свободных тиолов из реагента для сопряженного окисления-восстановления может быть от приблизительно 0,05 до приблизительно 50 мМ, более предпочтительно приблизительно 0,1 - приблизительно 25 мМ и еще более предпочтительно приблизительно 0,2 - приблизительно 20 мМ.
Кроме того, реагент для сопряженного окисления-восстановления может содержать окисленные тиолы при более высоких, равных или более низких концентрациях в сравнении с восстановленным тиоловым компонентом. Например, реагент для сопряженного окисления-восстановления может быть комбинацией восстановленного глутатиона и окисленного глутатиона. Посредством реальных рабочих примеров было обнаружено, что отношение восстановленного глутатиона к окисленному глутатиону от приблизительно 1:1 до приблизительно 100:1 (восстановленные тиолы:окисленные тиолы) может работать одинаково хорошо. Альтернативно в другом воплощении реагент для сопряженного окисления-восстановления может быть цистеином или комбинацией цистеина и цистина. Таким образом, при включении окисленных тиолов в исходный реагент для сопряженного окисления-восстановления отношение восстановленных тиолов к окисленным тиолам может быть в предпочтительном варианте от приблизительно 1:10 до приблизительно 1000:1, более предпочтительно приблизительно 1:1 - приблизительно 500:1, еще более предпочтительно приблизительно 5:1-100:1, еще более предпочтительно приблизительно 10:1.
Контактирование препарата рекомбинантного белка с реагентом для сопряженного окисления-восстановления выполняют в течение времени, достаточного для увеличения относительной доли желательной конформации. Любое относительное увеличение в этой доле является желательным, но предпочтительно по меньшей мере 10% белка с нежелательной конформацией превращается в белок с желательной конформацией. Более предпочтительно по меньшей м