Способ определения частоты мутантных по т-клеточному рецептору лимфоцитов периферической крови человека
Иллюстрации
Показать всеИзобретение относится к области медицинской генетики, конкретно к методам определения соматических генных мутаций в клетках человека. Для осуществления способа выделяют фракцию мононуклеарных клеток периферической крови, окрашивают их меченными антителами к CD3 и CD4 и анализируют иммунофенотип клеток с помощью проточной цитометрии. Выделенные клетки дополнительно окрашивают мечеными антителами к CD56 и(или) HLA-DR. Далее на основе показателей светорассеяния выделяют неповрежденные лимфоциты, среди которых затем выявляют мутантные CD3-CD4+CD56- (и/или HLA-DR-) клетки. Частоту мутантных клеток вычисляют как отношение числа CD3-CD4+CD56- (и/или HLA-DR-) лимфоцитов к числу CD3+CD4+клеток. Использование способа позволяет повысить точность идентификации и количественной оценки мутантных клеток, проводить дозиметрию и индикацию действия генотоксических факторов на организм человека. 4 ил., 2 табл.
Реферат
Изобретение относится к области медицины, точнее к области медицинской генетики, конкретно к проточно-цитометрическому способу определения частоты мутантных по Т-клеточному рецептору Т-лимфоцитов в периферической крови человека на основе анализа иммунофенотипа клеток.
Информацию о количестве мутаций в соматических клетках человека используют для индикации действия генотоксических агентов, определения дозы действия таких агентов, а также для определения спонтанной интенсивности соматического мутагенеза в различных тканях и органах. Эта информация необходима для экологического мониторинга, научного обоснования норм и правил безопасной работы с генотоксическими факторами разнообразной природы, отбора лиц, пригодных для работы во вредных условиях. Кроме того, по общепринятому мнению, соматические мутации являются причиной злокачественной трансформации клеток, причем большая часть из них - генные, а не структурные мутации. Выявление лиц с большим количеством/частотой клеток, несущих генные мутации, является важной медицинской задачей, т.к., по всей вероятности, позволит формировать группы людей с повышенным риском развития злокачественных новообразований, при диспансеризации рано выявлять опухоли, а следовательно, вылечивать таких больных, уменьшать затраты на лечение и снижать смертность заболевших.
Лимфоциты периферической крови являются основным объектом исследования соматических мутаций разного типа, включая генные и структурные мутации. Эффективность возникновения тех и других мутаций под действием различных генотоксических факторов, а также механизмы и последствия их формирования в определенной степени различаются. Поэтому для решения упомянутых выше научных и практических задач необходимо располагать информацией о частоте не только структурных (хромосомных, хроматидных), но и генных мутаций в клетках периферической крови (как наиболее доступного биологического материала). Для этого необходимо иметь методы, позволяющие точно и быстро выявлять мутации в отдельных генных локусах при обследовании больших контингентов людей.
Известен способ определения частоты клеток с мутациями по локусу гликофорина A (Langlois et al., 1987). Он основан на проточно-цитометрическом анализе иммунофенотипа эритроцитов периферической крови. Способ высокопроизводителен, однако пригоден для обследования только гетерозиготных по указанному локусу лиц, которые составляют примерно половину популяции. Невозможность обследования всей популяции является существенным недостатком способа.
Известен способ определения частоты лимфоцитов с мутациями по локусу гипоксантин - гуанин фосфорибозил трансферазы (Albertini et al., 1982). Идентификацию мутантных клеток проводят с помощью методов клонирования клеток в селективной среде, что занимает около 10-14 суток. Для анализа требуется 10-20 мл периферической крови. Длительное время культивирования, большая трудоемкость и довольно большой объем крови, необходимый для исследования, являются недостатками способа.
Известен способ определения частоты лимфоцитов с мутациями по локусу Т-клеточного рецептора (Kyoizumi et al., 1990). Способ основан на выявлении среди Т-лимфоцитов, а именно Т-хелперов, характеризующихся CD4+ фенотипом, клеток с фенотипом CD3-CD4+ (в дальнейшем CD3-CD4+ клетки). Сокращение CD от англ. «claster of differentiation» обозначает кластер дифференцировки клеток крови, т.е. субпопуляцию клеток, характеризующихся присутствием и/или отсутствием на их поверхности специфических антигенов, каждый из которых обозначен цифрой; в настоящее время известно более 300 таких специфических антигенов-маркеров на поверхности клеток кроветворного ряда. Материалом для исследования являлись образцы периферической крови, из которых была выделена фракция мононуклеарных клеток с помощью фиколл-пака. Мононуклеарные клетки были окрашены меченными фикоэритрином (ФЭ) антителами к CD3-антигену и меченными флуоресцеином (ФЛ) антителами к CO4-антигену. Анализ иммунофенотипа клеток был проведен с помощью однолазерной проточной цитометрии. CD3-CD4+ лимфоциты были выделены японскими исследователями, клонированы в присутствии фитогемагглютинина и исследованы. В результате было установлено, что около 85% клонированных клеток несут мутации в локусе Т-клеточного рецептора (T-cell receptor - TCR). Эти мутации и являются основной причиной отсутствия на поверхности мутантных клеток CD3-антигена, поэтому предложенный способ был назван методом определения лимфоцитов, мутантных по TCR. Поскольку на момент разработки японскими исследователями описанного способа не было известно других лимфоцитов с фенотипом CD3-CD4+, кроме мутантных Т-хелперов, этот способ считали достаточным для выявления мутантных Т-хелперов. Данный способ, основанный на высокоскоростном полуавтоматическом анализе клеток, обладает высокой производительностью, позволяет обследовать до нескольких десятков образцов в течение одного рабочего дня. К несомненному достоинству способа относится также относительно небольшой объем периферической крови, необходимый для проведения анализа. Поэтому способ пригоден для обследования больших контингентов людей.
Недостаток этого способа определения TCR-мутантных лимфоцитов: за время, прошедшее с момента его разработки, было обнаружено, что не только мутантные Т-хелперы, но и некоторые нормальные ядерные (не мутантные) клетки крови также имеют фенотип CD3-CD4+. Такие клетки вносят неточность в выявление мутантных Т-хелперов и завышают их количество.
Известны результаты определения частоты TCR-мутантных лимфоцитов у персонала онкологических клиник (Lanza A. et al., 1999). Способ определения частоты TCR-мутантных клеток, использованный этой работе, полностью соответствует тому, который был предложен в работе Kyoizumi et al., 1990, поэтому имеет тот же недостаток - неточность выявления мутантных Т-хелперов.
Известны результаты определения частоты TCR-мутантных лимфоцитов у онкологических больных и здоровых лиц (Замулаева И.А. и др., 2001). В данном случае способ определения частоты TCR-мутантных клеток также полностью соответствует тому, который был предложен в работе Kyoizumi et al., 1990, поэтому имеет тот же недостаток - неточность.
Известен способ выявления в периферической крови человека так называемых натуральных киллеров (NK-клеток) с фенотипом CD3-CD4+CD56+ (Mittag et al., 2005). Способ основан на использовании семицветной лазерной сканирующей микроскопии клеток. Сначала клетки цельной крови окрашивают с помощью смеси моноклональных антител, меченных разными флуорохромами. Затем проводят лизирование эритроцитов, оставшиеся ядросодержащие клетки наносят на предметное стекло и анализируют их светорассеяние и флуоресценцию. Для определения количества NK-клеток с фенотипом CD3-CD4+CD56+ используют два алгоритма: 1) выделяют последовательно популяции клеток с низким светорассеянием, среди них популяцию клеток CD14-CD45+high, среди последних - популяцию CD3-CD16- клеток, среди последних - популяцию CD19-CD56+CD4+ клеток; 2) выделяют последовательно популяции клеток с низким светорассеянием, среди них популяцию клеток CD14-CD45+high, среди последних - популяцию СD3-CD16+ клеток, среди последних - популяцию CD56+CD4+ клеток. Таким образом, идентифицируют CD3-CD4+CD56+ клетки и определяют их количество в процентах от общего числа лейкоцитов и NK-клеток. Авторы указанной работы, посвященной решению проблем иммунологии, а не генетики, не предполагают и не анализируют возможный вклад NK-клеток в общее количество CD3-CD4+клеток.
Главный недостаток способа: не доказано, что идентифицируемые таким способом CD3-CD4+CD56-CD16- клетки действительно представляют собой Т-хелперы, несущие мутации по TCR-локусу. Более того, авторы способа даже не рассматривают такой возможности. Кроме того, поскольку TCR-мутантные клетки встречаются с очень низкой частотой (Kyoizumi et al., 1990), для надежного определения их частоты необходимо анализировать несколько сотен тысяч нормальных немутантных клеток. Проточная цитометрия позволяет это делать за несколько минут, в то время как лазерная сканирующая микроскопия даже в автоматическом режиме работы - за несколько часов (возможно, несколько десятков часов). Поэтому описанный способ, основанный на использовании лазерной сканирующей микроскопии, непригоден для точной количественной оценки мутантных клеток из-за низкой производительности. К недостаткам способа следует также отнести необходимость использования большого количества моноклональных антител и дорогостоящего оборудования, что обусловливает высокую стоимость такого анализа.
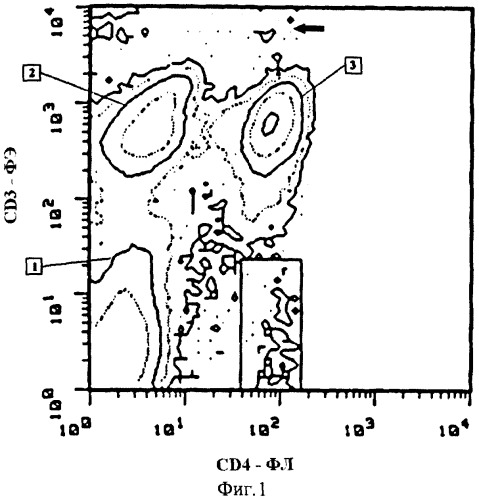
Прототипом рассматриваемого изобретения является проточно-цитометрический способ выявления TCR-мутантных лимфоцитов (Kyoizumi et al., 1992). В этом способе образцы периферической крови наслаивают на фиколл-гипак, затем центрифугируют и по плотности клеток выделяют фракцию мононуклеарных клеток. Мононуклеарные клетки окрашивают антителами к CD4, меченными ФЛ, и к CD3, меченными ФЭ. Затем к мононуклеарным клеткам добавляют пропидиум иодид в конечной концентрации 10 мкг/мл для разделения живых и мертвых клеток. С помощью проточного цитометра получают распределение клеток по интенсивности флуоресценции ФЛ и ФЭ (фиг.1). Для CD3+CD4+ клеток определяют среднее значение интенсивности флуоресценции ФЭ. На графике распределения клеток по интенсивности флуоресценции ФЛ и ФЭ устанавливают аналитическое окно для идентификации мутантных клеток. Верхняя граница этого окна соответствует 4% от средней интенсивности флуоресценции по ФЭ нормальных CD3+CD4+ клеток. Частоту мутантных клеток вычисляют как отношение количества клеток с фенотипом CD3- CD4+, попадающих в описанное аналитическое окно, к числу CD3+CD4+ клеток.
Недостаток описанного в прототипе способа определения частоты TCR-мутантных лимфоцитов заключается в следующем: способ основан на предположении, что фенотип CD3-CD4+ присущ только мутантным клеткам. Однако, как указано в работе Mittag et al., 2005, в крови могут присутствовать нормальные клетки с таким же фенотипом. Наличие таких клеток в крови завышает результаты определения частоты TCR-мутантных лимфоцитов при использовании прототипа.
Техническим результатом заявляемого изобретения является создание способа, обеспечивающего иммунофенотипическую идентификацию и количественную оценку TCR-мутантных лимфоцитов периферической крови человека в смеси нормальных и мутантных клеток, характеризующихся фенотипом CD3-CD4+.
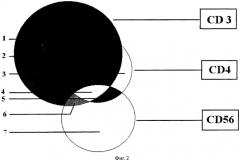
Для достижения технического результата в соответствии с прототипом выделяют фракцию мононуклеарных клеток периферической крови, окрашивают их меченными антителами к CD3 и CD4 и анализируют иммунофенотип клеток с помощью проточной цитометрии. В отличие от прототипа выделенные клетки дополнительно окрашивают мечеными антителами к CD56 и HLA-DR - антигенам, характерным для нормальных NK- клеток (фиг.2). В отношении разнообразия флуорохромов возможны два варианта: 1) все антитела, за исключением CD4, промечивают одним и тем же флуорохромом, для анализа используют приборы, имеющие только два флуоресцентных канала; 2) для промечивания каждого из указанных типов антител используют разные флуорохромы, анализ фенотипа клеток проводят с помощью проточных цитометров, оснащенных тремя флуоресцентными каналами. Второй вариант позволяет не только выделить TCR-мутантные Т-хелперы из смеси нормальных и мутантных клеток с фенотипом CD3-CD4+, но и определить количество нормальных NK-клеток в указанной смеси. Далее на основе показателей светорассеяния выделяют неповрежденные лимфоциты, среди которых затем выявляют мутантные CD3-CD4+CD56- (и/или HLA-DR-) клетки. Частоту мутантных клеток определяют по соотношению числа CD3-CD4+CD56-(и/или HLA-DR-) лимфоцитов и числа CD3-CD4+ клеток.
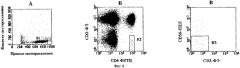
Фиг.1. Контурный график распределения мононуклеарных клеток по интенсивности флуоресценции ФЛ и ФЭ. Стрелка указывает мертвые клетки, окрашенные пропидиум иодидом. Прямоугольник показывает аналитическое окно для мутантных CD3-CD4+ клеток:
1 - субпопуляция CD3-CD4+ клеток;
2 - субпопуляция CD3+CD4- клеток;
3 - субпопуляция CD3+CD4+ клеток.
Фиг.2. Идентификация различных субпопуляций клеток мононуклеарной фракции крови по коэкпрессии поверхностных маркеров CD3, CD4, CD56. Окружности обозначают множество клеток с экспрессией каждого из перечисленных маркеров. Цифры указывают субпопуляции клеток с разным иммунофенотипом:
1 - CD3+CD4-CD56- T-лимфоциты;
2 - CD3+CD4+CD56- Т-хелперы;
3 - CD3-CD4+CD56- TCR-мутантные Т-хелперы;
4 - CD3+CD4+CD56+ NKT-клетки;
5 - CD3-CD4+CD56+ NK-клетки;
6 - CD3+CD4-CD56+ NKT-клетки;
7 - CD3-CD4-CD56+ NK-клетки.
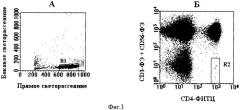
Фиг.3.
А. Распределение мононуклеарных клеток по интенсивности прямого и бокового светорассеяния. R1 - регион неповрежденных клеток.
Б. Распределение мононуклеарных клеток из региона R1, окрашенных антителами к CD3, CD4, CD56 в соответствии с предлагаемым способом, по интенсивности флуоресценции ФИТЦа и ФЭ. Регион R2 показывает аналитическое окно для мутантных CD3-CD4+CD56- клеток.
Фиг.4.
А. Распределение мононуклеарных клеток по интенсивности прямого и бокового светорассеяния. R1 - регион неповрежденных клеток.
Б. Распределение мононуклеарных клеток из региона R1 по интенсивности флуоресценции ФИТЦа и ФЭ. R2 - регион CD3-CD4+ клеток.
В. Распределение мононуклеарных клеток из региона R2 по интенсивности флуоресценции ФЭ и ПХЛ. Регион R3 показывает аналитическое окно для мутантных CD3-CD4+CD56- клеток.
Пример 1.
Описание предлагаемого способа с использованием двух флуорохромов.
3 мл венозной крови собирают в пробирки с антикоагулянтом. Кровь разбавляют в 2 раза раствором Хенкса, затем наслаивают на 3 мл раствора фиколл-урографина (плотность 1,077) и центрифугируют в течение 30 минут при 250 g. Клетки из слоя мононуклеаров собирают, добавляют 10 мл раствора Хенкса и центрифугируют при 350 g в течение 15 мин. Осадок ресуспендируют в 10 мл раствора Хенкса и центрифугируют в тех же условиях. Затем осадок ресуспендируют в 0,01 М фосфатном буфере (ФБ, рН 7,2-7,4), содержащем 0,15 М NaCl, и центрифугируют при 350 g в течение 15 мин. Последнюю процедуру повторяют два раза. Отбирают (1,0-1,5)·106 клеток.
К клеткам добавляют моноклональные антитела к CD4, меченные флуоресцеинизотиоционатом - ФИТЦем, а также к CD3 и CD56 (или HLA-DR), меченные ФЭ, и инкубируют в темноте 30-40 минут. Затем к клеткам добавляют 1,0-2,0 мл ФБ, содержащего 1,0% бычьего сывороточного альбумина и 0,1% NaN3, и центрифугируют (300 g, 5 минут). К осадку добавляют 0,4-0,5 мл ФБ, затем суспензию клеток фильтруют через нейлоновый фильтр (Д-45 мкм) и фиксируют в 0,5 мл 1% раствора формальдегида в ФБ.
Образцы анализируют на проточном цитофлуориметре, оснащенном двумя флуоресцентными каналами и лазером (длина волны 488 нм). Анализ клеток в образце проводят по четырем параметрам: интенсивности прямого и бокового (бидиректного) светорассеяния (линейная шкала), флуоресценции ФИТЦа и ФЭ (логарифмическая шкала). Для измерения флуоресценции ФИТЦа используют узкополосные фильтры 530/30 нм, ФЭ - 575/26 нм.
Полученные данные регистрируют в табличном виде. Анализ данных осуществляют в следующем порядке (фиг.3). С помощью известных технических средств строят график распределения клеток по интенсивности светорассеяния (фиг.3А). На графике выбирают регион неповрежденных лимфоцитов (R1). Строят график распределения клеток из региона R1 по интенсивности флуоресценции (фиг.3Б). На графике определяют количество клеток с иммунофенотипом CD3+CD4+, характерным для нормальных Т-хелперных лимфоцитов, определяют среднюю интенсивность их флуоресценции по ФЭ. На том же графике выбирают регион R2 (аналитическое окно для клеток с иммунофенотипом CD3-CD4+CD56- (или HLA-DR-), который соответствует мутациям по TCR-локусу). Верхняя граница этого региона соответствует 4% от средней интенсивности флуоресценции нормальных CD3+CD4+ по ФЭ. Далее определяют частоту (фракцию) мутантных клеток как отношение числа клеток с фенотипом СD3-CD4+CD56- (или HLA-DR-) к числу CD3+CD4+ клеток. В каждом образце анализируют 2·105 лимфоцитов.
Пример 2.
Описание предлагаемого способа с использованием трех флуорохромов.
3 мл венозной крови собирают в пробирки с антикоагулянтом. Кровь разбавляют в 2 раза раствором Хенкса, затем наслаивают на 3 мл раствора фиколл-урографина (плотность 1,077) и центрифугируют в течение 30 минут при 250 g. Клетки из слоя мононуклеаров собирают, добавляют 10 мл раствора Хенкса и центрифугируют при 350 g в течение 15 мин. Осадок ресуспендируют в 10 мл раствора Хенкса и центрифугируют в тех же условиях. Затем осадок ресуспендируют в ФБ, содержащем 0,15 М NaCl, и центрифугируют при 350 g в течение 15 мин. Последнюю процедуру повторяют два раза. Отбирают (1,0-1,5)·106 клеток.
К клеткам добавляют моноклональные антитела к CD4, меченные флуоресцеинизотиоционатом - ФИТЦем, к CD3, меченные ФЭ, к CD56 (или HLA-DR), меченные перидининхлорофиллином (ПХЛ), и инкубируют в темноте 30-40 минут. Затем к клеткам добавляют 1,0-2,0 мл ФБ, содержащего 1,0% бычьего сывороточного альбумина и 0,1% NaN3, и центрифугируют (300 g, 5 минут). К осадку добавляют 0,4-0,5 мл ФБ, затем суспензию клеток фильтруют через нейлоновый фильтр (Д-45 мкм) и фиксируют в 0,5 мл 1% раствора формальдегида в ФБ.
Образцы анализируют на проточном цитофлуориметре, оснащенном тремя флуоресцентными каналами и лазером (длина волны 488 нм). Анализ клеток в образце проводят по пяти параметрам: интенсивности прямого и бокового светорассеяния (линейная шкала), флуоресценции ФИТЦа, ФЭ и ПХЛ (логарифмическая шкала). Для измерения флуоресценции ФИТЦа используют узкополосные фильтры 530/30 нм, ФЭ -575/26 нм, ПХЛ - 675/20 нм.
Полученные данные регистрируют в табличном виде. Анализ данных осуществляют в следующем порядке (фиг.4). С помощью известных технических средств строят график распределения клеток по интенсивности светорассеяния (фиг.4А), где выбирают регион неповрежденных лимфоцитов (R1). Строят график распределения клеток из региона R1 по интенсивности флуоресценции ФИТЦа и ФЭ (фиг.4Б), где определяют количество клеток с иммунофенотипом CD3+CD4+, характерным для нормальных Т-хелперных лимфоцитов, и определяют среднюю интенсивность их флуоресценции по ФЭ. На графике (фиг.4Б) выделяют регион R2 клеток с иммунофенотипом CD3-CD4+. Верхняя граница этого региона соответствует 4% от средней интенсивности флуоресценции нормальных CD3+CD4+ по ФЭ. Строят график распределения клеток из региона R2 по интенсивности флуоресценции ФЭ и ПХЛ (фиг.4В), где определяют фракцию (количество) СD3-СD4+СD56-(или HLA-DR-), который соответствует клеткам с мутациями по TCR-локусу (R3). Далее определяют частоту мутантных клеток как отношение числа клеток с фенотипом CD3-CD4+CD56- (или HLA-DR-) к числу CD3+CD4+ клеток. В каждом образце анализируют 2·105 лимфоцитов.
Описанная комбинация флуорохромов позволяет не только выделить TCR-мутантные Т-хелперы из смеси CD3-CD4 клеток и определить их частоту, но и оценить фракцию (количество) нормальных CD3-CD4+CD56+ NK-клеток.
Пример 3.
Сравнение результатов определения частоты TCR-мутантных клеток в периферической крови 9 лиц с помощью антител к CD3 и CD4 (по методике прототипа) или с помощью антител к CD3, CD4 и HLA-DR (способ, описанный в примере 1) (табл.1).
Таблица 1
| № донора крови | Частота TCR-мутантных клеток, ×10-4 | Уменьшение частоты мутантных клеток по сравнению с прототипом, % | |
| При использовании антител к CD3 и CD4 | При использовании антител к CD3, CD4 и HLA-DR | ||
| 1 | 18,3 | 8,0 | 56,3 |
| 2 | 12,0 | 8,5 | 29,2 |
| 3 | 7,3 | 4,6 | 37,0 |
| 4 | 7,0 | 2,5 | 64,3 |
| 5 | 6,3 | 6,0 | 4,8 |
| 6 | 5,2 | 3,9 | 25,0 |
| 7 | 5,1 | 3,8 | 25,5 |
| 8 | 3,6 | 3,3 | 8,3 |
| 9 | 2,5 | 2,0 | 20,0 |
| В среднем | 30,0 |
Из примера 3 следует, что частота TCR-мутантных клеток у всех обследованных лиц ниже при использовании дополнительных антител к HLA-DR, чем в прототипе. В среднем уменьшение составляет 30%.
Пример 4.
Результаты определения частоты TCR-мутантных клеток с помощью различных смесей антител в 4-х независимых экспериментах. Во всех случаях были использованы антитела к CD4, меченные ФЛ, и антитела к CD3, CD56, HLA-DR, меченные ФЭ (табл.2).
Таблица 2
| № пробы | Поверхностные маркеры, антитела к которым вносятся в пробу | Частота TCR-мутантных клеток, ×10-4,среднее ±SE |
| 1 | CD3, CD4 | 4,5±0,7 |
| 2 | CD3, CD4, HLA-DR | 3,8±0,6 |
| 3 | CD3, CD4, CD56 | 3,9±1,1 |
| 4 | CD3, CD4, HLA-DR, CD56 | 3,8±0,8 |
Из примера 4 следует, что клетки, связывающие антитела к HLA-DR, несут на своей поверхности маркер CD56, т.е. действительно являются нормальными NK-клетками, как и предполагалось.
Положительный эффект предлагаемого способа определения частоты TCR-мутантных клеток позволяет повысить точность идентификации мутантных клеток, что, в свою очередь, позволит более точно:
- проводить индикацию действия генотоксических агентов на организм человека;
- определять дозы действия таких агентов;
- оценивать интенсивность спонтанного мутагенеза в соматических клетках человека;
- формировать группы повышенного канцерогенного риска и группы лиц, непригодных к работе во вредных условиях, связанных с генотоксическими воздействиями.
Повышение точности способа определения TCR-мутантных лимфоцитов имеет важное значение для решения научных и практических задач в области медицинской генетики, экологии человека, онкологии, молекулярной эпидемиологии, радиационной биологии и радиационной медицины.
Например, актуальной проблемой радиационной экологии человека является выяснение генотоксических эффектов действия ионизирующего излучения в малых дозах на население регионов, загрязненных радионуклидами в результате аварии на Чернобыльской АЭС. Предлагаемый способ определения частоты TCR-мутантных лимфоцитов обеспечивает более точную оценку эффектов радиационного воздействия на генетический материал соматических клеток жителей загрязненных радионуклидами территорий. Нами проведено обследование 529 жителей ряда загрязненных районов Брянской, Калужской, Орловской и Тульской областей. Установлено, что средняя частота TCR-мутантных клеток варьирует в широком диапазоне от 0,8·10-4 до 52,9·10-4, составляя в среднем 4,3·10-4.
Предлагаемый способ оценки соматического мутагенеза по TCR-локусу требует небольшого объема периферической крови, является высокопроизводительным, поэтому позволяет обследовать большой контингент людей в короткие сроки.
Литература
1. Замулаева И.А., Смирнова С.Г., Орлова Н.В., Селиванова Е.И., Андреев В.Г., Саенко А.С. Повышенная частота мутантных по локусам Т-клеточного рецептора и гликофорина А клеток как возможный критерий для формирования группы риска онкологических заболеваний // Российский онкологический журнал. - 2001. - №1. - С.23-25.
2. Albertini R.J., Castle K.L., Borchering W.R. T-cell cloning to detect the mutant 6-thioguanine resistant lymphocytes present in human peripheral blood // Proc. Natl. Acad. Sci. - 1982. - V.79. - P.6617-6621.
3. Kyoizumi S., Akiyama M., Hirai Y. et al. Spontaneous loss and alteration of antigen receptor expression in mature CD4+Т cells // J. Exp. Med. - 1990. - V.171. - P.1981-1999.
4. Kyoizumi S., Akiyama M., Umeki S., Hirai Y. et al. Frequency of mutant Т lymphocytes defective in the expression of the T-cell antigen receptor gene among radiation-exposed people // Mutat. Res. - 1992. - V.265. - P.173-180.
5. Langlois R.G., Bigbee W.L., Kyoizumi S. et al. Evidence for increased somatic mutations at the glycophorin A locus in atomic bomb survivors // Science. - 1987. - V.236. - P.445-448.
6. Lanza A., Robustelli della Guna F.S., Zibera C. et al. Somatic mutations at the T-cell antigen receptor in antineoplastic drug-exposed populations: comparison with sister chromatid exchange frequency // Int. Arch. Occup. Environ. Health. - 1999. - V.72. - P.315-322.
7. Mittag A., Lenz D., Gerstner A.O.H. et al. Polychromatic (Eight-color) slide-based cytometry for phenotyping of leukocyte, NK, and NKT subsets // Cytometry A. - 2005. - V.65. - N2. - P.103-115.
Способ определения частоты мутантных по Т-клеточному рецептору лимфоцитов периферической крови человека, включающий выделение мононуклеарных клеток посредством центрифугирования, окрашивание мононуклеарных клеток антителами к CD3, меченными фикоэритрином, и к CD4, меченными флуоресцеином, анализ иммунофенотипа лимфоцитов с помощью проточной цитометрии, отличающийся тем, что мононуклеарные клетки дополнительно окрашивают антителами к CD56 и(или) HLA-DR, меченными фикоэритрином или другими флуорохромами, посредством светорассеяния выделяют неповрежденные лимфоциты, определяют количество клеток с иммунофенотипом CD3+CD4+, клеток с иммунофенотипом CD3-CD4+CD56- (или HLA-DR-) и определяют частоту CD3-CD4+CD56- TCR-мутантных клеток среди CD3+CD4+T-хелперов как отношение числа клеток с фенотипом CD3-CD4+CD56-(или HLA-DR-) к числу CD3+CD4+клеток.