2-арилпропионовые кислоты и содержащие их фармацевтические композиции
Иллюстрации
Показать всеИзобретение относится к медицине и касается применения соединений (R,S)-2-арилпропионовых кислот формулы (Ia) и их (R)- и (S)-энантиомеров, в качестве ингибиторов IL-8 индуцируемого хемотаксиса нейтрофилов (PMN лейкоцитов), проявляющих неожиданную способность эффективно ингибировать IL-8-индуцируемый хемотаксис нейтрофилов и дегрануляцию без заметного влияния на активность циклооксигеназ, для лечения таких заболеваний как псориаз, язвенный колит, меланома, хроническое обструктивное легочное заболевание (COPD), буллезная пузырчатка, ревматоидный артрит, идиопатический фиброз, гломерулонефрит, и для профилактики и лечения повреждений, вызванных ишемией и реперфузией. 7 н. и 2 з.п. ф-лы, 3 табл.
Реферат
Настоящее изобретение относится к (R,S) 2-арилпропионовым кислотам, их энантиомерам (R) и (S) и к содержащим их фармацевтическим композициям, которые используют для профилактики и лечения повреждений тканей, вызванных усиленным накоплением полиморфоядерных нейтрофилов (PMN лейкоциты) в участках воспалений.
Определенные клетки крови (макрофаги, гранулоциты, нейтрофилы, полиморфоядерные) реагируют на химические стимулы (при стимуляции веществами, называемыми хемокинами) путем миграции в направлении градиента концентрации стимулирующего агента, и процесс этот носит название хемотаксиса. Основные известные стимулирующие агенты или хемокины представлены продуктами разложения комплемента C5a, некоторыми N-формилпептидами, образующимися в результате лизиса поверхностей бактерий, или пептидами синтетического происхождения, такими как формил-метионил-лейцил-фенилаланин (f-MLP) и, главным образом, разнообразными цитокинами, включая интерлейкин-8 (IL-8). Интерлейкин-8 является эндогенным хемотаксическим фактором, продуцируемым большинством содержащих ядра клеток, таких как фибробласты, макрофаги, эндотелиальные и эпителиальные клетки, подвергнутые воздействию TNF-α (фактор некроза опухоли) стимулов, интерлейкины IL-1α и IL-1β и липополисахариды бактериальных стенок (LPS), так же, как и те же нейтрофилы, экспонированные воздействию LPS, или N-формилпептиды бактериального происхождения (f-MLP). К семейству указанного хемотаксического фактора [известного также как активирующий нейтрофилы фактор (NAF), T-лимфоцитный хемотаксический фактор, моноцитпроизводный нейтрофильный хемотаксический фактор (MDNCF)] принадлежит ряд IL-8-подобных хемокинов [GRO α, β, γ и NAP-2], которые связываются с IL-8 рецепторами (Chang et al., J. Immunol., 148, 451, 1992). Нейтрофилы защищают от бактериальной инфекции благодаря способности этих клеток мигрировать из периферической крови через эндотелиальные соединения и тканевые матрицы в направлении активных участков (то есть вдоль градиентов концентрации хемотаксического фактора), где они действуют, атакуя микроорганизмы, удаляя поврежденные клетки и восстанавливая ткани (M.A. Goucerot-Podicalo et al., Pathol. Biol (Paris), 44, 36, 1996).
При некоторых патологических состояниях, характеризуемых усиленным накоплением нейтрофилов, более серьезное повреждение тканей на участке связано с инфильтрацией нейтрофильных клеток. Недавно была продемонстрирована роль активации нейтрофилов в определении повреждений, связанных с пост-ишемической реперфузией и гипероксией легких.
Экспериментальные модели [N. Sekido et al., Nature, 365, 654, 1993 и T. Matsumoto et al., Lab. Investig., 77, 119, 1997] и клинические исследования [A Mazzone et al., Recent Prog. Med., 85, 397, 1994; G. Receipts et al., Atheroscl., 91, 1, 1991] продемонстрировали прямую корреляцию между клеточными повреждениями и степенью инфильтрации PMN лейкоцитов, причем IL-8 являются наиболее специфическими и мощными ее активаторами. У пациентов с острой респираторной недостаточностью (ARDS) усиленное накопление нейтрофилов в воздушных путях и в легочных жидкостях можно хорошо скоррелировать с концентрацией цитокина IL-8 (E.J. Miller et al., Am. Rev. Respir. Dis., 146, 437, 1992) и с тяжестью патологии (Kurodowska et al., Immunol., 157, 2699, 1996). Было показано, что лечение анти-IL-8 антителами является эффективным в моделях острой респираторной недостаточности и легочных повреждений, вызванных эндотоксемией (K. Yokoi et al.; Lab. Invest., 76, 375, 1997).
Была продемонстрирована специфическая роль IL-8 в возникновении поражений после пост-ишемической реперфузии у пациентов с острым разрывом миокарда (Y. Abe et al., Br. Heart J., 70, 132, 1993); ключевая роль, демонстрируемая IL-8 в опосредствовании повреждений, связанных с пост-ишемической реперфузией, поддерживается также результатами, полученными с использованием анти-IL-8 антител в экспериментальной модели фокальной церебральной ишемии у кроликов (T. Matsumoto et al., Lab. invest., 77, 119, 1997).
Биологическая активность IL-8 осуществляется за счет взаимодействия интерлейкина с CXCR1 и CXCR2 мембранными рецепторами, которые относятся к семейству семи трансмембранных рецепторов, экспрессируемых на поверхности человеческих нейтрофилов и некоторых типов T-клеток (L. Xu et al., J.Leukocyte Biol., 57, 335, 1995).
Хотя известно, что CXCR1 активация играет ключевую роль в IL-8-опосредствованном хемотаксисе, недавно было выдвинуто предположение, что CXCR2 активация может играть патофизиологическую роль в хронических воспалительных заболеваниях, таких как псориаз. Действительно, патофизиологическая роль IL-8 в псориазе подтверждается также воздействием IL-8 на функции кератиноцитов.
Действительно, было показано, что IL-8 являются эффективными стимуляторами пролиферации эпидермальных клеток, а также ангиогенеза, обоих важных аспектов псориатического патогенеза (A. Tuschil et al. J Invest Dermatol, 99, 294, 1992; Koch AE et al, Science, 258, 1798, 1992). Кроме того, IL-8 индуцируют экспрессию главного комплекса гистосовместимости II (MHC-II) фрагмент HLA-DR на культивируемых кератиноцитах (L. Kemeny et al., Int Arch Allergy Immunol, 10, 351, 1995). Предполагают, что влияние CXCL8 на функции кератиноцитов опосредствовано CXCR2 активацией. В соответствии с этой гипотезой сообщалось, что CXCR2 чрезмерно экспрессированы в пораженной коже пациентов, больных псориазом (R. Kulke et al., J. Invest. Dermatol, 110, 90, 1998).
Кроме того, доказано, что патофизиологическая роль IL-8 в развитии и метастазах меланомы может быть опосредствована CXCR2 активацией.
Потенциальная патогенетическая роль IL-8 в кожной меланоме не зависит от их хемотаксической активности в отношении человеческих PMNs. Действительно, предполагают, что IL-8 действует как основной фактор роста и образования метастазов для клеток меланомы.
Было обнаружено, что значительное количество CXL8 продуцируется клетками меланомы, и известно, что клетки меланомной опухоли экспрессируют иммунореактивный CXCR2 рецептор (L.R. Bryan et al., Am J Surg, 174, 507, 1997). Известно, что IL-8 вызывает гаптотактическую миграцию, а также пролиферацию меланомных клеток (J.M. Wang et al., Biochem Biophys Res Commun, 169, 165, 1990).
Подробно описана потенциальная патогенная роль IL-8 в легочных заболеваниях (поражения легких, синдром острой респираторной недостаточности, астма, хронические воспаления легких и кистозный фиброз) и особенно в патогенезе COPD (хроническое обструктивное легочное заболевание) через схему CXCR2 рецепторов (D. WP Hay and H.M. Sarau., Current Opinion в Pharmacology 2001, 1:242-247).
Были описаны фенилуреидо соединения, которые могут селективно препятствовать связыванию IL-8 с CXCR2 рецептором (J.R. White et al., J. Biol. Chem., 273, 10095, 1998); использование этих соединений при лечении патологических состояний, опосредствованных интерлейкином-8, заявлено в WO 98/07418.
Изучение вклада отдельных (S) и (R) энантиомеров кетопрофена в противовоспалительную активность рацемата и их роль в модуляции хемокинов продемонстрировали (P. Ghezzi et al., J. Exp. Pharm. Ther., 287, 969, 1998), что два энантиомера и их соли с хиральными и нехиральными органическими основаниями могут ингибировать дозозависимым образом хемотаксис и повышение внутриклеточной концентрации ионов Ca2+, индуцируемое IL-8 в отношении человеческих PMN лейкоцитов (патентная заявка США 6069172). Затем было продемонстрировано (C. Bizzarri et al., Biochem. Pharmacol. 61, 1429, 2001), что кетопрофен участвует в активности ингибирования биологической активности IL-8 с другими молекулами, принадлежащими к классу нестероидных противовоспалительных агентов (NSAID), таких как флурбипрофен, ибупрофен и индометацин. Типичное для NSAID ингибирование активности фермента циклооксигеназы (COX) ограничивает терапевтическое применение этих соединений в контексте лечения нейтрофилзависимых патологических состояний и воспалительных состояний, таких как псориаз, идиопатический легочный фиброз, острая респираторная недостаточность, повреждения, вызванные реперфузией, и гломерулонефрит. Ингибирование синтеза простагландинов, возникающих в результате деятельности ферментов циклооксигеназы, включает увеличение продуцирования цитокинов, которые, подобно TNF-α, играют роль в амплификации нежелательных провоспалительных эффектов нейтрофилов.
Более низкая COX ингибирующая эффективность (R) энантиомеров NSAID, принадлежащих подклассу фенилпропионовых кислот, по сравнению с эффективностью (S) энантиомеров предполагает, что (R) энантиомеры кетопрофена, флурбипрофена и ибупрофена могут быть потенциально полезными агентами при лечении нейтрофилзависимых патологий. Тот факт, что некоторые (R) энантиомеры превращаются in vivo в соответствующие (S) энантиомеры в организмах некоторых видов животных и людей, тем самым проявляя COX ингибирующую активность, является серьезным ограничением использования этих соединений при лечении IL-8-опосредствованных патологий. Вышеуказанные предпосылки объясняют трудности, которые встречаются при идентификации селективности IL-8 ингибиторов, принадлежащих классу 2-фенилпропионовых кислот.
Было высказано предположение, что хиральное превращение R-энантиомеров 2-фенилпропионовых кислот связано со стереоспецифическим образованием промежуточных сложных R-профенил-CoA тиоэфиров; было продемонстрировано, что получение производного по карбоксильной функции позволяет избежать "in vivo" метаболического превращения без изменения эффективности ингибирования IL-8. Исследования взаимосвязи структуры и активности, проведенные для класса производных 2-фенилпропионовых кислот, привели к обнаружению новых классов эффективных и селективных ингибиторов IL-8 биологических активностей, пригодных для "in vivo" введения. Амиды R-2-арилпропионовой кислоты и N-ацилсульфонамиды были раскрыты как эффективные ингибиторы IL-8 индуцируемого хемотаксиса нейтрофилов и дегрануляции (WO 01/58852; WO 00/24710).
Авторы обнаружили, что избранные подклассы 2-арилпропионовых кислот демонстрируют неожиданную способность эффективно ингибировать IL-8-индуцируемый хемотаксис нейтрофилов и дегрануляцию без заметного влияния на активность циклооксигеназ. Как R-, так и S-энантиомеры (R,S)-2-арилпропионовой кислоты, описанные далее, в действительности не активны в отношении ингибирования циклооксигеназ в интервале концентраций от 10-5 до 10-6 М.
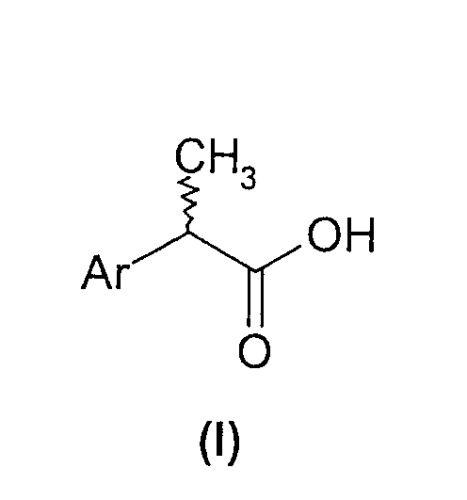
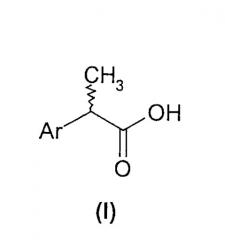
В настоящем изобретении предложены (R,S)-2-арилпропионовые кислоты формулы (I) и их (R)- и (S)-энантиомеры:
и их фармацевтически приемлемые соли,
где
Ar представляет фенильное кольцо, замещенное
- группой в 3-(мета) положении, выбранной из линейной или разветвленной C1-C5-алкильной, C2-C5-алкенильной или C2-C5-алкинильной группы, необязательно замещенной C1-C5-алкоксикарбонилом, замещенного или незамещенного фенила, линейного или разветвленного C1-C5-гидроксиалкила, арилгидроксиметила, или 3-(мета) линейная или разветвленная C1-C5-алкильная группа образует, вместе с заместителем в орто- или пара-положении бензольного кольца, насыщенные или ненасыщенные, замещенные или незамещенные бициклоарилы; или
- группой в 4-(пара) положении, выбранной из C1-C5-ацилокси, замещенного или незамещенного бензоилокси, C1-C5-ациламино, замещенного или незамещенного бензоиламино, C1-C5-сульфонилокси, замещенного или незамещенного бензолсульфонилокси, C1-C5-алкансульфониламино, замещенного или незамещенного бензолсульфониламино, C1-C5-алкансульфонилметила, замещенного или незамещенного бензолсульфонилметила, C3-C6-циклоалкила; 2-фурила; 3-тетрагидрофурила; 2-тиофенила; 2-тетрагидротиофенильной группы или C1-C8 (алканоил, циклоалканоил, арилалканоил)-C1-C5-алкиламино, например, ацетил-N-метиламино, пивалоил-N-этиламиногруппы; или
- группой в 2-(орто) положении, выбранной из замещенного или незамещенного арилметила, замещенного или незамещенного арилокси, замещенного или незамещенного ариламино, где заместители у арильной группы выбирают из C1-C4-алкила, C1-C4-алкокси, хлора, фтора и/или трифторметильной группы;
для использования в качестве ингибиторов IL-8 индуцируемого хемотаксиса человеческих PMN.
Фенильное кольцо в Ar группе может быть необязательно замещено другими группами, такими как C1-C5-алкил или группа галогена.
Термин "замещенный" в приведенном выше определении означает замещенный группой, выбранной из C1-C5-алкила, галогена, гидрокси, C1-C5-алкокси, амино, C1-C5-алкиламино, нитро, или цианогрупп.
Предпочтительными Ar в соединениях формулы (I) являются фенильные группы 3-замещенные: изопроп-1-ен-1-илом, этилом, изопропилом, пент-2-ен-3-илом, пент-3-илом, 1-фенилэтилен-1-илом, α-метилбензилом, α-гидроксибензилом, α-гидроксиэтилом, α-гидроксипропилом, бициклические арильные структуры, такие как 3-метилиндан-5-ил, 3-метилиндан-7-ил, 8-метилтетрагидронафт-2-ил, 5-метилтетрагидронафт-1-ил, и фенильные группы 4-замещенные трифторметансульфонилокси, 2-пропансульфонилокси, бензилсульфонилокси, бензолсульфонилокси, 2'-этилбензолсульфонилокси, 2'-хлорбензолсульфонилокси, метансульфониламино, трифторметансульфониламино, 2-пропансульфониламино, бензилсульфониламино, бензолсульфониламино, 2'-этилбензолсульфониламино, аминосульфонилметил, 2'-хлорбензолсульфониламино, трифторметансульфонилметил, бензолсульфонилметил, аминосульфонилокси, аминосульфониламино; и фенильные группы 2-замещенные 2-(2,6-дихлорфениламино)фенилом, 2-(2,6-дихлорфениламино)-5-хлорфенилом, 2-(2,6-дихлор-3-метилфениламино)фенилом, 2-(3-трифторметилфениламино)фенилом, 2-(2,6-дихлорфенокси)фенилом, 2-(2-хлорфенокси)фенилом, 2-(2,6-дихлорбензил)фенилом, 2-(2-хлорбензил)фенилом.
Особенно предпочтительными соединениями настоящего изобретения являются:
(R,S) 2-[3'-(альфа-этилпропил)фенил]пропионовая кислота
(R) 2-[3'-(альфа-этилпропил)фенил]пропионовая кислота
(S) 2-[3'-(альфа-этилпропил)фенил]пропионовая кислота
2-[3'-(альфа-гидроксиэтил)фенил]пропионовая кислота, и ее диастереоизомеры
2-[3'-(альфа-гидроксипропил)фенил]пропионовая кислота и ее диастереоизомеры
(R,S) 2-[3'-изопропилфенил]пропионовая кислота
(R) 2-[3'-изопропилфенил]пропионовая кислота
(S) 2-[3'-изопропилфенил]пропионовая кислота
(R) 2-(4'-трифторметансульфонилокси)фенилпропионовая кислота
(S) 2-(4'-трифторметансульфонилокси)фенилпропионовая кислота
(R) 2-(4'-бензолсульфонилокси)фенилпропионовая кислота
(S) 2-(4'-бензолсульфонилокси)фенилпропионовая кислота
(R) 2-[4'-(2"-этил)бензолсульфонилокси]фенилпропионовая кислота
(S) 2-[4'-(2"-этил)бензолсульфонилокси]фенилпропионовая кислота
(R) 2-[4'-(2"-хлор)фенилсульфонилокси]фенилпропионовая кислота
(S) 2-[4'-(2"-хлор)фенилсульфонилокси]фенилпропионовая кислота
(R) 2-[4'-(2"-пропан)сульфонилокси]фенилпропионовая кислота
(S) 2-[4'-(2"-пропан)сульфонилокси]фенилпропионовая кислота
(R) 2-(4'-бензилсульфонилокси)фенилпропионовая кислота
(S) 2-(4'-бензилсульфонилокси)фенилпропионовая кислота
(R) 2-(4'-аминосульфонилокси)фенилпропионовая кислота
(S) 2-(4'-аминосульфонилокси)фенилпропионовая кислота
(R) 2-(4'-трифторметансульфониламино)фенилпропионовая кислота
(S) 2-(4'-трифторметансульфониламино)фенилпропионовая кислота
(R) 2-(4'-метансульфониламино)фенилпропионовая кислота
(S) 2-(4'-метансульфониламино)фенилпропионовая кислота
(R) 2-[4'-(2"-пропан)сульфониламино]фенилпропионовая кислота
(S) 2-[4'-(2"-пропан)сульфониламино]фенилпропионовая кислота
(R) 2-(4'-бензолсульфониламино)фенилпропионовая кислота
(S) 2-(4'-бензолсульфониламино)фенилпропионовая кислота
(R) 2-[4'-(2"-этил)бензолсульфониламино]фенилпропионовая кислота
(S) 2-[4'-(2"-этил)бензолсульфониламино]фенилпропионовая кислота
(R) 2-[4'-(2"-хлор)бензолсульфониламино]фенилпропионовая кислота
(S) 2-[4'-(2"-хлор)бензолсульфониламино]фенилпропионовая кислота
(R) 2-(4'-бензилсульфониламино)фенилпропионовая кислота
(S) 2-(4'-бензилсульфониламино)фенилпропионовая кислота
(R) 2-(4'-аминосульфониламино)фенилпропионовая кислота
(S) 2-(4'-аминосульфониламино)фенилпропионовая кислота
(R) 2-(4'-трифторметансульфонилметил)фенилпропионовая кислота
(S) 2-(4'-трифторметансульфонилметил)фенилпропионовая кислота
(R) 2-(4'-бензолсульфонилметил)фенилпропионовая кислота
(S) 2-(4'-бензолсульфонилметил)фенилпропионовая кислота
Следующей задачей настоящего изобретения является получение новых соединений формулы (Ia)
их (R)- и (S)-энантиомеров и их фармацевтически приемлемых солей,
- где Ar представляет фенильное кольцо, замещенное в 4- (пара) положении группой, выбранной из C1-C5-сульфонилокси, замещенного или незамещенного бензолсульфонилокси, C1-C5-алкансульфониламино, замещенного или незамещенного бензолсульфониламино, C1-C5-алкансульфонилметила, замещенного или незамещенного бензолсульфонилметила.
Фенильное кольцо в Ar группе формулы (Ia) может быть необязательно замещено другими группами, такими как C1-C5-алкил или группа галогена.
Термин "замещенный" в вышеуказанном определении означает замещенный группой, выбранной из C1-C5-алкила, галогена, гидрокси, C1-C5-алкокси, амино, C1-C5-алкиламино, нитро или цианогрупп.
Наиболее предпочтительными соединениями формулы Ia, как определено выше, являются:
(R) 2-(4'-трифторметансульфонилокси)фенилпропионовая кислота
(S) 2-(4'-трифторметансульфонилокси)фенилпропионовая кислота
(R) 2-(4'-бензолсульфонилокси)фенилпропионовая кислота
(S) 2-(4'-бензолсульфонилокси)фенилпропионовая кислота
(R) 2-[4'-(2"-этил)бензолсульфонилокси]фенилпропионовая кислота
(S) 2-[4'-(2"-этил)бензолсульфонилокси]фенилпропионовая кислота
(R) 2-[4'-(2"-хлор)фенилсульфонилокси]фенилпропионовая кислота
(S) 2-[4'-(2"-хлор)фенилсульфонилокси]фенилпропионовая кислота
(R) 2-[4'-(2"-пропан)сульфонилокси]фенилпропионовая кислота
(S) 2-[4'-(2"-пропан)сульфонилокси]фенилпропионовая кислота
(R) 2-(4'-бензилсульфонилокси)фенилпропионовая кислота
(S) 2-(4'-бензилсульфонилокси)фенилпропионовая кислота
(R) 2-(4'-аминосульфонилокси)фенилпропионовая кислота
(S) 2-(4'-аминосульфонилокси)фенилпропионовая кислота
(R) 2-(4'-трифторметансульфониламино)фенилпропионовая кислота
(S) 2-(4'-трифторметансульфониламино)фенилпропионовая кислота
(R) 2-(4'-метансульфониламино)фенилпропионовая кислота
(S) 2-(4'-метансульфониламино)фенилпропионовая кислота
(R) 2-[4'-(2"-пропан)сульфониламино]фенилпропионовая кислота
(S) 2-[4'-(2"-пропан)сульфониламино]фенилпропионовая кислота
(R) 2-(4'-бензолсульфониламино)фенилпропионовая кислота
(S) 2-(4'-бензолсульфониламино)фенилпропионовая кислота
(R) 2-[4'-(2"-этил)бензолсульфониламино]фенилпропионовая кислота
(S) 2-[4'-(2"-этил)бензолсульфониламино]фенилпропионовая кислота
(R) 2-[4'-(2"-хлор)бензолсульфониламино]фенилпропионовая кислота
(S) 2-[4'-(2"-хлор)бензолсульфониламино]фенилпропионовая кислота
(R) 2-(4'-бензилсульфониламино)фенилпропионовая кислота
(S) 2-(4'-бензилсульфониламино)фенилпропионовая кислота
(R) 2-(4'-аминосульфониламино)фенилпропионовая кислота
(S) 2-(4'-аминосульфониламино)фенилпропионовая кислота
(R) 2-(4'-трифторметансульфонилметил)фенилпропионовая кислота
(S) 2-(4'-трифторметансульфонилметил)фенилпропионовая кислота
(R) 2-(4'-бензолсульфонилметил)фенилпропионовая кислота
(S) 2-(4'-бензолсульфонилметил)фенилпропионовая кислота.
Соединения настоящего изобретения не влияют на продуцирование PGE2 в мышиных макрофагах, стимулированных липополисахаридами (LPS, 1 мкг/мл) во всем интервале концентраций: от 10-5 до 10-6 M, и таким образом лишены какой-либо ингибирующей активности в отношении циклооксигеназ (COX). Благодаря отсутствию COX ингибиторной активности как R-, так и S-энантиомеров описанной 2-фенилпропионовой кислоты, соединения настоящего изобретения являются первыми 2-фенилпропионовыми кислотами с характеристиками, необходимыми для терапевтического использования при лечении патологий, связанных с усиленным хемотаксисом нейтрофилов, и активацией, индуцируемой IL-8. Ожидаемая метаболическая хиральная инверсия R-энантиомеров настоящего изобретения приводит к получению соответствующих S-энантиомеров, которые имеют с R-энантиомерами сопоставимые характеристики с точки зрения IL-8 эффективности и COX селективности.
Соединения настоящего изобретения формулы (I) обычно выделяют в форме их солей присоединения как органических, так и неорганических фармацевтически приемлемых оснований.
Примерами таких оснований являются: гидроксид натрия, гидроксид калия, гидроксид кальция, (D,L)-лизин, L-лизин, трометамин.
3-(Мета) и 2-(орто) замещенные 2-арилпропионовые кислоты формулы (I) и их энантиомеры раскрыты в WO 01/58852 и в WO 00/24710
Кислоты формулы I, как определено выше, получают путем алкилирования станнанами полизамещенной 2-фенилпропионовой кислоты, содержащей перфторбутансульфонатную группу в орто- или мета- или пара-положении, как будет раскрыто далее.
Энантиомеры 2-арилпропионовой кислоты формулы (I) можно получить обычным и стереоспецифическим синтезом: известно также превращение рацематов в один из энантиомеров после превращения в 2-арил-2-пропилкетены, как раскрыто Larse RD et al., J. Am. Chem. Soc., 111, 7650, 1989 и Myers AG, ibidem, 119, 6496, 1997. Стереоселективный синтез 2-арилпропионовой кислоты относится, главным образом, к S-энантиомерам, но их можно модифицировать таким образом, чтобы получить R-энантиомеры, выбирая подходящий хиральный вспомогательный агент. Арилалкилкетоны в качестве субстратов для синтеза α-арилалкановых кислот раскрыты, см. например BM Trost and JH Rigby, J. Org. Chem., 14, 2926, 1978; арилирование Meldrum кислот раскрыто, см. JT Piney и RA Rowe, Tet. Lett., 21, 965, 1980; винная кислота в качестве хирального вспомогательного агента раскрыта, см. Castaldi et al., J. Org. Chem., 52, 3019, 1987; α-гидроксисложные эфиры в качестве хиральных реагентов раскрыты, см. RD Larsen et al., J. Am. Chem. Soc., 1ll, 7650, 1989 и процитированный здесь патент США 4940813.
Способ получения 2-(2-OH-фенил)пропионовых кислот и их сложных эфиров раскрыт в итальянском патенте 1283649. Общепринятым и эффективным способом получения R-энантиомера (R,S)-2-(5-бензоил-2-ацетокси)пропионовой кислоты и кислот формулы (Ia) является превращение хлоридов указанных карбоновых кислот (хлорангидридов) в соответствующие проп-1-кетены при взаимодействии с третичным амином, например диметилэтиламином, с последующим взаимодействием кетена с R(-)пантолактоном с получением сложных эфиров R-энантиомеров указанных кислот с R-дигидро-3-гидрокси-4,4-диметил-2(3H)фуран-2-оном. В результате последующего омыления сложного эфира LiOH получают соответствующие свободные кислоты.
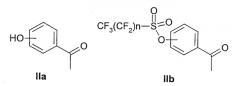
Общий способ получения R-2-арилпропионовых кислот формулы (Ia) включает, например, осуществление взаимодействия сложных эфиров 4-гидроксифенилпропионовой кислоты или сложных эфиров 4-аминофенилпропионовой кислоты с соответствующими C1-C5-сульфонилхлоридами или бензолсульфонилхлоридами в присутствии подходящего органического или неорганического основания; или осуществление взаимодействия сложных эфиров 4-хлорметилфенилпропионовых кислот с соответствующими C1-C5-тиолатами или бензолтиолатами в присутствии подходящего органического или неорганического основания, что подробно раскрыто в разделе "Общий способ синтеза (S)- и (R)-2-[(4'-арил/алкилсульфониламино)фенил]пропионовых кислот формулы Ia" и в последующих разделах. Типичный способ получения соединений формулы (Ia) включает осуществление взаимодействия гидроксиарилкетонов формулы (Ia) моно- или полизамещенных перфторбутансульфонилфторидом до получения перфторбутансульфоновых сложных эфиров формулы (IIb), где n представляет целое число от 1 до 9:
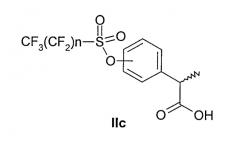
Соединения формулы (IIb) подвергают перегруппировке Вилгеродта для того, чтобы получить, после этерификации и метилирования по альфа углероду, арилпропионовые производные формулы (IIc), где n представляет целое число от 1 до 9 и R3 представляет C1-C4-алкил или C2-C4-алкенил.
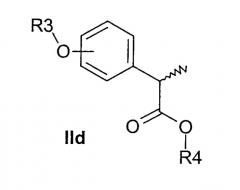
Соединения формулы (IIc) подвергают взаимодействию с соответствующим трибутилстаннаном формулы Bu3SnR4, где R4 представляет линейный или разветвленный C2-C6-алкил; линейный или разветвленный C2-C6-алкенил, или линейный или разветвленный C2-C6-алкинил, незамещенный или замещенный арильной группой, до получения соответствующих (R,S)-2-арилпропионатов формулы (IId).
Алкенильные или алкинильные группы можно гидрировать в условиях каталитического гидрирования для получения соответствующих насыщенных алкильных групп. Соединения формулы (IId) обрабатывают, используя способ дерацемизации, как было раскрыто выше для превращения соответствующих хлорангидридов в кетены, то есть при взаимодействии с R(-)пантонолактоном и c последующим гидролизом, превращают в чистые R-энантиомеры; в результате реакции промежуточного кетена с хиральным вспомогательным S(+)-пантонолактоном получают соответствующий чистый S-энантиомер.
Соединения настоящего изобретения формулы (I) оценивают in vitro в отношении их способности ингибировать хемотаксис полиморфоядерных лейкоцитов (здесь и далее обозначаемых PMN) и моноцитов, индуцируемых фракциями IL-8 и GRO-α. Для этой цели, чтобы выделить PMN из гепаринизированной человеческой крови, взятой у здоровых взрослых добровольцев, мононуклеаты удаляют осаждением на декстране (в соответствии со способом, раскрытым WJ. Ming et al., J. Immunol, 138, 1469, 1987), а красные кровяные клетки гипотоничным раствором. Жизнеспособность клеток оценивают путем исключения трипанового синего, тогда как отношение циркулирующих полиморфонуклеатов оценивают, используя цитоцентрифугат после окрашивания Diff Quick.
Человеческие рекомбинантные IL-8 (Pepro Tech) используют в качестве стимулирующих агентов в экспериментах по хемотаксису, получая практически идентичные результаты: лиофилизованный белок растворяют в объеме HBSS, содержащем 0,2% альбумина бычьей сыворотки (BSA), чтобы получить таким образом исходный раствор с концентрацией 10-5 M, который далее разбавляют HBSS до концентрации 10-9 M, для анализа хемотаксиса.
Во время анализа хемотаксиса (по способу W. Falket et al., J. Immunol. Methods, 33, 239, 1980) используют фильтры, не содержащие PVP, с пористостью 5 мкм и микрокамеры, пригодные для репликации.
Соединения настоящего изобретения формулы (I) оценивают при концентрации в интервале значений от 10-6 до 10-10 M; для этой цели их добавляют в той же самой концентрации, как в нижние поры, так и в верхние поры микрокамер. Оценку способности соединений настоящего изобретения формулы (I) ингибировать IL-8-индуцируемый хемотаксис человеческих моноцитов осуществляют в соответствии со способом, раскрытым Van Damme J. et al. (Eur. J. Immunol., 19, 2367, 1989).
В качестве примера в следующей таблице приведены результаты по ингибированию (C=10-6 M) для некоторых представителей соединений в тестах по IL-8-индуцируемому PMN хемотаксису:
| Пример | Название | % ингибирования (с=10-6 M) |
| 5 | (R,S) 2-[3'-изопропилфенил]пропионовая кислота | 51±12 |
| 10 | (S) 2-[3'-изопропилфенил]пропионовая кислота | 43±18 |
| 14 | (S) 2-[3'-изопропилфенил]пропионовая кислота | 50±9 |
| 7 | (R,S), (R,S) 2-[3'-(альфа-метил-бензил)фенил]пропионовая кислота | 54±4 |
| 16 | (R,S), (R,S) 2-[3'-(альфа-гидроксиэтил)фенил]пропионовая кислота | 57±6 |
| 18 | (R,S) 2-[(2'-(2",6"-дихлорфенил)амино]фенил пропионовая кислота | 52±3 |
| 19 | (R) 2-[(2'-(2",6"-дихлорфенил)амино]фенил пропионовая кислота | 46±14 |
| 20 | (S) 2-[(2'-(2",6"-дихлорфенил)амино]фенил пропионовая кислота | 50+7 |
| 6 | (R,S) 2-[3'-(альфа-этилпропил)фенил]пропионовая кислота | 58+2 |
| 22 | (R,S) 2-[(2'-(2",6"-дихлор)фенокси)фенил]пропионовая кислота | 41+9 |
Вышеперечисленные соединения демонстрируют умеренную эффективность в тесте по GRO-α индуцируемому PMN хемотаксису, что предполагает селективное воздействие на CXCR1 опосредствованную схему.
Особенно предпочтительными соединениями настоящего изобретения являются соединения формулы Ia, которые демонстрируют дополнительное свойство эффективного ингибирования GROα-индуцируемого PMN хемотаксиса; такая активность допускает терапевтическое использование этих соединений в связанных с IL-8 патологиях, где CXCR2 схема участвует специфически или вместе с CXCR1 сигналами.
В приводимой далее таблице приводятся биологические активности соединений, демонстрирующих высокую эффективность ингибирования PMN хемотаксиса, индуцируемого как IL-8, так и селективным CXCR2 агонистом GRO-α.
Представлены некоторые примеры селективных GRO-α эффективных ингибиторов.
Двойственные ингибиторы IL-8 и GRO-α индуцируемых биологических активностей весьма предпочтительны с точки зрения представляющих интерес терапевтических применений, но описываемые соединения, селективно воздействующие на CXCR1 IL-8 рецептор, или CXCR2 GRO-α/IL-8 рецептор, могут найти полезное терапевтическое применение при лечении специфических патологий, как раскрыто далее.
| Результаты биологических активностей в отношении CXCR1 и CXCR2 рецепторов (% ингибирования) | |||
| Пример | Название | IL-8c=10-8M | GRO-αc=10-8M |
| 24 | (R) 2-(4'-бензолсульфониламино)фенилпропионовая кислота | 49±11 | 33±11+ |
| 25 | (R) 2-(4'-метансульфониламино)фенилпропионовая кислота | 25±7 | 32±5 |
| 26 | (R) 2-[4'-(2"-пропан)сульфониламино]фенилпропионовая кислота | 54±14 | 44±12 |
| 27 | (R) 2-(4'-трифторметансульфониламино)фенилпропионовая кислота | 8±10 | 40±14 |
| 28 | (R) 2-(4'-бензилсульфониламино)фенилпропионовая кислота | 60±10 | 24±8 |
| 29 | (R)2-[4'-(2"-хлор)бензолсульфониламино]фенил пропионовая кислота | -2±10 | 66±10 |
| 30 | (R) 2-[4'-(2"-этил)бензолсульфониламино] фенилпропионовая кислота | 44±14 | 80±10 |
| 31 | (S) 2-[4'-аминосульфониламино)фенилпропионовая кислота | 55±10 | 2±5 |
| 32 | (R) 2-(4'-бензолсульфонилокси)фенилпропионовая кислота | 28±11 | 25±10 |
| 35 | (R) 2-[4'-(2"-пропан)сульфонилокси]фенилпропионовая кислота | 49±8 | 46±6 |
| 34 | (R) 2-(4'-трифторметансульфонилокси)фенилпропионовая кислота | 62±7 | 59±10 |
| 33 | (R) 2-(4'-бензилсульфонилокси)фенилпропионовая кислота | 59±11 | 25±11 |
| 36 | (R) 2-[4'-(2"-хлор)бензолсульфонилокси] фенилпропионовая кислота | 25±7 | 65±10 |
| 37 | (R) 2-[4'-(2"-этил)бензолсульфонилокси]-фенилпропионовая кислота | 45±13 | 70±10 |
| 38 | (R) 2-(4'-аминосульфонилокси)фенилпропионовая кислота | 65±10 | 5±7 |
| 40 | (R) 2-(4'-трифторметансульфонилметил)фенилпропионовая кислота | 48+7 | 45±7 |
| 39 | (R) 2-(4'-бензолсульфонилметил)фенилпропионовая кислота | 60±7 | 52+5 |
Все соединения настоящего изобретения демонстрируют высокую степень селективности в отношении ингибирования IL-8-индуцируемого хемотаксиса по сравнению с хемотаксисом, индуцируемым C5a (10-9 M) или f-MLP(10-8 M).
Соединения формулы (I), оценивавшиеся ex vivo в крови in toto (в целом) в соответствии с процедурой, раскрытой Patrignani et al., в J. Pharmacol. Exper. Ther., 271, 1705, 1994, как было обнаружено, полностью не эффективны в качестве ингибиторов ферментов циклооксигеназы (COX). Почти во всех случаях соединения формулы (I) не препятствуют продуцированию PGE2, индуцируемым в мышиных макрофагах за счет стимуляции липополисахаридами (LPS, 1 мкг/мл) в концентрационном интервале от 10-5 до 10-7 M. Ингибирование продуцирования PGE2, которое может быть зарегистрировано, в большинстве случаев находится у предела статистической значимости и более часто составляет величину менее 15-20% от базового значения. Пониженная эффективность ингибирования CO является преимуществом для терапевтического применения соединений настоящего изобретения, поскольку ингибирование синтеза простагландинов является стимулом для клеток макрофагов к усилению синтеза TNF-α (индуцируется LPS или перекисью водорода), которые являются важными медиаторами активации нейтрофилов и стимулами продуцирования цитокина интерлейкина-8.
С точки зрения экспериментальных доказательств, обсуждавшихся выше, и роли, которую играет интерлейкин-8 (IL-8), и подобные ему в способах, которые включают активацию и инфильтрацию нейтрофилов, соединения настоящего изобретения особенно полезны для лечения заболеваний, таких как псориаз (R. J. Nicholoff et al., Am. J. Pathol., 138, 129, 1991). Другими заболеваниями, которые можно лечить соединениями настоящего изобретения, являются кишечные хронические воспалительные патологии, такие как язвенные колиты (Y. R. Mahida et al., Clin. Sci., 82, 273, 1992) и меланома, хроническое обструктивное легочное заболевание (COPD), буллезная пузырчатка, ревматоидный артрит (M. Selz et al., J. Clin. Invest., 87, 463, 1981), идиопатический фиброз (E. J. Miller, previously cited, и P. C. Carre et al., J. Clin. Invest., 88, 1882, 1991), гломерулонефрит (T. Wada et al., J. Exp. Med., 180, 1135, 1994) и профилактика и лечение повреждений, вызванных ишемией и реперфузией.
Ингибирование активации CXCR1 и CXCR2 пригодно, как подробно изложено выше, особенно при лечении хронических воспалительных патологий (например, псориаза), при которых предполагается, что активация обоих IL-8 рецепторов играет решающую патофизиологическую роль в развитии заболевания.
Действительно, известно, что активация CXCR1 является существенной в IL-8-опосредствованном PMN хемотаксисе (Hammond M et al., J. Immunol, 155,1428, 1995). С другой стороны, предполагают, что активация CXCR2 является существенной для IL-8-опосредствованной пролиферации эпидермальных клеток и ангиогенеза у больных псориазом (Kulke R et al., J Invest Dermatol, 110, 90, 1998).
Кроме того, CXCR2 селективные антагонисты находят особенно полезные терапевтические применения при лечении важных легочных заболеваний, таких как хроническое обструктивное легочное заболевание COPD (D. WP Hay и H.M. Sarau., Current Opinion в Pharmacology 2001, 1:242-247).
Следующей задачей настоящего изобретения является получение соединений, пригодных для лечения псориаза, язвенного колита, меланомы, хронического обструктивного легочного заболевания (COPD), буллезной пузырчатки, ревматоидного артрита, идиопатического фиброза, гломерулонефрита и для профилактики и лечения повреждений, вызванных ишемией и реперфузией, а также использование таких соединений для получения лекарственных средств для лечения указанных выше заболеваний. Фармацевтические композиции, включающие соединение настоящего изобретения и подходящий носитель, также включены в объем настоящего изобретения. Соединения настоящего изобретения, вместе с обычно используемым адьювантом, носителем, разбавителем или эксципиентом, могут быть приготовлены в форме фармацевтических композиций и их стандартных дозированных форм, и как таковые, могут быть использованы в твердом виде, таком как таблетки, или заполненные капсулы, или в виде жидкостей, таких как растворы, суспензии, эмульсии, эликсиры, или заполненные ими капсулы, все это для перорального введения, или в виде стерильных растворов для инъекций для парентерального (включая подкожное) введения. Такие фармацевтические композиции и их стандартные дозированные формы могут включать ингредиенты в обычных пропорциях, вместе с дополнительными активными соединениями или основами, или без них, и такие стандартные дозированные формы могут содержать любые подходящие эффективные количества активного ингредиента, соответствующие назначенному интервалу дневных доз.
Если кислоты настоящего изобретения используют в качестве лекарственных средств, их обычно вводят в форме фармацевтических композиций. Такие композиции можно получить способом, хорошо известным фармацевтам, и они включают, по крайней мере, одно активное соединение.
Обычно соединения настоящего изобретения вводят в фармацевтически эффективном количестве. Количество действительно вводимого соединения обычно определяет врач, учитывая соответствующие обстоятельства, включая подлежащее лечению состояние, выбранный способ введения, конкретное вводимое соединение, возраст, вес и реакцию индивидуального пациента, тяжесть симптомов заболевания и т.п.
Фармацевтические композиции настоящего изобретения можно вводить различными способами, включая пероральный, ректальный, трансдермальный, по