Способ мониторинга электрической активности желудочно-кишечного тракта в эксперименте
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к гастроэнтерологии. Выполняют срединную лапаротомию, вживляют биполярные электроды в серозно-мышечный слой желудка и тонкой кишки, вводят зонд в тонкую кишку, проводят провода от электродов и зонда через мягкие ткани передней брюшной стенки и тазовой области, выводят их наружу под кожей хвоста и осуществляют мониторинг электрической активности ЖКТ. При вживлении электродов оси их располагают поперек продольной оси, при этом первый электрод вживляют в антральный отдел желудка, второй - в начальную часть двенадцатиперстной кишки, третий - в начальный участок тощей кишки на 10-15 см дистальнее дуадено-еюнального перехода, четвертый - в среднюю часть подвздошной кишки, а зонд устанавливают в начальном участке тощей кишки на 5 см проксимальнее третьего электрода. Затем до и после введения прикинетиков осуществляют одновременную регистрацию и исследование динамики электрической активности ЖКТ, а оценку электрической активности осуществляют по изменению интенсивности потенциала действия, временных параметров миоэлектрического комплекса и координации работы ЖКТ. Способ повышает достоверность оценки функционального состояния ЖКТ. 1 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к экспериментальной медицине и может быть использовано в оперативной гастроэнтрологии для медико-биологических экспериментов с использованием электромиографии.
Нарушения электрической активности желудочно-кишечного тракта (ЖКТ) различной степени тяжести развиваются практически после всех операций при острых хирургических заболеваниях, а также при травматических повреждениях органов брюшной полости. При этом в раннем послеоперационном периоде возможна эндотоксемия. Следствием указанных обстоятельств в этом периоде может быть развитие функциональной кишечной непроходимости или воспаление кишечника, которые неизменно сопровождаются нарушением электрической активности ЖКТ и координации между его отделами. Изучение причин нарушений электрической активности ЖКТ требует тщательного анализа для получения данных о лечении.
Известен способ регистрации электрической активности желудка и тонкой кишки. Способ состоит в контроле биопотенциалов электродами, вживленными в желудочно-кишечный тракт, информация с которых характеризует состояние электрической активности ЖКТ. Сигнал с электродов по проводам, скрепленным с иглами электродов пайкой, поступает в электрическую цепь с согласующими, усиливающими и фильтрующими, а также с регистрирующими приборами. Оценку электрической активности выполняют по временным параметрам миоэлектрического комплекса. Однако способ ограничен в возможностях, поскольку при контроле электрической активности не производят замеров интенсивности генерации потенциала действия в различных отделах ЖКТ. Такие замеры необходимы в качестве количественной оценки как динамики восстановления электрической активности в отделах ЖКТ, также как и ответной реакции этих отделов на фармакологические действия. При этом исследуют либо электрическую активность двух отделов ЖКТ, либо только двенадцатиперстной и тощей кишки (см. Zenilman M.E., Parodi J.E., Becker J.M. Preservation and Propagation of Cyclie Myoelectrric Activity After Feeding in Rat Small Intestine // Am. J. Physiol. - 1992 - Vol.263-G248-253), либо электрическую активность только тощей кишки, располагая в ней несколько электродов (см. Per M.Hellstrom, Mikael Thollander, Elvar Theodorsson Nociceptive inhibition of migrationg myoelectric complex by nitric oxide and monoaminergic pathways in the rat // Am. J. Physiol, 1998 - Vol.274-G 480-G486), либо электроды размещают в трех отделах - желудке, двенадцатиперстной кишке и начальном участке тощей кишки (см. Ping Fang, Lei Dong, jin-Yan luo, Xiao-Long Wan, Ke-Xin Du, Ning-Li Chai Effects of motilin and ursodeoxycholic acid on gastrointestinal myoelectric activity of different origins in fasted rats // WorldJ Gastroenterol 2004; 10(17)ж2509-2513).
Известен способ моделирования послеоперационной эндотоксемии, при котором крысам с поврежденной брюшиной в брюшину вводили в качестве эндотокситна липолисахарид (см. статью «Effects of peritoneal injury and endotoxin on myoelectric activity and transit» Tanabe Y, Calland J.F., Schirmer B.D.J Sung Res.2004 Feb; 116(2)330-6 Department of Surgery, Universiti of Virginia Health Sciences, Center, Charlottesville, Virginia 22908-0709, USA). В этой статье описано исследование влияния эндотоксина совместно с повреждением брюшины на электрическую активность ЖКТ крыс и приведены результаты, полученные с использованием миографии.
Однако в этом способе анализ проведен только по временным параметрам миоэлектрического комплекса, без учета потенциала действия, что ограничивает достоверность и требует дополнительного исследования для получения количественной оценки состояния ЖКТ. К тому же в эксперименте крысам были вживлены лишь три электрода в тонкую кишку и не проведена проверочная оценка электрической активности двенадцатиперстной кишки и желудка, которая также нарушается при эндотоксемии. Это снижает достоверность исследования, в котором проведена только оценка состояния одновременно двенадцатиперстной кишки и желудка.
К тому же, в этом способе липополисахарид был введен в брюшную полость и неизвестно, сколько эндотоксина попало в кровь. При этом введение липополисахарида в брюшную полость может привести к локализации воспалительного процесса в отдельных местах брюшной полости, что дополнительно снизит достоверность информации о состоянии электрической активности всех отделов ЖКТ и может привести к необходимости дополнительных экспериментов, что требует значительного времени.
Наиболее близким аналогом выбран способ исследования электрической активности желудочно-кишечного тракта (ЖКТ)в эксперименте, включающий срединную лапаротомию, вживление биполярных электродов в серозно-мышечный слой желудка и тонкой кишки, введение зонда в тонкую кишку, проведение проводов от электродов и зонда через мягкие ткани передней брюшной стенки и тазовой области, выведение их наружу под кожей хвоста и мониторинг электрической активности ЖКТ (см. книгу «Искусственное питание в неотложной хирургии травматологии», изд. Москва, НИИ скорой помощи им. Н.В.Склифасовского, 2001 г., с.112-115, с.126-129).
Однако как в этом, так и во всех описанных выше аналогах при проведении экспериментов на крысах не предложено оптимальное расположение электродов и зонда, их взаимное расположение в отделах ЖКТ, позволяющее усилить уровень сигнала, поступающего с электродов, повысить точность показаний регистрирующей аппаратуры в послеоперационный период с возможностью исключить взаимное влияние выходных электрических сигналов. В этом способе не приведено оптимально возможное время проведения отдельных этапов эксперимента в раннем послеоперационном периоде для исследования электрической активности и не предложена необходимая последовательность действий, необходимая при контроле электрической активности крыс, что снижает достоверность и точность показаний. Ни в этом аналоге, ни в одном из перечисленных выше нет наиболее полного исследования электрической активности одновременно желудка, двенадцатиперстной кишки, тощей и подвздошной кишок методом вживления электродов в экспериментах на крысах.
Задачей предложенного технического решения является увеличение достоверности, точности и объективности оценки функционального состояния электрической активности ЖКТ в раннем послеоперационном периоде, с рассмотрением всех характерных причин патологий у крыс, возможных в этом периоде, в повышении надежности и достоверности прогнозирования и в улучшении профилактики и лечения нарушений электрической активности при операции при одновременном сокращении времени эксперимента на крысах.
Для решения поставленной задачи в предложенном способе исследования электрической активности желудочно-кишечного тракта (ЖКТ) в эксперименте, включающем срединную лапаротомию, вживление биполярных электродов в серозно-мышечный слой желудка и тонкой кишки, введение зонда в тонкую кишку, проведение проводов от электродов и зонда через мягкие ткани передней брюшной стенки и тазовой области, выведение их наружу под кожей хвоста и мониторинг электрической активности ЖКТ, согласно изобретению при вживлении электродов оси их располагают поперек продольной оси, при этом первый электрод вживляют в антральный отдел желудка, второй - в начальную часть двенадцатиперстной кишки, третий - в начальный участок тощей кишки на 10-15 см дистальнее дуадено-еюнального перехода, четвертый - в среднюю часть подвздошной кишки, а зонд устанавливают в начальном участке тощей кишки на 5 см проксимальнее третьего электрода, затем до и после введения прикинетиков осуществляют одновременную регистрацию и исследование динамики электрической активности ЖКТ, а оценку электрической активности осуществляют по изменению интенсивности потенциала действия, временных параметров миоэлектрического комплекса и координации работы ЖКТ.
Кроме того, для решения поставленных задач, согласно изобретению, во время лапаротомии вводят эндотоксин путем инъекции в бедренную вену крысы 0,1 мл раствора липополисахарида Esherichia coli в дозе, изменяющейся в пределах 200-500 мкг на кг массы животного.
Технический результат состоит в возможности при экспериментах на крысах наиболее полного рассмотрения характерных причин нарушений электрической активности ЖКТ в раннем послеоперационном периоде с возможностью исследования влияния этих причин на электрическую активность желудка, двенадцатиперстной, тощей и подвздошной кишки методом игольчатых электродов в экспериментах на крысах, в увеличении достоверности получаемой информации, в повышении точности и объективности оценки функционального состояния электрической активности ЖКТ крыс в раннем периоде после операции, в повышении надежности рекомендаций по лечению нарушений электрической активности ЖКТ при одновременном сокращении времени эксперимента.
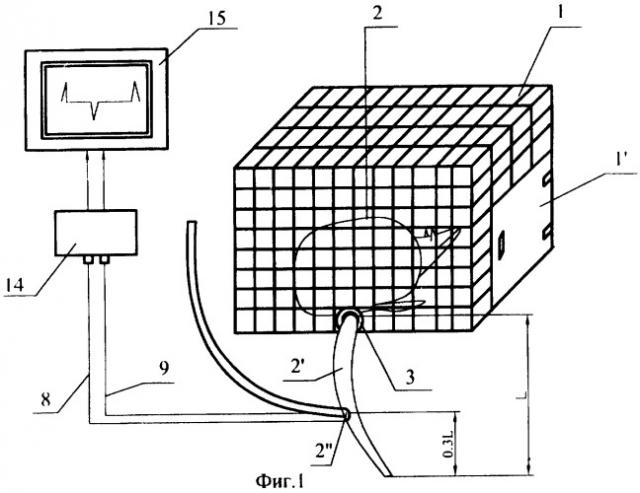
На фиг.1 приведена схема расположения крысы в клетке при проведении эксперимента, показано подключение электродов к регистрирующей аппаратуре.
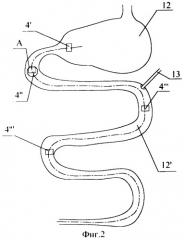
На фиг.2 приведено расположение электродов и зонда в ЖКТ при экспериментах.
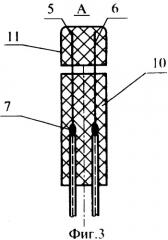
На фиг.3 приведена конструкция электрода.
Устройство содержит клетку 1, предназначенную для размещения в ней крысы 2. Клетка имеет объем, обеспечивающий комфортную подвижность крысы, и выполнена с дверцей 11. Устройство снабжено крепежной втулкой 3, имеющей форму шпульки для крепления на хвосте крысы. С помощью втулки, встраиваемой в клетку 1, крысу фиксируют в клетке.
В состав устройства входят электроды 4I, 4II, 4III, 4IV (см. фиг.2, 3), каждый из которых состоит из двух параллельных игл 5, 6, которые одной стороной скреплены припоем 7 с соответствующим приводом 8, 9.
Иглы 5, 6 электродов закреплены в корпусе 10 на постоянном расстоянии друг относительно друга. Каждый электрод снабжен упругой пластиной 11, предназначенной для надежного закрепления вживленных концов игл электродов в желудке 12 и кишечнике 121 крысы при эксперименте.
Первый электрод 4I располагают в антральном отделе желудка 12, второй 4II и третий 4III электроды - соответственно в начальной части двенадцатиперстной кишки и в начальном участке тощей кишки, а четвертый электрод 4IV вживляют в среднюю часть подвздошной кишки, при этом зонд 13 устанавливают перед третьим 4III электродом, в начальном участке тощей кишки.
Зонд 13 предназначен для введения лекарственных веществ. Зонд 13 и провода 8, 9 протягивают под кожей хвоста крысы 2 и выводят через прокол 2II в ее хвосте 2I
Выходы проводов 8, 9 электродов подключают через согласующее устройство 14 к регистрирующему устройству 15, что предназначено для получения информации об изменениях электрической активности ЖКТ крысы при проведении экспериментов сразу после операции.
Способ реализуется следующим образом.
Крысам под наркотиком проводили срединную лапаратомию. В антральный отдел желудка 12 вживляли первый электрод 4I. В начальную часть двенадцатиперстной кишки, начальный участок тощей кишки (на расстоянии 10-15 см дистальнее от дуадено-еюнального перехода) и в среднюю часть подвздошной кишки вживляли еще три электрода - второй 4II, третий 4III, четвертый электрод 4IV. Концы игл электродов фиксировали упругой пластиной 11. Оси электродов располагали поперек продольной оси отделов ЖКТ, что позволяет исключить искажение сигнала о состоянии электрической активности и повысить точность получаемой информации.
Вживление первого электрода 4I в антральный отдел желудка 12 позволяет повысить чувствительность сигнала при контроле потенциала действия, поскольку в антральном отделе наиболее сильная сократительная активность по сравнению с другими отделами желудка.
Вживление второго электрода 4II в начальный участок двенадцатиперстной кишки при наличии первого электрода 4I позволяет оценить состояние электрической активности двенадцатиперстной кишки по сравнению с состоянием желудка.
Вживление третьего электрода 4III в начальный участок тощей кишки, на 10-15 см дистальнее дуадено-еюнального перехода дает возможность получения наиболее точной информации о электрической активности тощей кишки и координации работы выше лежащих отделов.
Вживление четвертого электрода 4IV в среднюю часть подвздошной кишки позволяет оценить электрическую активность дистальных отделов кишечника и координацию работы подвздошной кишки относительно выше лежащих отделов - тощей, двенадцатиперстной кишки и желудка.
Наличие четырех электродов 4I-4IV, установленных указанным образом, позволяет получить информацию, одновременно снятую со всех отделов ЖКТ: с антрального отдела желудка, двенадцатиперстной кишки, с тощей и подвздошной кишки, что позволяет получить наилучшую достоверность контроля о состоянии электрической активности всех отделов ЖКТ в данный период времени, а также получить информацию о координации работы отделов. Возможно исследование электрической активности верхних отделов ЖКТ с установкой трех электродов в желудок, двенадцатиперстную и тощую кишку. Вживление менее трех электродов (двух-одного) не позволит изучить характеристики мигающего миоэлектрического комплекса.
Установка зонда 13 в начальном участке тощей кишки позволяет получить наиболее интенсивное всасывание веществ, поступающих через зонд, поскольку только этот участок тощей кишки имеет способность наиболее интенсивного всасывания. Установка зонда на 5 см проксимальнее третьего электрода 4III позволяет по сигналу с третьего электрода 4III получить информацию с достаточной степенью точности о изменении электрической активности отделов ЖКТ после подачи веществ через зонд 13.
Зонд 13 и провода электродов проводили через мягкие ткани тазовой области и между кишками, проводили под кожей хвоста крысы и выводили из хвоста 2 через прокол 2II в хвосте. После этого на хвости животного надевали втулку 3. Крысу с надетой на хвост втулкой 3 помещали в клетку 1 и закрепляли в клетке иглой (на чертеже не показана), прокалывающей ткани хвоста 2 и проходящей через поперечные отверстия (на чертеже не показаны) в стенке втулки.
Электрическую активность ЖКТ измеряли регистрирующим устройством 15 (с помощью компьютера) по сигналам от вживленных электродов, которые по проводам 8, 9 поступали в согласующее устройство 14 для обработки, затем в программу регистрирующего устройства 15 (в компьютер). Контроль электрической активности участков ЖКТ проводили по программе, составленной с использованием изменения интенсивности потенциалов действия и временных параметров миоэлектрического комплекса отделов ЖКТ. Методика расчета электрической активности по потенциалам действия описана в пат.RU №2057483. Такой подход оценки динамики ЖКТ позволяет в каждый момент времени оценить с хорошей точностью среднюю интенсивность и длительность генерации потенциалов действия, с получением информации на экране регистрирующего устройства о изменениях электрической активности ЖКТ. Компьютерная программа преобразует и обобщает полученные результаты контроля, проводит их статистическую обработку и выдает информацию об изменениях интенсивности потенциалов действия и изменениях временных параметров миоэлектрического комплекса. Эта информация является характеристикой электрической активности как всего ЖКТ, так и его отделов, в которые вживлены электроды. При этом по полученным данным выявляют нарушения электрической активности ЖКТ, с учетом которых возможно последующее восстановление.
Контроль электрической активности выполняли ежедневно в течение не менее одного часа, поскольку регистрация в течение меньшего времени не дает достоверных данных об уровне электрической активности и о деталях ее организации. Это связано с длительностью физиологического цикла, включающего все фазы электрической активности, который в среднем составляет 10-15 мин, а в час регистрируют от 4 до 6 периодов миоэлектрического комплекса. Кроме того, в раннем послеоперационном периоде нарушается генерация мигрирующего миоэлектрического комплекса и требуется время для восстановления его динамики. В это время при восстановлении динамики электрической активности органов ЖКТ появляются хаотичные единичные потенциалы действия, пачки потенциалов действия, начиная со слабой и переходя в сильную интенсивность. После чего формируются различные фазы миоэлектрического комплекса. Первыми восстанавливаются ритмические фазы тощей кишки, затем двенадцатиперстной кишки и в последнюю очередь нормализуются ритмические фазы желудка. Наличие распространяющегося миоэлектрического комплекса от желудка к тощей и подвздошной кишке свидетельствует о высокой степени координированности отделов ЖКТ. Отсутствие восстановления миоэлектрического комплекса с появлением в сигнале паттернов, не характерных для нормальной электрической активности, свидетельствует о явно выраженном нарушении электрической активности ЖКТ.
В способе предусмотрено в раннем послеоперационном периоде введение в ЖКТ через зонд прокинетиков, влияющих на электрическую активность ЖКТ. После этого в течение не менее 2 часов регистрировали ответную реакцию желудка и кишечника крысы. При сохранных механизмах регуляции введение препаратов, стимулирующих электрическую активность, вызывает, как правило, усиление генерации потенциалов действия в соответствующих отделах ЖКТ. При одновременной регистрации электрической активности в желудке и различных отделах тонкой кишки тестовое фармакологическое воздействие позволяет определить также степень координированности работы желудка и кишки, что дополнительно повышает достоверность информации.
В способе во время лапаротомии в бедренную вену животного вводили 0,1 мл раствора липополисахарида Esherichija coli в дозе, изменяющейся в пределах 200-500 мкг на кг массы животного, после чего выполняли оценку влияния эндотоксемии в послеоперационном периоде на электрическую активность ЖКТ, которую контролировали по изменению интенсивности генерации потенциала действия, координации отделов работы желудка, двенадцатиперстной, тощей и подвздошной кишки и временных параметров миоэлектрического комплекса. Проводили анализ динамики, характеризующий введение эндотоксинов. В течение послеоперационной эндотоксемии обнаружили исчезновение миоэлектрического комплекса и появление характерного патологического сигнала в верхних отделах тонкой кишки, длительность которого в 4-6 раз больше периода медленной волны, амплитуда потенциала действия - в 2-3 раза больше, чем максимальная амплитуда потенциалов действия при норме. Скорость распространения потенциалов действия от двенадцатиперстной к тощей кишке составляла 0,8-1,0 см/сек.
Пример 1.
Исследования предложенного способа выполняли на 10 половозрелых крысах-самцах с исходной массой тела 300-400 г, которые до проведения эксперимента содержались на полноценном рационе из натуральных продуктов. После восемнадцатичасовой пищевой депривации под кетаминовым наркозом крысам производили срединную лапаротомию. Поперек продольной оси желудка и кишечника крысам вживляли иглы четырех биполярных электродов: в стенку антральной части желудка, в начальной части двенадцатиперстной кишки и в начальной части тощей кишки, на 10-15 см дистальнее дуодено-еюнального перехода, и в среднюю часть повздошной кишки. Зонд устанавливали на 5 см проксимальнее третьего электрода, в начальном участке тощей кишки. Электроды фиксировали в организме упругими пластинами, а зонд пришивали к кишке двойным швом. После фиксации в организме животного зонд и электроды проводили через мягкие ткани брюшной стенки и тазовой области, затем протаскивали под кожей хвоста и выводили наружу на расстоянии, равном 0,3 от длины хвоста крысы. После этого на хвосты крыс надевали втулку для крепления хвоста крыс в клетках и крыс распределяли по клеткам для проведения эксперимента и разделяли на две группы: первая - контрольная, вторая - опытная с ежедневным введением прокинетика «координакс» в течение 3-х суток после операции.
В контрольной группе анализ электрической активности исследуемых отделов ЖКТ показал, что у всех крыс в первые сутки после операции на электромиограммах регистрировались единичные потенциалы действия, отдельные пачки потенциалов действия слабой интенсивности. На электромиограммах двенадцатиперстной и тощей кишки наблюдали чередующиеся ритмы с периодом покоя и активности длительностью 25±5 сек и 50±10 сек. Мигрирующий миоэлектрический комплекс отсутствовал. На третьи сутки после операции в фоновых записях желудка отмечали группы пачек потенциалов действия слабой интенсивности. На электромиограммах двенадцатиперстной, тощей и подвздошной кишки пиковая активность была более выражена. Характер электрической активности соответствовал фазе II.
Также отмечали появление кратковременных хаотичных фаз III различной длительности. К пятым суткам после операции отмечалось формирование фаз III на электромиограммах желудка и двенадцатиперстной кишки, однако их длительность была нарушена. На электромиограммах тощей и подвздошной кишки наблюдали все три фазы нормальной продолжительности, однако их генерация не носила стабильного характера. На седьмые сутки регистрировали нормальный миоэлектрический комплекс, распространяющийся от желудка к подвздошной кишке. Период миоэлектрического комплекса составлял от 650+50 сек. Продолжительность фазы III - 210+60 сек. Появление стабильного миоэлектрического комплекса на седьмые сутки после операции и восстановление суммарной спайковой активности исследуемых отделов ЖКТ свидетельствует о нормализации координированного распространения сокращений вдоль ЖКТ и нормализации сократительной способности гладких мышц желудка, двенадцатиперстной кишки, тощей и подвздошной кишки.
В опытной группе у всех крыс в первые сутки после операции на электромиограммах отмечались единичные потенциалы действия, отдельные пачки потенциалов действия слабой интенсивности.
На электромиограммах двенадцатиперстной и тощей кишки наблюдали чередующиеся ритмы с периодом покоя и активности длительностью 25+5 сек и 50+10 сек. Мигрирующий миоэлектрический комплекс отсутствовал. В момент введения раствора прокинетика «координакса» в тощую кишку регистрировали кратковременное (в течение 20 сек) появление потенциалов действия на электромиограммах тощей кишки, что, по-видимому, может быть связано с непосредственной стимуляцией слизистой оболочки тощей кишки. При анализе электромиограмм, зарегистрированных на протяжении 2 часов после действия этого препарата, через 30-40 минут наблюдали чередование периодов четко распространяющихся потенциалов действия от желудка к тощей кишке длительностью 1-2 минуты с периодами покоя продолжительностью до 5 минут. При этом отсутствовали синхронные и хаотичные потенциалы действия в указанных отделах ЖКТ. В фоновых записях этой группы уже на вторые сутки после операции наблюдали появление миоэлектрического комплекса с нормальным периодом, но сниженной амплитуды, распространяющегося от желудка к подвздошной кишке. На электромиограммах исследуемых отделов присутствовали все фазы. На третьи сутки после операции в фоновых записях регистрировался нормальный миоэлектрический комплекс, начинающийся в желудке и распространяющийся к подвздошной кишке. Период миоэлектрического комплекса составлял 680+30 сек. Продолжительность фазы III - 280+40 сек.
Таким образом, в раннем периоде после операции выявили выраженные нарушения электрической активности ЖКТ с исчезновением миоэлектрического комплекса. В исследовании восстановление миоэлектрического комплекса желудка и тонкой кишки происходило на 7 сутки после операции. Внутрикишечное введение прокинетика координакса укорачивало общие сроки восстановления миоэлектрического комплекса до 3 суток.
Пример 2
Исследования предложенного способа выполняли на 10 половозрелых крысах-самцах. Во время лапаратомии помимо вживления зонда и электродов по вышеописанной методике крысам в бедренную вену вводили 0,1 мл раствора Lipopolysaccharides from Escherichija coli, начиная с дозы 200 мкг на кг массы животного. Ежедневно на протяжении 8 суток после операции проводили электрофизиологический мониторинг электрической активности ЖКТ.
В первые сутки после операции на электромиограммах наблюдали хаотичные единичные потенциалы действия и пачки слабой интенсивности в желудке, двенадцатиперстной кишке, тощей и подвздошной кишке. На вторые сутки и третьи сутки суммарная интенсивность потенциалов действия в желудке была снижена. На электромиограммах двенадцатиперстной, тощей и подвздошной кишки в основном регистрировались нерегулярные потенциалы действия слабой интенсивности. Однако средняя суммарная интенсивность потенциалов действия этих отделов существенно повышалась за счет мощных распространяющихся потенциалов действия. Этот паттерн характеризовался чередованием периодов активности длительностью 10 сек и периодов покоя длительностью 10 сек. Амплитуда потенциалов действия была в 2-3 раза больше, чем максимальная амплитуда потенциалов действия при нормальном состоянии. Скорость распространения потенциалов действия от двенадцатиперстной к тощей кишке составляла 0.8-1 см/сек.
В последующие сроки такого паттерна не наблюдали. Динамика электрической активности характеризовалась постепенным формированием фаз III на электромиограммах желудка, двенадцатиперстной и тощей кишки. К восьмым суткам после операции регистрировали нормальный миоэлектрический комплекс, распространяющийся от желудка к тонкой кишке. Интенсивность генерации потенциала действия во всех отделах не отличалась от нормальных значений.
Технико-экономический эффект предложенного технического решения состоит в возможности получить достоверную и точную оценку электрической активности и функционального состояния ЖКТ в раннем послеоперационном периоде, в получении оценки моделирования эндотоксемии в раннем периоде после операции, в возможности по полученным параметрам изменений интенсивности потенциалов действия и временных параметров миоэлектрического комплекса, с учетом координации работы отделов ЖКТ, составления прогнозов с достаточной точностью и назначения лечения.
1. Способ исследования электрической активности желудочно-кишечного тракта (ЖКТ) в эксперименте, включающий срединную лапаротомию, вживление биполярных электродов в серозно-мышечный слой желудка и тонкой кишки, введение зонда в тонкую кишку, проведение проводов от электродов и зонда через мягкие ткани передней брюшной стенки и тазовой области, выведение их наружу под кожей хвоста и мониторинг электрической активности ЖКТ, отличающийся тем, что при вживлении электродов оси их располагают поперек продольной оси, при этом первый электрод вживляют в антральный отдел желудка, второй - в начальную часть двенадцатиперстной кишки, третий - в начальный участок тощей кишки на 10-15 см дистальнее дуадено-еюнального перехода, четвертый - в среднюю часть подвздошной кишки, а зонд устанавливают в начальном участке тощей кишки на 5 см проксимальнее третьего электрода, затем до и после введения прикинетиков осуществляют одновременную регистрацию и исследование динамики электрической активности ЖКТ, а оценку электрической активности осуществляют по изменению интенсивности потенциала действия, временных параметров миоэлектрического комплекса и координации работы ЖКТ.
2. Способ исследования электрической активности желудочно-кишечного тракта (ЖКТ) в эксперименте по п.1, отличающийся тем, что во время лапаротомии вводят эндотоксин путем инъекции в бедренную вену крысы 0,1 мл раствора липополисахарида Esherichia coli в дозе, изменяющейся в пределах 200-500 мкг на кг массы животного.