Замещенные дигидро 3-галоген-1h-пиразол-5-карбоксилаты, их получение и использование
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы I и формулы II
где R1 представляет собой галоген; R2 представляет галоген; R3 представляет C1-C4 алкил; Х представляет N или СН; и n равно 0-3, при условии, что когда Х представляет собой СН, тогда n равно, по меньшей мере, 1.
где R1 представляет галоген; R2 представляет галоген; R3 представляет собой Н или C1-C4 алкил; Х представляет собой N или СН; и n равно от 0 до 3, при условии, что когда Х представляет собой СН, тогда n равно, по меньшей мере, 1. Изобретение также относится к способу получения соединения формулы I, способу получения соединения формулы II, способ получения соединения формулы III. Также описываются промежуточные соединения формулы 4. Технический результат - получение новых биологически активных соединений, которые представляют интерес в качестве инсектицидов, а также способ их получения. 6 н. и 18 з.п. ф-лы, 3 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым соединениям 3-галоген-1-арил-замещенных дигидро-1H-пиразолов и пиразолов на основе карбоновых кислот. Эти соединения являются пригодными для получения определенных соединений на основе антранил-амидов, которые представляют интерес в качестве инсектицидов (смотри, например, публикацию PCT WO 01/070671).
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Tetrahedron Letters, 1999, 40, 2605-2606 описывает получение соединений 1-фенил-3-бромпиразол-5-карбоновых кислот, включающее получение реакционно-способного промежуточного соединения бромнитрилимина. Циклоприсоединение этого промежуточного соединения со сложным акриловым эфиром дает сложный 1-фенил-3-бром-2-пиразолин-5-карбоксилатный эфир, который затем может быть окислен до желаемого сложного 1-фенил-3-бром-2-пиразол-5-карбоксилатного эфира. Альтернативно, циклоприсоединение сложного эфира пропиолата непосредственно дает сложный 1-фенил-3-бром-2-пиразол-5-карбоксилатный эфир.
Патент США 3153654 описывает конденсацию определенного необязательно замещенного арила (например, фенил или нафтил, которые необязательно замещены низшим алкилом, низшим алкокси или галогеном) гидразинов с определенными сложными фумаровыми или малеиновыми эфирами, с получением производных 3-пиразолидинон карбоновых кислот.
Публикации непрошедших экспертизу патентов Японии 9-316055 и 9-176124 описывают получение соединений сложных пиразоловых эфиров карбоновых кислот и производных пиразолинов, соответственно, которые замещены алкилом в 1-положении.
J. Med. Chem. 2001, 44, 566-578 описывает получение 1-(3-цианофенил)-3-метил-1H-пиразол-5-карбоновой кислоты и ее использование при получении ингибиторов фактора свертывания крови Xa.
Настоящее изобретение предлагает методики, пригодные для удобного получения 3-галоген-5-карбоксилат-1-арил-замещенных дигидро-1H-пиразолов и пиразолов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединению формулы I
где
R1 представляет собой галоген;
каждый R2 представляет собой, независимо, С1-C4 алкил, С2-C4 алкенил, С2-C4 алкинил, C3-С6 циклоалкил, C1-C4 галогеналкил, С2-C4 галогеналкенил, С2-C4 галогеналкинил, C3-С6 галогенциклоалкил, галоген, CN, NO2, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 алкилсульфинил, C1-C4 алкилсульфонил, C1-C4 алкиламино, C2-C8 диалкиламино, C3-С6 циклоалкиламино, C3-С6 (алкил)циклоалкиламино, С2-C4 алкилкарбонил, C2-C6 алкоксикарбонил, C2-C6 алкиламинокарбонил, C3-C8 диалкиламинокарбонил или C3-C6 триалкилсилил;
R3 представляет собой H или C1-C4 алкил;
X представляет собой N или CR4;
R4 представляет собой H или R2; и
n равно от 0 до 3, при условии, что, когда X представляет собой CH, n равно, по меньшей мере, 1.
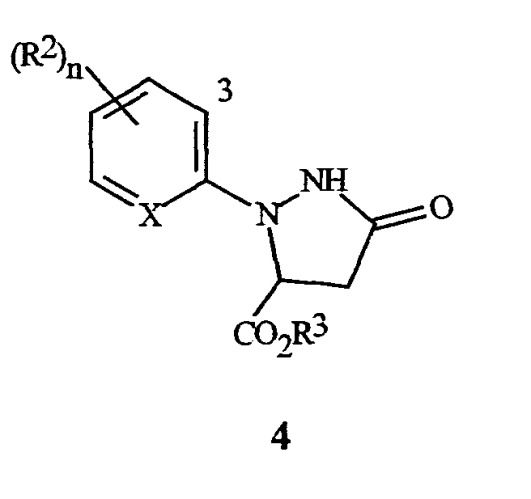
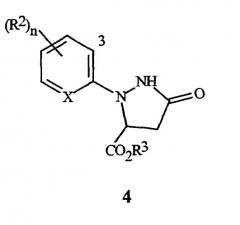
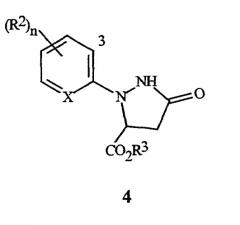
Настоящее изобретение также относится к способу получения соединения формулы I, включающему (1) обработку соединения формулы 4
(где X, R2 и n являются такими, как описано выше для формулы I, и R3 представляет собой C1-C4 алкил) галогенирующим агентом, с получением соединения формулы I; а затем, в случае получения соединений формулы I, где R3 представляет собой H, (2) преобразование соединения, полученного в (1) в соединение, где R3 представляет собой H.
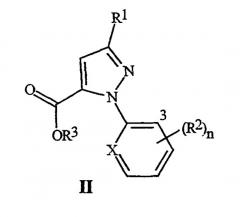
Настоящее изобретение также относится к соединению формулы II
где R1 представляет собой галоген (и X, R2, R3 и n являются такими, как определено выше, для формулы I), и к способу получения соединения формулы II. Способ включает (3) обработку соединения формулы I окислителем, необязательно, в присутствии кислоты, с получением соединения формулы II; а когда соединение формулы I, где R3 представляет собой C1-C4 алкил, используется для получения соединения формулы II, где R3 представляет собой H, (4) преобразование соединения, полученного в (2), в соединение формулы II, где R3 представляет собой H.
Настоящее изобретение также предусматривает соединения формулы 4, где X представляет собой N, и их использование при получении соединений формул I и II, где X представляет собой N (и R2, R3 и n являются такими, как определено выше, для формулы I).
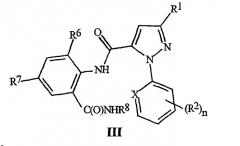
Настоящее изобретение также включает способ получения соединения формулы III
где X, R1, R2, и n являются такими, как определено выше, для формулы II; R6 представляет собой CH3, Cl или Br; R7 представляет собой F, Cl, Br, I или CF3; и R8 представляет собой C1-C4 алкил, с использованием соединения формулы II, где R6 представляет собой H. Этот способ отличается получением соединения формулы II с помощью способа, как указано выше.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В указанных выше перечислениях, термин "алкил", используемый либо сам по себе, либо в составных словах, таких как "алкилтио" или "галогеналкил", включает алкил с прямой или разветвленной цепью, такой как метил, этил, н-пропил, изо-пропил, или различные изомеры бутила, пентила или гексила. "Алкенил" может включать алкены с прямой или разветвленной цепью, такие как 1-пропенил, 2-пропенил, и различные изомеры бутенила, пентенила и гексенила. "Алкенил" также включает полиены, такие как 1,2-пропадиенил и 2,4-гексадиенил. "Алкинил" включает алкины с прямой или разветвленной цепью, такие как 1-пропинил, 2-пропинил, и различные изомеры бутинила, пентинила и гексинила. "Алкинил" также может включать остатки, содержащие множество тройных связей, такие как 2,5-гексадиинил. "Алкокси" включает, например, метокси, этокси, н-пропилокси, изопропилокси и различные изомеры бутокси, пентокси и гексилокси. "Алкоксиалкил" обозначает алкокси замещение группы алкила. Примеры "алкоксиалкила" включают CH3OCH2, CH3OCH2CH2, CH3CH2OCH2, CH3CH2CH2CH2OCH2 и CH3CH2OCH2CH2. "Алкилтио" включает алкилтио остатки с прямой или разветвленной цепью, такие как метилтио, этилтио, и различные изомеры пропилтио, бутилтио, пентилтио и гексилтио. "Циклоалкил" включает, например, циклопропил, циклобутил, циклопентил и циклогексил. "Циклоалкилалкил" указывает на алкильную группу, замещенную циклоалкильной группой, и включает, например, циклопропилметил, циклобутилэтил, циклопентилпропил и циклогексилметил. "Циклоалкиламино" обозначает, что атом азота амино присоединен к циклоалкильному радикалу и атому водорода и включает такие группы, как циклопропиламино, циклобутиламино, циклопентиламино и циклогексиламино. "(Алкил)циклоалкиламино" обозначает циклоалкиламино группу, где атом водорода замещен алкильным радикалом; примеры включают такие группы, как (алкил)циклопропиламино, (алкил)циклобутиламино, (алкил)циклопентиламино и (алкил)циклогексиламино. Предпочтительно, алкил в (алкил)циклоалкиламино представляет собой C1-C4 алкил, в то время как циклоалкил в циклоалкиламино и (алкил)циклоалкиламино представляет собой C3-C6 циклоалкил.
В этой заявке термин "арил" относится к ароматическому кольцу, или к кольцевой системе, или к гетероароматическому кольцу, или кольцевой системе, при этом, каждое кольцо или кольцевая система является необязательно замещенной. Термин "ароматическая кольцевая система" обозначает полностью ненасыщенные карбоциклы и гетероциклы, в которых, по меньшей мере, одно кольцо полициклической кольцевой системы является ароматическим. Ароматический указывает на то, что каждый из атомов кольца находится по существу в одной и той же плоскости и имеет p-орбиталь, перпендикулярную плоскости кольца, и в котором (4n + 2)π электронов, где n равно 0 или положительному целому числу, являются связанными с кольцом, в соответствии с правилом Хюккеля. Термин "ароматическая карбоциклическая кольцевая система" включает полностью ароматические карбоциклы и карбоциклы, в которых, по меньшей мере, одно кольцо полициклической кольцевой системы является ароматическим (например, фенилом и нафтилом). Термин "гетероароматическое кольцо или кольцевая система" включает полностью ароматические гетероциклы и гетероциклы, в которых, по меньшей мере, одно кольцо полициклической кольцевой системы является ароматическим, и в которых, по меньшей мере, один атом кольца не является углеродом, и которые могут содержать от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из азота, кислорода и серы, при условии, что каждое гетероароматическое кольцо содержит не более чем 4 атома азота, не более чем 2 атома кислорода и не более чем 2 атома серы (где ароматический указывает на то, что выполняется правило Хюккеля). Гетероциклические кольцевые системы могут быть соединены через любой доступный атом углерода или азота, путем замещения водорода на указанном атоме углерода или азота. Более конкретно, термин "арил" относится к остатку
где R2 и n являются такими, как определено выше, и "3" обозначает 3-е положение для заместителей на остатке.
Термин "галоген", либо сам по себе, либо в составных словах, таких как "галогеналкил", включает фтор, хлор, бром или йод. Кроме того, когда он используется в составных словах, таких как "галогеналкил", указанный алкил может быть частично или полностью замещен атомами галогенов, которые могут быть одинаковыми или различными. Примеры "галогеналкила" включают F3C, ClCH2, CF3CH2 и CF3CC12. Термины "галогеналкенил", "галогеналкинил", "галогеналкокси", и тому подобное, определяются по аналогии с термином "галогеналкил". Примеры "галогеналкенила" включают (C1)2C = CHCH2 и CF3CH2CH = CHCH2. Примеры "галогеналкинила" включают HC ≡ CCHCl, CF3C ≡ C, CC13C ≡ C и FCH2C ≡ CCH2. Примеры "галогеналкокси" включают CF3O, CC13CH2O, HCF2CH2CH2O и CF3CH2O.
Примеры "алкилкарбонила" включают C(O)CH3, C(O)CH2CH2CH3 и C(O)CH(CH3)2. Примеры "алкоксикарбонила" включают CH3OC(=O), CH3CH2OC(=O), CH3CH2CH2OC(=O), (CH3)2CHOC(=O) и различные изомеры бутокси- или пентоксикарбонила. Термины "алкиламинокарбонил" и "диалкиламинокарбонил" включают, например, CH3NHC(=O), CH3CH2NHC(=O) и (CH3)2NC(=O).
Общее количество атомов углерода в группе-заместителе указывается с помощью приставки "Ci-Cj", где i и j представляют собой цифры от 1 до 8. Например, C1-C3 алкилсульфонил обозначает соединения от метилсульфонила до пропилсульфонила. В указанных выше перечислениях, когда соединение формулы I содержит гетероароматическое кольцо, все заместители соединяются с этим кольцом через любой доступный атом углерода или азота, путем замещения водорода на указанном атоме углерода или азота.
Когда группа содержит заместитель, который может представлять собой водород, например R4, тогда, когда этот заместитель берется как атом водорода, тогда очевидно, что это эквивалентно тому, что указанная группа является незамещенной.
Определенные соединения по настоящему изобретению могут существовать в виде одного или нескольких стереоизомеров. Различные стереоизомеры включают энантиомеры, диастереомеры, атропоизомеры и геометрические изомеры. Специалист в данной области должен помнить, что один из стереоизомеров может быть более активным и/или может проявлять полезные эффекты, при обогащении им, по отношению к другому стереоизомеру (стереоизомерам), или когда он отделен от другого стереоизомера (стереоизомеров). Кроме того, специалист в данной области знает, как выделить, увеличить содержание и/или селективно получить указанные стереоизомеры. Соответственно, соединения по настоящему изобретению могут присутствовать в виде смеси стереоизомеров, отдельных стереоизомеров, или в виде оптически активной формы.
С точки зрения стоимости, простоты синтеза и/или наибольшей полезности предпочтительными являются следующие соединения:
1. Соединения формулы I, где R1 представляет собой Cl или Br;
каждый R2 представляет собой, независимо, Cl или Br, и один R2 находится в 3-м положении; и
X представляет собой N.
2. Соединения формулы I, где
R1 представляет собой Cl или Br;
X представляет собой N; и
n равно 0.
Особенно следует отметить соединения формулы I (включая, но, не ограничиваясь предпочтительными соединениями 1), где n равно от 1 до 3.
3. Соединения формулы II, где
X представляет собой N.
4. Соединения формулы II, где
R1 представляет собой Cl или Br;
каждый R2 представляет собой независимо Cl или Br, и один R2 находится в 3-м положении; и
X представляет собой N.
5. Соединения формулы II, где
R1 представляет собой Cl или Br;
X представляет собой N; и
n равно 0.
Особенно следует отметить соединения формулы II (включая, но не ограничиваясь предпочтительными соединениями 3 и 4), где n равно от 1 до 3.
6. Соединения формулы 4 (где R3 представляет собой C1-C4 алкил), где каждый R2 представляет собой независимо Cl или Br, и один R2 находится в 3-м положении.
7. Соединения формулы 4 (где R3 представляет собой C1-C4 алкил), где
X представляет собой N; и
n равно 0.
Особенно следует отметить соединения формулы 4 (где R3 представляет собой C1-C4 алкил), включая, но, не ограничиваясь предпочтительными соединениями 6, где n равно от 1 до 3.
3-е положение определяется с помощью цифры "3", изображенной в арильном остатке, включенном выше в формулу I, формулу II и формулу 4.
Особенно предпочтительны соединения формулы II, где, когда R1 представляет собой Cl или Br, n равно 1, и R2, выбранный из Cl или Br, находится в 3-м положении; тогда X представляет собой N. Включены соединения, где n равно от 1 до 3.
Особенно предпочтительны соединения формулы II, где, когда R1 представляет собой Cl или Br, n равно 1, и R2, выбранный из Cl или Br, находится в 3-м положении; тогда X представляет собой CR4. Включены соединения, где n равно от 1 до 3.
Предпочтительные способы представляют собой такие, которые содержат предпочтительные соединения, указанные выше. Отмеченные способы являются такими, которые включают соединения, отмеченные выше. Особенно отмеченными являются способ получения соединения формулы I, где n равно от 1 до 3; и способ получения соединения формулы II, где n равно от 1 до 3.
Многостадийный способ получения соединений формулы I и формул II, предусмотренный здесь, включает (a) обработку соединения формулы 2
соединением формулы 3
где R3 представляет собой C1-C4 алкил,
в присутствии основания, с получением соединения формулы 4
где X, R2 и n являются такими, как определено выше, и R3 представляет собой H или C1-C4 алкил.
Соединение формулы 4, где R3 представляет собой C1-C4 алкил, может затем (1) обрабатывается галогенирующим агентом, с получением соединения формулы I; а, в случае получения соединения формулы I, где R3 представляет собой H, и (2) соединения, полученные в (1), преобразуются в соединение, где R3 представляет собой H.
Соединение формулы I, полученное в (1) или (2), может затем (3) обрабатываться окислителем, необязательно в присутствии кислоты, с получением соединения формулы II; и когда соединения формулы I, где R3 представляет собой C1-C4 алкил, используются для получения соединений формулы II, где R3 представляет собой H, (4), осуществляют преобразование соединения, полученного в (3), в соединение формулы II, где R3 представляет собой H
Схема 1 иллюстрирует стадию (a).
Схема 1
На стадии (a), соединение формулы 2 обрабатывают соединением формулы 3, где R3 представляет собой C1-C4 алкил (могут быть использованы сложные фумаратный или малеатный эфиры, или их смесь), в присутствии основания и растворителя. Основание, как правило, представляет собой соль алкоксида металла, такую как метоксид натрия, метоксид калия, этоксид натрия, этоксид калия, третбутоксид калия, третбутоксид лития, и тому подобное. Необходимо использовать более чем 0,5 эквивалента основания, по отношению к соединению формулы 2, предпочтительно, в пределах между 0,9 и 1,3 эквивалента. Необходимо использовать более чем 1,0 эквивалент соединения формулы 3, предпочтительно, в пределах между 1,0 и 1,3 эквивалента. Могут быть использованы полярные протонные и полярные апротонные органические растворители, такие как спирты, ацетонитрил, тетрагидрофуран, N,N-диметилформамид, диметилсульфоксид, и тому подобное. Предпочтительные растворители представляют собой спирты, такие как метанол и этанол. Является особенно предпочтительным, чтобы спирт был таким же, как и тот, что используется при получении сложного фумаратного или малеатного эфира и алкоксидного основания. Как правило, взаимодействие осуществляют путем смешивания соединения формулы 2 и основания в растворителе. Смесь может нагреваться или охлаждаться до желаемой температуры, и соединение формулы 3 добавляют в течение некоторого периода времени. Типичные температуры реакции находятся в пределах между 0°C и температурой кипения используемого растворителя. Взаимодействие может осуществляться при давлении, большем, чем атмосферное давление, для увеличения температуры кипения растворителя. Как правило, предпочтительными являются температуры в пределах, примерно, между 30° и 90°C. Время добавления может быть настолько быстрым, насколько позволяет изменение температуры (теплоперенос). Типичное время добавления находится в пределах между 1 минутой и 2 часами. Оптимальная температура реакции и время добавления изменяются в зависимости от характера соединений формулы 2 и формулы 3. После добавления, реакционная смесь может выдерживаться, в течение некоторого времени, при температуре реакции. В зависимости от температуры реакции, необходимое время выдерживания может находиться в пределах от 0 до 2 часов. Типичное время выдерживания составляет примерно от 10 до 60 минут. Затем реакционная масса может быть подкислена путем добавления органической кислоты, такой как уксусная кислота, и тому подобное, или неорганической кислоты, такой как хлористоводородная кислота, серная кислота, и тому подобное. В зависимости от условий реакции и средств выделения, могут быть получены соединения формулы 4, где R3 представляет собой H, или соединения формулы 4, где R3 представляет собой C1-C4 алкил. Например, соединение формулы 4, где R3 представляет собой C1-C4 алкил, может гидролизоваться in situ до соединения формулы 4, где R3 представляет собой H, когда в реакционной смеси присутствует вода. Соединения формулы 4, где R3 представляет собой H, легко могут преобразовываться в соединения формулы 4, где R3 представляет собой С1-C4 алкил, с использованием способов эстерификации, хорошо известных в данной области. Соединения формулы 4, где R3 представляет собой С1-C4 алкил, являются предпочтительными. Желаемый продукт, соединение формулы 4, может быть выделено с помощью способов, известных специалисту в данной области, таких как кристаллизация, экстракция или дистилляция.
На стадии (1), как иллюстрируется на схеме 2, соединение формулы 4 обрабатывают с помощью галогенирующего реагента, как правило, в присутствии растворителя. Галогенирующие реагенты, которые могут быть использованы, включают оксигалогениды, тригалогениды и пентагалогениды фосфора, тионилхлорид, дигалогентриалкилфосфораны, дигалогендифенилфосфораны, оксалилхлорид и фосген. Предпочтительными являются оксигалогениды и пентагалогениды фосфора. Для получения полного преобразования, необходимо использовать, по меньшей мере, 0,33 эквивалента оксигалогенида фосфора, по отношению к соединению формулы 4, предпочтительно, в пределах между 0,33 и 1,2 эквивалента. Для получения полного преобразования, необходимо использовать, по меньшей мере, 0,20 эквивалента пентагалогенида фосфора по отношению к соединению формулы 4, предпочтительно, в пределах примерно между 0,20 и 1,0 эквивалентом. Соединения формулы 4, где R3 представляет собой C1-C4 алкил, являются предпочтительными для этой реакции.
Схема 2
Типичные растворители для такого галогенирования включают галогенированные алканы, такие как дихлорметан, хлороформ, хлорбутан, и тому подобное, ароматические растворители, такие как бензол, ксилол, хлорбензол, и тому подобное, простые эфиры, такие как тетрагидрофуран, п-диоксан, простой диэтиловый эфир, и тому подобное, и полярные апротонные растворители, такие как ацетонитрил, N,N-диметилформамид, и тому подобное. Необязательно, может быть добавлено органическое основание, такое как триэтиламин, пиридин, N,N-диметиланилин, или что-либо подобное. Добавление катализатора, такого как N,N-диметилформамид, также является необязательным. Предпочтительным является способ, в котором растворитель представляет собой ацетонитрил, и основание отсутствует. Как правило, когда используется ацетонитрил как растворитель, не требуется ни основания, ни катализатора. Предпочтительный способ осуществляется путем смешивания соединения формулы 4 с ацетонитрилом. Затем, за удобное время, добавляется галогенирующий реагент, а затем, смесь выдерживают при желаемой температуре до завершения реакции. Температура реакции, как правило, находится в пределах между 20°C и температурой кипения ацетонитрила, а время реакции, как правило, является меньшим чем 2 часа. Затем реакционную массу нейтрализуют с помощью неорганического основания, такого как бикарбонат натрия, гидроксид натрия, и тому подобное, или органического основания, такого как ацетат натрия. Желаемый продукт, соединение формулы I, может быть выделено с помощью способов, известных специалистам в данной области, включая кристаллизацию, экстракцию и дистилляцию.
На стадии (2), соединение формулы I, где R3 представляет собой C1-C4 алкил, сложный эфир, может быть гидролизовано до соединения формулы I, где R3 представляет собой H, до карбоновой кислоты. Гидролиз может катализироваться с помощью кислот, ионов металлов и с помощью ферментов. Йодтриметилсилан отмечается как пример кислоты, которая может быть использована для катализа гидролиза (смотри Advanced Organic Chemistry, Third Ed., Jerry March, John Wiley & Sons, Inc. New York, 1985, pp. 334-338, обзор методов). Способы гидролиза, катализируемого основаниями, не рекомендуются для гидролиза соединений формулы I и могут привести к разложению. Карбоновая кислота может быть выделена с помощью способов, известных специалистам в данной области, включая кристаллизацию, экстракцию и дистилляцию.
На стадии (3), как иллюстрируется на схеме 3, соединение формулы I обрабатывают окислительным агентом, необязательно, в присутствии кислоты. Соединение формулы I, где R3 представляет собой C1-C4 алкил (то есть, предпочтительный продукт стадии (1)), является предпочтительным, в качестве исходного материала для стадии (3). Окислительный агент может представлять собой перекись водорода, органические пероксиды, персульфат калия, персульфат натрия, персульфат аммония, моноперсульфат калия (например, Oxone®) или перманганат калия. Для достижения полного превращения (преобразования), необходимо использовать, по меньшей мере, один эквивалент окислительного агента, по отношению к соединению формулы I, предпочтительно, примерно от одного до двух эквивалентов. Это окисление, как правило, осуществляется в присутствии растворителя. Растворитель может представлять собой простой эфир, такой как тетрагидрофуран, п-диоксан, и тому подобное, сложный органический эфир, такой как этилацетат, диметилкарбонат, и тому подобное, или полярный апротонный органический растворитель, такой как N,N-диметилформамид, ацетонитрил, и тому подобное. Кислоты, пригодные для использования на стадии окисления, включают неорганические кислоты, такие как серная кислота, фосфорная кислота, и тому подобное, и органические кислоты, такие как уксусная кислота, бензойная кислота, и тому подобное. Кислота, когда она используется, должна быть использована в пропорции, большей чем 0,1 эквивалента, по отношению к соединению формулы I. Для достижения полного преобразования, можно использовать от одного до пяти эквивалентов кислоты. Для соединений формулы I, где X представляет собой CR2, предпочтительный окислитель представляет собой перекись водорода, и окисление предпочтительно осуществляют в отсутствие кислоты. Для соединений формулы I, где X представляет собой N, предпочтительный окислитель представляет собой персульфат калия, и окисление предпочтительно осуществляют в присутствии серной кислоты. Взаимодействие может осуществляться путем перемешивания соединения формулы I в желаемом растворителе и в кислоте, если она используется. Затем может добавляться окислитель, с удобной скоростью. Температура реакции, как правило, изменяется, самое меньшее, примерно от 0°C до температуры кипения растворителя, с целью получения разумного времени взаимодействия, для завершения реакции, предпочтительно, меньше чем за 8 часов. Желаемый продукт, соединение формулы II, где R3 представляет собой C1-C4 алкил, может быть выделено с помощью способов, известных специалистам в данной области, включая кристаллизацию, экстракцию и дистилляцию.
Схема 3
На стадии (4), как иллюстрируется на схеме 4, соединение формулы II, где R3 представляет собой C1-C4 алкил, то есть сложный эфир, может быть преобразовано в соединение формулы II, где R3 представляет собой H, то есть карбоновую кислоту. Способы преобразования сложных эфиров в карбоновые кислоты хорошо известны специалистам в данной области. Соединения формулы II (R3 представляет собой C1-C4 алкил) могут быть преобразованы в соединения формулы II (R3 представляет собой H) с помощью многочисленных способов, включая нуклеофильное расщепление в безводных условиях, или гидролитических способов, включая использование либо кислот, либо оснований (смотри T.W. Greene и P.G.M. Wuts, Protective Groups in Organic Synthesis, 2nd ed., John Wiley & Sons, Inc., New York, 1991, pp. 224-269, обзор методов). Для способа схемы 4, предпочтительными являются способы гидролиза со щелочным катализом. Пригодные для использования основания включают гидроксиды щелочных металлов (таких как литий, натрий или калий). Например, сложный эфир может быть растворен в смеси воды и спирта, такого как этанол. При обработке гидроксидом натрия или гидроксидом калия, сложный эфир омыляется, с получением натриевой или калиевой соли карбоновой кислоты. Подкисление с помощью сильной кислоты, такой как хлористоводородная кислота или серная кислота, дает карбоновую кислоту. Карбоновая кислота может быть выделена способами, известными специалистам в данной области, включая кристаллизацию, экстракцию и дистилляцию.
Схема 4
Следует отметить, что определенные соединения формулы I, где R1 представляет собой галоген, могут быть получены из других соединений формулы I, где R1 представляет собой другой галоген или представляет собой сульфонатную группу, такую как п-толуолсульфонат, бензолсульфонат и метансульфонат. Например, соединение формулы I, где R1 представляет собой Br, может быть получено путем обработки, с помощью бромистого водорода, соответствующего соединения формулы I, где R1 представляет собой Cl или п-толуолсульфонат. Взаимодействие осуществляется в соответствующем растворителе, таком как дибромметан, дихлорметан или ацетонитрил. Взаимодействие может осуществляться при атмосферном давлении или около него, или при давлении, превышающем атмосферное давление, в емкости высокого давления. Когда R1,в исходном соединении формулы I, представляет собой галоген, такой как Cl, взаимодействие предпочтительно осуществляется таким образом, что галогенид водорода, генерируемый в реакции, удаляется с помощью продувки или других соответствующих средств. Взаимодействие может осуществляться при температуре в пределах между примерно 0 и 100°C, удобнее всего, около температуры окружающей среды (например, примерно 10-40°C), а более предпочтительно, в пределах примерно между 20 и 30°C. Добавление катализатора на основе кислоты Льюиса (например, трибромида алюминия, для получения соединения формулы I, где R1 представляет собой Br) может ускорить реакцию. Продукт формулы I может быть выделен с помощью обычных способов, известных специалистам в данной области, включая экстракцию, дистилляцию и кристаллизацию.
Исходные соединения формулы I, где R1 представляет собой галоген, могут быть приготовлены так, как уже описано для схемы 2. Исходные соединения формулы I, где R1 представляет собой сульфонатную группу, могут, подобным же образом, быть получены из соответствующих соединений формулы 4 с помощью стандартных способов, таких как обработка сульфонилхлоридом (например, п-толуолсульфонилхлоридом) и основанием, таким как третичный амин (например, триэтиламин), в соответствующем растворителе, таком как дихлорметан.
Без дальнейших пояснений, предполагается, что специалист в данной области, используя предшествующее описание, может использовать настоящее изобретение в его наиболее полном объеме. По этой причине, следующие далее примеры должны рассматриваться исключительно как иллюстративные и не ограничивающие описание каким-либо образом. Исходный материал для следующих далее примеров может и не обязательно готовиться с помощью конкретного способа получения, процедура которого описывается в других примерах. Процентные содержания представляют собой проценты по массе (массовые), исключая смеси хроматографических растворителей или те места, где указано иное. Доли и проценты для смесей хроматографических растворителей указаны по объему, если не указано иного. Спектры 1H ЯМР указываются в м.д., в сторону слабого поля, от тетраметилсилана; "s" обозначает синглет, "d" обозначает дублет, "t" обозначает триплет, "q" обозначает квартет, "m" обозначает мультиплет, "dd" обозначает дублет дублетов, "dt" обозначает дублет триплетов, и "br s" обозначает уширенный синглет.
ПРИМЕР 1
Получение этил 5-оксо-2-фенил-3-пиразолидинкарбоксилата (альтернативное название этил 1-фенил-3-пиразолидинон-5-карбоксилат) с использованием диэтилмалеата
В 300-мл четырехгорлую колбу, оснащенную механической мешалкой, термометром, капельной воронкой для добавления реагента, обратным холодильником и вводом для азота, загружают 80 мл абсолютного этанола, 80,0 мл (0,214 моль) 21% этоксида натрия в этаноле и 20,0 мл (0,203 моль) фенилгидразина. Оранжевый раствор обрабатывают по каплям 40,0 мл (0,247 моль) диэтилмалеатом в течение примерно в 18 минут. Температура реакционной массы возрастает от 25 до 38°C в течение первых 5 минут добавления. Используют водяную баню попеременно с продолжением добавления для поддержания температуры реакции в пределах между 38-42°C. Полученный оранжево-красный раствор выдерживают в условиях окружающей среды в течение 30 минут. Затем его переносят в делительную воронку, содержащую 20,0 мл (0,349 моль) ледяной уксусной кислоты и 700 мл воды. Смесь экстрагируют 250 мл дихлорметана. Экстракт сушат над сульфатом магния, фильтруют, а затем концентрируют на роторном испарителе. Полученное черно-желтое масло (52,7 г) разбавляют 100 мл простого эфира, при этом кристаллизация продукта является достаточно быстрой для того, чтобы вызвать легкое кипение. Суспензию выдерживают в течение 2 часов в условиях окружающей среды. Затем ее охлаждают примерно до 0°C. Продукт отделяют посредством фильтрования, промывают 2 x 20 мл холодного простого эфира, а затем сушат на воздухе на фильтре в течение примерно 15 минут. Продукт состоит из 29,1 г (61%) белого порошка с высокой степенью кристалличности. По 1Н ЯМР никаких значительных примесей не обнаруживается. Фильтрат концентрируют до 20,8 г коричневого масла. Анализ масла показывает присутствие дополнительных 6,4 г (13%) желаемого продукта. Следовательно, общий выход реакции составляет 74%.
1Н ЯМР (ДМСО-d6) δ 10,25 (с, 1H), 7,32 (т, 2H), 7,15 (д, 2H), 7,00 (т, 1H), 4,61 (дд, 1H), 4,21 (кв, 2H), 2,95 (дд, 1H), 2,45 (дд, 1H), 1,25 (т, 3H).
ПРИМЕР 2
Получение этил 5-оксо-2-фенил-3-пиразолидинкарбоксилата (альтернативное название этил 1-фенил-3-пиразолидинон-5-карбоксилат) с использованием диэтилфумарата
В 500-мл четырехгорлую колбу, оснащенную механической мешалкой, термометром, капельной воронкой для добавления реагента, обратным холодильником и вводом для азота, загружают 150 мл абсолютного этанола, 15,0 г (0,212 моль) 96% этоксида натрия в этаноле и 20,0 мл (0,203 моль) фенилгидразина. Оранжевую смесь обрабатывают по каплям 40,0 мл (0,247 моль) диэтилфумарата в течение периода 75 минут. Во время добавления температура реакционной массы возрастает от 28 до 37°C максимально, и конечная температура составляет 32°C. Полученный несколько мутный оранжевый раствор выдерживают в условиях окружающей среды в течение 135 минут. Затем реакционную смесь выливают в делительную воронку, содержащую 15,0 мл (0,262 моль) ледяной уксусной кислоты и 700 мл воды. Смесь экстрагируют 150 мл дихлорметана. Экстракт сушат над сульфатом магния, фильтруют, а затем концентрируют на роторном испарителе. Полученное буро-желтое масло (41,3 г) разбавляют 100 мл простого эфира. Добавляют несколько затравочных кристаллов. Смесь выдерживают в течение 30 минут в условиях окружающей среды. Затем ее охлаждают примерно до 0°C. Продукт отделяют посредством фильтрования, промывают 2 x 10 мл холодного простого эфира, а затем сушат на воздухе на фильтре в течение примерно 15 минут. Продукт состоит из 9,5 г (20%) белого порошка с высокой степенью кристалличности. По 1Н ЯМР никаких значительных примесей не обнаруживается. Фильтрат концентрируют до 31 г коричневого масла. Анализ масла показывает присутствие дополнительных 7,8 г (16%) желаемого продукта. Следовательно, общая селективность реакции составляет 36%.
ПРИМЕР 3
Получение этил 5-оксо-2-(2-пиридинил)-3-пиразолидинкарбоксилата (альтернативное название этил 1-(2-пиридинил)-3-пиразолидинон-5-карбоксилат)
В 200-мл четырехгорлую колбу, оснащенную механической мешалкой, термометром, капельной воронкой для добавления реагента, обратным холодильником и вводом для азота, загружают 18 мл абсолютного этанола, 18,0 мл (0,0482 моль) 21% этоксида натрия в этаноле и 5,00 г (0,0458 моль) 2-гидразинопиридина. Раствор нагревают до 34°C. Затем его обрабатывают по каплям 9,0 мл (0,056 моль) диэтилмалеатом в течение периода в 20 минут. Во время добавления температура реакционной массы возрастает максимально до 48°C. Полученный оранжевый раствор выдерживают в условиях окружающей среды в течение 85 минут. Затем его выливают в делительную воронку, содержащую 4,0 мл (0,070 моль) ледяной уксусной кислоты и 300 мл воды. Смесь экстрагируют 2 x 50 мл дихлорметана. Экстракт сушат над сульфатом магния, фильтруют, а затем концентрируют на роторном испарителе. Полученное оранжевое масло (10,7 г) подвергают флэш-хроматографии на колонке с 200 г силикагеля, используя 4% метанол в хлороформе в качестве элюента (50 мл фракции). Фракции 9-12 выпаривают на роторном испарителе с получением 3,00 г оранжевого масла, которое содержит 77% желаемого продукта, 15% хлороформа и 8% диэтил 2-этоксибутандиоата. Фракции 13-17 концентрируют с получением 4,75 г оранжево-желтого масла, которое содержит 94% желаемого продукта и 6% хлороформа. Фракции 18-21 концентрируют с получением 1,51 г оливково-зеленого масла, которое содержит 80% желаемого продукта и