Способ получения 2-метил-5-замещенных-1,3,4-оксадиазолов
Иллюстрации
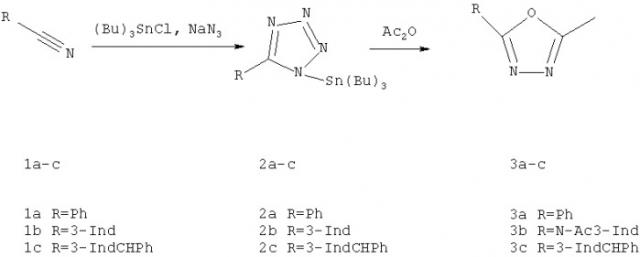
Показать всеИзобретение относится к области химии гетероциклических соединений, обладающих потенциальной биологической активностью, в частности к способу получения 2-метил-5-замещенных-1,3,4-оксадиазолов. Описывается способ получения 2-метил-5R-замещенных-1,3,4-оксадиазолов, где R означает арил, гетарил или алкил, циклизацией трибутилстаннильных производных тетразола в присутствии ангидридов алифатических кислот по схеме:
Способ позволяет по упрощенной технологии получить 2-метил-1,3,4-оксадиазолы, замещенные в 5-положении объемными заместителями.
Реферат
Настоящее изобретение относится к области химии гетероциклических соединений, обладающих потенциальной биологической активностью, в частности к способу получения 2-метил-5-замещенных-1,3,4-оксадиазолов. Такие ароматические производные 1,3,4-оксадиазолов представляют собой класс химически стойких и термоустойчивых полимеров, обладают люминесцирующими свойствами, входят в состав жидко-кристаллических пленок, токопроводящих полимерных композиций [N.Weijuan, S.Jianhua, Ch.Kongchang, T.He, Chemistry Letters, 26(1), 101, 1997].
Наиболее близким аналогом является способ получения 2,5-дифенил-1,3,4-оксадиазола внутримолекулярной циклизацией 1,2-дифенилгидразина с хлорокисью фосфора при нагревании без растворителя [Методы получения химически чистых реактивов и препаратов. Выпуск 2, стр.57, Москва, 1961].
Недостатками способа, принятого за прототип, являются труднодоступность синтеза 1,3,4-оксадиазолов, имеющих объемные заместители, или недоступность (неустойчивость соответствующих ацилгидразидов).
Задачей изобретения является устранение указанных недостатков при получении 1,3,4-оксадиазолов.
Согласно настоящему изобретению предлагается способ получения 2-метил-5-замещенных-1,3,4-оксадиазолов общей формулы:
где R означает арил, гетарил или алкил, заключающийся в том, что трибутилстаннильные производные тетразола подвергают циклизации в присутствии ангидрида алифатической кислоты.
Для получения указанных 1,3,4-оксадиазолов используют предварительно полученные трибутилстаннильные производные тетразола, циклизация которых ангидридами алифатической кислоты позволяет получить 2,5-дизамещенные-1,3,4-оксадиазолы в одну стадию по следующей схеме:
Пример 1
Получение 2,5-дифенил-1,3,4-оксадиазола известным способом.
В колбу емкостью 0,5 л, снабженную механической мешалкой и обратным холодильником, помещают раствор 10 г 98%-ного гидразингидрата в 200 мл сухого пиридина и к нему медленно, по каплям, добавляют 56 г бензоилхлорида. После окончания прибавления всего бензоилхлорида смесь кипятят 20 мин, а затем содержимое колбы выливают в холодную воду (500-600 мл). Выпавший бесцветный кристаллический продукт отфильтровывают, промывают на фильтре водой и сушат. Выход 1,2-дибензоилгидразина количественный, т. пл. 237°С. Смешивают 24 г 1,2-дибензоилгидразина с 80 мл хлорокиси фосфора и кипятят в колбе емкостью 250 мл с обратным холодильником в течение 1 ч, причем находящееся в виде суспензии вещество целиком переходит в раствор. После этого отгоняют 40 мл хлорокиси фосфора, а остаток осторожно выливают в пятикратное количество холодной воды. Выпавший бесцветный кристаллический осадок отфильтровывают, промывают водой и сушат, выход 19 г (91% теории), т. пл. 137°С.
Способ получения 2 и 3
Пример 2
Общая методика получения соединений 2.
Растворяют в 20 мл о-ксилола (0.02 моль) азида натрия (0.02 моль) трибутилоловохлорида и нагревают при температуре кипения в течение 5 ч. Охлаждают до комнатной температуры. Затем добавляют (0.0065 моль) нитрила 1а-с и нагревают при температуре кипения еще 15 ч. Контроль над ходом реакции ведут по ТСХ (Silufol UV-254, система ЭА-CCl4 (1:4)). Горячий раствор фильтруют от неорганических солей. Охлаждают до комнатной температуры. Выливают в холодный петролейный эфир или гексан. Промывают несколько раз горячим гептаном.
Пример 3
По приведенной методике получены:
На основе бензонитрила - 5-фенил-1-(трибутилстаннил)-1H-1,2,3,4-тетраазол 2а - т. пл. 66-68°С. [М.Casey, Ch.Moody, Ch.Rees, J.Chem. Soc., Perkin Trans. 1, 1933 (1984)].
Пример 4
На основе 3-цианиндола - 3-[1-(Трибутилстаннил)-1H-1,2,3,4-тетраазол-5-ил]-1H-индол 2b. Т. пл. 148-150°С. Спектр ЯМР 1Н CD3CN (d, м. д., J/Гц); 9.60 (уш.с., 1Н, NH); 8.28 (м., 1Н, H(4)Ind); 7.85 (д., 1Н, H(2)Ind, J=2.75); 7.51 (м., 1Н, H(7)Ind); 7.24 (м., 1Н, H(6)Ind); 7.19 (м., 1Н, H(5)Ind); 1.68-1.36 (м., 12Н, (CH2)6); 0.89 (т., 9Н, (СН3)3, J=7.15). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 474 [M]+ (10). Найдено (%): С, 52.89; Н, 6.87; N, 14.41; C21H33N5Sn. Вычислено (%): С, 53.19; Н, 7.01; N, 14.77.
Пример 5
На основе 2-(1H-индол-3-ил)-2-фенилацетонитрила - 3-фенил[1-(трибутилстаннил)-1H-1,2,3,4-тетраазол-5-ил]метил-1H-индол 2с - Т. пл. 199.5-200.5°С (изопропанол). Спектр ЯМР 1Н DMSO-d6 (d, м. д., J/Гц); 7.43 (м., 2Н, Н(2,6)ph); 7.37 (м., 1Н, H(4)Ind); 7.31 (м., 1Н, H(7)Ind); 7.22 (м., 2Н, Н(3,5)ph); 7.12 (м., 1Н, Н(4)ph); 7.09 (м., 1Н, H(2)Ind); 7.01 (м., 1Н, H(6)Ind); 6.85 (м., 1Н, H(5)Ind); 5.86 (с., 1Н, CH); Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 563 [M]+ (15), 206 [IndCHPh]+ (100). Найдено (%):С, 59.59; Н, 6.97; N, 12.41; C28H39N5Sn. Вычислено (%): С, 59.39; Н, 7.07; N, 12.56.
Общая методика получения 3а-с
Соединения 2а-с (0.0062 моль) растворяют в 40 мл уксусного ангидрида. Нагревают при температуре кипения 9 ч. Отгоняют на роторном испарителе уксусный ангидрид. Остаток промывают несколько раз гептаном.
Перекристаллизовывают из изопропилового спирта.
Пример 6
По приведенной методике получены:
2-Метил-5-фенил-1,3,4-оксадиазол 3а - т. пл. 65-68°С (изопропанол). Спектр ЯМР 1H CD3CN (d, м. д., J/Гц); 8.01 (м., 2Н, o-Ph); 7.6 (м., 3Н, м-п-Ph); 2.55 (с., 3Н, СН3). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 160 [М]+. Найдено (%): С, 74.42; Н, 5.03; N, 14.22; C9H8N2О. Вычислено (%): С, 74.72; Н, 5.23; N, 14.52.
Пример 7
1-[3-(5-Метил-1,3,4-оксадиазол-2-ил)-1H-индол-1-ил]-1-этанон 3b. Т. пл. 176-178°С (изопропанол). Спектр ЯМР 1H CD3CN (d, м. д., J/Гц); 8.45 (м., 1Н, H(7)Ind); 8.25 (м., 1Н, H(2)Ind); 8.25 (м., 1Н, H(4)Ind); 7.49 (м., 1Н, H(6)Ind); 7.43 (м., 1Н, H(5)Ind); 2.68 (с., 3Н, СН3); 2.57 (с., 3Н, СН3). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 240 [М]+ (45), 199 [М-СОСН3]+ (100). Найдено (%): С, 69.74; Н, 4.82; N, 10.86. C14H12N2O2. Вычислено (%): С, 69.99; Н, 5.03; N, 11.66.
Пример 8
3-[(5-Метил-1,3,4-оксадиазол-2-ил)(фенил)метил]-1H-индол 3с. Т. пл. 185-186°С (изопропанол). Спектр ЯМР 1H CD3CN (d, м. д., J/Гц); 7.42 (м., 1Н, H(7)Ind); 7.35 (м., 1Н, H(4)Ind); 7.3-7.4 (м., 5Н, Ph); 7.16 (д., 1Н, H(2)Ind, J=2.56); 7.13 (м., 1Н, H(6)Ind); 6.99 (м., 1Н, H(5)Ind); 5.94 (с., 1Н, СН); 2.43 (с., 3Н, СН3). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн (%)): 289 [M]+ (100), 206 [IndCHPh]+ (95). Найдено (%): С, 74.44; Н, 5.12; N, 14.26. C18H15N3O. Вычислено (%): С, 74.72; Н, 5.23; N, 14.52.
Как видно из приведенных примеров, разработанный способ позволяет по простой технологии получать 2-метил-5-замещенные-1,3,4-оксадиазолы разнообразного строения, содержащие алкильные, арильные и гетарильные заместители в 5-положении 1,3,4-оксадиазольного цикла.
Способ получения 2-метил-5-замещенных-1,3,4-оксадиазолов общей формулы
где R означает арил, гетарил или алкил, характеризующийся тем, что трибутилстаннильные производные тетразола подвергают циклизации в присутствии ангидрида алифатической кислоты.