Способ получения три- и тетраорганилалкинилолова
Иллюстрации
Показать всеИзобретение относится к способу получения ацетиленовых оловоорганических соединений общей формулы
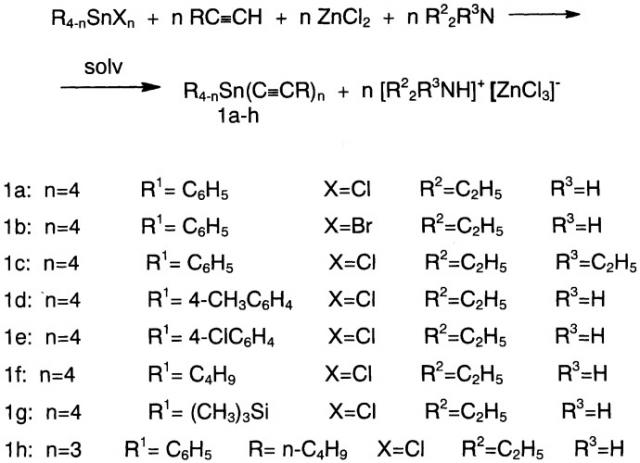
R4-nSn(C≡CR1)n,
где R - низший алкил; R1 - фенил, гексинил, триметилсилилэтинил и др.; n=3 или 4. Для упрощения и безопасности способа получения предлагается указанные соединения синтезировать при взаимодействии алкилтригалогенидов олова или тетрагалогенидов олова с 1-алкинами в присутствии вторичного третичного алифатического амина и хлорида цинка в среде углеводородного растворителя при температуре 20-70°С при мольном соотношении тетрагалогенид олова:1-алкин:хлорид цинка:амин = 1:4:4,2:8,4 или мольном соотношении алкилтрихлоролово:1-алкин:хлорид цинка:амин = 1:3:3,1:6,2 с выходами 48-82%. 1 н.п. ф-лы.
Реферат
Изобретение относится к способу получения ацетиленовых оловоорганических соединений общей формулы
где R - низший алкил; R1 - фенил, гексинил, триметилсилилэтинил и др.; n=3 или 4.
В настоящее время такие соединения как три- и тетраорганилалкинилолова находят применение в качестве катализаторов полимеризации /Lachini M., Castro P.M., Kalmi M., Leskela M., Repo Т. / The use of tetra (phenylethynyl)tin as an initiator for the ring-opening polymerization of lactide. // Organometallics. - 2004. - Vol.23. - P.4547-4549./, а также в качестве прекурсоров композитных материалов, сочетающих свойства органических и неорганических соединений /Jaumier P., Jousscaume В., Riaque H., Toupance Т., Lahcini M. / Functional Organotin Alkynides as precursors of Tin-Based Hybrid Materials. // Mat. Res. Soc. Symp.Proc. - 2000. - Vol.628. - P.CC1.2.1-CC1.2.7./.
Известен способ получения три- и тетраорганилалкинилолова заключающийся во взаимодействии тетрагалогенидов олова или алкилтрихлоролова с алкинилидами щелочных металлов - лития, натрия /Wrackmeyer В., Kehr G. / Tetra-1-alkynyltin compounds and exchange reactions with tin tetrachloride 13C and 119Sn nuclear magnetic resonance study. // Main. Group Met. Chem. - 1993. - Vol.16. - №.5. - Р.305-314/. В соответствии с данным методом исходное ацетиленовое соединение - 1-алкин превращают в металлоорганическое соединение - алкинилид под действием, например, бутиллития при температуре - 78°С. Полученный алкинилид лития вводят в реакцию с галогенпроизводным соединением олова при той же температуре, получая соответствующие соединения три- и тетраорганилалкинил олова.
Также известен способ получения три- и тетраорганилалкинилолова, в котором в качестве исходных веществ используются алкинилиды магния. Получение алкинилидов магния проводят в две стадии, включающие получение реактива Гриньяра и его взаимодействие с 1-алкином. Полученные реактивы Иоцича обрабатывают галогенпроизводным соединением олова, получая при этом соответствующие органилалкинилстаннаны. /Hartman H., Reiss W., Karbstein В. / Uber eineue klasse von phenylathinylverbindungen der elenente Sn, P, As and Sb. // Naturwissenschaften. - 1959. - Vol.46. - P.321/.
Способы получения три- и тетраорганилалкинилолова, основанные на взаимодействии галогенпроизводных соединений олова с алкинилидами металлов получили большое распространение, однако им присущ ряд существенных недостатков. Эти синтезы требуют применения легковоспламеняющихся реагентов, таких как бутиллитий или мелкодисперсный металлический натрий. Также существенным недостатком является многостадийность синтеза.
Известен способ получения три- и тетраорганилалкинилстаннанов, в котором в качестве исходных оловосодержащих соединений используют три- и тетра(диалкиламино)олово. Взаимодействие три- и тетра(диалкиламино)олова с 1-алкинами протекает при комнатной температуре и позволяет получать три- и тетраорганилалкинилстаннаны с выходами до 90% /Lorberht J. / Spaltung der zinn-stickstoffbindung: (phenylalkinyl) stannane. // J.Organomet. Chem. - 1969. - Vol.l6. - P.327-331; Wrackmeyer В., Kehr G., Zhou H. / Synthesis and multinuclear magnetic resonance studies (13C, 15N, 29Si, 119Sn) of alkynyl(dialkylamino)tin compounds. // Main. Group Met. Chem. - 1992. - Vol.15. - №.2. - P.89-99./. Однако применение данного способа на практике затруднено за счет труднодоступности три- и тетра(диалкиламино)олова. Эти вещества в свою очередь получают из соответствующих галогенидов олова взаимодействием их с диалкиламидом лития, получаемым при обработке диалкиламина бутиллитием. Таким образом, синтез исходных соединений сопряжен также с рядом технических трудностей.
Наиболее близким аналогом к предлагаемому является способ получения органооловоацетиленов, основанный на взаимодействии галогенидов ди- и триалкилолова с 1-алкинами в присутствии вторичного амина при 40-50°С /а.с. СССР №825533. МПК (3) C07F 7/22 - 30.04.1981. - Способ получения органооловоацетиленов. - Комаров Н.В., Андреев А.А., Шеин О.Г./ в соответствии с реакцией:
где R, R1, R2 - органические радикалы, X - галоген, n=1 или 2.
Однако данный способ, хорошо применимый для синтеза ацетиленовых оловоорганических соединений, содержащих один или два ацетиленовых фрагмента, не пригоден для получения три- и тетраорганилалкинилолова, так как при взаимодействии тетрагалогенидов олова и органилтригалогенидов олова с аминами образуются прочные комплексные соединения, не способные к взаимодействию с 1-алкинами.
Технической задачей является разработка простого и безопасного способа получения три- и тетраорганилалкинилолова.
Поставленная цель достигается тем, что соответствующий три- или тетрагалогенидолова общей формулы R4-nSnXn, где значение R и n указано ниже; Х - хлор или бром, подвергают взаимодействию с 1-алкинами в присутствии вторичного или третичного амина и хлорида цинка при температуре 20-70°С в среде углеводородов, соотношении реагирующих веществ галогенсодержащее соединение олова:1-алкин:хлорид цинка:амин соответственно 1:4:4,2:8,4 при использовании тетрагалогенидов олова и 1:3:3,1:6,2 при использовании тригалогенидов олова по схеме:
Выход образующихся при этом три- и тетраорганилалкинилстаннанов общей формулы (1) составляет 48-82%. В данную реакцию вступают различные три- и тетрагалогениды олова, например тетрахлоролово, тетрабромолово, бутилтрихлоролово. Реакция протекает в присутствии таких аминов, как диэтиламин и триэтиламин, причем наилучшие выходы целевого продукта получены при использовании диэтиламина.
Три- и тетраорганилалкинилстаннаны представляют собой белые кристаллические соединения, легко гидролизуемые влагой воздуха. Поэтому их синтез проводят в условиях, исключающих воздействие влаги воздуха, с использованием безводных растворителей.
Пример 1. Получение тетрафенилэтинилолова.
В трехгорлую колбу, снабженную мешалкой, обратным холодильником с хлоркальциевой трубкой и капельной воронкой помещают 0,018 моль (2,5 г) безводного хлорида цинка и 0,036 моль (2,7 г) диэтиламина в 15 мл толуола. Реакционную смесь нагревают до перехода всего хлорида цинка в комплексное соединение. Затем реакционную массу охлаждают до температуры 20-30°С, вводят 0,017 моль (1,73 г) фенилацетилена и медленно прикапывают при интенсивном перемешивании раствор 4,2710"3 моль (1,11 г) тетрахлорида олова в 10 мл толуола. Перемешивают 20 минут, после чего отделяют верхний слой, представляющий раствор тетрафенилэтинилолова в толуоле. Его упаривают на роторном испарителе. Целевой продукт выделяется в виде белой кристаллической массы и очищается перекристаллизацией из гептана.
Получают 1,83 г (82%) тетрафенилэтинилолова с Тпл=174°С.
ИК-спектр:2152(С≡С).
ЯМР 1Н: 7.26-7.36, 7.60 (м) 5Н.
ЯМР 13С: 85.5 SnC1≡; 110.8≡C2; 122.4, 128.4, 129.4, 132.4 Ph.
МАСС: 524 [M+] (7), 404 (27), 322 (82), 202 (100), 120 (28), 102 (24).
Лит. Данные: Тпл 174°С.
Пример 2. Тетрафенилэтинилолово.
Получают аналогично примеру 1 из 0,017 моль (1,73 г) фенилацетилена, 4,27·10-3 моль (1,87 г) тетрабромида олова, 0,018 моль (2,5 г) безводного хлорида цинка и 0,036 моль (2,7 г) диэтиламина в 15 мл толуола.
Получают 1,38 г (62%) тетрафенилэтинилолова с Тпл=174°С.
Пример 3. Тетрафенилэтинилолово.
Получают аналогично примеру 1 при температуре 40°С из 0,017 моль (1,73 г) фенилацетилена, 4,27·10-3 моль (1,11 г) тетрахлорида олова, 0,018 моль (2,5 г) безводного хлорида цинка и 0,036 моль (3,6 г) триэтиламина в 15 мл толуола.
Получают 1,40 г (63%) тетрафенилэтинилолова с Тпл=174°С.
Пример 4. Тетра(п-толлилэтинил)олово.
Получают аналогично примеру 1 из 0,017 моль (1,97 г) п-толлилацетилена, 4,27·10-3 моль (1,11 г) тетрахлорида олова, 0,018 моль (2,5 г) безводного хлорида цинка и 0,036 моль (2,7 г) диэтиламина в 15 мл толуола.
Выход 1,73 г (70%) с Тпл 202-203°С.
ИК-спектр: 2150 (С≡С).
ЯМР 1Н: 2.37 (с) 3Н; 7.13, 7.15 (д) 2Н; 7.47, 7.49 (д) 2Н.
ЯМР 13С: 21.7 СН3; 84.8 SnC1≡; 109.9=С2; 119.2, 129.1, 132.4, 139.6 Ar.
МАСС: 579 [М+] (9), 460 (27), 350 (89), 230 (100), 120 (40), 115 (51).
Пример 5. Тетра(п-хлорфенилэтинил)олово.
Получают аналогично примеру 1 из 0,017 моль (1,97 г) п-толлилацетилена, 4,27·10-3 моль (1,11 г) тетрахлорида олова, 0,018 моль (2,5 г) безводного хлорида цинка и 0,036 моль (2,7 г) диэтиламина в 15 мл толуола.
Выход 2,0 г (72%) с Тпл 161°С.
ИК-спектр: 2154(С≡С).
ЯМР 1Н: 7.31, 7.34 (д) 2Н; 7.50, 7.53 (д) 2Н.
ЯМР 13С: 86.0 SnC1≡; 108.8≡C2; 120.4, 128.9, 133.8, 135.7 Ar.
МАСС: 658 [М+] (7), 390 (71), 270 (100), 200 (49), 155 (60), 136 (41), 120(19).
Лит. Данные: Тпл 161°С.
Пример 6. Тетрагексинилолово.
Получают аналогично примеру 1 из 0,017 моль (1,39 г) 1-гексина, 4,27·10-3 моль (1,11 г) тетрахлорида олова, 0,018 моль (2,5 г) безводного хлорида цинка и 0,036 моль (2,7 г) диэтиламина в 20 мл гексана.
Выход 1,26 г (67%).
ИК-спектр: 2165 (С≡С).
ЯМР 1H: 1.99 (т) 2Н; 1.25 (м) 4Н; 0.73 (т) 3Н.
ЯМР 13С: 76.5 SnC1≡; 111.6≡C2; 19.9; 30.7; 22.2; 13.8.
МАСС: 444 [М+] (10), 363 (100), 282 (22), 201 (20), 120 (10).
Пример 7. Тетра(триметилсилилэтинил)олово.
В трехгорлую колбу, снабженную мешалкой, обратным холодильником с хлоркальциевой трубкой и капельной воронкой помещают 0,018 моль (2,5 г) безводного хлорида цинка и 0,036 моль (2,7 г) диэтиламина и 0,017 моль (1,66 г) триметилсилилацетилена в 15 мл бензола. Реакционную смесь нагревают до 70°С и медленно прикапывают при интенсивном перемешивании раствор 4,27·10-3 моль (1,11 г) тетрахлорида олова в 10 мл бензола. Перемешивают при той же температуре 20 минут, охлаждают и проводят выделение по вышеописанной методике.
Получают 1,04 г (48%) тетра(триметилсилилэтинил)олова.
ИК-спектр: 2158(С≡С).
ЯМР 13С: 102.7 SnC1≡; 120.6≡С2; -0.7.
Пример 8. Бутилтри(фенилэтинил)олово.
Получают аналогично примеру 1. Из 6·10-3 моль (1,7 г) бутилтрихлоролова, 0,018 моль (1,83 г) фенилацетилена, 0,019 моль (2,6 г) хлорида цинка и 0,038 моль (2,8 г) диэтиламина получают 1,4 г бутилтри(фенилэтинил)олова с Тпл 70°С. Выход 61%.
ИК-спектр: 2146 (С≡С).
ЯМР 1Н: 1.8 (т) 3Н; 2.2 (т) 2Н; 2.9-3.1 (м) 4Н; 7.20-7.31; 7.56 (м) 15Н.
ЯМР 13С: 20.2 CH2-Sn; 25.9 СН3; 34.7, 35.3 CH2; 84.7 SnC1≡; 110.59≡C2; 121.8,127.8,128.6,132.2 Ph.
МАСС: 480 [М+] (8) 322 (63), 202 (100), 177 (31), 120 (38), 102 (21), 57 (28).
Лит. Данные: Тпл 70°С.
Предлагаемый способ получения три- и тетраорганилалкинилидов олова основан на использовании легкодоступного промышленного сырья - три- и тетрагалогенидов олова и терминальных ацетиленов. Способ более прост, поскольку исключает ряд промежуточных стадий получения исходных веществ и промежуточных соединений, не требует сложной аппаратуры и легко осуществим на практике. Кроме того, он обеспечивает высокие выходы конечных продуктов, не требует применения огне- и взрывоопасных реагентов, таких как бутиллитий, мелкодисперсный металлический натрий, алкинилидов металлов.
Способ получения три- и тетраорганилалкинилидов олова общей формулы
R4-nSn(C≡CR1)n,
где R - низший алкил; R1 - фенил, п-хлорфенил, п-толил, гексинил, триметилсилилэтинил; n=3 или 4,
взаимодействием галогенсодержащего соединения олова с 1-алкинами в присутствии алифатического амина, отличающийся тем, что взаимодействие галогенида олова с 1-алкином проводят в присутствии вторичного или третичного алифатического амина и хлорида цинка при температуре 20-70°С в среде углеводородного растворителя, при мольном соотношении реагирующих веществ тетрагалогенид олова:1-алкин:хлорид цинка:амин = 1:4:4,2:8,4 или при мольном соотношении реагирующих веществ алкилтрихлоролово:1-алкин:хлорид цинка:амин = 1:3:3,1:6,2.