Среда для определения гемолитической активности культур рода listeria
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано при бактериологической диагностике листериоза в исследовательских целях для характеристики штаммов по их биологической активности. Среда состоит из двух слоев - подложечного агара и покрывного агара. Подложечный агар содержит агар «Дифко» и физиологический раствор. Покрывной агар содержит агар «Дифко», дрожжевой экстракт, дитиотрейтол, дефибринированную кровь кролика, натрий хлористый, а в качестве питательной основы - мясопептонный бульон или бульон Хоттингера. Изобретение позволяет исследовать уровень экспрессии листериолизина, проводить массовый скрининг и дифференциацию популяций штаммов листерий по признаку гемолитической активности. 2 ил., 3 табл.
Реферат
Изобретение относится к ветеринарной и медицинской микробиологии и может быть использовано при бактериологической диагностике листериоза, исследовательских целях, характеристике штаммов по их биологической активности.
В бактериологии широко используются методы определения гемолитической активности микроорганизмов, у которых данный признак связывается с проявлением патогенных свойств, например, таких как: возбудители кокковых инфекций, листериоза, клостридиозов, гемофилезов, колибактериозов, йерсинеозов, микобактериозов и др.
Внутри рода Listeria выделяют три вида (L.monocytogenes, L.ivanovii и L.seeligeri), вызывающих лизис эритроцитов человека и животных (лошади, крупного рогатого скота, овец, кроликов) по бета-типу (И.А.Бакулов «Листериоз сельскохозяйственных животных», Москва-1967, с.26-27). Гемолизин листерий экспрессируется при культивировании, как на жидких, так и на твердых питательных средах, причем скорость и уровень его продукции зависят от состава среды, температуры инкубации и фазы роста. Качественную оценку гемолитической активности листерий принято определять на классическом кровяном агаре, состоящем из 1,5% мясопептонного агара с добавлением 5% дефибринированной крови барана. При этом исследуемую суточную бульонную культуру микроорганизма высевают на поверхность кровяного агара. Посевы инкубируют при (36±1)°С в течение 24...48 ч, после чего производят учет результатов визуально по наличию узкой прозрачной зоны лизиса эритроцитов вокруг колоний или просветлению среды под колониями, свидетельствующему о гемолизе, который лучше виден при удалении последних с поверхности агара (Листериоз, Методические указания, №11, М. 2001).
Недостатком этой среды является ее низкая чувствительность. Значительная плотность агара и высокая концентрация эритроцитов при низкой продукции листериолизина затрудняют диффузию экзотоксинов в толщу агара и, соответственно, выявление признака гемолитической активности (Detection of Listeriolysin, the Thiol-Dependent Hemolysin in Listeria monocytogenes, Listeria ivanovii, and Listeria seeligeri M. Leimeister-Wachter and T. Chakraborty Vol.57, No.8 // Infect, and Immun., Aug. 1989, p.2350-2357). При этом учет и оценка признака несколько субъективны. Кроме того, лизис эритроцитов под колонией может вызываться продуктами метаболизма микробных клеток, т.е. быть неспецифичным.
Для повышения чувствительности выявления гемолитической активности у листерий в микробиологической практике была предложена тест-система, основанная на феномене синергизма с Rhodococcus eqvi и Staphylococcus aureus - САМР-тест (ГОСТ Р 51921-2002 «Продукты пищевые. Методы выявления бактерий Listeria monocytogenes»). Суть САМР-теста заключается в следующем: двухсуточные культуры гемолитических штаммов Rhodococcus eqvi и Staphylococcus aureus высевают на кровяной агар двумя параллельными вертикальными линиями на расстоянии 4...5 см друг от друга. Между вертикальными линиями культур R.eqvi и S.aureus засевают параллельными горизонтальными линиями исследуемые культуры листерий на расстоянии друг от друга не менее 1 см и отступающими от вертикальных линий на 0,5 см. Посевы инкубируют при (36±1)°С в течение 24 ч. Оценку и учет результатов ведут по наличию гемолиза (просветление среды) в зоне роста испытуемых штаммов/изолятов листерий, соседствующих с вертикальными штрихами культур R.eqvi и S.aureus.
Поскольку при постановке САМР-теста используется классический кровяной агар, ему присущи те же недостатки, что и описанному выше. Кроме того, возникает необходимость поддержания в лабораторных условиях культур R.eqvi и S.aureus, обладающих синергическим эффектом в отношении гемолитических штаммов листерий, причем эти штаммы должны быть коллекционными и не подвергаться многократному пассированию in vitro, а в литературе описаны штаммы L.monocytogenes, резистентные к феномену синергизма (Cytolysins and the CAMP (synergistic hemolysis) phenomenon in Listeria. J.A.Vazquez-Boland, C.Delgado, J.F.Femandez-Garayzabal, R.I.Tascon, M.Blanco, M.B.Lopez, G.Suarez and L.Dominguez The Eleventh International Symposium on Problems of Listeriosis, 1992. - P.11-12).
Наиболее близким по существу к предлагаемому изобретению является однослойный кровяной агар с добавлением 5% дефибринированной крови барана, в котором в качестве основы используют либо колумбийский (23,0 г/л пептона, 1,0 г/л крахмала кукурузного, 5,0 г/л хлорида натрия, 15,0 г/л агар-агара), либо триптон-соевый агар (15 г/л триптиказы, 5 г/л папаинового гидролизата соевой муки, 5,0 г/л хлорида натрия, 15,0 г/л агар-агара) как наиболее эффективные основы для тестирования гемолитической активности гемпозитивных микроорганизмов (Листериоз, Методические указания №11, М. 2001)
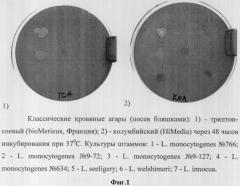
Определение гемолитической активности листерий проводят следующим образом. Компоненты колумбийского или триптон-соевого агара ресуспендируют в необходимом количестве дистиллированной воды. Суспензию расплавляют в водяной бане, стерилизуют автоклавированием при 121°С в течение 15 мин и после охлаждения до 45°С в нее вносят 5% об./об. дефибринированной крови барана. Приготовленный таким образом кровяной агар разливают по 15...20 мл в чашки Петри. После полного застывания агарового слоя на его поверхность высевают исследуемые суточные бульонные культуры листерий. Посевы инкубируют при (36±1)°С в течение 24...48 ч, после чего производят визуальный учет результатов по наличию узкой прозрачной зоны лизиса эритроцитов вокруг колоний или просветлению среды под колониями. Как видно из фиг.1 на триптон-соевом и колумбийском агарах зоны гемолиза (просветление среды под колониями) выявляются лишь у 1-3 и 1-2 из пяти гемолитически активных (1-5) штаммов листерий соответственно (Табл.1).
Использование в качестве основы колумбийского или триптон-соевого агара обеспечивает быстрый и обильный рост прихотливых по питательным потребностям микроорганизмов и на этих агарах более четко проявляются гемолитические реакции. Кроме того, кукурузный крахмал служит источником энергии и одновременно нейтрализует токсические метаболиты.
Вместе с тем на кровяном агаре, приготовленном выше описанным способом, лишь у штаммов гиперпродуцентов гемолизинов вокруг колоний формируется узкая зона лизиса эритроцитов. У большей же части гемолитически активных штаммов листерий лизис эритроцитов проявляется в виде просветления среды под колонией, что делает учет признака несколько субъективным. Недостаток обусловлен значительной плотностью агара, затрудняющей диффузию гемолизина, а также тем, что количество молекул гемолизина, продуцируемых клетками листерий, при концентрации эритроцитов 5% недостаточно для их полного лизиса в зоне гемолиза.
Целью изобретения является разработка среды для определения гемолитической активности культур рода Listeria, обладающей высокой эффективностью выявления данного признака, за счет создания лучших условий синтеза и проявления функциональной активности тиолзависимого листериолизина, а также за счет применения наиболее чувствительных к его действию эритроцитов кролика. Среда позволяет исследовать уровень экспрессии листериолизина, проводить массовый скрининг и дифференциацию популяций штаммов/изолятов листерий по признаку гемолитической активности.
Питательная среда для определения гемолитической активности культур рода Listeria, отличающаяся тем, что она состоит из двух слоев - подложечного агара и покрывного агара, при этом подложечный агар содержит агар «Дифко» и физиологический раствор, покрывной агар - агар «Дифко», дрожжевой экстракт, дитиотрейтол, дефибринированную кровь кролика, натрий хлористый, а в качестве питательной основы - мясопептонный бульон или бульон Хоттингера, при следующем содержании в них компонентов, мас.%:
| - подложечный агар | |
| агар «Дифко» - | 1,0-1,5 |
| физиологический раствор - | остальное |
| - покрывной агар | |
| агар «Дифко» - | 0,6-0,8 |
| дрожжевой экстракт - | 0,9-1,1 |
| дитиотрейтол - | 0,03 |
| дефибринированная кровь кролика - | 3,0-3,5 |
| натрий хлористый - | 0,35 |
| мясопептонный бульон, | |
| бульон Хоттингера - | остальное |
По отношению к прототипу заявляемая среда имеет следующие отличительные признаки.
Принципиальным отличием является то, что на предлагаемой среде рост культуры микроорганизма происходит на поверхности тонкого слоя покрывного агара, представляющего собой питательную среду, дополнительно содержащую дрожжевой экстракт (ДЭ) в качестве стимулятора роста клеток листерий и дитиотрейтол (ДТТ) как индуктор синтеза и функциональной активности тиолзависимого листериолизина. Снижение содержания агара в покрывном слое до 0,6...0,8% способствует лучшей диффузии гемолизинов в толщу агара с эритроцитами, а применение более чувствительных эритроцитов кролика в концентрации 3,0...3,5% - выявлению их деструктивной активности. Применение в качестве подложки более плотного (1,0...1,5%) прозрачного агара «Дифко» замедляет диффузию листериолизина непосредственно под колонию и облегчает регистрацию наличия гемолиза за счет отсутствия демаскирующего эффекта. В связи с этим вокруг колоний гемолитически активных культур листерий формируется прозрачная зона с лизированными эритроцитами (фиг.2), которая, в отличие от прототипа, хорошо поддается объективному учету и регистрации. Как видно из фиг.2, зона лизиса эритроцитов наблюдается не только под колониями гемолитически активных штаммов, но вокруг них (культуры №№1-5). Причем зона лизиса эритроцитов регистрируется даже у культуры вида Listeria seeligeri (№5), которая обладает самой низкой гемолитической активностью (Табл.1).
| Таблица 1 | ||||
| Сравнительная эффективность выявления признака гемолитической активности у листерий | ||||
| № п/п | Наименование штамма | Регистрация гемолиза | ||
| Колумбийский агар | Триптон-соевый агар | Предлагаемая среда | ||
| 1 | L.monocytogenes 634 | - | - | + |
| 2 | L.monocytogenes 766 | + | + | + |
| 3 | L.monocytogenes 9-72 | + | + | + |
| 4 | L.monocytogenes 9-127 | - | + | + |
| 5 | L.ivanovii | + | + | + |
| 6 | L.seeligeri 100/100 | - | - | + |
| 7 | L.murrayi | - | - | - |
| 8 | L.welshimeri | - | - | - |
| 9 | L.inocua | - | - | - |
Использование двуслойного кровяного агара позволяет проводить наблюдения в динамике, выявляя степень ферментативной активности в любой из периодов развития колоний, обладает высокой чувствительностью и наглядностью.
Возможность практического использования изобретения подтверждается примерами конкретного выполнения.
Пример 1
Для определения наличия гемолитической активности различных видов листерий получают их 18...24 ч бульонные культуры.
Кровь у кролика берут стандартным методом - пункцией из сердца с соблюдением правил асептики в сосуд с бусами для получения дефибринированной крови.
Приготовление покрывного агара производят следующим образом: к 50 мл мясопептонного бульона с рН 7,2...7,4 (МПБ - питательная основа) добавляют навеску 0,6 г (0,6 мас.%) агара «Дифко», 0,9 г (0,9 мас.%) ДЭ и 0,35 г (0,35 мас.%) натрия хлористого для получения конечной концентрации соли в смеси 0,85% (с учетом ее содержания в МПБ) и объем смеси доводят мясопептонным бульоном до 100 мл (98,15 мас.%). Смесь расплавляют в водяной бане и стерилизуют автоклавированием при 121°С в течение 15 мин.
Готовят двухслойный кровяной агар: расплавляют 1%-ный агар «Дифко», приготовленный на физиологическом растворе, охлаждают до 55...60°С и разливают в стерильные чашки Петри по 15 мл. К 96 мл (96 мас.%) покрывного агара, предварительно расплавленного и охлажденного до 45°С, добавляют 3,0 мл (3,0 мас.%) дефибринированной крови кролика, 1 мл (1,0 мас.%) 3% стерильного раствора ДТТ, перемешивают и затем наносят по 5 мл на застывший слой подложечного агара.
| Таблица 2 | |||
| Выявление признака гемолитической активности у листерий | |||
| № п/п | Наименование штамма | Регистрация гемолиза | |
| Среда на основе МПБ | Среда на основе БХ | ||
| 1 | L.monocytogenes 634 | + | + |
| 2 | L.monocytogenes 766 | + | + |
| 3 | L.monocytogenes 9-72 | + | + |
| 4 | L.monocytogenes 9-127 | + | + |
| 5 | L.ivanovii | + | + |
| 6 | L.seeligeri 100/100 | + | + |
| 7 | L.murrayi | - | - |
| 8 | L.welshimeri | - | - |
| 9 | L.inocua | - | - |
На поверхность двухслойного кровяного агара бляшками наносят суточные бульонные культуры листерий (L.monocytogenes, L.ivanovii, L.seeligeri, L.murrayi, L.welshimeri, L.inocua). Посевы инкубируют при температуре 36 (±1)°С. Учет результатов производят визуально через 24, 36 и 48 ч. Вокруг изолированных бляшек L.monocytogenes, L.ivanovii и L.seeligeri формируются четко ограниченные совершенно прозрачные зоны гемолиза вследствие полного разрушения эритроцитов (фиг.2, табл.2). Вокруг изолированных бляшек L.murrayi, L.welshimeri, L.inocua зоны гемолиза отсутствуют.
Пример 2
Для определения наличия гемолитической активности различных видов листерий получают их суточные агаровые культуры и готовят двухслойные агаровые пластины. Первым слоем в чашку Петри наливают по 20 мл стерильно расплавленного 1,5%-ного агара «Дифко», приготовленного на физиологическом растворе. Готовят покрывной агар: смешивают 100 мл бульона Хоттингера с рН 7,2...7,4 (БХ), 0,8 г (0,8 мас.%) агара «Дифко», 1,1 г (1,1 мас.%) ДЭ, 0,35 г (0,35 мас.%) NaCl для получения конечной концентрации соли в смеси 0,85% (с учетом ее содержания в БХ) стерилизуют автоклавированием при 121°С в течение 15 мин. После его охлаждения до 45°С стерильно смешивают 95,5 мл (95,5 мас.%) покрывного агара, 3,5 мл (3,5 мас.%) дефибринированной крови кролика и 1 мл (1,0 мас.%) 3% стерильного раствора ДТТ. По 5 мл покрывного кровяного агара наслаивают на подложечный агар.
На поверхность приготовленного двухслойного кровяного агара уколом наносят суточные агаровые культуры листерий (L.monocytogenes, L.ivanovii, L.seeligeri, L.murrayi, L.welshimeri, L.inocua). Посевы инкубируют при температуре 36(±1)°С. Учет результатов производят визуально через 24, 36 и 48 ч. Вокруг изолированных колоний L.monocytogenes, L.ivanovii и L.seeligeri формируются четко ограниченные совершенно прозрачные зоны гемолиза вследствие полного разрушения эритроцитов (табл.2). Вокруг изолированных бляшек L.murrayi, L.welshimeri, L.inocua зоны гемолиза отсутствуют.
Пример 3
Для определения уровня продукции листериолизина различными штаммами/изолятами L.monocytogenes материал суточных бульонных культур штаммов 766, 634, 9-72, 9-127 наносят бляшками на поверхность двухслойного кровяного агара, приготовленного как описано выше (примеры 1 и 2).
Посевы инкубируют при температуре 36(±1)°С. Учет результатов производят визуально через 36 ч путем измерения радиуса колонии и ширины зоны гемолиза (четко ограниченная совершенно прозрачная зона вследствие полного разрушения эритроцитов) от края колонии до границы зоны гемолиза. Об уровне гемолитической активности судят по соотношению радиуса колонии (rк) и ширины зоны гемолиза:
| rк< ширины зоны гемолиза | - высокий |
| rк= или превышает ширину зоны гемолиза менее чем в | |
| 1,5 раза | - средний |
| rк> ширины зоны гемолиза в 1,5 и более раза | - низкий |
Результаты определения гемолитической активности представлены в таблицах 1 и 2.
| Таблица 3 | ||||
| Результаты определения уровня гемолитической активности штаммов L.monocytogenes | ||||
| № п/п | Наименование штамма | Радиус колоний, мм | Ширина зоны гемолиза, мм | Уровень гемолитической активности |
| 1 | L.monocytogenes 634 | 3,0 | 1,0 | низкий |
| 2 | L.monocytogenes 766 | 4,0 | 1,5 | низкий |
| 3 | L.monocytogenes 9-72 | 4,0 | 4,0 | средний |
| 4 | L.monocytogenes 9-127 | 3,5 | 4,0 | высокий |
Питательная среда для определения гемолитической активности культур рода Listeria, отличающаяся тем, что она состоит из двух слоев - подложечного агара и покрывного агара, при этом подложечный агар содержит агар «Дифко» и физиологический раствор, покрывной агар - агар «Дифко», дрожжевой экстракт, дитиотрейтол, дефибринированную кровь кролика, натрий хлористый, а в качестве питательной основы мясо-пептонный бульон или бульон Хоттингера при следующем содержании компонентов в каждом слое, мас.%:
Подложечный агар:
| агар «Дифко» | 1,0-1,5 |
| физический раствор | до 100 |
Покрывной агар:
| агар «Дифко» | 0,6-0,8 |
| дрожжевой экстракт | 0,9-1,1 |
| дитиотрейтол | 0,03 |
| дефибринированная кровь кролика | 3,0-3,5 |
| натрий хлористый | 0,35 |
| мясопептонный бульон | |
| или бульон Хоттингера | до 100 |