Способ воздействия на организм путем адресной доставки биологически активных веществ в митохондрии, фармацевтическая композиция для его осуществления и соединение, применяемое для этой цели
Иллюстрации
Показать всеИзобретение относится к области биологии и медицины. Предлагается соединение общей формулы (I):
где А - эффекторная группа, L - линкерное звено, В - представляет собой Скулачев-ион Sk или заряженный гидрофобный пептид. Соединение может быть использовано для приготовления фармацевтической композиции для адресной (направленной) доставки биологически активных веществ в митохондрии, осуществляемой за счет электрохимического потенциала ионов водорода в митохондрии. Изобретение также может быть полезным при лечении заболеваний и состояний, связанных с нарушением нормального функционирования митоходрий, в частности заболеваний, связанных с повышенным образованием свободных радикалов и активных форм кислорода. Заявленное изобретение, благодаря направленному накоплению биологически активного вещества в митохондриях, позволяет увеличить эффективность последнего, снизить общую дозировку, вероятность и силу побочных эффектов: 6 н. и 20 з.п. ф-лы, 14 ил.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к области биологии и медицины, и в частности может быть использовано в медицине для приготовления фармацевтической композиции для адресной (направленной) доставки биологически активных веществ в митохондрии, осуществляемой за счет электрохимического потенциала ионов водорода в митохондрии. Кроме того, изобретение относится к способу воздействия на организм, который предусматривает указанную доставку требуемых биологически активных веществ в митохондрии.
Уровень техники
Митохондрии живой клетки играют ключевую роль в ряде важнейших внутриклеточных процессов, таких как энергетический обмен в клетке (самая главная функция митохондрии - обеспечение клетки энергией), метаболизм определенных веществ (например, жирных кислот) и др. Также митохондрии участвуют в образовании и утилизации свободных радикалов и активных форм кислорода (СР и АФК) - крайне реакционно способных веществ, способных влиять на множество процессов в клетке. Наконец, в последнее десятилетие была доказана ключевая роль митохондрии в процессе запрограммированной клеточной смерти.
Известно большое количество заболеваний, связанных с нарушением нормального функционирования митохондрий. К ним относят все заболевания, связанные с повышенным образованием СР и АФК, одиночной или массовой гибелью клеток в составе ткани или органа, нарушением программы клеточного самоубийства - апоптоза, нарушением в обмене жирных кислот и так далее.
Полагают, что, воздействуя на митохондрии, можно влиять на самые разные аспекты жизнедеятельности клетки и всего организма.
В рамках этого изобретения предлагается новая технология воздействия на митохондрии живой клетки при помощи направленной, адресной доставки и накопления в этих органеллах различных биологически активных веществ.
Преимущества такого подхода очевидны - направленное накопление вещества позволяет увеличить эффективность его применения, снизить общую дозировку (так как эффективная концентрация достигается за счет многократного накопления вещества в определенном компартменте клетки), снизить вероятность и силу побочных эффектов.
Само устройство митохондрий предоставляет уникальную возможность для такой адресации - функционирующие митохондрии активно выкачивают из себя в цитоплазму ионы водорода и, таким образом, создают на своей внутренней мембране мощнейший электрохимический потенциал ионов водорода - протонный потенциал.
Исследования в области биоэнергетики позволили к настоящему времени создать большое количество веществ, способных проникать сквозь мембраны и накапливаться в митохондриях за счет энергии протонного электрохимического потенциала - такие вещества получили название "ионов Скулачева" (Green DE, "The electromechanochemical model for energy coupling in mitochondria", 1974, Biochem. Biophys. Acta., 346:27-78). Эти ионы, как правило, не обладают ярко выраженной биологической активностью. Настоящее изобретение заключается в использовании ионов Скулачева в составе нового соединения, содержащего, помимо самого иона, другое желательное вещество для адресной доставки в митохондрии этого другого вещества, которое в контексте данного изобретения названо эффектором.
К настоящему моменту известно крайне ограниченное количество биологически активных соединений, адресно доставляемых в митохондрии за счет энергии электрохимического потенциала ионов водорода. К таким веществам можно отнести, например, антиоксиданты, описанные в US 6331532 и ЕР 1047701 (вещества митохинол (MitoQ), митовитамин Е (MitoVitE) и ЕР 1534720 (миметики супероксиддисмутазы или глутатионпероксидазы, соединенные с трифенилфосфонием). Некоторые из этих веществ и их активность описаны в работах, упомянутых ниже.
Вещества, содержащие миметики супероксиддисмутазы или глутатионпероксидазы заявлены в ЕР 1534720 как митохондриально адресованные антиоксиданты для лечения и профилактики болезней, связанных с окислительным стрессом и т.п. В экспериментальных примерах описания изобретения ЕР 1534720 приведены данные об их способности проникать в митохондрии и их антиоксидантном действии в растворе и при взаимодействии с изолированными митохондриями. Никаких данных о действии этих веществ на клетки или на организм в целом не приведено. В то же время есть данные о высокой реакционной способности указанных миметиков по отношению к сульфгидрильным группам белков. Такая реакционная способность должна вызывать резкое снижение эффективности митохондриально адресованных антиоксидантов, содержащих миметики супероксиддисмутазы или глутатионпероксидазы (эбселен), что, в свою очередь, ставит под сомнение их применимость. Это подтверждается данными, приведенными в статье Filipovska A, Kelso GF, Brown SE, Beer SM, Smith RA, Murphy MP. J. Biol. Chem. 2005, 280(25):24113-26. В этой работе было показано, что эбселен, соединенный с остатком, адресно доставляющим его в митохондрии (все соединение названо митоэбселен) обладает той же эффективностью, что и обычный эбселен. Другими словами, адресация соединений типа митоэбселена, если и повышает их антиоксидантное действие, то такое преимущество нивелируется нежелательной побочной активностью митоэбселена.
MitoVitE также представляет собой митохондриально адресованный антиоксидант, содержащий трифенилфосфоний в качестве адресующей группы и остаток витамина Е в качестве антиоксиданта. В описании изобретения ЕР 1047701 приведены данные об антиоксидантном действии этого вещества в гомогенате мозга крысы, способности MitoVitE вещества проникать в изолированные митохондрии и в клетки в культуре; также показано, что в концентрации до 10 мкМ MitoVitE не влияет на жизнеспособность клеток в культуре, а дальнейшее повышение концентрации MitoVitE приводит к снижению выживаемости клеток. Однако никакого антиоксидантного действия MitoVitE на отдельные клетки, а также на ткани, органы или целый организм показано не было. Действие MitoVitE на клетки в культуре описано в статье Jauslin ML, Meier Т, Smith RA, Murphy MP, FASEB J. 2003 17(13):1972-4. Из данной работы следует, что действие MitoVitE по предотвращению запрограммированной гибели клеток не исчезает на фоне разобщителя FCCP (3-флюорометил-карбонилцианид фенилгидразон), то есть в условиях, когда направленное накопление MitoVitE в митохондриях невозможно. Эти данные свидетельствуют о том, что митохондриальная адресация MitoVitE если и имеет место, то не играет решающей роли в биологической активности этого соединения.
Митохондриально адресованный антиоксидант MitoQ и его варианты (MitoQ5, MitoQ3) представляют собой убихинон (убихинол в восстановленной форме), соединенный с трифенилфосфонием через С-10 линкерную группу (С-5, С-3 соответственно). В описании изобретения US 6331532 MitoQ заявлен как действующее вещество композиций, предназначенных для лечения и профилактики заболеваний, связанных с окислительным стрессом. В экспериментах, приведенных в описании изобретения, показаны антиоксидантные свойства MitoQ в растворе, способность этого вещества проникать в изолированные митохондрии, влияние на эффективность дыхания изолированных митохондрии. Однако не приводится никаких данных о действии MitoQ на отдельные клетки, ткани, органы, о наличии или отсутствии токсичности.
Дополнительные данные по активности MitoQ приведены в WO 2005019233 той же группы изобретателей, где показана эффективность MitoQ для предотвращения перекисного окисления липидов на изолированных митохондриях, а также в работе (Adlam VJ, Harrison JC, Porteous CM, James AM, Smith RA, Murphy MP, Sammut IA, 2005, FASEB J. 19:1088-95). В этой статье приведен единственный пример действия MitoQ на организм в эксперименте по скармливанию этого вещества крысам, с последующим изучением свойств их сердца на системе Лагендорфа (изолированного перфузионного сердца). Приведенные данные косвенно подтверждают заявление, что MitoQ можно использовать для профилактики или лечения ишемического повреждения миокарда. Однако в описываемой работе есть целый ряд неточностей и неопределенных мест, которые не позволяют убедительно доказать такое заявление. Так, используемая авторами работы 30-минутная нормотермическая ишемия с последующей реперфузией - это часто применяемая модель ишемического повреждения миокарда. Однако ее существенным недостатком является электрическая нестабильность сердца во время реперфузии. Известно, что часть сердец не восстанавливает свою активность вовсе из-за периодической или постоянной фибрилляции, и практически в каждом опыте такой серии возникает периодическая аритмия. В цитируемой статье нет указаний ни об аритмии, ни о фибрилляции. Поэтому остается неясным, характеризуют ли полученные авторами средние величины целую группу образцов или только те опыты, в которых аритмия была менее выраженной. Кроме того, по приведенным выше причинам, количество животных в каждой серии (6) явно недостаточно для данной модели.
Отчасти предположение о некорректности полученных авторами данных подтверждается довольно странным наблюдением значительного прироста сократительной функции как в контрольной, так и в опытных сериях в условиях реперфузии, которая неизбежно должна была бы сопровождаться гибелью кардиомиоцитов. Такой результат возможен, если при расчете сократительной функции использовали только те сердца, которые продолжали работать, исключая "выключившиеся", вошедшие, однако, в подсчет скорости перфузии. Такой способ очевидно некорректен. Хотя средние данные на любом сроке реперфузии в группе, обработанной MitoQ выше, чем в группах, обработанных контрольными препаратами, эти группы между собой не сопоставлены и достоверны ли различия между ними, неясно. Таким образом, основной вывод авторов о том, что только MitoQ является кардиопротекторным соединением, выглядит не вполне убедительным. Такое мнение подкрепляется отсутствием в группах, обработанных контрольными веществами, результатов исследования ультраструктуры, выхода лактатдегидрогеназы, цитохрома С, каспазы 3, комплекса 1 и аконитазной активности в митохондриях.
В общем, детальное изучение данной работы показывает наличие весьма слабых мест на этапе отбора и анализа результатов. Вероятно, авторский коллектив не имеет большого опыта работы на данной модели. Таким образом, можно утверждать, что кардиопротекторное действие MitoQ остается недоказанным.
Кроме того, следует отметить, что при наличии весьма обнадеживающих результатов по действию MitoQ на культуры клеток, есть несколько наблюдений, ставящих под сомнение возможность практического применения этого соединения. В опытах на культурах клеток было показано, что свое аитиоксидантное и противоапоптозное действие MitoQ оказывает при его концентрации в среде около 1 мкМ. На данный момент считается доказанным, что в этих условиях концентрация MitoQ в митохондриях может достигать 1 мМ. В то же время в работе Smith RA, Porteous CM, Gane AM, Murphy MP, Proc Natl Acad Sci USA, 2003, 100(9):5407-12 было показано, что при скармливании MitoQ лабораторным животным его накопление в тканях мозга и в сердечной мышце - местах, наиболее уязвимых для окислительного стресса - происходит до максимальной концентрации 100 пмоль на грамм живого веса. Расчеты показывают, что при такой концентрации MitoQ в ткани, даже максимально насыщенной митохондриями (сердечной мышце), концентрация MitoQ внутри митохондрий не превышает 100 нмоль. То есть более чем в 1000 раз меньше, чем концентрация, при которой достигались эффекты, продемонстрированные на культуре клеток. При этом увеличить дозировку, назначаемую лабораторным животным, хотя бы в 10 раз не позволяет токсичность препарата.
Таким образом, существующий уровень техники раскрывает только один тип митохондриально адресованных соединений - вещества, заявляемые как митохондриально адресованные антиоксиданты. Никаких других митохондриально адресованных биологически активных соединений к настоящему моменту неизвестно. Следует отметить, что и раскрытые вещества, заявляемые как митохондриально адресованные антиоксиданты, не решают поставленной задачи, поскольку их биологическая активность описана крайне слабо и перспективы практического применения для заявленных целей неопределенны. Кроме того, для большинства из раскрытых соединений уже доказана их неэффективность.
Сущность изобретения
В основе изобретения лежит принцип концентрации биологически активных веществ в митохондриях живой клетки за счет использования энергии электрохимического потенциала ионов водорода и ионов Скулачева. Такой подход неожиданно позволил многократно снизить дозировку используемых биологически активных веществ, направленно эффективно воздействовать на митохондрии, которые являются ключевым элементом в важнейших внутриклеточных процессах, что предоставляет возможность многократно снизить вероятность и силу нежелательных побочных эффектов.
Таким образом, одним из аспектов настоящего изобретения является способ воздействия на организм при помощи биологически активных веществ, адресно доставляемых в митохондрии за счет энергии электрохимического потенциала ионов водорода.
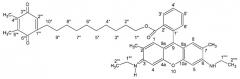
Другим аспектом изобретения является композиция для адресной доставки биологически активного вещества в митохондрии клетки, включающая в себя соединение, состоящее из адресующей части, обеспечивающей доставку всего соединения в митохондрии, линкерной группы и эффектора - вещества, обладающего требуемой биологической активностью. В целом такое соединение может быть представлено общей формулой:
где А - эффекторная группа, представляющая собой:
а) антиоксидант (II)
и/или его восстановленная форма,
где m - целое число 1-3; Y - одинаковые или разные заместители, представляющие собой низший алкил или низший алкокси; или два вицинальных Y связаны между собой таким образом, что образуют структуру:
и/или его восстановленную форму,
где R1 и R2 одинаковые или разные заместители, независимо друг от друга представляющие собой низший алкил или низший алкокси;
б) прооксидант,
в) индуктор апоптоза,
г) ингибитор антиапоптозных белков митохондриальной локализации,
д) фотосенсибилизатор.
В этом аспекте изобретения в соединении композиции:
антиоксидант представляет собой соединение, способное взаимодействовать с СР и АФК, нейтрализуя их опасные свойства. Предпочтительно, чтобы при этом в своей радикальной форме это соединение могло взаимодействовать с дыхательной цепью митохондрий и таким образом восстанавливать свои антиоксидантные свойства для следующего взаимодействия с СР и/или АФК. Предпочтительным антиоксидантом, отвечающем структуре II является 2,3-диметил-1,4-бензохинол (остаток пластохинона - сильнейшего антиоксиданта из тилакоидов протопластов, то есть одного из самых насыщенных СР и АФК мест в живой природе);
прооксидант представляет собой соединение, способное образовывать и/или стимулировать образование свободных радикалов и/или активных форм кислорода при попадании в клетку: паракват, менадион, органические гидропериксные соединения;
индуктор апоптоза представляет собой соединение, которое будучи доставленным в митохондрии тем или иным образом активирует запрограммированную гибель клетки (апоптоз), предпочтительным индуктором апоптоза в составе соединения (I) является фениларсеноксид, известный как наиболее успешный в настоящее время - индуктор образования поры;
ингибитор антиапоптозных белков митохондриальной локализации представляет собой соединение, способное взаимодействовать с одним или более антиапоптозных белков, находящимися в митохондрии (в том числе встроенными в митохондриальную мембрану) и подавлять активность этих белков. Предпочтительным ингибитором антиапоптозных белков митохондриальной локализации является АВТ737. Полагают, что они особенно полезны для использования в комбинации с химиотерапийным агентом для облегчения индукции апоптоза;
фотосенсибилизатор представляет собой соединение, способное образовывать синглетный кислород или другие АФК или СР при облучении светом, предпочтительными фотосенисибилизаторами являются фталоцианин, содержащий или не содержащий металлический заместитель и его комплексы: порфирин и его производные, в частности, BDP-Mac или BDP-MaD; фоскан (mTHPC).
L - линкерное звено, представляющее собой:
а) простую или разветвленную углеводородную цепь, не обязательно замещенную одним или более заместителем и которая при необходимости содержит одну или более двойную или тройную связь;
б) природную изопреноидную цепь;
n - целое число 1-20;
В - адресующая группа, представляющая собой:
а) Скулачев-ион Sk:
Sk+Z-,
где Sk - липофильный катион, Z - фармакологически приемлемый анион;
б) заряженный гидрофобный пептид из 1-20 аминокислот;
за исключением соединений, в которых А представляет собой убихинон (то есть 2-метил-4,5-диметокси-3,6-диоксо-1,4-циклогексадиенил) или токоферол или миметик супероксиддисмутазы или эбселен, при том что L - дивалентный децил или дивалентный пентил или дивалентный пропил, а В - трифенилфосфоний;
а также его сольваты, изомеры или пролекарственные формы и фармакологически приемлемый носитель.
Следующим аспектом изобретения является терапевтический или профилактический (предотвращающий) агент - соединение, отвечающее структуре (I), - полезный при заболеваниях, для устранения, предупреждения или облегчения которых эффективным является снижение количества свободных радикалов и/или активных форм кислорода в отдельных клетках, тканях, участках, органах, во всем организме, с помощью митохондриально адресованных антиоксидантов. В связи с этим аспектом изобретения предлагается:
применение митохондриально адресованных антиоксидантов, отвечающих структуре (I) для увеличения продолжительности жизни человека или другого животного;
применение терапевтического или профилактического агента, полезного при заболевании, связанном со старением организма и усилением окислительного стресса;
в частности применение митохондриально адресованных антиоксидантов для борьбы с заболеваниями глаз, связанными с окислительным стрессом и/или массовой гибелью клеток сетчатки или других типов клеток, вовлеченных в процессы, обеспечивающие зрение; для борьбы с катарактой, макулодистрофией сетчатки;
применение митохондриально адресованных антиоксидантов, отвечающих структуре (I), для лечения или профилактики заболеваний, связанных с массовой запрограммированной смертью клеток в тканях и органах и и/или связанных с распространением в пораженной ткани сигналов, инициирующих запрограммированную гибель клеток;
применение митохондриально адресованных антиоксидантов, отвечающих структуре (I) для профилактики и/или лечения сердечно-сосудистых заболеваний, для которых показана ключевая роль запрограммированной гибели клетки, апоптоза или некроза; для профилактики и/или лечения инфаркта, инсульта; для предотвращения вредных последствий реоксигенации;
применение митохондриально адресованных антиоксидантов, отвечающих структуре (I), во время хирургических операций для защиты здоровых тканей от повреждения;
применение митохондриально адресованных антиоксидантов, отвечающих структуре (I), в трансплантологии для борьбы с отторжением тканей и для сохранения трансплантационного материала;
применение митохондриально адресованных антиоксидантов, отвечающих структуре (I), в косметологии для преодоления последствий ожогов, улучшения заживания ран и хирургических швов;
применение митохондриально адресованных антиоксидантов в качестве противовоспалительного средства.
Кроме того, аспектом изобретения является терапевтический или профилактический (предотвращающий) агент, отвечающий структуре (I), для онкологических заболеваний. В связи с этим аспектом изобретения предлагается:
применение митохондриально адресованных антираковых препаратов для борьбы с метастазированием, ангиогенезом, в том числе для направленного запуска запрограммированной клеточной смерти в раковых клетках;
применение качестве митохондриально адресованных антираковых препаратов митохондриально адресованных прооксидантов отвечающих структуре (I), предпочтительно митохондриально адресованный паракват, митохондриально адресованный менадион, или митохондриально адресованные антиоксиданты, неспособные восстанавливаться дыхательной цепью митохондрий и таким образом проявляющие прооксидантные свойства (например, дезмитоксимито Q);
применение в качестве митохондриально адресованных антираковых препаратов митохондриально адресованных индукторов апоптоза, отвечающих структуре (I). Такой подход предпочтителен по сравнению с использованием традиционных индукторов апоптоза, поскольку митохондрии предоставляют большое количество возможностей для запуска запрограммированной клеточной смерти. Одним из предпочтительных способов такого запуска является сшивание сульфгидрильных групп белков, располагающихся в мембране митохондрий через эффекторную группу митохондриально адресованного индуктора апоптоза. Предпочтительной эффекторной группой такого соединения является фениларсеноксид;
применение в качестве митохондриально адресованных антираковых препаратов, отвечающих структуре (I), митохондриально адресованных ингибиторов антиапоптозных белков митохондриальной локализации. Предпочтительными белками, активность которых должны подавлять такие препараты, являются bc1-2 и родственные белки. Одним из предпочтительных ингибиторов является АВТ737.
Также аспектом изобретения является использование в качестве митохондриально адресованного антиракового препарата композиции, включающей в себя отвечающие структуре (I) митохондриально адресованные ингибиторы антиапоптозных белков митохондриальной локализации и обычные препараты, индуцирующие запрограммированную гибель раковых клеток.
Также аспектом изобретения является использование в качестве митохондриально адресованного антиракового препарата композиции, включающей в себя отвечающие структуре (I) митохондриально адресованные антиоксиданты и обычные препараты, индуцирующие запрограммированную гибель раковых клеток. В этом аспекте изобретения предпочтительным является использование антиоксидантов, соединенных с липофильными катионами, поскольку в раковых клетках наблюдается повышенная, по сравнению со здоровыми клетками, активность ферментов, способных откачивать липофильные катионы из этих клеток (ферменты системы множественной лекарственной устойчивости). Таким образом, митохондриально адресованный антиоксидант будет преимущественно накапливаться в здоровых клетках, что приведет к их преимущественному выживанию в условиях антираковой терапии, что в свою очередь снизит силу нежелательных последствий такой терапии;
применение митохондриально адресованных антиоксидантов для увеличения эффективности химиотерапии и радиотерапии рака;
применение в качестве митохондриально адресованного антиракового препарата митохондриально адресованного фотосенсибилизатора;
применение в фотодинамической терапии рака митохондриально адресованного фотосенсибилизатора, позволяющего уничтожать раковые клетки за счет митохондриальной индукции апоптоза. Такой подход имеет ряд существенных преимуществ перед традиционными методами фотодинамической терапии, поскольку а) позволяет уничтожать раковые клетки с помощью запрограммированной клеточной смерти, а не некротизации (приводящей к целому ряду нежелательных последствий), б) позволяет существенно снизить концентрацию применяемого фотосенсибилизатора, что снижает вероятность возникновения и силу побочных эффектов;
применение митохондриально адресованного антиоксиданта SkQ1 в качестве предпочтительного антиракового агента.
Еще одним аспектом изобретения является применение митохондриально адресованного антиоксиданта, содержащего в качестве адресной группы остаток структуры (III), для лечения заболеваний, связанных с обменом веществ; диабета.
Также аспектом изобретения является метод обеззараживания ткани, крови, другой субстанции, содержащей клетки и клеточные элементы, при помощи свободных радикалов. В рамках этого метода нужные клетки и клеточные элементы защищены от окислительного стресса при помощи митохондриально адресованного антиоксиданта, а болезнетворные агенты уничтожаются свободными радикалами.
Другим аспектом изобретения является применение митохондриально адресованных антиоксидантов в биотехнологии для увеличения жизнеспособности клеток животных или человека в культуре для исследовательских или технологических нужд. Этот аспект изобретения основывается на факте, что в большом количестве случаев концентрация кислорода в культуральной среде при выращивании клеток в культуре существенно превышает концентрацию кислорода в ткани, что резко увеличивает вероятность окислительного стресса у клеток, что, в свою очередь, ведет к повышенной вероятности апоптоза или некроза, снижает жизнеспособность таких клеток. Обработка клеток митохондриально адресованным антиоксидантом резко снижает остроту окислительного стресса. Также обработка митохондриально адресованным антиоксидантом значительно увеличивает биомассу клеток, что приводит к их большей продуктивности. В связи с этим аспектом предлагается:
применение митохондриально адресованных антиоксидантов для увеличения продуктивности животных (в том числе человеческих), растительных или грибковых клеток в культуре, при использовании для продукции фармакологических препаратов; белков; антител;
применение митохондриально адресованных антиоксидантов для увеличения продуктивности целых растений, при использовании для продукции фармакологических репаратов: белков, антител;
применение митохондриально адресованных антиоксидантов для увеличения продуктивности клеток дрожжей и других грибов родов Saccharomyces, Pichia, Hansenula, Endomyces, Yarrowia в культуре, при использовании для продукции фармакологических препаратов: белков, антител;
применение митохондриально адресованных антиоксидантов для увеличения жизнеспособности растительных протопластов в культуре, при использовании для продукции фармакологических препаратов: белков, антител; при использовании для получения генетически модифицированных растений;
применение митохондриально адресованных антиоксидантов при получении генетически модифицированных растений для увеличения жизнеспособности регенерирующих растений, клеток в каллусах;
применение митохондриально адресованных прооксидантов для борьбы с болезнетворными микроорганизмами - грибами, простейшими, бактериями;
применение митохондриально адресованных индукторов апоптоза для борьбы с болезнетворными микроорганизмами - грибами, простейшими, бактериями;
Следующим аспектом изобретения является метод синтеза митохондриально адресованных антиоксидантов, использующих липофильный катион в качестве адресной группы.
Краткое описание фигур
На фиг.1 показано проникновение SkQ1 через искусственную мембрану.
На фиг.2 продемонстрировано; спонтанное окисление производных хинолов MitoQ и SkQ1.
На фиг.3 показано увеличение скорости окисления производных хинолов "MitoQ" и "SkQ1" при введении в систему супероксидного радикала. А - скорость окисления восстановленных форм кислородом воздуха и супероксидным радикалом; Б - скорость окисления восстановленных форм только супероксидным радикалом.
На фиг.4 представлено восстановление "MitoQ" и "SkQ1" дыхательной цепью митохондрий печени крысы (0,2 мг/мл белка), энергизованных сукцинатом (5 мМ) в присутствии 2 μM ротенона.
На фиг.5 описывается окисление хинолов "MitoQ" и "SkQ1" дыхательной цепью митохондрий печени крысы. "MitoQ" и "SkQ" за счет дыхательной цепи митохондрий, энергизованных сукцинатом (5 мМ) в присутствии 2 μМ ротенона. После полного восстановления производных хинола дыхательную цепь блокировали 25 мМ малонатом и измеряли скорость реокисления "MitoQ" и "SkQ"
На фиг.6 показано цитотоксическое действие SkQ1 и mitoQ на клетки линии Hela. % живых клеток пропорционален ОП492 МТТ-формазана.
На фиг.7 показано влияние SkQ и других препаратов на заболеваемость крыс OXYS макулодистрофией. По оси ординат - % глаз с дегеративными изменениями макулярной области сетчатки.
На фиг.8 приведен процент глаз с изменениями макулы 2-й степени. Прием SkQ1 не только снизил заболеваемость макулодистрофией, но и существенно снизил выраженность изменения сетчатки. По оси ординат - % глаз со 2-й стадией заболевания.
На фиг.9 описываются дегенеративные изменения в макулярной области сетчатки OXYS до приема препаратов и после 45-дневного курса KBr, SkQ1 или витамина Е.
На фиг.10 описано влияние SkQ1 и других препаратов на заболеваемость крыс OXYS катарактой. По оси ординат - % глаз с изменениями хрусталиков.
На фиг.11 приведен процент глаз с изменениями хрусталиков 2-й степени. Прием SkQ1 не только снизил заболеваемость, но и существенно снизил выраженность тяжести течения катаракты. По оси ординат - % глас с изменениями, соответствующими 2-й стадии заболевания.
На фиг.12 показано состояние хрусталиков крыс OXYS перед началом приема препаратов и после 45-дневного курса KBr, SkQ1 и витамина Е.
На фиг.13 описано влияние трех концентраций SkQ1 на выживаемость мышей с привитой асцитной карциномой Эрлиха.
На фиг.14 показано действие ингибитора синтеха белка, циклогексимида Д (ЦгД) и антиоксидантов на клетки Yarrowia lipolytica, обработанные 5 мМ перекисью водорода. Выживаемость оценивали по количеству образовавшихся колоний на твердой среде. На твердую среду клетки переносили через 3 часа инкубации.
Осуществление изобретения
Ниже приведены ряд экспериментальных примеров, чтобы проиллюстрировать возможность осуществления изобретения, в частности действие веществ, отвечающих структуре (I), в соответствии с изобретением. Эти примеры призваны лишь подтвердить обоснованность притязаний и не должны восприниматься как ограничивающие область его использования или применения.
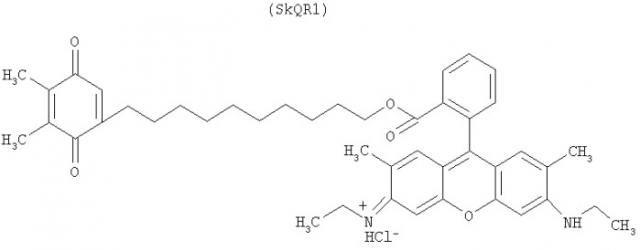
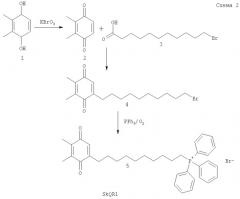
Экспериментальный пример I: синтез веществ структуры (I) - 2,3-диметил-1,4-бензохинон-5-децилового эфира родамина G.
Было синтезировано соединение SkQR1, отвечающее структуре (I) и содержащее в качестве адресующей группы остаток родамина G, а в качестве антиоксидантной эффекторной группы - остаток пластохинона, выбранного поскольку он является природным антиоксидантом, присутствующим в наиболее насыщенном СР и АФК месте в живой природе - тилакоидах хлоропластов растений.
В работе использовали следующие реагенты и растворители: 2,3-Диметил-гидрохинон, 11-бромундекановая кислота, родамин G, N,N'-дициклогексилкарбодиимид, бромноватистокислый калий, азотнокислое серебро, персульфат аммония, карбонат цезия фирм Fluka, Aldrich, Sigma, Merck; Silicagel 60 (0,063-0,2 мм) фирмы Merck и растворители отечественного производства: диметилформамид, дихлорметан, хлороформ, метанол, изопропанол, этилацетат, бензол, ацетонитрил и другие. Очистку и абсолютирование растворителей проводили по стандартным методикам
В работе использовали метод тонкослойной хроматографии (ТСХ) на пластинах Kieselgel 60 F254 (Merck). Соединения, содержащие группы, поглощающие в УФ-области, обнаруживали с помощью хемископа Брумберга. Соединения, содержащие хиноновое кольцо, обнаруживали в парах аммиака. Соединения, содержащие родамин, обнаруживали визуально.
Ультафиолетовые спектры поглощения регистрировали на спектрофотометре "Cary 50 Bio" фирмы "Varian".
Высокоэффективная жидкостная хроматография (ВЭЖХ) выполнялась на приборе Adjilent 1100 в градиенте ацетонитрила в 10 мМ Н3PO4.
Масс-спектрометрометрические анализы проводили методом TOF MALDI MS на масс-спектрометрах Ultraflex и Autoflex фирмы Bruker Daltonik (Германия), оснащенных лазером 337 нм и методом ESI MS.
ИК-спектры регистрировали в пленке на приборе Specord 40.
ПМР и С13-ЯМР были зарегистрированы при температуре 303К на приборе Brucker Avance-400.
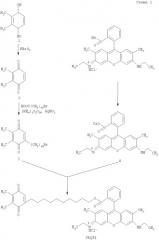
Синтез SkQR1 представлен на схеме (Схема 1)
Синтез 2,3-диметил-1,4-бензохинона (2)
В раствор 0.34 г (2 ммоль) бромноватистокислого калия в 6 мл воды и 0.3 мл 5Н серной кислоты при перемешивании и нагревании при 60°С прибавили 0.83 г (6 ммоль) 2,3-диметилгидрохинона. Затем температуру реакции подняли до 80°С. После завершения реакции реакционную смесь охладили до комнатной температуры и экстрагировали эфиром. Эфирный экстракт промыли водой и сушили безводным хлористым кальцием. Осушитель отфильтровали, фильтрат упарили в вакууме. Вес остатка 0.74 г (90%). Вещество растворили в 20 мл эфира и пропустили через слой силикагеля (30×30 мм), дополнительно промыли силикагель эфиром несколько раз. Эфир упарили и получили 0.67 г хроматографически чистого (99.37% по ВЭЖХ) 2,3-диметил-1,4-бензохинона.
ТСХ: Rf 0.46 (хлороформ); ВЭЖХ: τ=17.6 мин (0-90% В за 26.4 мин; А: 10 мМ Н3PO4; В: ацетонитрил); Т.пл. 60°С; УФ-спектр (метанол): λmax 209 нм, 256 нм, 344 нм.
Синтез 2,3-диметил- 5-(10'-бромдецил)-1,4-бензохинона (3)
136 мг (1 ммоль) 2,3-Диметил-1,4-бензохинона (2) растворили в 10 мл смеси ацетонитрила и воды (1:1) и прибавили 292 мг (1.1 ммоль) 11-бромундекановой кислоты и 170 мг (1 ммоль) азотнокислого серебра. Смесь нагрели до 60-70°С и в раствор по каплям добавили раствор 228 мг (1 ммоль) персульфата аммония в 10 мл воды. Нагревание продолжали еще 1 час, реакционную смесь охладили и экстрагировали эфиром. Эфирный раствор промыли разбавленным раствором бикарбоната натрия, сушили сернокислым магнием и упаривали. Остаток очищали флаш-хроматографией на колонке с силикагелем. Выход соединения 3 в виде темно-красного масла 70%.
ТСХ: Rf 0.62 (хлороформ); ВЭЖХ: τ=23 мин (79-90% В за 26.4 мин; А: 10 мМ Н3PO4; В: ацетонитрил); УФ-спектр (метанол): λmax 207 нм, 258 нм, 344 нм; MALDI-TOF MS: вычислено для C18H27O2Br: 355.3; найдено m/z 356.1 (МН+; 100%); ИК: 2928, 2336, 1600, 1496, 1304 см-1.
Синтез цезиевой соли родамина G (4)
200 мг (0.48 ммоль) Родамина G растворяли в 6 мл метанола, добавляли 1 мл 2 М водного раствора карбоната цезия. Продукт выделяли фильтрованием, промывали эфиром, сушили в вакууме при 60°С. Выход соединения 4 в виде темно-фиолетового кристаллического вещества 210 мг (80%).
Т.пл. >250°С (разл.).
Синтез 10-(2',3'-диметил-1',4'-бензохинон-5'-деканоил)родамина G
190 мг Соединения 4 суспендировали в 5 мл ДМФА, добавили 200 мг (0.56 ммоль) соединения 3. Смесь нагревали до 50°С и перемешивали 48 часов при этой температуре, после чего растворитель удаляли в вакууме. Выделение продукта проводили методом колоночной хроматографии на силикагеле в системе хлороформ-метанол (4:1). Фракцию, содержащую основной продукт, упаривали, к остатку добавляли 150 мкл 5Н раствора хлористого водорода в диоксане, снова упаривали, полученное масло кристаллизовали под бензолом. Выход: 160 мг (65%).
ТСХ: Rf 0.68 (хлороформ-метанол, 4:1); Rf 0,80 (хлороформ-метанол-вода, 65:25:4);
ВЭЖХ: τ=23.9 мин. (0-90% В за 26.4 мин; А: 10 мМ Н3PO4; В: ацетонитрил);
Т.пл. 178-180°С (разл.);
УФ (этанол): λmax 250, 350, 535 нм, ε535=80000;
Элементный анализ: вычислено для С44Н53ClN2O5: С, 72.86; Н, 7.36; С1, 4.89; N, 3.86; найдено: С, 72.53; Н, 7.21; Cl, 4.22; N, 3.61;
ES MS: вычислено для C44H51N2O5 688,89; найдено m/z 689,4 (MH+; 100%);
ИК (пленка): 3200, 2928, 2336, 1700, 1685, 1600, 1496, 1304 см-1;
1Н-ЯМР (400 МГц; DMSO-d6; нумерация атомов указана на структуре, приведенной ниже): 0,95-1,25 м.д. (неразр.м., 14Н, 2'', 3'', 4'', 5'', 6'', 7'', 8'' -(СН2)7); 1,24 м.д. (т., 6Н, J=6,8 Гц, 2'''', 2''''' -(СН3)2); 1,41 м.д. (квинт., 2Н, J=7,5 Гц); 1,92 и 1,94 м.д. (каждый сигнал - с., 3Н, 4''', 5''' -(СН3)2); 2,09 м.д. (с., 6Н, 2,7 -(СН3)2); 3,48 м.д. (квинт., 4Н, - 1'''', 1'''' -(СН2)2); 3,85 м.д. (т., 2Н, J=6,3 Гц, 1'' -СН2); 6,57 м.д. (с., 1Н, Н3 ,); 6,80 и 6,91 м.д. (каждый сигнал - с., 3Н, H1, Н5 и Н4, Н8); 7,44 м.д. (дд., 1Н; J1=7,8, J2=1 Гц; Н6 ,,,); 7,74 м.д. (т., 2Н, J=5,8 Гц; 3,6 -NH); 8,60-8,70 м.д. (м. 2Н, Н4 ,,, и Н5 ,,,); 8,22 м.д. (дд, 1Н, J1=8,2; J2=1,1 Гц, Н3 ,,,).
13С-ЯМР (400 МГц; DMSO-d6): 11,59 и 11,98 м