Фармацевтическая композиция для лечения и профилактики пролиферативных заболеваний молочной железы
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к средствам для лечения и профилактики пролиферативных заболеваний молочной железы. Предложена фармацевтическая композиция для лечения и профилактики пролиферативных заболеваний молочной железы в виде твердой лекарственной формы, состоящая из ядра, содержащего тамоксифен, дииндолилметан в качестве действующих веществ, связующее, по крайней мере, один антиоксидант, разрыхлитель, смазывающее, наполнитель, стабилизатор, выбранный из группы: поливинилпирролидон, кроскармелоза, альгинат натрия, глицерофосфат кальция или их смеси, и кишечнорастворимой оболочки. Композиция позволяет получить эффективное средство без побочных эффектов. 3 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится к области медицины, а именно к средствам для лечения и профилактики пролиферативных заболеваний молочной железы.
Мастопатия - это фиброзно-кистозная болезнь, характеризующаяся нарушением соотношения эпителиального и соединительно-тканного элементов молочной железы. Причиной этого заболевания могут быть различные факторы, основными из которых являются: наследственность, сопутствующие гинекологические заболевания, нарушения в эндокринной системе, неблагоприятные факторы репродуктивного возраста (поздние роды, раннее и позднее менархе и др.). Молочные железы, в силу физиологических особенностей, находятся в состоянии постоянной смены процессов пролиферации и инволюции, связанной с фазами менструального цикла и соответствующим им различным уровнем половых гормонов. На молочные железы оказывают влияние концентрации в организме эстрогенов и прогестерона, вырабатываемых яичниками и корой надпочечников, а также гонадотропных гормонов передней доли гипофиза - фолликулостимулирующего гормона и пролактина. В период беременности большое влияние оказывают гормоны, вырабатываемые плацентой. Поэтому нарушение нормального функционирования гипоталамо-гипофизарной системы на любом ее уровне может явиться причиной нарушения гормонального равновесия. Под влиянием гормональных сдвигов нарушаются физиологические преобразования в тканях молочных желез и развиваются очаги патологической пролиферации эпителия. Хроническое нарушение физиологии молочных желез могут привести к развитию мастопатии, а в ряде случаев, и к раку молочной железы.
Таким образом, целый ряд причин, нарушающих гормональное равновесие, в конечном итоге воздействует на физиологические преобразования в тканях молочных желез, где развиваются очаги патологической пролиферации эпителия. Различные формы мастопатии (а их около 50) встречаются, по данным исследователей, примерно у 60% женщин старше 35 лет. Это широко распространенное заболевание. При первичном осмотре врача оно выявляется у 30-40% женщин. Если же провести более подробное обследование молочной железы с применением УЗИ, маммографии, рентгенорадиографии и гистологическими исследованиями, то чуть ли не у 80% пациенток обнаруживаются различные рода патологии.
Нельзя сказать, что мастопатия является предраковым заболеванием, однако, необходимо заметить, что некоторые формы мастопатии могут способствовать развитию рака. Это происходит, когда при мастопатии имеет место пролиферация эпителия, выстилающего протоки желез. В этом случае риск развития рака груди возрастает в 1,6 раза. При наличии атипичных изменений в эпителии риск развития рака груди возрастает в 5,3 раза.
Рак молочной железы в настоящее время встречается в 3-5 раз чаще на фоне доброкачественных заболеваний молочной железы и в 30-40 раз чаще при некоторых формах узловой мастопатии. По статистике, 40% женщин детородного возраста страдают мастопатией. Эта цифра возрастает до 60% в группе женщин, имеющих какую-либо гинекологическую патологию. Заболеваемость раком молочной железы увеличивается в среднем, примерно, на 1% в год. В структуре смертности он стоит на втором месте, при этом "темп прироста" по показателям смертности остается самым высоким - 28%. По данным экспертов ВОЗ, начиная с 2000 года в мире выявляется и будет ежегодно выявляться от 800 тыс. до 1 млн больных раком молочной железы. По оценкам ряда исследователей, в следующем десятилетии 5 млн женщин во всем мире будет страдать от этого заболевания.
Все вышеизложенное свидетельствует о том, что современная медицина не располагает достаточно эффективными средствами в борьбе с этим опасным заболеванием
Молекулярные механизмы развития опухолей молочной железы
Клетки молочной железы подвергаются непрерывному воздействию различных факторов, стимулирующих их пролиферацию. Как уже отмечалось, существует несколько альтернативных путей, через которые клетки получают сигналы, стимулирующие ее к активному делению. В первую очередь, следует подчеркнуть роль эстрогенов. Опухоли молочной железы традиционно подразделяются на эстроген-зависимые и эстроген-независимые. Как развиваются события в случае эстроген-зависимой пролиферации? Эстроген (Е) попадает в клетку и активирует эстрогеновый рецептор (ER), который находится в цитоплазме клетки в неактивном состоянии. Взаимодействие гормона с рецептором активирует последний и способствует его проникновению в ядро. Попав в ядро, этот комплекс стимулирует экспрессию так называемых эстроген-зависимых генов. К ним, прежде всего, относятся рецептор к эпидермальному фактору роста (EGF-R), фактор роста кератиноцитов (KGF), циклин-зависимая киназа (CDK), фактор роста эндотелия сосудов (VEGF), инсулино-подобный фактор роста (IGF) и множество других белков. Все эти белки повышают чувствительность клеток молочной железы к факторам, индуцирующим гиперпластические процессы. В случае, если в организме женщины имеется повышенное содержание одного из производных эстрогенов, а именно 16α-гидроксистерона, эти процессы многократно усиливаются (Марк Клемонс «Эстрогены и риск развития рака молочной железы», N. Engl. Med., 2001, vol 344, N 4). Именно поэтому повышенное содержание 16α-гидроксистерона рассматривается в настоящее время как фактор риска развития рака молочной железы.
Однако, как уже упоминалось, существуют эстроген-независимые варианты развития опухолей. Какие же механизмы «работают» в этом случае?
Цитокиновый путь регуляции связан с фактором некроза опухоли (TNF-α). В больших концентрациях этот цитокин активирует проапоптотические (рецептор-опосредованные) сигнальные каскады, то есть останавливает процессы клеточного деления и вызывает физиологическую гибель клеток. Однако в малых дозах действует как фактор выживания и пролиферации. При этом стимулируется активность циклооксигеназы-2 (СОХ-2) - основного фермента, участвующего в биосинтезе простагландинов (PGE2). Последние являются активаторами ядерного фактора NF-kB, который включает экспрессию генов эпидермального фактора роста (EGF-R), фактора роста кератиноцитов (KGF), циклин-зависимой киназы (CDK), фактора роста эндотелия сосудов (VEGF), инсулино-подобного фактора роста (IGF). Все эти белки, как уже упоминалось, стимулируют клеточное деление.
Наконец, третий путь, через который происходит активация клеточного деления в молочных железах, - это сигнальные каскады, стимулируемые ростовыми факторами. Для опухолей молочной железы это, чаще всего, эпидермальный фактор роста (EGF), который также способен активировать ядерный фактор NF-kB и через него стимулировать клеточное деление.
Таким образом, в настоящее время мы достаточно хорошо представляем патогенетические механизмы развития опухолей молочной железы. Очевидно, что, блокируя основные каналы поступления сигналов, стимулирующих пролиферацию, мы можем рассчитывать на успех в профилактике и лечении этой патологии. То есть фармакологическая коррекция должна осуществляться на всех этапах и по отношению ко всем сигнальным каскадам, которые выполняют ключевые патофизиологические функции. Мало вероятно, что в природе существует соединение, способное блокировать все сигнальные пути, стимулирующие опухолевую трансформацию клеток молочной железы. Поэтому единственный путь оптимизации медикаментозного лечения - это разработка комбинированных лекарственных препаратов, состоящих из фармакологически активных соединений, обладающих различными механизмами действия в отношении клеток опухолей молочной железы. Поиск таких комбинаций и явился основной задачей данного исследования.
Лечение мастопатии
Вся современная медикаментозная тактика лечения мастопатии и рака груди строится на использовании антиэстрогеновых препаратов. В настоящее время в медицинской практике наиболее широко используются для лечения мастопатии и пролиферативных заболеваний молочной железы повторяющиеся курсы терапии Тамоксифеном. Основной механизм действия Тамоксифена заключается в его способности связываться с эстрогеновыми рецепторами и таким образом блокировать один из путей стимуляции клеточного деления, который реализуется в организме через эстрадиол и его производные. За 30-летнию историю применения Тамоксифен продлил жизнь многим женщинам (Powles Т.J. Efficacy of tamoxifen as treatment of breast cancer. Semin. Oncol., 24 (Suppl. I): S1-48-S1-54, 1997., Forbes J.F. The control of breast cancer: the role oftamoxifen. Semin. Oncol., 24 (Suppl.1): S1-5-S1-19, 1997).
Получены убедительные данные в клинических исследованиях по профилактике рака груди у женщин, относящихся к группам риска (Smigel К. Breast Cancer Prevention Trial shows major benefit, some risk. J. Natl. Cancer Inst. (Bethesda), 90: 647-648, 1998). Однако данный метод эффективен для весьма ограниченного круга больных и может стать причиной серьезных заболеваний. Тамоксифен эффективен исключительно в отношении эстроген-положительных опухолей. Только 60% опухолей являются эстроген-положительными и лишь половина из них поддается терапии Тамоксифеном. (Legha S.S. Tamoxifen in the treatment of breast cancer. Ann. Intern. Med., 109: 219-228, 1988). После 12-18 месяцев терапии Тамоксифеном у большинства пациентов развивается устойчивость к этому препарату (Wiebe V.J., Osbome С.К., Fuqua S.A., DeGregorio М.W. Tamoxifen resistance in breast cancer. Crit. Rev. Oncol. HematoL, 14: 173-188, 1993. Lykkesfeldt A.E. Mechanisms of tamoxifen resistance in the treatment of advanced breast cancer. Acta Oncol 35 (Suppl.5): 9-14, 1996). Более того, установлено, что Тамоксифен способен стимулировать рост опухолей молочной железы после длительного применения препарата (Gottardis М. М., Jordan V.С. Development of tamoxifen-stimulated growth of MCF-7 tumors in athymic mice after long-term antiestrogen administration. Cancer Res., 48: 5183-5187, 1988). Дело в том, что Тамоксифен существует в виде двух изомеров: трансформа, обладающая выраженной антиэстрогенной активностью, и цис-форма, являющаяся слабым эстрогеном. Так вот было установлено, что при длительном назначении Тамоксифена опухолевая ткань приобретает способность превращать трансизомеры в цис-изомеры. Этот процесс не только нейтрализует все лечебные свойства Тамоксифена, но и превращает его в стимулятор роста опухоли (WO 9203973, 1992, Onset of antiestrogen resistence in breast cancer). Для того чтобы избежать развития устойчивости, рекомендуется использовать низкие дозы препарата и назначать его прерывистыми курсами. Среди побочных эффектов Тамоксифена отмечена его способность индуцировать рост опухолей эстроген-зависимых тканей, и результатом его длительного применения может являться индукция рака эндометрия (Peters-Engl С, Frank W, Danmayr Е, et al. Association between endometrial cancer and tamoxifen treatment of breast cancer, Breast Cancer Res Treat., 1999, Vol.54, N.3, P.255-260).
Несмотря на некоторые отрицательные свойства Тамоксифена он остается основным лекарственным средством для лечения гормон-зависимых пролиферативных заболеваний молочных желез. Прямым показанием для назначения Тамоксифена являются гормон-положительные опухоли молочной железы. Однако определение эстрогеновых рецепторов доступно далеко не всем медицинским учреждениям, поэтому часто препарат назначается без лабораторных исследований. Как мы упоминали ранее, примерно 70% женщин принимает Тамоксифен без всякой надежды на успех. В случае развития устойчивости к Тамоксифену или отсутствии эстрогеновых рецепторов в ткани развивающейся опухоли современная медицина не имеет никакой альтернативы за исключением хирургического удаления органа. Кроме того, Тамоксифен вызывает мутации в генах-супрессорах опухолевого роста, снижая, таким образом, естественные механизмы противоопухолевой защиты клеток. Наконец, Тамоксифен индуцирует гиперплатические процессы в эндометрии, что является одним из основных осложнений при длительном приеме препарата.
Предпринимаются многочисленные попытки оптимизировать лечение рака груди с помощью Тамоксифена. Совершенствование методов лечения осуществляется по двум направлениям. Во-первых, предупреждение или прогнозирование развития феномена устойчивости опухолей к Тамоксифену. В частности, разработаны лабораторные методики, позволяющие мониторировать развитие резистентности к Тамоксифену, основанные на измерении соотношения транс- и цис-изомеров Тамоксифена в опухолевой ткани (US 5384260,1995, Detection of Onset ofantiestrogen resistence in breast cancer). Во-вторых, синтезируются новые производные Тамоксифена, которые, по мнению авторов, вызывают меньше побочных эффектов (Patent WO 2004087123, 2004, Prevention and treatment of breast cancer with 4-hydroxy tamoxifen).
Описаны также попытки комбинации тамоксифена с изофлавоноидами с целью снижения риска развития рака эндометрия на фоне длительного приема Тамоксифена (МХРА 00005292, 2002, Composition and method of prevention or treatment of breast cancer). Однако все эти подходы решают лишь часть проблем, связанных с эффективным лечением рака груди.
Устранить большинство недостатков терапии Тамоксифеном, а именно - развитие резистентности к препарату, возникновение побочных эффектов, а также обеспечить возможность эффективного лечения гормон-независимых опухолей можно путем комбинации Тамоксифена с индол-3-карбинолом.
Индол-3-карбинол - это фитонутриент, содержащийся в овощах семейства крестоцветных, в разных видах капусты. Противоопухолевая защита, оказываемая игдол-3-карбинолом, основана на широком спектре его активностей. В частности, один из механизмов противоопухолевой защиты - это его взаимодействие с AhR, что блокирует связывание последнего с канцерогенами. То есть индол-3-карбинол - природный лиганд для AhR. При активации Ah-рецептора в результате взаимодействия с индол-3-карбинол образованный комплекс проникает в ядро и способствует транскрипции CYP1A1 -изоформы цитохрома Р450, которая способна гидроксилировать эстрон во 2-м положении с образованием 2-гидроксиэстрона (2-ОНЕ1). Данный метаболит обладает антипролиферативной (антиэстрогенной) активностью (Huang CS, Chem HD, Chang KJ, et al. Breast cancer risk associated with genotype polymorphism of the estrogen-metabolizing genes CYP17, CYP1A1, and COMT: a multigenic study on cancer susceptibility. Cancer Res, 1999, Vol.59, N.19, p.4870-4875). В отсутствии индол-3-карбинола рецептор Ah активируется ариловыми углеводородами, поступающими в организм из окружающей среды или с продуктами питания (особенно с консервированной пищей), что способствует экспрессии CYPB1, гидроксилирующего Е1 в 4-м и 16α-положении. (Swaneck GE, Fishman J. Covalent binding of the endogenous estrogen 16 alphahydroxyestrone to estradiol receptor in human breast cancer cells: characterization and intranuclear localization. Proc Nati Acad Sci USA.1988, 85:7831-7835).
Образованные метаболиты (4-ОНЕ1 и 16α-ОНЕ1, соответственно) являются сильнейшими канцерогенами для клеток-мишеней. Маркером эффективности действия индол-3-карбинол является соотношение 2-ОНЕ1/16α-ОНЕ1.
К настоящему времени описано единственное фармакологически активное соединение, способное через активацию цитохромов смещать равновесие метаболитов эстрогенов в сторону 2-гидроксиэстрона (2-ОНЕ1) и, соответственно, снижать содержание 16α-гидроксиэстрона - это индол-3-карбинол.
В связи с этим для разработки обоснованных схем лечения и профилактики пролиферативных заболеваний молочных желез необходимо проводить лабораторное исследование на метаболиты эстрадиола.
Индол-3-карбинола - это сильнейший антиэстроген, отличный от Тамоксифена, так как действует не как прямой конкурент за связывание с эстрогеновыми рецепторами, а индуцирует образование 2-гидроксиэстрона (2-ОНЕ1), который обладает антиэстрогенными функциями, антиоксидант, лиганд к AhR-рецептору, а также блокатор СОХ-2, то есть фактор, обладающий мощным антипролиферативным свойством. Простое перечисление его функций показывает, что его активности распространяются на различные клеточные структуры, и подобное комплексное воздействие на сигнальные пролиферативные пути является уникальным свойством индол-3-карбинола и существенно дополняет противоопухолевые свойства Тамоксифена. Однако спектр активности индол-3-карбинола не ограничивается перечисленными свойствами. Препарат обладает удивительной способностью избирательно индуцировать в опухолевых клетках эпителиального происхождения процессы программируемой клеточной гибели - апоптоз (Rahman KM, Aranha О, Glazyrin A et al., Translocation of Bax to mitochondria induces apoptotic cell death in indole-3-carbinol (I3C) treated breast cancer cells, Oncogene, 2000, Vol.19, №50, 5764-5771).
Транслокация Bax из цитоплазмы в митохондрию является критическим событием при развитии апоптоза. Индол-3-карбинол стимулирует этот процесс, что сопровождается снижением митохондриального потенциала, выходом цитохрома с, активацией про-апоптотических каспаз (-3 и -9), наступлением апоптоза. Кроме того, индол-3-карбинол стимулирует образование супрессоров опухолевого роста, а именно - р21 и р27. Все эти эффекты, в сочетании с высокой избирательной активностью, характеризуют индол-3-карбинол с позиций мощного про-апоптотического фактора в отношении всех видов опухолей (Rahman KM, Aranha О, Sarkar FH. Indole-3-carbinol (I3C) induces apoptosis in tumorigenic but not in nontumorigenic breast epithelial cells. Nutr Cancer. 2003; 45(1):101-12).
Как уже отмечалось, тамоксифен, обладая антиэстрогенной активностью, вызывает рост опухолей, развитие которых зависит от эстрогена (эстрадиола) и/или его метаболитов. Ответ на вопрос, что является причиной этого, был найден после того, как были изучены особенности сигнал-проводящих путей в тех тканях, стимулятором роста которых является эстрадиол. Существует 2 вида рецепторов к эстрогену, ERa и ERb. Эстроген-зависимые ткани экспрессируют эти рецепторы в различных комбинациях. Взаимодействие эстрадиола с ERa и/или ERb вызывает димеризацию субъединиц с последующими конформационными изменениями в димере рецептора, обладающим различной способностью к стимуляции эстрадиол-индуцируемого пролиферативного сигнала. Показано, что активация ERa-субъединицы рецептора приводит к стимуляции пролиферации клетки-мишени, тогда как активация ERb оказывает ингибирующее влияние на пролиферативный сигнал. Образование гомо- или гетеродимерной формы рецептора эстрогена - отличительная особенность различных эстроген-зависимых тканей. Из этих наблюдений следует важный практический вывод - применение фармакологически активных соединений, обладающих сродством к зстрогеновым рецепторам, может вызывать совершенно противоположные эффекты на различных тканях за счет того, что клетки могут по-разному воспринимать один и тот же сигнал.
Тамоксифен блокирует естественную антиопухолевую защиту клеток.
Еще один из механизмов опухолевой индукции связан с блокадой Тамоксифеном гена р53 - естественного суппрессора опухолей. У здоровых субъектов р53 «посылает» сигналы к прекращению клеточного цикла, и, если в цикл вовлечена атипичная клетка, вызывает ее гибель. И если подобная активность Тамоксифена, несомненно, полезна для усиления чувствительности раковой клетки к химиотерапии, в здоровой клетке этот феномен провоцирует нарушение устойчивости к развитию Тамоксифен-зависимого рака.
Индол-3-карбинол отчасти похож на Тамоксифен по тем показателям, которые направлены на гибель опухолевых клеток. Он также прерывает клеточных цикл. Однако его антиопухолевая активность выше и безопаснее, чем у Тамоксифена. Сравнительный анализ антиопухолевой активности показал, что Тамоксифен вызывает 60%-ную гибель клеток, тогда как индол-3-карбинол - 90%. Важным отличием между ним является тот факт, что в ER-негативных опухолях индол-3-карбинол прекращает синтез ДНК вновь образованных клеток, в то время как тамоксифен аналогичным эффектом не обладает. Индол-3-карбинол восстанавливает р21, р53 и другие опухолевые супрессоры, которые работают в процессе образования новых клеток, и тормозит таким образом формирование новых опухолевых клонов. Тамоксифен же вызывает мутации в генах-супрессорах опухолевого роста ослабляя природные механизмы контроля. В отличие от Тамоксифена индол-3-карбинол вызывает апоптоз клеток, вызванных химическими канцерогенами, в том числе и диоксином. Остается добавить, что индол-3-карбинол малотоксичен. Согласно клиническим испытаниям, в дозе, многократно превышающей терапевтическую, индол-3-карбинол не вызывает никаких побочных эффектов.
Индол-3-карбинол действует на опухолевые клетки молочных желез по механизмам, отличным от Тамоксифена. Более того, индол-3-карбинол компенсирует ряд побочных эффектов, возникающих при приеме Тамоксифена. Все вышеизложенное позволяет предположить, что комбинация индол-3-карбинола и Тамоксифена будет эффективна при терапии гиперпластических процессов вне зависимости от наличия или отсутствия эстрогеновых рецепторов, а также не будет вызывать побочных явлений при длительном приеме препаратов. Это предположение получило подтверждение в работе (Cover CM, Hsieh SJ, Cram EJ, Hong C, Riby JE, Bjeldanes LF, Firestone GL. Indole-3-carbinol and tamoxifen cooperate to arrest the cell cycle of MCF -7 human breast cancer cells. Cancer reseach, 1999, 15, 59(6), 1244-1251). Авторами получены убедительные доказательства того, что комбинация индол-3-карбинола и Тамоксифена обладает существенно более выраженным ингибирующим действием в отношении клеток рака молочных желез, чем данные вещества в отдельности. Кроме того, эта комбинация подавляла рост клеток опухолей молочной железы как при наличии, так и при отсутствии на них эстрогеновых рецепторов.
Однако индол-3-карбинол является очень нестабильным соединением и при попадании в кислую среду желудка превращается в несколько производных (Grose KR, et al. 1992. Oligomerization of indole-3-carbinol in aqueous acid. Chem Res Toxicol 5:188-93; Ameson DW, Hurwitz A, McMahon LM et al. Presence of 3,3'-diindolylmethane in human plasma after oral administration of indole-3-carbinol [abstract 2833], Proc Am Assoc Cancer Res 1999; 40:429).
Большинство производных индол-3-карбинола выделены и охарактеризованы. Одним из таких производных является диинлолилметан (DIM). Установлено, что DIM индуцирует конверсию эстрадиола по пути 2-гидроксилирования (К.М. Dalessandri, G.L. Firestone et al Pilot Study: Effect of 3-Diindolylmethane Supplements on Urinary hormone metabolites in Postmenopausal women with a history of eriy-stage breast cancer. Nutrition and cancer, 2004, 50(2), 161-167).
DIM обладает выраженным цитостатическим эффектов в отношении опухолевых клеток молочных желез и эндометрия. (Chang YC, et al. 1999. Cytostatic and antiestrogenic effects of 2-(indole-3-ylmethyl)-3,3'-diindolylmethane, a major in vivo product of dietary indole-3-carbinol. Biochem Pharm 58:825-34; Hong CB, Kim HA, Firestone GL, Bjeldanes LF, 3,3'-Diindolyl-methane (DIM) induces a G(l) cell cycle arrest in human breast cancer cells that is accompanied by Spl-mediated activation of p21(WAFl/CIPl) expression, Carcinogenesis (Lond) 2002;23:1297-305; Leong H, Firestone GL, Bjeldanes LF, Cytostatic effects of 3,3'-diindolylmethane in human endometrial cancer cells result from an estrogen receptor-mediated increase in transforming growth factor-alpha expression, Carcinogenesis (Lond) 2001:22:1809-17). Свойство DIM ингибировать неопластические процессы в клетках эндометрия имеет особое значение, так как одним из побочных эффектов длительного приема тамоксифена является индукция рака эндометрия. (Peters-Engl С, Frank W, Danmayr E, et al. Association between endometrial cancer and tamoxifen treatment of breast cancer. Breast Cancer Res Treat, 1999, Vol.54, N.3, P.255-260).
Как и индол-3-карбинол, DIM обладает сродством к арилкарбоновым рецепторам, реализуя через этот путь свой антиэстрогенный и противоопухолевый потенциал (Chen I, et al. Aryl hydrocarbon receptor-mediated antiestrogenic and antitumorigenic activity of diindolylmethane, Carcinogenesis 19:1631-9).
Одним из принципиальных критериев, которому должно отвечать любое химические соединение, претендующее на основу для создания лекарственного средства, является стабильность при хранении. Как уже упоминалось, индол-3-карбинол является чрезвычайно лабильным соединением, быстро разлагаясь на свету и в присутствии кислорода. В отличие от индол-3-карбинола DIM более устойчив при хранении, обладая практически всеми противоопухолевыми свойствами своего предшественника. По этим причинам DIM был выбран как альтернатива индол-3-карбинолу при создании комбинированного препарата, содержащего тамоксифен для лечения пролиферативных заболеваний молочных желез.
Однако дииндолилметан обладает недостаточной всасываемостью и проявляет также некоторые побочные эффекты. По данным литературы DIM является сильным ингибитором циклооксигеназы - ключевого фермента синтеза простагландинов (Киселев В.И., Ляшенко А.А. Молекулярные механизмы гиперпластических процессов). Это свойство дииндолилметана играет важную роль в его противоопухолевой активности. Однако циклооксигеназа необходима для нормальной физиологии слизистой желудка, а лечение рака молочной железы предполагает длительный прием препарата.
Нами была разработана фармацевтическая композиция в виде формы для перорального введения, позволяющая избежать осложнений, связанных с вышеперечисленными побочными эффектами действующих начал комбинации.
Объектом настоящего изобретения является комбинированный состав, получивший название Индоксифен (Indoxifen), содержащий в качестве активных веществ 2-25 мг Тамоксифена и 50-200 мг дииндолилметана (DIM), вспомогательные вещества, улучшающие растворимость, биодоступность дииндолилметана и стабильность при хранении, и кишечнорастворимую оболочку.
А именно, согласно изобретению предлагается фармацевтическая композиция для лечения и профилактики пролиферативных заболеваний молочной железы в виде твердой лекарственной формы, состоящей из ядра, содержащего тамоксифен, дииндолилметан в качестве действующих веществ, связующее, по крайней мере, один антиоксидант, разрыхлитель, смазывающее, наполнитель, стабилизатор, выбранный из группы: поливинилпирролидон, кроскармелоза, альгинат натрия, глицерофосфат кальция или их смеси, и кишечнорастворимой оболочки при следующем содержании компонентов в г:
| тамоксифен | 0,002-0,025 |
| дииндолилметан | 0,05-0,2 |
| связующее | 0,01-0,02 |
| антиоксидант | 0,0001-0,003 |
| разрыхлитель | 0,01-0,04 |
| наполнитель | 0,05-0,3 |
| смазывающее | 0,001-0,003 |
| стабилизатор | 0,003-0,02 |
при соотношении массы ядра к массе оболочки 10:1.
В качестве связующего композиция может содержать сахарозу, альгиновую кислоту или ее соли, желатин и др.
В качестве антиоксиданта композиция преимущественно содержит лимонную кислоту и/или бутилгидроксианизол.
В качестве разрыхлителя, как правило, включаются пектины, крахмалы, природные или синтетические, такие как крахмал картофельный, натрия гликолят крахмала.
Для улучшения сыпучести используются традиционные смазывающие агенты, например стеариновая кислота, ее соли, такие как стеарат магния, стеарат кальция и т.д.
Наполнитель может быть выбран из различных Сахаров, например сахарозы, циклодекстрана, а также производных целлюлозы. Наиболее предпочтительно использование лактозы, микрокристаллической целлюлозы или их смеси. Для получения стабильной при хранении лекарственной формы помимо антиоксидантов в состав вводятся стабилизаторы, выбранные из группы: поливинилпирролидон, кроскармелоза, альгинат натрия, глицерофосфат кальция или их смеси.
Композиция может быть выполнена в виде различных твердых лекарственных форм: таблеток, капсул, гранул, пеллетов, пастилок, предпочтительно она выполнена в форме таблетки или капсулы.
Кишечнорастворимое покрытие может быть приготовлено на основе соединения, выбранного из группы, включающей гидроксипропилметилцеллюлозы фталат, целлюлозаацетатфталат, сополимер метакриловой кислоты с метилметакрилатом, поливинилпирролидон, сополимер метакриловой кислоты и этилакрилата, смеси ацетилфталилцеллюлозы с маслом касторовьм, кислотой олеиновой.
Предпочтительно использование в качестве оболочки покрытие Акрилиз, содержащее
| Сополимер метакриловой кислоты с | |
| этилакрилатом 1:1 | 40% |
| Двуокись титана | 15% |
| Тальк | 37,25% |
| Триэтилацетат | 4,8% |
| Кремния оксид | |
| коллоидный безводный | 1,25% |
| Натрия гидрокарбонат | 1,2% |
| Натрия лаурилсульфат | 0,5% |
Маркером эффективности действия индол-3-карбинол является соотношение 2-ОНЕ1/16α-ОНЕ1. Стабильное превышение 2-гидроксиэстрона более чем в 2 раза на протяжении 1-3 месяцев на фоне приема препарата - показатель адекватной коррекции гормонального фона и терапевтической эффективности дииндолилметана.
Изобретение поясняется следующими графическими материалами:
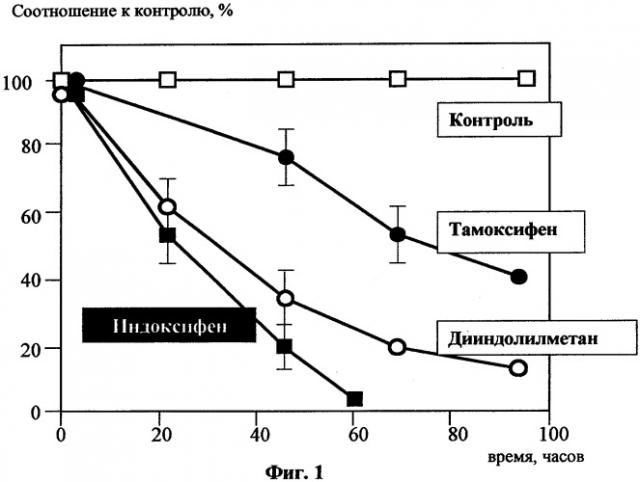
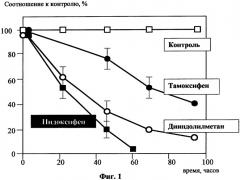
Фиг.1 отражает кинетику гибели клеток линии рака молочной железы (ER+) MCF-7 при действии тамоксифена, дииндолилметана и Индоксифена,
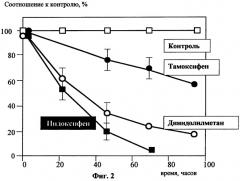
Фиг.2 отражает кинетику гибели клеток линии рака молочной железы (ER-) MDA-MB-486 при действии тамоксифена, дииндолилметана и Индоксифена,
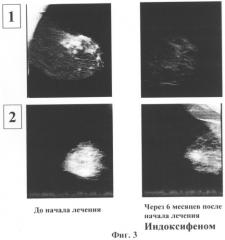
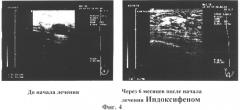
на Фиг.3 изображена рентгенорадиологическая картина выраженной положительной динамики у женщин с различными формами мастопатии после курса лечения Индоксифеном (6-месячный курс),
на Фиг.4 показаны данные ультразвукового исследования после 6-месячного курса Индоксифеном - наблюдалось уменьшение количества кистозных образований.
Изобретение может быть проиллюстрировано следующими примерами.
Пример 1
Сравнительный анализ противоопухолевой активности дииндолилметана, Тамоксифена и их комбинации (Индоксифена).
Для экспериментов использовали клеточную линию аденокарциномы молочной железы MDA-MB-468, не содержащую эстрогеновых рецепторов, и клеточную линию MCF-7 того же происхождения, имеющую рецепторы к эстрогенам дииндолилметана (производство - ООО «БиоМедИнвест») и Тамоксифен (производство) растворяли в DMSO в 1000-кратной концентрации. Во всех экспериментах на 1 мл культуральной жидкости добавляли 1 мкл раствора DMSO, содержащего препараты. Результаты экспериментов представлены на Фиг.1 и Фиг.2.
Пример 2
Изготовление капсул Индоксифена
25 мг Тамоксифена субстанции перемешивают с 200 мг дииндолилметана (производство ООО «БиоМедИнвест»). Добавляют в качестве инертного наполнителя 0,15 микрокристаллической целлюлозы, 0,02 поливилпирролидона низкомолекулярного как стабилизатор, в качестве связующего - 0,01 полиэтиленгликоля, в качестве разрыхлителя - 0,01 фармацевтического крахмала, 0,0005 янтарной кислоты как антиоксиданта, 0,001 кальция стеарата в качестве смазывающего. Полученная смесь тщательно перемешивается до однородного состояния и фасуется в кишечнорастворимые желатиновые капсулы, содержащие 5% гидроксипропилметилцеллюлозы фталата и двуокись титана 0,003%
Пример 3
| Изготовление таблеток Индоксифена | |
| Состав на одну таблетку: | |
| Дииндолилметан (НД фирмы) | 0,05 г |
| Тамоксифен | 0,005 г |
| Коллидон 30 (Евр. фарм. 2004 г.) | 0,01 г |
| Лактоза 80 меш. (Евр. фарм. 2004 г.) | 0,050 г |
| Бутилгидроксианизол | 0,0001 г |
| Натрия гликолят крахмала | 0,010 г |
| МКЦ-102 (Евр. фарм. 2004 г.) | 0,1619 г |
| Коллидон CL | 0,010 г |
| Магния стеарат (ТУ 6-09-16-1533-90 «ч») | 0,003 г |
| Масса таблетки - ядра | 0,30 г |
| Кишечнорастворимое покрытие Акрилиз | 0,03 г |
| Таблетка, покрытая оболочкой | 0,33 г |
| 2. Состав на одну таблетку: | |
| Дииндолилметан | 0,05 г |
| (НД фирмы) | |
| Тамоксифен | 0,005 г |
| Коллидон 30 | 0,01 г |
| (Евр.фарм. 2004 г.) | |
| Лактоза 80 меш. | 0,050 г |
| (Евр.фарм. 2004 г.) | |
| Бутилгидроксианизол | 0,0001 г |
| Лимонная кислота | 0,003 г |
| Кроскармелоза | 0,010 г |
| МКЦ-102 (Евр. фарм. 2004 г.) | 0,1589 г |
| Крахмал 1500 | 0,010 г |
| Кальция стеарат (ТУ 6-09-16-1533-90 «ч») | 0,003 г |
| Масса таблетки - ядра | 0,30 г |
| Кишечнорастворимое покрытие Акрилиз | 0,03 г |
| Таблетка, покрытая оболочкой | 0,33 г |
| 3. Состав на одну таблетку: | |
| Дииндолилметан (НД фирмы) | 0,05 г |
| Тамоксифен | 0,005 г |
| Коллидон 30 (Евр. фарм. 2004 г.) | 0,01 г |
| Лактоза 80 меш. (Евр. фарм. 2004 г.) | 0,050 г |
| Бутилгидроксианизол | 0,0001 г |
| Альгинат натрия | 0,003 г |
| Кроскармелоза | 0,010 г |
| МКЦ-102 (Евр. фарм. 2004 г.) | 0,1589 г |
| Крахмал 1500 | 0,010 г |
| Магния стеарат (ТУ 6-09-16-1533-90 «ч») | 0,003 г |
| Масса таблетки - ядра | 0,30 г |
| Кишечнорастворимое | |
| покрытие Акрилиз | 0,03 г |
| Таблетка, покрытая оболочкой | 0,33 г |
| 4. Состав на одну таблетку: | |
| Дииндолилметан (НД фирмы) | 0,05 г |
| Тамоксифен | 0,005 г |
| Коллидон 30 (Евр. фарм. 2004 г.) | 0,01 г |
| Лактоза 80 меш. (Евр. фарм. 2004 г.) | 0,050 г |
| Аскорбиновая кислота | 0,003 г |
| Альгинат натрия | 0,003 г |
| Кроскармелоза | 0,010 г |
| МКЦ-102 (Евр. фарм. 2004 г.) | 0,156 г |
| Крахмал 1500 | 0,040 г |
| Магния стеарат (ТУ 6-09-16-1533-90 «ч») | 0,003 г |
| Масса таблетки - ядра | 0,33 г |
| Кишечнорастворимое покрытие Акрилиз | 0,033 г |
| Таблетка, покрытая оболочкой | 0,333 г |
| 5. Состав на одну таблетку: | |
| Дииндолилметан (НД фирмы) | 0,05 г |
| Тамоксифен | 0,005 г |
| Коллидон 30 (Евр. фарм. 2004 г.) | 0,01 г |
| Лактоза 80 меш. | 0,050 г |
| (Евр. фарм. 2004 г.) | |
| Глицерофосфат кальция | 0,003 г |
| Лимонная кислота | 0,003 г |
| Альгинат натрия | 0,003 г |
| Кроскармелоза | 0,010 г |
| МКЦ-102 (Евр.фарм. 2004 г.) | 0,153 г |
| Крахмал 1500 | 0,010 г |
| Магния стеарат (ТУ 6-09-16-1533-90 «ч») | 0,003 г |
| Масса таблетки - ядра | 0,30 г |
| Кишечнорастворимое покрытие Акрилиз | 0,03 г |
| Таблетка, покрытая оболочкой | 0,33 г |
Пример 4
Клинические исследования по определению эффективности комбинации Дииндолилметан и Тамоксифена для терапии пролиферативных заболеваний молочных желез
За период январь - июль 2004 г. в Федеральном маммологическом центре на базе Центра ренгенорадиологии МЗ РФ было обследовано более 500 женщин в возрасте от 30 до 50 лет, из которых была выбрана группа пациенток - 35 человек с выраженными клиническими проявлениями мастопатии (болевым синдромом, нарушениями в эндокринной системе и гинекологической сфере). Исследования проводились с помощью комплекса методов включающих: клиническое исследование, маммографию, УЗИ, пункционную биопсию с использованием стереотаксических установок с последующим цитологическим, гистологическим и иммуногистохимическими исследованиями (для определения эстроген-зависимости), маммосцинтиграфию. У всех пациенток проведено лабораторное исследование соотношения метаболитов эстрадиола. Выявлено достоверное превышение концентрации 16α-гидроксиэстрона по сравнению со здоровыми контрольными группами.
Были выявлены следующие изменения в молочных железах:
1. Диффузная фиброзно-кистозная мастопатия с преобладанием железистого компонента (аденоз) у 9 женщин в возрасте 35-40 лет.
Клинически болезнь сопровождалась болевыми ощущениями, особенно в предменструальный период, набуханием молочных желез, уплотнением. Пальпаторно молочные железы представлялись плотными с отдельными диффузно расположенными узлами, нерезко отграниченными от окружающих тканей.
На рентгенограммах при этом отмечалось наличие множественных теней неправильной формы с нечеткими расплывчатыми контурами.
2. Диффузная фиброзно-кистозная мастопатия с преобладанием фиброзного компонента у 6 женщин в возрастной группе 40-50 лет.
Клиническая картина и субъективные ощущения почти не отличались от предыдущей формы.
Рентгенологическая картина также была схожа. Вся молочная железа интенсивно затемнена, с узкой полоской просветления, обусловленной подкожно-жировой клетчаткой. Но, в отличие от аденоза, при фиброзе контуры отдельных участков лобулярной гиперплазии подчеркнуты, а не разрыхлены.
3. Диффузная фиброзно-кистозная мастопатия с преобладанием кистозного компонента. Данная патология наблюдалась в 9 случаях у женщин 35-40 лет.
Клиническая картина была аналогичной предыдущим формам мастопатии, однако пальпировались отдельные участки уплотнения округлой или овальной формы, эластической консистенции, довольно хорошо отграниченные от окружающих тканей при размере более 2 см.
На рентгенограммах на фоне пестрого неоднородного рисунка, обусловленного чередованием жировой, соединительной и железистой ткани, визуализировались округлые, овальные или с вдавлениями от соседних кист уплотнения размеры от 0,3 до 6-8 см. Все они характеризовались четкими, ровными контурами и нередко сопровождаются ободком просветления, характеризующего экспансивный рост. При наличии нескольких камер в кистах контуры были полицикличными, но всегда резкими. В 1 случае для исключения инфильтративного роста и более четкого выявления ободка просветления произведена прицельная рентгенография с дозированной компрессией, пункцией с последующей пневмокистографией. Наиболее информативным методом диагностики данной патологии было УЗИ, при котором кисты выявлялись в 100% случаев.
4. Смешанная форма диффузной фиброзно-кистозной мастопатии. Встречалась у 8 женщин в возрасте 30-40 лет.
Морфологическая картина смешанной формы мастопатии довольно пестрая - отмечается избыточное развитие железистых долек, скл