Суппозитории вагинальные на основе 3,3 -дииндолилметана (метиндола)
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и используется для лечения генитальных кондилом и неопластических заболеваний репродуктивных органов. Средство для лечения генитальных кондилом и неопластических заболеваний репродуктивных органов в форме суппозитория вагинального, которое содержит в качестве активной субстанции метиндол (3,3'-дииндолилметан), липофильную основу, содержащую твердый кондитерский жир, поливинилпирролидон и бутилгидроксианизол, взятые в определенном соотношении. Вышеописанное средство способствует эффективному лечению генитальных кондилом и неопластических заболеваний репродуктивных органов. 1 з.п. ф-лы, 4 ил., 1 табл.
Реферат
Изобретение относится к области медицины и химико-фармацевтической промышленности, а именно касается средств для лечения генитальных кондилом и неопластических заболеваний репродуктивных органов.
Папилломавирусная инфекция (ПВИ) является наиболее распространенным инфекционным заболеванием, передающимся половым путем. Согласно статистике более 50% сексуально активного населения в течение жизни инфицируется вирусом папилломы человека (ВПЧ). Биологический и медицинский интерес к папилломавирусам объясняется тем, что они относятся к опухолеродным, способным вызвать доброкачественную гиперплазию, а некоторые их типы - инициировать развитие злокачественных опухолей аногенитальной области: рак шейки матки, вульвы, влагалища и пр. Следствием инфицирования ВПЧ считают также цервикальные интраэпителиальные неоплазии (CIN), относящиеся к предраковым состояниям. ДНК ВПЧ высокой степени онкогенного риска (преимущественно 16 и 18 типов) обнаруживают в 50-80% образцов умеренной и тяжелой дисплазии плоского эпителия шейки матки и в 90% инвазивного рака.
Рак шейки матки (РШМ) занимает второе место по распространенности среди злокачественных новообразований у женщин. Ежегодно в мире регистрируется около полумиллиона новых случаев данного заболевания и 270000 вызванных им смертей. Стандартизированный показатель заболеваемости и смертности от РШМ составляет 16,2 и 9 на 100000 населения, соответственно. При этом приблизительно 52% всех случаев цервикального рака возникает в Азии. В России от РШМ (4,8% среди всех злокачественных опухолей у женщин) ежегодно умирает более 6 тыс.больных (у женщин в возрасте от 20 до 40 лет РШМ является основной причиной смерти), показатель заболеваемости - приблизительно вдвое выше.
Не меньшей по значимости медицинской проблемой являются доброкачественные проявления ПВИ, к которым относятся экзофитные и эндофитные поражения различных участков эпителия вульвы, влагалища и шейки матки, а также окружающих кожных покровов и слизистых оболочек, включая анус. Экзофитные формы (генитальные кондиломы) включают в себя разнообразные по внешнему виду и размеру остроконечные, папиллярные и папулообразные образования, нередко осложняющиеся присоединением вторичной бактериальной инфекции и сопровождающиеся не только психологическими, но и физическими страданиями пациента.
Частота генитальных кондилом (генитальных бородавок), являющихся следствием инфицирования доброкачественными ВПЧ-типами, по данным Минздрава РФ (2001 г.) составляет 26 на 100 000 населения. Эндофитные формы (субклиническая ПВИ) представляют собой различные морфологические изменения плоского эпителия без наружных разрастаний.
Генитальные кондиломы являются также причиной возвратного респираторного папилломатоза у детей, что обусловлено вертикальной трансмиссией вируса от инфицированной матери к ребенку (Минкина Г.Н., Манухин И.Б., Франк Г.А., Предрак шейки матки, Москва, «Аэрограф-Медиа», 2001).
Основными методами лечения генитальных кондилом и предраковых неопластических заболеваний репродуктивных органов, обусловленных ВПЧ, в настоящее время являются химическая деструкция, хирургическое иссечение или аблация. Данные методы нередко сопровождаются осложнениями, требуют применения дорогостоящего медицинского оборудования и далеко не всегда оказываются эффективными. При этом огромное число молодых женщин с невыраженной клинической картиной вагинального кондиломатоза, не подлежащие деструктивному лечению, являются носителями инфекции и представляют опасность для половых партнеров и будущего ребенка.
При инфицировании эпителиальных тканей папилломавирус использует целый набор механизмов, подчиняющих своим интересам жизнедеятельность инфицированной клетки. Известно, что ДНК ВПЧ кодирует синтез двух белков Е6 и Е7, индуцирующих переход дифференцированных клеток в S-фазу клеточного цикла. На стадии активной репродукции вируса экспрессия генов Е6 и Е7 регулируется белковым продуктом гена Е2 - репрессором транскрипции этих генов. Именно поэтому, пока вирус находится в эписомальном состоянии, имеют место доброкачественные процессы разрастания инфицированных тканей. Ключевым событием в малигнизации клеток является интеграция вируса в геном клетки-хозяина, которая сопровождается делецией гена Е2.
Контроль клеточного цикла и дифференцировки осуществляется посредством онкогенных белков Е6 и Е7, инактивирующих "ключевые" белки-регуляторы пролиферативной активности клеток - проапоптотический белок р53 и белок ретинобластомы (pRB). Установлено, что белок Е7 способен образовывать стабильный комплекс с белком pRB, вызывая его деградацию, что приводит к высвобождению транскрипционного фактора E2F, который стимулирует транскрипцию генов, необходимых для репликации ДНК в S-фазе клеточного цикла. Кроме того, Е7 влияет на активность целого ряда других белков-регуляторов клеточного цикла, таких как А- и Е-циклины, сdk2-киназа и ингибиторы циклин-зависимой киназы р21 и р27.
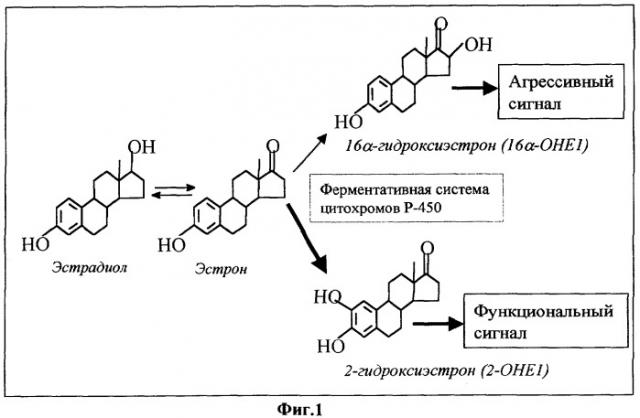
Известно, что в патогенезе вирусной инфекции, приводящей к повышению пролиферативной активности инфицированных клеток доброкачественного характера (а иногда и с их злокачественным перерождением), значительную роль играет эндокринная система, в частности уровень и активность женских половых гормонов - эстрогенов (Вестник дерматологии и венерологии, 2000, №6, стр.20-23). При этом относительное постоянство пролиферативной клеточной активности в эстроген-чувствительных тканях контролируется с помощью специальных метаболических механизмов, конвертирующих эстрадиол (наиболее активный эстроген) в биологически активные его производные. Основной пул эндогенного эстрогена утилизируется посредством локализованной в печени монооксигеназной системы цитохромов Р-450, катализирующей образование его гидрокси-производных, что облегчает их растворимость и последующее выведение из организма через почки и желчевыводящие пути. Ферментативная система цитохромов Р-450 обеспечивает конверсию эстрадиола в два основных метаболита: 16α-гидроксиэстрон (16α -ОНЕ1) и 2-гидроксиэстрон (2-ОНЕ1) (фиг.1).
16α-ОНЕ1 относится к категории "агрессивных" гормонов, вызывающих длительный канцерогенный эффект (Proc. Natl. Acad. Sci. USA, 1982, v.79, p.3047-3051). Показано, что этот эффект обусловлен образованием прочных ковалентных связей 16α-ОНЕ1, являющегося агонистом эстрогена, с ядерными эстрогеновыми рецепторами. 2-ОНЕ1 обладает умеренными функциями и, в отличие от 16α-ОНЕ1, напротив, нормализует клеточный рост. При повышении уровня 2-ОНЕ1 наблюдается тенденция к гибели опухолевых клеток и профилактике их дальнейшего образования.
Изучение функций этих двух метаболитов позволило выявить однозначную связь между уровнем 16α-ОНЕ1 и риском развития опухолей в эстроген-зависимых тканях и заключить, что соотношение 2-ОНЕ1 к 16α-ОНЕ1 является одновременно универсальным биомаркером и надежным диагностическим критерием при определении риска и прогноза развития эстроген-зависимых опухолей.
Давно было отмечено, что тканевые изменения в цервикальном канале, вызванные ВПЧ, локализованы главным образом в эстроген-чувствительных зонах. Более того, было установлено, что там, где наблюдается активная экспрессия белков ВПЧ, отмечен высокий уровень синтеза (16α-ОНЕ1), сравнимый с таковым в раковых клетках молочной железы.
Следует подчеркнуть, что в норме эпителиальные клетки шейки матки не способны обеспечивать превращение эстрадиола в 16α-гидроксиэстрон. Таким образом, активная репродукция ВПЧ индуцирует образование "агрессивного" метаболита в инфицированных клетках (Киселев В.И., Киселев О.И. Вирусы папилломы человека в развитии рака шейки матки. СПб. - М.: Роза мира, 2003).
В то же время было показано, что ВПЧ-инфицированные кератиноциты человека проявляют пролиферативную активность in vitro, но при этом не имеют опухолевого фенотипа при микроскопическом исследовании. Добавление в культуральную среду экзогенного 16α-ОНЕ1 превращает клетки в типично раковые (Int. J. Cancer, 1991, v.49, p.867-869).
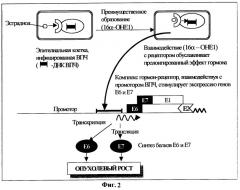
Таким образом, формируется порочный круг, при котором вирус через образование "агрессивной" формы эстрадиола создает благоприятные условия для развития опухоли, стимулируя синтез онкобелка Е7. В свою очередь, онкобелок Е7, с одной стороны, активирует механизмы патологической пролиферации клеток, а с другой - блокирует противовирусную иммунологическую защиту (фиг.2).
Суммируя вышесказанное, можно заключить, что инфицирование эпителиальных клеток ВПЧ является необходимым, но недостаточным фактором для их малигнизации. Для формирования необратимой неоплазии необходимы: 1) индукция метаболических механизмов конверсии эстрадиола в 16α-ОНЕ1, играющего ключевую роль в раковом перерождении ВПЧ-инфицированных клеток; 2) активная экспрессия онкогенов Е6 и Е7 вируса, стимулируемая взаимодействием комплекса гормон-рецептор с промотором ДНК ВПЧ; 3) индукция множественных повреждений хромосомной ДНК в инфицированной клетке, завершающая процесс опухолевой трансформации.
В связи с появлением вирусной концепции цервикального канцерогенеза принципиально изменились и подходы к лечению диспластических процессов шейки матки. В настоящее время хирургические методы (по причине высокого процента рецидивов после их применения) стали играть второстепенную роль. На первое место вышла этиопатогенетическая терапия, имеющая два основных направления: 1) воздействие на этиологический фактор - ВПЧ; 2) блокирование основных механизмов канцерогенеза.
К сожалению, лекарственных средств, избирательно воздействующих на ВПЧ, в настоящее время не существует. Наиболее часто для лечения ВПЧ-инфекции используются препараты интерферона (IFN) - белка, вырабатываемого клетками иммунной системы в ответ на стимуляцию вирусными антигенами. Однако в большинстве случаев даже длительная IFN-терпия не приводит к клиническому улучшению. Показано, что устойчивость к действию IFN ВПЧ-инфицированных цервикальных клеток определяется повышенным уровнем экспрессии онкобелка Е7, внутриклеточно инактивирующего фактор регуляции IFN, который включает транскрипцию генов, кодирующих синтез противовирусных белков.
На протяжении многих лет ведутся поиски природных и синтетических противоопухолевых соединений, способных остановить развитие предраковых состояний шейки матки. Наконец эти поиски увенчались успехом. Недавно было идентифицировано химическое соединение с антиканцерогенными свойствами - индол-3-карбинол (I3С) - фитонутриент, изофлавоноид, содержащийся в овощах семейства крестоцветных. Многочисленные данные литературы указывают на то, что длительный прием этого соединения предупреждает развитие опухолей кишечника, легких, органов женской репродуктивной системы. I3С стимулирует противоопухолевый эффект многих лекарственных препаратов, снижает мутагенную активность канцерогенов.
Большая часть исследований, посвященных I3С, касается его противоопухолевой активности в т.н. эстроген-зависимых органах и тканях (молочные железы, эндометрий и шейка матки), для которых характерно циклическое изменение уровня клеточной пролиферативной активности. Уникальность действия I3C заключается в том, что он вмешивается в оба этих пути, нарушая их функционирование и препятствуя, таким образом, клеточной пролиферации. С одной стороны, он обладает выраженным антиэстрогенным эффектом, стимулируя образование антипролиферативного 2-гидроксиэстрона и улучшая таким образом соотношение 2-ОНЕ1/16α-ОНЕ1 в пользу первого, а с другой - препятствует фосфорилированию цитоплазматических белков - участников каскадной передачи, индуцируемой EGF. Еще одним важнейшим механизмом противоопухолевого действия I3C является его способность индуцировать апоптоз - "программируемую гибель" опухолевых клеток через систему bax-bcl.
РШМ, ассоциированный с ВПЧ, также исследовался как потенциальная мишень для терапии I3C. Первые многообещающие результаты были получены в 1999 г. группой американских исследователей на модели трансгенных мышей, содержащих в геноме интегрированную форму ВПЧ-16. Ранее было установлено, что содержание этих мышей на диете, в состав которой входит 17-α-эстрадиол, приводит к развитию у них РШМ (J.Cell. Biochem., 2000, 34 (Suppl.): 103-114). В дальнейших исследованиях удалось достоверно подтвердить многообразие противоопухолевых активностей I3C в ВПЧ-трансформированных клетках цервикального эпителия. Было показано, что in vitro и in vivo:
1) I3C снимает эстрадиол-зависимую индукцию онкогена Е7, резко снижая таким образом уровень экспрессии онкобелка Е7 и препятствуя гормон-зависимой пролиферации инфицированных клеток;
2) I3C нормализует метаболизм эстрадиола в клетках, инфицированных ВПЧ, препятствуя образованию канцерогенного метаболита 16α-ОНЕ1, стимулирующего экспрессию онкогенов ВПЧ;
3) I3C индуцирует апоптотические процессы ВПЧ-инфицированных клеток, вызывая избирательную гибель клеток с опухолевыми свойствами (J. Nutrit, 2001, 131, 3294-3302).
Противоопухолевая активность I3C как средства профилактики и лечения РШМ была подтверждена и в недавних плацебо-контролируемых клинических исследованиях (Gynecol. Oncol, 78, 123-129, 2000). У пациенток с CIN II и III степени, ежедневно принимавших 200-400 мг I3C (опытная группа), наблюдалась полная регрессия опухоли в 47% случаев, тогда как в контрольной группе не было зафиксировано ни одного случая регрессии.
Обсуждая противоопухолевую и противовирусную активность I3C, необходимо учитывать, что данное соединение отличается крайней нестабильностью и легко подвергается олигомеризации, которая многократно усиливается в кислой среде. При этом основным олигомерным продуктом I3C является его димерная форма - 3,3'-дииндолилметан (DIM). Как показали фармакокинетические исследования, под воздействием кислой среды желудка принятый перорально I3C почти мгновенно превращается в DIM (Ameson DW, Hurwitz A, McMahon LM, Robaugh D: Presence of 3,3'-diindolylmethane in human plasma after oral administration of indole-3-carbinol (abstr.) Proc. Am. Assoc. Cancer Res, 40, 2833, 1999).
Экспериментально доказано, что практически все множественные противоопухолевые механизмы, индуцируемые I3C in vitro и in vivo, характерны и для DIM.
В одном из последних экспериментальных исследований была показана способность DIM вызывать апоптоз цервикальных ВПЧ-инфицированных кератиноцитов человека в условиях in vitro. При этом на одной из трех исследованных клеточных линий цервикального рака DIM демонстрировал в несколько раз большую эффективность, чем I3C (величина (LD50) составляла 50-60 мкМ для DIM и 200 мкМ для I3C соответственно), но так же, как и его метаболический предшественник (I3C), не вызывал апоптотических изменений в нормальных (нетрансформированных) кератиноцитах (J.Nutrit, 2001, 131, 3294-3302).
Несколько лет тому назад с помощью метода microarray-анализа было установлено, что сходство противоопухолевой и противовирусной активности I3C и DIM проявляется и на субмолекулярном (генетическом) уровне. В клеточных линиях цервикального рака DIM, подобно I3С, конститутивно изменял транскрипцию более чем 100 генов, большая часть которых прямо или косвенно контролирует клеточную пролиферацию (апоптоз), а также экспрессию ВПЧ-онкогенов в вирус-инфицированных клетках (J.Nutr. 132, 3314-3324, 2002).
В заключение необходимо упомянуть еще об одном, недавно описанном, важнейшем свойстве DIM - его иммуномодулирующей активности. Было показано, что в условиях in vitro в опухолевых клетках DIM стимулирует IFNα-зависимые сигнальные каскады посредством активации экспрессии рецепторов IFNα, а также других IFN-респонсивных регуляторных белков (Cells. Mol. Pharmacol, 2006, 69, 430-439). Имея в виду высокую противовирусную и противоопухолевую активность IFNα, данное свойство может иметь большое клиническое значение при использовании DIM для лечения цервикальных дисплазий, обусловленных ВПЧ.
Суммируя все вышесказанное, можно заключить, что препарат на основе DIM должен обладать высокой противоопухолевой и противовирусной активностью в отношении ВПЧ-инфицированных клеток.
Однако, хотя метиндол является более стабильным соединением, чем индол-3-карбинол, он обладает низкой биодоступностью, что может ограничивать его применение в качестве лекарственного средства.
Для повышения растворимости и биодоступности были разработаны различные лекарственные формы DIM. Однако они также обладают рядом недостатков. Поэтому поиск новых более эффективных составов является по-прежнему актуальным.
Известны вагинальные суппозитории DIM для лечения лейшманиоза, полученные нагреванием цетостеарилового спирта с активным веществом, а также с добавлением церамидов или их производных, с последующим введением полученной смеси с триглицеридной основой и формованием свечей (WO 2005/107747, 2005-11-17).
Известен патент US 6689387, 10.02.2004, описывающий различные формы дииндолилметана для лечения мастальгии и эндметриоза. В том числе отмечается, что возможно использование в виде суппозиториев с традиционными связующими и таким носителем как триглицериды.
Известные суппозитории не обеспечивают пролонгированного действия активного вещества, необходимого для лечения папилломавирусной инфекции. Кроме того, лечение неопластических нарушений требует значительного времени. В то же время триглицеридные основы при длительном применении вызывают изъязвление слизистых оболочек.
В качестве наиболее близкого аналога может быть указан патент RU 2196568.
Данное решение касается фармацевтической композиции для профилактики и лечения опухолей, ассоциированных с вирусами папилломы человека, а именно дисплазии и рака шейки матки и папилломатоза гортани. Изобретение заключается в том, что предлагается композиция на основе индол-3-карбинола в качестве действующего начала, возможно, в виде вагинальных суппозиториев, на основе витепсола. Поскольку действующее вещество достаточно не стойкое, оно не может обеспечить необходимую эффективность лечения.
Задачей настоящего изобретения является разработка лекарственной формы для более эффективного лечения генитальных кандилом и неопластических заболеваний при отсутствии побочных эффектов, стабильной при хранении.
Поставленная задача решается препаратом, представляющим собой суппозитарии вагинальные («Цервикон»), содержащие в качестве активной субстанции метиндол (3,3'-дииндолилметан - DIM), липофильную основу, содержащую твердый кондитерский жир, поливинилпирролидон и бутилгидроксианизол или бутилгидрокситолуол при следующем содержании, мас.%:
| Метиндол | 2,0-6,0 |
| Поливинилпирролидон | 0,5-1,2 |
| Бутилгидроксианизол | |
| или бутилгидрокситолуол | 0,3-0,5 |
| Липофильная основа | остальное |
Метиндол содержится в количестве 0,045-0,110 г на дозу.
В качестве липофильной основы предпочтительно использование твердого кондитерского жира, такого, как твердый жир тип «А» или «Б», но также возможно введение дополнительно эмульгаторов, эфиров фталевой кислоты и спиртов, гидрогенизированных растительных масел, восков, парафина, ланолина, кулинарного жира, масла какао.
Известно, что твердые кондитерские жиры имеют мелкозернистую структуру, которая плавится в узком интервале, имеют хорошую пластичность и легко смешиваются со многими веществами. Выпускаемые кондитерские жиры готовят на пальмоядерной основе и на основе саломаса.
Кроме того, было обнаружено, что при использовании данной основы с ПВП и антиоксидантом, практически не возникало нежелательного воздействия на слизистую, как в случае основ, состоящих преимущественно из триглицеридов, таких как, витепсол, эстаринум, широко используемых в фармацевтической практике.
Бутилгидроксианизол и бутилгидрокситолуол - синтетические продукты, относящиеся к производным фенола. Проявляют эффективное антиоксидантное действие и являются известными консервантами. Введение их в суппозиторную массу дает дополнительный эффект воздействия на пораженную слизистую.
В качестве поливинилпирролидона предпочтительно использование ПВП низкомолекуллрного, например, марок Коллидон CL, CL-M- с молекулярной массой 12600±2700 или Повидон - с массой 8000±2000.
Способ приготовления суппозиториев заключается в том, что расплавляют компоненты липофильной основы, часть ее отдельно растирают с действующим веществом до получения гомогенной взвеси, к охлажденной оставшейся части основы добавляют поливинилпирролидон и антиоксидант, и затем полученную взвесь перемешивают до однородного состояния и формуют свечи методом выливания в формы заданных размеров.
Изобретение поясняется следующими графическими материалами:
Фиг.1 отражает метаболизм эстрадиола.
Фиг.2 отражает роль эстрогенов в канцерогенезе эпителиальных клеток шейки матки, инфицированных ВПЧ.
На Фиг.3 показана транскрипция гена Е7 в клетках CaSki в присутствии эстрадиола (Фиг.3А - 1 - до добавления эстрадиола, 2 - инкубация в течение 4 часов, 3 - 24 часов, 4 - 48 часов) и в присутствии эстрадиола + Цервикон (Фиг.3Б - 1 - до добавления эстрадиола + Цервикон, 2 - инкубация в течение 4 часов, 3 - 24 часов, 4 - 48 часов).
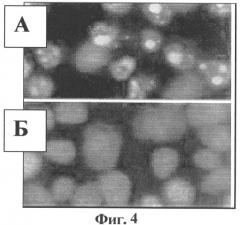
На Фиг.4 показана индукция апоптоза в присутствии Цервикона (на Фиг.4А - в клетках видна конденсация хроматина, свидетельствующая о клеточной гибели).
Изобретение иллюстрируется следующими примерами.
Пример 1
Суппозитории вагинальные, содержащие
| дииндолилметан | 0,05 г |
| 3,3'-Дииндолилметан | 0,05 г |
| Твердый жир тип «А» | 2,02 г |
| Коллидон CL | 0,02 г |
| Бутилгидроксианизол | 0,01 г |
ИТОГО-2.1 г
Пример 2
| Суппозитории вагинальные, содержащие | |
| дииндолилметан | 1,0 г |
| 3,3'-Дииндолилметан | 0,1 г |
| Твердый жир тип «А» | 1,97 г |
| Коллидон CL | 0,02 г |
| бутилгидрокситолуол | 0,01 г |
ИТОГО-2.1 г
Пример 3
Материалы и методы.
Экспериментальная модель. В качестве модели использовали клеточную линию цервикальной карциномы CaSki, содержащую множественные копии интегрированного генома ВПЧ 16-го типа, клеточную линию С33-А (не содержащую ДНК ВПЧ) и культивируемые эпителиальные клетки, полученные из цервикальной области у пациенток с диагнозом "ВПЧ-индуцированная дисплазия".
Клетки поддерживали в среде RPMI-1640 с добавлением 10% фетальной бычьей сыворотки. Свечи по примеру 1 растворяли в водноспиртовом растворе, содержащем 20% этанола, и добавляли к клеткам так, чтобы конечная концентрация входящего в его состав 3,3'-дииндолилметана составляла 50 мкМ.
Выделение РНК. Клеточную суспензию смешивали с 0,5 мл лизирующего раствора, содержащего 4М гуанидинтиоционина, 0,2% SDS, 25mM цитрата натрия (р7,0), суспензировали на Вортексе в течение 10 с и лизировали в ледяной бане 15 мин.
После этого в пробирку вносили 50 мкл 2М ацетата натрия (рН 4,0) и 500 мкл фенола, смесь интенсивно встряхивали, центрифугировали и отбирали водную фазу. Процедуру повторяли дважды и затем к водной фазе добавляли равный объем изопропанола. После 2 часов инкубации в холодильнике при 20°С осадок собирали, центрифугировали и растворяли в 50 мкл ТЕ-буфера.
Анализ транскрипции гена Е7 ВПЧ 16 типа. Изучение транскрипции гена Е7 проводили методом Нозерн-гибридизации. Для этого 10 мкг суммарной РНК, выделенной из клеточной суспензии, разделяли методом электрофореза в агарозном геле, содержащем формальдегид, и переносили на нитроцеллюлозные фильтры. Пробу для гибридизации готовили путем амплификации фрагмента гена Е7 в присутствии меченого dTTP(p32). В качестве матрицы для амплификации использовали плазмиду рТНЕ716, содержащую онкоген Е7 ВПЧ 16-го типа.
Масс-спектрометрический (GC-MS) анализ метаболитов эстрадиола. Образцы готовились из супернатантов клеток, обработанных эстрадиолом и заявленным составом в концентрациях соответственно 1 и 50 мкМ. В супернатант (5 мл) вносили дейтерированный эстрадиол в качестве стандарта и наносили на колонку С 18 Sep-Pak (Water Associates, Milford, MA).
Элюцию стероидов проводили раствором метанол/аскорбиновая кислота. Общий объем элюата доводили до 0,5 мл мягким нагреванием при 50°С под вакуумом, а оставшийся объем пробы высушивали в жидком азоте. Каждый образец растворяли в 10 мкл пиридина и 50 мкл бис-(триметилсилил) трифлюороактамида (BSTFA) и оставляли в течение ночи при комнатной температуре. По 2 мкл каждого образца анализировали на газовом масс-спектрометре. Результаты анализа выражали в нг/мг клеточного белка.
Тест биотрансформации эстрогенов. Анализ биотрансформации проводился радиометрическим методом, основанным на образовании 3Н2O за счет переноса протона со специфически меченного эстрадиола, как описано в (Telang NT, Bradlow HL and Osborne MP "In vitro biotransformation of estradiol by explant cultures of murine mammary tissues" Breast Cancer Res. Treat. 1989, 13, 173-181).
Меченый эстроген добавлялся к клеткам монослоя в растворе 0,1% пропиленгликоля. После 24 часов инкубации подсчитывалась радиоактивность в культуральной жидкости. Из полученных значений вычитали уровень фоновой биотрансформации в культуральной среде без клеток и пересчитывали на мг белка, определенного методом Лоури.
Экспериментальная часть.
Исследование экспрессиии онкогенов вирусов папилломы человека в трансформированных клетках при воздействии индинолом. Экспрессию гена Е7 ВПЧ-16 исследовали на клеточной линии CaSki, содержащей до 500 копий генома ВПЧ-16 в интегрированном состоянии. В культуральную среду вносили эстрадиол (конечная концентрация 1 мкМ) и состав по примеру 1 (конечная концентрация DIM 50 мкМ), инкубацию продолжали в течение 4, 24 и 48 часов. В указанное время клетки собирали, выделяли суммарную РНК и определяли уровень экспрессии гена Е7 методом Нозерн-гибридизации. Результаты исследований представлены на Фиг.3.
В данном эксперименте исследован уровень экспрессии гена Е7 в клетках CaSki при добавлении в культуральную среду эстрадиола.
Из результатов, представленных на Фиг.3, видно, что эстрадиол существенно индуцирует синтез мРНК гена Е7, причем данный эффект нарастает во времени (фиг.3А), а добавление заявленного состава практически полностью нивелирует этот эффект (фиг.3Б).
Изучение особенностей метаболизма эстрадиола в эпителиальных клетках, инфицированных ВПЧ. Как было установлено ранее, в клетках, трансформированных ВПЧ "высокого риска", наблюдается изменение в метаболизме эстрадиола в сторону образования "агрессивного" 16α-гидроксиэстрона. Этот метаболит обладает канцерогенными свойствами и способен образовывать ковалентные комплексы с эстрогеновыми рецепторами, вызывая продолжительные гормон-зависимые эффекты, в том числе стимулируя экспрессию онкогенов ВПЧ. Нами было изучено влияние индинола на метаболизм эстрадиола, в частности, образование 16α-гидроксиэстрона в клетках, трансформированных ВПЧ (см. таблицу).
| Образование 16α-гидроксиэстрона в клетках, трансформированных ВПЧ 16 типа | |||
| №№ | Тип клеток | % 16α - гидроксиэстрона на мкг клеточного белка | |
| Эстрадиол | Эстрадиол + Цервикон | ||
| 1 | CaSki ВПЧ (+) | 16,0±0,1 | 2,2±0,5 |
| 2 | С 33-А ВПЧ (-) | 0,08±0,03 | 0,08±0,08 |
| 3 | Цервикальный эпителий | 0,7±0 | 0,5±0,1 |
| 4 | Цервикальный эпителий из трансформированных зон | 12,6±0,5 | 2,1±0,3 |
Пример 4
Исследование индукции апоптоза клеток, трансформированных ВПЧ
в присутствии препарата по примеру 2.
Нами была исследована способность препарата индуцировать апоптоз клеток, инфицированных вирусом папилломы человека.
Для количественной оценки выживаемости клеток и доли клеток, находящихся в апотозе, использовали сочетание двух красителей - бромистого этидия, проникающего в клетки с поврежденной мембраной (т.е. мертвые и некротические клетки) и окрашивающего их ядро в ярко оранжевый, почти красный цвет, и акридинового оранжевого, окрашивающего живые клетки в ярко зеленый цвет и позволяющего наблюдать разные фазы конденсации хроматина и блеббинг мембраны. В клетках, находящихся на поздних стадиях апоптоза, наблюдаются ярко оранжевые области конденсированного хроматина в ядре, что отличает их от некротических клеток, которые при этом оказываются равномерно окрашенными в оранжевый цвет. Долю клеток в состоянии апоптоза рассчитывали в процентах от их общего числа.
Клетки CaSki и С 33-А инкубировали с флуоресцентным красителем Hoechst 33342 (Sigma) в культуральной среде в концентрации 5 мкл/мл при 37°С 30 мин, затем фиксировали в 2% параформальдегиде при комнатной температуре 10 мин, однократно отмывали ФБС и анализировали с помощью флуоресцентного микроскопа Opton.
Как показали эксперименты, после 24-х-часовой инкубации клеток CaSki в культуральной среде, содержащей заявленный препарат (конечная концентрация DIM 50 мкМ), в поле зрения наблюдалось более 50% апоптотических клеток - (см. фиг.4А), тогда как в клетках линии С 33-А при тех же условиях процент клеток в состоянии апоптоза составлял не более 5% (фиг.4Б).
Пример 5. Исследования воздействия на генитальные кондиломы.
Были проведены также исследования на пациентах с диагнозом «генитальная остроконечная кондилома».
Диагностика проводилась на основании цитологического, гистологического исследования биоптатов, определения антител к ВПЧ и обнаружения ДНК ВПЧ и онкобелка Е7.
Из 25 пациентов группы генитальные кондиломы примерно в 90% случаев ассоциировались с другими урогенитальными инфекциями. Примерно 10% ранее лечились методом электрокоагуляции.
15 пациентам вводили 2 раза в день свечи по примеру 2 и 10 пациентам свечи по примеру 1 в течение 10 недель - 12 недель до того, как генитальные бородавки разрешились. При контрольном осмотре через полтора года рецидива остроконечных кондилом в основной группе не было, у 3 пациенток отмечен рецидив. Назначено дополнительное лечение с увеличением дозы.
Выводы
Проведенные нами исследования позволили установить, что новая лекарственная форма Цервикон (суппозитории вагинальные, содержащие субстанцию метиндол (3,3'-дииндолилметан - DIM), обладает высокой специфической противоопухолевой активностью в отношении эпителиальных клеток человека, инфицированных ВПЧ, которая реализуется через следующие механизмы:
1. Цервикон снимает эстрадиол-зависимую индукцию онкогена Е7 ВПЧ-16, препятствуя таким образом гормон-зависимой пролиферации инфицированных клеток.
2. Цервикон нормализует метаболизм эстрадиола в клетках, инфицированных ВПЧ, препятствуя образованию канцерогенного метаболита гидроксиэстрона, стимулирующего экспрессию онкогенов ВПЧ.
3. Цервикон индуцирует апоптотические процессы ВПЧ-инфицированных клеток, вызывая избирательную гибель клеток с опухолевыми свойствами.
Есть все основания считать, что местно применяемый в виде суппозиториев вагинальных новый препарат обладает большей противоопухолевой и противовирусной активностью в отношении ВПЧ-инфицированных цервикальных клеток по сравнению с орально принимаемым DIM (в той же конечной концентрации) и его метаболическим предшественником - I3C, превращаемым в DIM в желудочно-кишечном тракте.
Таким образом, препарат может быть рекомендован при лечении диспластических процессов шейки матки, обусловленных вирусами папилломы человека.
Кроме того, суппозитории обеспечивают необходимое время при высокой биодоступности активного вещества, которое позволяет применять их при таких трудноизлечимых патологиях, как генитальные кандиломы.
1. Средство для лечения генитальных кондилом и неопластических заболеваний репродуктивных органов в форме суппозитория вагинального, характеризующееся тем, что содержит в качестве активной субстанции метиндол (3,3'-дииндолилметан), липофильную основу, содержащую твердый кондитерский жир, поливинилпирролидон и бутилгидроксианизол при следующем содержании компонентов, мас.%:
| Метиндол | 2,0-6,0 |
| Поливинилпирролидон | 0,5-1,2 |
| Бутилгидроксианизол | |
| или бутилгидрокситолуол | 0,3-0,5 |
| Липофильная основа | остальное |
2. Средство по п.1, в котором в качестве липофильной основы содержится твердый жир тип «А».