Антитела против il-6, композиции, способы и применение
Иллюстрации
Показать всеИзобретение относится к биотехнологии и иммунологии. Предложены варианты химерных анти-IL-6-антител на основе мышиного антитела CLB-8, каждое из которых содержит константную область из одного или нескольких антител человека. Описаны варианты: нуклеиновых кислот, кодирующих анти-IL-6-антитело, векторов, клеток-хозяина. Раскрыт способ получения анти-IL-6-антитела с использованием нуклеиновой кислоты или вектора. Описаны варианты композиций для применения в способе модуляции злокачественного расстройства или расстройства иммунной системы, опосредуемого IL-6. Раскрыто применение анти-IL-6-антитела для лечения иммунологического расстройства или заболевания, опосредуемого IL-6, а также применение анти-IL-6-антитела для модуляции злокачественного расстройства или расстройства иммунной системы, опосредуемого IL-6. Использование вариантов химерного анти-IL-6-антитела, которое сохраняет высокую аффинность мышинного анти-IL-6-антитела при уменьшении иммуногенности, может найти применение в медицине для лечения заболеваний, опосредованных IL-6. 12 н. и 14 з.п. ф-лы, 16 ил., 3 табл.
Реферат
Предшествующий уровень техники
Область, к которой относится изобретение
Настоящее изобретение относится к антителам, включая их определенные части или варианты, специфичные по меньшей мере к одному белку интерлейкину-6 (IL-6, также называемому интерфероном β2) или к его фрагментам, а также к кислотам, кодирующим указанные антитела против IL-6, к комплементарным нуклеиновым кислотам, векторам, клеткам-хозяевам и к способам их получения и использования, включая терапевтические композиции, их введение и устройства для их введения.
Описание прототипов
Интерлейкин-6 (IL-6) представляет собой провоспалительный цитокин, который продуцируется многими клетками различных типов. Основными источниками IL-6 in vivo являются стимулированные моноциты, фибробласты и эндотелиальные клетки. Другие клетки, такие как макрофаги, Т- и В-лимфоциты, гранулоциты, кератиноциты, тучные клетки, остеобласты, хондроциты, глиальные клетки и клетки гладких мышц также продуцируют IL-6 после стимуляции (Kishimoto T., Blood 74:1-10 (1989) и Kurihara N. et al., J. Immunology 144:4226-4230 (1990)). Некоторые опухолевые клетки также продуцируют IL-6 (Smith P.C. et al., Cytokine and Growth Factor Reviews 12:33-40 (2001)), и недавно было показано, что IL-6 является прогностическим фактором, указывающим на прогрессирование рака предстательной железы (Nakashima J. et al. Clinical Cancer Research 6:2702-2706 (2000)). Продуцирование IL-6 может регулироваться самим IL-6 и зависит от типа клеток, причем IL-6 может стимулировать или ингибировать свой собственный синтез.
IL-6 может связываться с рецептором IL-6, экспрессируемым на активируемых митогеном В-клетках, Т-клетках, периферических моноцитах и некоторых опухолях (Ishimi Y. et al., Immunology 145:3297-3303 (1990)). Рецептор IL-6 имеет по меньшей мере две различные формы и состоит из альфа-цепи, называемой gp80, которая ответственна за связывание с IL-6, и из бета-цепи, называемой gp130, которая необходима для передачи сигнала (Adebanjo O. et al., Cell Biology 142:1347-1356 (1998) и Poli V. et al., EMBO 13:1189-1196 (1994)). Все цитокины семейства, которое включает в себя IL-6, LIF, онкостатин М, IL-11, CNTF и СТ-1, имеют рецепторы, содержащие субъединицу gp130. Кроме того, все члены семейства, к которому принадлежит цитокин IL-6, могут индуцировать экспрессию белков острой фазы в печени (Bellido T. et al., J. Clin. Investigation 97:431-437 (1996)).87908790.
Известны по меньшей мере две главные биологические функции IL-6: опосредование белков острой фазы и действие в качестве фактора дифференцировки и активации (Avvisti G. et al., Baillieres Clinical Hematology 8:815-829 (1995) и Poli V. et al., EMBO 13:1189-1196 (1994)). Известно, что белки острой фазы регулируют иммунные ответы, опосредуют воспалительные процессы и играют определенную роль в ремоделировании ткани. IL-6, в качестве фактора дифференцировки и активации, индуцирует дифференцировку В-клеток и секрецию антитела, индуцирует дифференцировку Т-клеток в цитотоксические Т-клетки, активирует факторы передачи клеточных сигналов и стимулирует гемопоэз (Ishimi Y. et al., J. Immunology 145:3297-3303 (1990)). Очевидно, что IL-6 участвует во многих важных функциях организма и в протекающих в нем процессах. В результате этого физиологические процессы, включая метаболизм в кости, опухолевую трансформацию и иммунные и воспалительные ответы, могут усиливаться, подавляться или предотвращаться путем модификации биологической активности IL-6 in vivo под действием антитела (Adebanjo O. et al., J. Cell Biology 142:1347-1356 (1998)).
Недавно проведенные исследования показали, что Mab против IL-6 может ингибировать in vivo рост опухолей предстательной железы (Smith P.C. & Keller E.T. The Prostate in press & Okatomo M. et al., Cancer Research 57:141-146 (1997) и карциномы почек (Weissglas M. et al., The Journal of Urology 153:554-557 (1995)). Помимо прямого влияния на рост опухоли, блокирование продуцирования IL-6 может быть также чувствительным к химическому воздействию и усиливать цитотоксическое действие (Smith P.C. et al. Cytokine and Growth Factor Reviews 12:33-40 (2001)). В целом, в литературе показано, что блокирование активности IL-6 может ингибировать деградацию кости, рост опухоли и кахексию при раке.
Пассивная иммунотерапия с использованием нечеловеческих поликлональных антител (например, антисыворотки) или моноклональных антитела (Mab) и их фрагментов (например, продуктов их протеолитического расщепления) является потенциальным терапевтическим средством, которое было разработано как средство для лечения различных заболеваний. Однако известно, что антитела, состоящие из фрагментов нечеловеческих антител, вырабатывают иммунный ответ при их введении человеку. Этот иммунный ответ часто не позволяет проводить повторное введение антитела в целях терапии и может приводить к опосредованному иммунным комплексом выведению этих антител из кровотока и тем самым к снижению терапевтического эффекта у пациентов. Примерами состояний, которые могут возникать в результате повторного введения антител, состоящих из фрагментов нечеловеческих антител, являются сывороточная болезнь и анафилаксия.
В попытке решить эти и другие проблемы было разработано несколько способов, включая получение химерных антител и "гуманизированных" антител для снижения иммуногенности антител/их фрагментов. Эти способы позволяют продуцировать антитела, имеющие пониженную иммуногенность. Указанные антитела в основном происходят от человеческих антител, и лишь их гипервариабельные области (определяющие комплементарность области, CDR) и некоторые каркасные остатки, которые влияют на конформацию CDR, не происходят от человеческих антител. Поэтому для иммунотерапии особенно подходящими являются новые человеческие или гуманизированные моноклональные антитела, используемые отдельно или в комбинации с уже существующими молекулами.
В соответствии с этим необходимо получить высокоаффинные, нейтрализующие химерные или человеческие антитела против IL-6 или их фрагментов, которые помогли бы решить многие из указанных проблем, а также необходимо получить улучшенные варианты известных антител или их фрагментов для их использования в целях предупреждения, лечения, ослабления или диагностики состояний, ассоциированных с IL-6.
Мышиные моноклональные антитела против IL-6, продуцируемые гибридомной клеточной линией, являются известными и описаны, например, в патенте США № 5618700. В патенте США № 5856135 описаны реконструированные человеческие антитела против человеческого IL-6, происходящие от мышиного моноклонального антитела SК2, в котором гипервариабельные области (CDR) из вариабельной области мышиного антитела SК2 были перенесены в вариабельную область человеческого антитела и присоединены к константной области человеческого антитела.
Нейтрализующие моноклональные антитела против IL-6 могут быть подразделены на две группы по их способности к распознаванию двух различных эпитопов на молекуле IL-6, называемых Сайтом I и Сайтом II. Сайт I представляет собой конформационный эпитоп, обозначенный gp130 и состоящий из амино-концевых и карбокси-концевых частей молекулы IL-6. Сайт II, обозначенный SIL6R, включает аминокислоты, играющие важную роль в данной активности (Brakenhoff et al., J. Immunol. (1990)(145:561)).
Мышиное моноклональное антитело против IL-6, называемое CLB-8, которое обладает высокой аффинностью и которое связывается с эпитопом gp130, т.е., сайтом I, является известным (Brakenhoff et al., см.выше). Однако, как описано выше, это мышиное антитело является в высокой степени иммуногенным для человека, а поэтому оно имеет ограниченное терапевтическое применение. Поэтому необходимость в получении антител против IL-6, которые обладали бы высокой аффинностью и желательным фармацевтическим профилем, остается актуальной.
Краткое описание изобретения
Настоящее изобретение относится к выделенным химерным гуманизированным и/или CDR-привитым антителам против IL-6, имеющим по меньшей мере одну антигенсвязывающую область, происходящую от высокоаффинного анти-IL-6-антитела CLB-8; а также к композициям анти-IL-6-антител; к кодирующим или комплементарным нуклеиновым кислотам; к векторам; к клеткам-хозяевам; к композициям; к лекарственным препаратам; к устройствам; к трансгенным животным; к трансгенным растениям; и к описанным здесь и воспроизводимым способам их получения и использования в комбинации с уже известным уровнем техники. Антитело согласно изобретению специфически и с высокой степенью аффинности нейтрализует человеческий IL-6.
Настоящее изобретение относится по меньшей мере к одному выделенному химерному гуманизированному или CDR-привитому анти-IL-6-антителу CLB-8 ("антителу cCLB-8"), описанному в настоящей заявке. Антитело cCLB-8 согласно изобретению включает любую белковую или пептидную молекулу, которая содержит по меньшей мере одну гипервариабельную область (CDR) тяжелой или легкой цепи или его лигандсвязывающую часть, происходящие от мышиного моноклонального антитела CLB-8, в комбинации с константной областью тяжелой или легкой цепи, с каркасной областью или с любой ее частью, которые могут быть включены в антитело согласно изобретению. В одном из вариантов настоящее изобретение относится к химерному антителу против IL-6, содержащему две легких и две тяжелых цепи, каждая из которых содержит по меньшей мере часть человеческой константной области и по меньшей мере часть вариабельной области (v), происходящей от мышиного моноклонального антитела cCLB-8, специфичного к человеческому IL-6, где указанное антитело связывается с высокой степенью аффинности с ингибирующим и/или нейтрализующим эпитопом человеческого IL-6, например такое как антитело cCLB-8. Настоящее изобретение также относится к фрагментам или к производному такого антитела, например к одному или нескольким частям цепи антитела, таким как константные, связывающие, дивергирующие или вариабельные области тяжелой цепи, или константные, связывающие или вариабельные области легкой цепи.
В одном из аспектов настоящее изобретение относится к выделенным молекулам нуклеиновой кислоты, содержащим полинуклеотид или комплементарный ему полинуклеотид, или гибридизующийся с ним полинуклеотид, кодирующий вышеупомянутые специфические антитела против IL-6, содержащие по меньшей мере одну конкретную последовательность, домен, часть или вариант. Настоящее изобретение также относится к рекомбинантным векторам, содержащим указанные молекулы нуклеиновой кислоты, кодирующие анти-IL-6-антитело, к клеткам-хозяевам, содержащим такие нуклеиновые кислоты и/или рекомбинантные векторы, а также к способам получения и/или использования указанных антителокодирующих нуклеиновых кислот, векторов и/или клеток-хозяев.
По крайней мере, одно антитело согласно изобретению связывается по меньшей мере с одним конкретным эпитопом, специфичным по меньшей мере к одному белку IL-6 или к его субъединице, фрагменту, части или любой их комбинации. По крайней мере, один эпитоп может содержать по меньшей мере одну антителосвязывающую область, которая включает по меньшей мере одну часть указанного белка, где указанный эпитоп, предпочтительно, состоит по меньшей мере из 1-5 аминокислот по меньшей мере одной его части, такой как, но не ограничивающейся ими, по меньшей мере один функциональный, внеклеточный, растворимый, гидрофильный, внешний или цитоплазматический домен указанного белка или любая его часть.
По крайней мере, одно указанное антитело может содержать по меньшей мере одну специфическую часть по меньшей мере одной гипервариабельной области (CDR)(например, CDR1, CDR2 или CDR3 вариабельной области тяжелой или легкой цепи), происходящей от мышиного моноклонального антитела CLB-8, и/или одной константной или вариабельной каркасной области или любой ее части. По крайней мере, одна аминокислотная последовательность антитела может кроме того, но необязательно, содержать по меньшей мере одну специфическую замену, инсерцию или делецию, описанные в настоящей заявке или известные специалистам.
Предпочтительными антителами согласно изобретению являются химерные, гуманизированные и/или CDR-привитые антитела, которые конкурентно ингибируют in vivo связывание человеческого IL-6 с мышиным анти-IL-6-антителом CLB-8, химерным анти-IL-6-антителом CLB-8 или антителом, обладающим, в основном, аналогичными связывающими свойствами, а также с фрагментами и областями.
Предпочтительными антителами согласно изобретению являются антитела, которые связываются с эпитопами, распознаваемыми CLB-8 и cCLB-8 и включенными в эпитоп gp130 Сайта 1. Описание предпочтительных методов определения специфичности моноклональных антител и аффинности посредством конкурентного ингибирования можно найти в работе Harlow et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1988), которая вводится в настоящее изобретение посредством ссылки.
Кроме того, настоящее изобретение относится по меньшей мере к одному анти-IL-6 анти-идиотипическому антителу, связанному по меньшей мере с одним анти-IL-6-антителом cCLB-8 согласно изобретению. Такое анти-идиотипическое антитело включает любую белок- или пептидсодержащую молекулу, которая содержит по меньшей мере часть иммуноглобулиновой молекулы, такой как, но не ограничивающейся ими, по меньшей мере одна гипервариабельная область (CDR) тяжелой или легкой цепи или ее лиганд-связывающая часть, вариабельная область тяжелой цепи или легкой цепи, константная область тяжелой цепи или легкой цепи, каркасная область или любая их часть, которые могут быть введены в анти-идиотипическое антитело против антитела согласно изобретению. Анти-идиотипическое антитело согласно изобретению может присутствовать у любого млекопитающего, либо оно может происходить от любого млекопитающего, такого как, но не ограничивающегося ими, человек, мышь, кролик, грызун, примат и т.п.
В одном из своих аспектов настоящее изобретение относится к выделенным молекулам нуклеиновой кислоты, содержащим полинуклеотид, комплементарный полинуклеотид или гибридизующийся с ним полинуклеотид, кодирующий по меньшей мере одно анти-идиотипическое антитело против IL-6, содержащее по меньшей мере одну специфическую последовательность, ее домен, часть или вариант. Настоящее изобретение также относится к рекомбинантным векторам, содержащим молекулы нуклеиновой кислоты, кодирующие антиидиотипическое антитело против IL-6, к клеткам-хозяевам, содержащим указанные нуклеиновые кислоты, и/или к рекомбинантным векторам, а также к способам получения и/или использования таких нуклеиновых кислот, кодирующих указанное антиидиотипическое антитело, к векторам и/или к клеткам-хозяевам.
Настоящее изобретение также относится по меньшей мере к одному способу экспрессии по меньшей мере одного вышеупомянутого анти-IL-6-антитела или анти-IL-6 антиидиотипического антитела в клетке-хозяине, предусматривающему культивирование описанной здесь клетки-хозяина в условиях, при которых по меньшей мере одно анти-IL-6-антитело экспрессируется в детектируемых и/или выделяемых количествах.
Настоящее изобретение также относится по меньшей мере к одной композиции, содержащей (а) выделенную нуклеиновую кислоту, кодирующую анти-IL-6-антитело cCLB-8 и/или описанное здесь антитело; и (b) подходящий носитель или разбавитель. Носитель или разбавитель может быть, но необязательно, фармацевтически приемлемым как и известные носители или разбавители. Кроме того, указанная композиция может содержать, но необязательно, по меньшей мере одно дополнительное соединение, белок или композицию.
Кроме того, настоящее изобретение относится по меньшей мере к способу получения по меньшей мере одного анти-IL-6-антитела cCLB-8 или к композиции, содержащей это антитело, для его введения в терапевтически эффективном количестве в целях облегчения или лечения по меньшей мере одного ассоциированного с IL-6 состояния в клетке, в органе, у животного или пациента, до и/или после возникновения данного состояния или при уже имеющемся состоянии, известном специалистам и/или описанным в настоящей заявке.
Настоящее изобретение также относится по меньшей мере к одной композиции, устройству и/или к способу доставки терапевтически или профилактически эффективного количества по меньшей мере одного анти-IL-6-антитела cCLB-8 согласно изобретению.
Кроме того, настоящее изобретение относится по меньшей мере к способу получения по меньшей мере одного анти-IL-6-антитела cCLB-8 или к композиции, содержащей это антитело, для диагностики по крайней мере одного ассоциированного с IL-6 состояния в клетке, в органе, у животного или пациента, до и/или после возникновения данного состояния или при уже имеющемся состоянии, известном специалистам и/или описанным в настоящей заявке.
Настоящее изобретение также относится по меньшей мере к одной композиции, устройству и/или способу диагностики с использованием по меньшей мере одного анти-IL-6-антитела согласно изобретению.
В одном из своих аспектов настоящее изобретение относится по меньшей мере к одному выделенному анти-IL-6-антителу cCLB-8 млекопитающего, содержащему по меньшей мере одну вариабельную область, включающую SEQ ID NO:7 или 8.
В другом своем аспекте настоящее изобретение относится по меньшей мере к одному выделенному анти-IL-6-антителу cCLB-8 млекопитающего, содержащему либо (i) все аминокислотные последовательности гипервариабельных областей (CDR) тяжелой цепи SEQ ID NO:1, 2 и 3, или (ii) все аминокислотные последовательности CDR легкой цепи SEQ ID NO:4, 5 и 6.
В другом своем аспекте настоящее изобретение относится по меньшей мере к одному выделенному анти-IL-6-антителу cCLB-8 млекопитающего, содержащему по меньшей мере одну CDR тяжелой или легкой цепи, имеющую аминокислотную последовательность по меньшей мере одной из SEQ ID NO:1, 2, 3, 4, 5 или 6.
В другом своем аспекте настоящее изобретение относится по меньшей мере к одному выделенному анти-IL-6-антителу cCLB-8 млекопитающего, содержащему по меньшей мере одну человеческую CDR, где указанное антитело специфически связывается по меньшей мере с одним эпитопом, включающим по меньшей мере 1-3 аминокислоты человеческого IL-6.
Кроме того, по меньшей мере одно антитело может, но необязательно, связываться с IL-6 с аффинностью (Кd), составляющей по меньшей мере 10-9 М, а предпочтительно по меньшей мере 10-10 М, и/или в значительной степени нейтрализовать по меньшей мере одну активность по меньшей мере одного белка IL-6. В предпочтительном варианте осуществления изобретения указанное антитело связывается с IL-6 с аффинностью (Кd), составляющей по меньшей мере 1×10-11 М, а предпочтительно, 5×10-10 М, и нейтрализует человеческий IL-6. Предпочтительно, чтобы указанное антитело не связывалось с другими членами суперсемейства IL-6 и блокировало передачу транс-сигнала GР130.
Настоящее изобретение также относится к выделенной нуклеиновой кислоте, кодирующей по меньшей мере одно выделенное анти-IL-6-антитело cCLB-8 млекопитающего; к выделенному нуклеиновокислотному вектору, содержащему выделенную нуклеиновую кислоту, и/или к прокариотической или эукариотической клетке-хозяину, содержащей указанную выделенную нуклеиновую кислоту. Указанной клеткой-хозяином может быть, но необязательно, по меньшей мере одна клетка, выбранная из клеток COS-1, COS-7, НЕК293, ВНК21, СНО, BSK-1, Нер G2, 653, SР2/0, 293, HeLa, клеток миеломы или лимфомы или любых дериватизированных, иммортализованных или трансформированных клеток. Настоящее изобретение также относится к способу продуцирования по меньшей мере одного анти-IL-6-антитела cCLB-8, предусматривающему трансляцию антителокодирующей нуклеиновой кислоты в условиях in vitro, in vivo или in situ, так чтобы указанное анти-IL-6-антитело экспрессировалось в детектируемых или выделяемых количествах.
Настоящее изобретение также относится к композиции, содержащей по меньшей мере одно выделенное химерное анти-IL-6-антитело cCLB-8 и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. Кроме того, указанная композиция может, но необязательно, содержать эффективное количество по меньшей мере одного соединения или белка, выбранного из группы, состоящей из детектируемой метки или репортера, антагониста TNF, противоревматического средства, миорелаксанта, наркотического средства, нестероидного противовоспалительного лекарственного средства (НСПВС), аналгетика, анестезирующего средства, седативного средства, местного анестезирующего средства, нейромышечного блокатора, противомикробного средства, средства против псориаза, кортикостероида, анаболического стероида, эритропоэтина, иммунизирующего средства, иммуноглобулина, иммунодепрессанта, гормона роста, гормонзаместительного лекарственного средства, радиофармацевтического препарата, антидепрессанта, антипсихотического средства, стимулятора, противоастматического средства, бета-агониста, стероида для ингаляции, эпинефрина или аналога цитотоксического или другого противоракового средства, антиметаболита, такого как метотрексат, антипролиферирующего средства, цитокина или антагониста цитокина.
Настоящее изобретение также относится к антиидиотипическому антителу или к его фрагменту, которые специфически связываются по меньшей мере с одним выделенным анти-IL-6-антителом cCLB-8 согласно изобретению.
Настоящее изобретение также относится к способу диагностики или лечения IL-6-ассоциированного состояния в клетке, в органе или у животного, где указанный способ предусматривает контактирование с указанной клеткой, тканью, органом или животным, либо введение в них композиции, содержащей эффективное количество по меньшей мере одного выделенного анти-IL-6-антитела cCLB-8 согласно изобретению. Кроме того, этот способ может, но необязательно, предусматривать использование эффективного количества 0,001-50 мг на килограмм клеток, ткани, органов или животного. Кроме того, указанный способ может, но необязательно, предусматривать контактирование или введение, осуществляемое по меньшей мере одним способом, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, интраабдоминального, внутрикапсулярного, внутрихрящевого, внутриполостного, внутрибрюшного, внутриможжечкового, интрацеребровентрикулярного, внутрикишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, внутрибрюшинного, интраплеврального, интрапростатического, внутрилегочного, интраректального, внутрипочечного, внутрисетчаточного, внутрипозвоночного, интрасиновиального, внутригрудного, внутриматочного, внутривезикулярного, болюсного, вагинального, ректального, трансбуккального, подъязычного, интраназального или чрескожного способов введения. Кроме того, этот способ может, но необязательно, предусматривать введение до, во время или после контактирования антитела по меньшей мере с одной композицией, или введения антитела по меньшей мере в одну композицию, содержащую эффективное количество по меньшей мере одного соединения или белка, выбранного из группы, состоящей из детектируемой метки или репортера, антагониста TNF, противоревматического средства, миорелаксанта, наркотического средства, нестероидного противовоспалительного лекарственного средства (НСПВС), аналгетика, анестезирующего средства, седативного средства, местного анестезирующего средства, нейромышечного блокатора, противомикробного средства, средства против псориаза, кортикостероида, анаболического стероида, эритропоэтина, иммунизирующего средства, иммуноглобулина, иммунодепрессанта, гормона роста, гормонзаместительного лекарственного средства, радиофармацевтического препарата, антидепрессанта, антипсихотического средства, стимулятора, противоастматического средства, бета-агониста, стероида для ингаляции, эпинефрина или аналога цитотоксического или другого противоракового средства, антиметаболита, такого как метотрексат, антипролиферирующего средства, цитокина или антагониста цитокина.
Настоящее изобретение также относится к медицинскому устройству, содержащему по меньшей мере одно выделенное анти-IL-6-антитело согласно изобретению, происходящее от млекопитающего, где указанное устройство является подходящим для контактирования или введения по меньшей мере одного анти-IL-6-антитела по меньшей мере одним способом, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, интраабдоминального, внутрикапсулярного, внутрихрящевого, внутриполостного, внутрибрюшного, внутриможжечкового, интрацеребровентрикулярного, внутрикишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, внутрибрюшинного, интраплеврального, интрапростатического, внутрилегочного, интраректального, внутрипочечного, внутрисетчаточного, внутрипозвоночного, интрасиновиального, внутригрудного, внутриматочного, внутривезикулярного, болюсного, вагинального, ректального, трансбуккального, подъязычного, интраназального или чрескожного введения.
Настоящее изобретение также относится к промышленному изделию, предназначенному для введения человеку в фармацевтических или диагностических целях и содержащему упаковочный материал и контейнер, включающий раствор или лиофилизованную форму по меньшей мере одного выделенного анти-IL-6-антитела согласно изобретению, происходящего от млекопитающего. Такое промышленное изделие может, но необязательно, содержаться в контейнере в качестве компонента устройства или системы для доставки парентеральным, подкожным, внутримышечным, внутривенным, внутрисуставным, внутрибронхиальным, интраабдоминальным, внутрикапсулярным, внутрихрящевым, внутриполостным, внутрибрюшным, внутриможжечковым, интрацеребровентрикулярным, внутрикишечным, интрацервикальным, внутрижелудочным, внутрипеченочным, интрамиокардиальным, внутрикостным, внутритазовым, интраперикардиальным, внутрибрюшинным, интраплевральным, интрапростатическым, внутрилегочным, интраректальным, внутрипочечным, внутрисетчаточным, внутрипозвоночным, интрасиновиальным, внутригрудным, внутриматочным, внутривезикулярным, болюсным, вагинальным, ректальным, трансбуккальным, подъязычным, интраназальным или чрескожным способом введения.
Настоящее изобретение также относится к способу получения по меньшей мере одного выделенного анти-IL-6-антитела согласно изобретению, предусматривающему продуцирование клетки-хозяина, трансгенного животного, трансгенного растения или клетки растения, способных экспрессировать выделяемое количество указанного антитела. Кроме того, настоящее изобретение относится по меньшей мере к одному анти-IL-6-антителу, продуцированному вышеуказанным способом.
Кроме того, настоящее изобретение относится к любому описанному здесь изобретению.
Описание чертежей
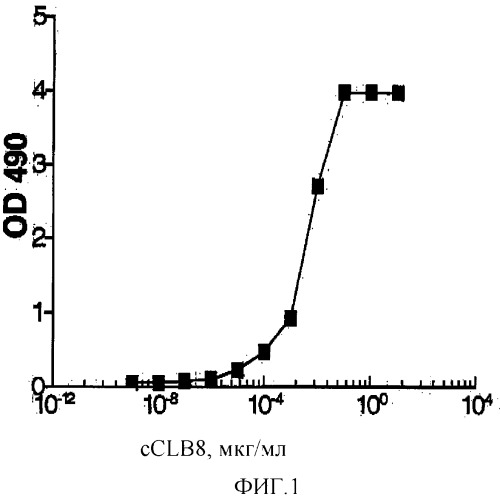
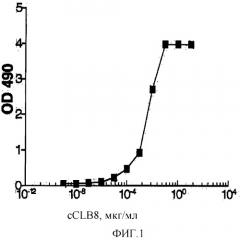
Фигура 1: График, иллюстрирующий связывание cCLB-8 с человеческим рекомбинантным IL-6.
Фигура 2: График, иллюстрирующий ингибирование IL-6-опосредованной секреции мышиного IgM из клеток SКW6.4 под действием cCLB-8.
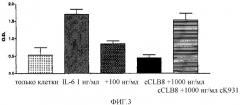
Фигура 3: График, иллюстрирующий ингибирование IL-6-опосредованного продуцирования МСР-1 под действием cCLB-8.
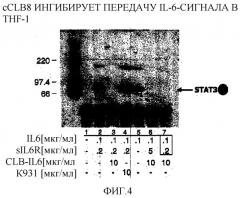
Фигура 4: Фотография Вестерн-блота, иллюстрирующая cCLB-8-ингибирование передачи сигнала IL-6 в человеческих моноцитах лейкоза ТНР-1.
Фигура 5: График, иллюстрирующий cCLB8-ингибирование IL-6-индуцированного продуцирования сывороточного амилоида А из клеток НерG2.
Фигура 6: График, иллюстрирующий способность cCLB-8 нейтрализовать rhIL-6-индуцированную пролиферацию клеток.
Фигура 7: График, иллюстрирующий относительное снижение потери массы тела организмом-хозяином, то есть мышью, несущей человеческую опухоль и обработанной античеловеческим и антимышиным антителами против IL-6.
Фигура 8А-G: График, иллюстрирующий исследуемые профили ингибирования сывороточных уровней для 7 антиидиотипических антител.
Фигура 9: График, иллюстрирующий ингибирование связывания cCLB-8 с человеческим IL-6 под действием антиидиотипических (анти-Id) Mab.
Фигура 10: График, иллюстрирующий ингибирование связывания анти-Id антитела с антителом cCLB-8, предварительно связанным с человеческим IL-6.
Подробное описание изобретения
Настоящее изобретение относится к выделенным рекомбинантным и/или синтетическим, химерным, гуманизированным или CDR-привитым анти-IL-6-антителам, имеющим по меньшей мере одну антигенсвязывающую область, происходящую от антитела CLB-8 и антиидиотипических антител против анти-IL-6-антител, а также к композициям и к кодирующим нуклеиновым кислотам, содержащим по меньшей мере один полинуклеотид, кодирующий такое анти-IL-6-антитело или антиидиотипическое антитело. Настоящее изобретение также включает, но не ограничивается ими, способы получения и использования нуклеиновых кислот, антител и антиидиотипических антител; а также диагностические и терапевтические композиции, способы и устройства.
Используемый здесь термин "антитело CLB-8 против интерлейкина-6", "анти-IL-6-антитело CLB-8", "часть анти-IL-6-антитела CLB-8" или "фрагмент анти-IL-6-антитела CLB-8" и/или "вариант антитела анти-IL-6-антитела CLB-8" и т.п. означает любую белок- или пептидсодержащую молекулу, которая включает по меньшей мере часть молекулы иммуноглобулина, содержащую по меньшей мере одну гипервариабельную область (CDR) тяжелой или легкой цепи или ее лигандсвязывающую часть, происходящую от мышиного моноклонального антитела CLB-8 в комбинации с вариабельной областью тяжелой цепи или легкой цепи, с константной областью тяжелой цепи или легкой цепи, с каркасной областью или любой их частью, которые могут быть включены в антитело согласно изобретению. Такое антитело, кроме того, но необязательно, взаимодействует со специфическим лигандом, таким способом, но не ограничивающимся им, в результате которого указанное антитело модулирует, снижает, увеличивает, подавляет, стимулирует, уменьшает, ослабляет, блокирует, ингибирует, отменяет и/или предотвращает по меньшей мере одну активность или связывание IL-6, либо активность или связывание рецептора IL-6 in vitro, in situ и/или in vivo. В качестве неограничивающего примера могут служить подходящее анти-IL-6-антитело согласно изобретению или его определенная часть, или вариант, которые могут связываться с высокой степенью аффинности с ингибирующим и/или нейтрализующим эпитопом человеческого IL-6. Подходящее анти-IL-6-антитело, его определенная часть или вариант могут также, но необязательно, влиять по меньшей мере на одну активность или функцию IL-6, такие как, но не ограничивающиеся ими, синтез РНК, ДНК или белка, высвобождение IL-6, передача сигнала рецептором IL-6, расщепление мембранного IL-6, активность IL-6, продуцирование и/или синтез IL-6.
Термин "антитело", кроме того, охватывает антитела, фрагменты их расщепления, определенные части и варианты, включая антитела-миметики или антитела, содержащие части антител, которые имитируют структуру и/или функцию антитела или его определенного фрагмента или определенной части, включая одноцепочечные антитела и их фрагменты, каждый из которых содержит по меньшей мере одну CDR, происходящую от моноклонального антитела CLB-8. Функциональными фрагментами являются антигенсвязывающие фрагменты, которые связываются с IL-6 млекопитающего. Так, например, фрагментами антител, способными связываться с IL-6 или с его частями, являются, но не ограничиваются ими, следующие фрагменты: Fab (например, образующийся в результате гидролиза папаином), Fab' (например, образующийся в результате гидролиза пепсином и частичного восстановления) и F(ab')2 (например, образующийся в результате гидролиза пепсином), facb (например, образующийся в результате гидролиза плазмином), pFc' (например, образующийся в результате гидролиза пепсином или плазмином), Fd (например, образующийся в результате гидролиза пепсином, частичного восстановления и реагрегации), Fv или scFv (например, полученные методами молекулярной биологии), которые входят в объем согласно изобретению (см. выше, например, Colligan, Immunology).
Такие фрагменты могут быть продуцированы методом ферментативного расщепления, методом синтеза или рекомбинантными методами, известными специалистам и/или описанными в настоящей заявке. Антитела могут быть также продуцированы в виде различных усеченных форм с использованием генов для антител, в которых один или несколько стоп-кодонов были введены в область, расположенную слева (по ходу транскрипции) от природного сайта терминации. Так, например, для встраивания ДНК-последовательностей, кодирующих СН1-домен и/или шарнирную область тяжелой цепи, был сконструирован комбинированный ген, кодирующий F(ab')2-фрагмент тяжелой цепи. Различные фрагменты антител могут быть связаны друг с другом стандартными химическими методами либо они могут быть получены в виде непрерывной белковой последовательности методами генной инженерии.
В соответствии с настоящим изобретением получают химерные или гуманизированные антитела, в которых CDR происходят от мышиного антитела CLB-8, способного связываться с человеческим IL-6 и по меньшей мере с его частью, а остальная часть антитела происходит от одного или нескольких человеческих антител. Таким образом, человеческая часть антитела может включать каркасную область, СL,СН-домены (например, СН1, СН2, СН3), шарнирную область, области VL, VН, которые являются, в основном, неиммуногенными для человека. Используемые здесь термины "химерные" антитела или "гуманизированные" антитела или "CDR-привитые" антитела означают любую комбинацию вышеописанных мышиных CDR с одним или несколькими белками или пептидами, происходящими от человеческого антитела. Области указанного антитела, происходящие от человеческих антител необязательно должны быть на 100% идентичны человеческим антителам. В предпочтительном варианте осуществления изобретения желательно, чтобы многие аминокислотные остатки человеческих антител были, по возможности, сохранены для снижения иммуногенности, но при этом человеческие остатки могут быть, если это необходимо, модифицированы так, чтобы был сохранен антигенсвязывающий сайт, образованный CDR, и в то же самое время была максимизирована "гуманизация" данного антитела. Такие изменения или модификации, необязательно и предпочтительно, сохраняют или снижают иммуногенность данного антитела у человека или у животных других видов, имеющих антитела, родственные немодифицированным антителам. Следует отметить, что гуманизированное антитело может быть продуцировано животным, не относящимся к человеку, либо прокариотическими или эукариотическими клетками, способными экспрессировать функционально перегруппированные гены человеческого иммуноглобулина (например, тяжелой цепи и/или легкой цепи). Кроме того, если указанное антитело является одноцепочечным антителом, то оно может содержать линкерный пептид, не обнаруживаемый в природных человеческих антителах. Так, например, Fv может содержать линкерный пептид, например, имеющий примерно от 2 до 8 глициновых остатков или других аминокислотных остатков, которые соединяют вариабельную область тяжелой цепи и вариабельную область легкой цепи. Предусматривается, что такие линкерные пептиды имеют человеческое происхождение.
Могут быть также использованы биспецифические, гетероспецифические, гетероконъюгированные или аналогичные им антитела, которые представляют собой моноклональные гуманизированные антитела, специфически связывающиеся по меньшей мере с двумя различными антигенами. В данном случае одной из специфичностей связывания является специфичность связывания по меньшей мере с одним белком IL-6, а другой специфичностью является специфичность связывания с любым другим антигеном. Методы получения биспецифических антител известны специалистам. Традиционный метод рекомбинантного продуцирования биспецифических антител основан на коэкспрессии двух пар "тяжелая цепь-легкая цепь" иммуноглобулина, где указанные две тяжелые цепи обладают различными специфичностями (Milstein & Cuello, Nature 305:537 (1983)). В результате случайной реаранжировки тяжелых и легких цепей иммуноглобулина эти гибридомы (квадромы) продуцируют смесь из 10 возможных различных молекул антитела, из которых только одна имеет правильную биспецифическую структуру. Очистка такой "правильной" молекулы, которую обычно осуществляют путем проведения постадийной аффинной хроматографии, является достаточно трудоемким процессом, и выходы продукта являются низкими. Аналогичные процедуры описаны, например,