Способ получения покрытий и пленок с применением органо-неорганических нанокомпозитных материалов на основе пленкообразующих органических полимеров, привитых олигосилоксановыми цепями
Иллюстрации
Показать всеСпособ получения покрытий на поверхности стекла, пластика и свободных пленок, обладающих повышенной поверхностной плотностью функциональных групп до 900 нм2, предусматривает нанесение на поверхности органо-неорганического нанокомпозитного материала на основе композиции, содержащей раствор пленкообразующих органических полимеров с привитыми олигосилоксановыми цепями и алкоксисиланы и/или полимеры, содержащие аминные, гидразидные, эпоксидные или карбоксильные функциональные группы, с последующей сушкой нанесенной на поверхность органо-неорганической композиции. Данные материалы могут быть использованы для конструирования био- и химических сенсоров, прежде всего в области генной диагностики, получения генных библиотек, проведения цепной полимеразной реакции на иммобилизованных нуклеиновых кислотах, в качестве носителей в нуклеотидном синтезе. 6 з.п. ф-лы, 2 табл., 6 ил.
Реферат
Область, к которой относится изобретение
Изобретение относится к способу получения покрытий на различных материалах (стекло, кремний, пластики) и свободных пленок, обладающих повышенной поверхностной плотностью функциональных групп (амино-, эпокси-, гидразино-, карбокси- и др.). Данные материалы могут быть использованы для конструирования био- и химических сенсоров, прежде всего в области генной диагностики, получения генных библиотек, проведения цепной полимеразной реакции (ПЦР) на иммобилизованных нуклеиновых кислотах, в качестве носителей в нуклеотидном синтезе.
Известный уровень техники
Иммобилизация олигонуклеотидов на различных поверхностях получила широкое распространение в методах генетической диагностики, основанных на реакции гибридизации (избирательное взаимодействие комплементарных участков нуклеиновых кислот). Данная реакция используется как завершающая стадия диагностических методик, так и для первичного выделения искомых нуклеотидных последовательностей с целью их дальнейшего использования, например, в ПЦР (патенты РФ №№ 2229118, 2198221, 2143004, 2206575, 2213974, 2236467). Иммобилизация олигонуклеотидов обычно осуществляется путем ковалентной прививки к функциональным группам на поверхности материала. В настоящий момент хорошо отработаны и коммерчески реализованы методы прививки к амино- и эпоксидным группам, также возможно использование гидразидных, карбоксильных, сульфгидрильных групп.
Наиболее простым и широко распространенным способом получения функционализированных поверхностей является обработка стекла органосилоксанами или другими реагентами, содержащими соответствующие функциональные группы (патенты США №№ 5077210, 5474796, 6689473; заявка США 20020076709; европейские патенты WO2005003391, WO01/14425; Strother T., Hamers R.J. and Smith L.M. Nucleic Acids Research, 2000, 28(18), 3535; Naoki Kimura, Ryuichi Oda, Yoshiaki Inaki and Osamu Suzuki Nucleic Acids Research, 2004, 32(7), e68; Fixe F., Dufva M., Telleman P. and Christensen C.B. V. Nucleic Acids Research, 2004, 32(1), e9; Ivanova E.P., Papiernik M., Oliveira A., Sbarski I., Smekal T., Grodzinski P. and Nicolau D. V. Smart Mater. Struct., 2002, 11 783]. Конечные покрытия имеют низкую плотность целевых групп, причем их расположение на ровной поверхности создает стерические препятствия для реакции гибридизации. Например, по данным [Levicky R., Herne T. H., Tarlov M.J., Satija S.K. J. Am. Chem. Soc., 1998, 120, 9787] размер 25-мерной двухцепочечной ДНК на подложке составляет ˜7 нм, что можно считать минимальной дистанцией между иммобилизованными олигонуклеотидами. Предельная плотность для плоской поверхности в этом случае составляет 0,2 пмоль/мм2. Подобное низкое содержание олигонуклеотидов на плоских поверхностях требует использования сложной и дорогой аппаратуры для детектирования реакции гибридизации, а также существенно понижает потенциал данных систем в качестве носителей для твердофазного нуклеотидного синтеза и ПЦР.
В этой связи предпринимаются значительные усилия для повышения эффективной плотности функциональных групп на поверхности, причем можно отметить несколько подходов к решению указанной проблемы. Предлагается покрывать модифицируемую поверхность гидрофильным полимером, образующим слой гидрогеля [Afanassiev V., Hanemann V., Wolfl S., Nucl.Acids Res., 2000, 28, e66; Timofeev E.N., Kochetkova S.V., Mirzabekov A.D., Florentiev V.L., Nucl.Acids Res., 1996, 24, 3142; Yershov G., Barsky V., Belgovskiy A., Kirillov Eu., Kreindlin E., Ivanov I., Parinov S., Guschin D., Drobishev A., Dubiley S., Mirzabekov A., Proc. Natl. Acad. Sci. USA, 1996, 93, 4913; Vasiliskov V., Timofeev E., Surzhikov S., Drobyshev A., Shick V., Mirzabekov A., BioTechniques, 1999, 27, 592; Consolandi C., Castiglioni B., Bordoni R., Busti E., Battaglia C., Bernardi L.R., De Bellis G., Nucleosides, Nucleotides, Nucleic Acids, 2002, 21, 561; Lee P. H., Sawan S.P., Modurson Z., Amold L.J., Reynolds M.A., Bioconjugate Chemistry, 2002, 13, 97] с последующей прививкой олигонуклеотидов к функциональным группам полимеров. Несмотря на значительное (до 100 пмол/мм2) увеличение плотности иммобилизации за счет расположения целевых групп в трехмерной структуре геля, ценность данных систем снижается из-за диффузионных затруднений при проникновении макромолекул нуклеиновых кислот в гель. Кроме того, свойства гидрогелевого покрытия существенно зависят от температуры, влажности, ионной силы, присутствия органических растворителей, что может привести к различным, часто непредсказуемым, осложнениям при гибридизации и нуклеотидном синтезе.
С другой стороны, в течение нескольких десятилетий широко известны и активно используются пористые носители для твердофазного, в том числе и нуклеотидного, синтеза. Как правило, это высокопористые силикагели или трехмерные органические полимеры с иммобилизованными аминными или другими функциональными группами. Ряд работ посвящен созданию аналогичных структур на поверхности стекла и других материалов. Например, предлагается наносить пористый органический полимерный носитель (размер частиц 1-100 мкм) на различные подложки (патент США № 6133436). К недостаткам данного подхода можно отнести сложную, многостадийную методику связывания микросфер носителя с подложкой, включающую отдельные стадии активации подложки, микросфер и собственно прививку. Учитывая достаточно высокую собственную стоимость микросферических функционализированных пористых носителей, стоимость получаемых изделий должна быть весьма высокой. В то же время связывание частиц с подложкой происходит за счет образования амидных связей между поверхностными карбоксильными группами и аминогруппами модифицированной подложки, при этом никакого связывания соседних микросфер между собой не предусматривается. Учитывая значительный размер микросфер (более 1 мкм), трудно ожидать достаточной механической прочности такого покрытия. Действительно, авторы указывают на необходимость бережного обращения с микросферическими покрытиями, что свидетельствует об их невысокой механической стабильности. Также рассматриваемая технология не позволяет получать прозрачные покрытия, необходимые для распространенных в биочиповых технологиях оптических методов регистрации результатов гибридизации.
Более перспективными представляются подходы, основанные на формировании трехмерных пористых и "холмистых" структур непосредственно на поверхности носителя. Значительное количество работ (US. Pat. Appl. 20030072951, US Pat. 4378250, 6916541; Eur. Pat. WO00/61282, Eur. Pat. Appl. WO2004099776, WO2004024955) посвящено проведению золь-гель реакции различных алкоксисиланов на поверхности стекла. При этом получают либо сильно развитую поверхность, которую функционализируют на следующей стадии, либо, используя алкоксисиланы с нужными функциональными группами (например, аминопропилтриэтоксисилан), сразу получают необходимое покрытие. Существенным ограничением данных методов является их применимость только к стеклянным или кремниевым подложкам, содержащим на поверхности силанольные группы, необходимые для прочного связывания с продуктами золь-гель реакции, которые сами по себе механически непрочны и хрупки. В то же время многие методики и оборудование в генетических и других молекулярно-биологических методах исследования рассчитаны на использование пластиковых поверхностей (полистирольные планшеты, пробирки для ПЦР).
Наиболее близкой к предлагаемому изобретению с точки зрения морфологии конечного покрытия является работа (Lam Dai Tran, Benoit Piro, Minh Chau Phama, Trung Ledoan Chiara Angiari, Le H. Daoc, Franck Teston Synthetic Metals, 2003, 139, 251), посвященная получению слоя политирамина путем электрополимеризации 4-гидроксифенилэтиламина. Авторами получены "холмистые" покрытия с неоднородностями размером менее 500 нм. Увеличение реальной площади поверхности за счет неоднородного рельефа позволило добиться плотности иммобилизации олигонуклеотидов в 5-8 пмоль/мм2. Недостатком данного подхода является сложность и дороговизна методики, требующая предварительной графитизации или платинирования подложки, а также непрозрачность конечного покрытия.
Следует отметить, что известные способы посвящены модификации готовых поверхностей, при этом возможность функционализации пленок и пластиков непосредственно в процессе их формирования не рассматривалась, что связано с низкой собственной механической прочностью покрытий, получаемых по известным методам.
Сущность изобретения
Задачей настоящего изобретения является разработка универсального подхода к созданию покрытий для различных материалов (стекло, металлы, пластики) и свободных пленок, обладающих высокой поверхностной плотностью функциональных групп за счет нанорельефного характера поверхности. Для получения покрытий и свободных пленок возможно использование высокотехнологичных методов полива. Полученные при осуществлении изобретения новые материалы могут быть использованы в гибридизационных методах генной диагностики.
Изобретение относится к способу получения покрытий на поверхности стекла и пластика, а также свободных пленок с повышенной поверхностной плотностью функциональных групп (до 900 нм-2) для конструирования био- и химических сенсоров, прежде всего в области генной диагностики, получения генных библиотек, проведения цепной полимеразной реакции на иммобилизованных нуклеиновых кислотах, в качестве носителей в нуклеотидном синтезе, в котором используют органо-неорганические нанокомпозитные материалы на основе пленкообразующих органических полимеров, привитых олигосилоксановыми цепями.
Способ включает применение раствора органического полимера (или смеси полимеров) с привитыми олигосилоксановыми цепями, способного образовывать пленки и покрытия с "холмистым" нанорельефом, обеспечивающим увеличение эффективной площади поверхности.
В качестве органических полимеров используют полимеры с функциональными группами, способными взаимодействовать с алкоксисиланами или продуктами их гидролиза: гидроксильные, ацетальные, эпоксидные, винилоксидные группы. Возможно использование ряда коммерческих полимеров: сополимеры винилацетата и винилового спирта; полиацетали (повинилформаль, поливинилбутираль, поливинилоктиналь); этилцеллюлоза и другие неполные эфиры целлюлозы, например ацетаты; полиэтиленгликоль, полипропиленгликоль; а также специально синтезированные полимеры и сополимеры на основе винилового спирта, гидроксиэтилметакрилата, аллилглицидилового эфира, виниловых эфиров этиленгликоля и других полигидроксилсодержащих соединений.
Прививку олигосилоксановых цепей осуществляют путем неполного гидролиза алкоксисиланов в присутствии органических полимеров, описанных выше. В качестве алкоксисиланов используются тетраэтоксисилан, тетраметоксисилан, алкилэтоксисиланы, например метилтриэтоксисилан или октилтриэтоксисилан.
Для получения функционализированных покрытий и пленок в органо-неорганическую композицию вводят алкоксисиланы и/или специальные полимеры, содержащие целевые функциональные группы и группы, способные обеспечить связывание данных полимеров с органо-неорганической композицией.
В качестве функциональных алкоксисиланов используют аминопропилтриэтоксисилан, аминопропилметилдиэтоксисилан, 3-глицидоксипропилтриметоксисилана и другие описанные в литературе.
В качестве функционализирующих полимеров используют продукты конденсации поливиниламина или полиаллиламина с аллилглицидиловым эфиром; сополимеры виниламина, аллиламина или винилового эфира моноэтаноламина с дивиниловыми эфирами (дивиниловый эфир диэтиленгликоля и аналогичные соединения) - для введения аминогрупп; полиаллилглицидиловый эфир; поливинилглицидиловый эфир этиленгликоля; сополимеры аллилглицидилового эфира или винилглицидилового эфира этиленгликоля с дивиниловыми эфирами - для введения эпоксигрупп; сополимеры акриловой, метакриловой, малеиновой кислоты или малеинового ангидрида с винилацетатом или дивиниловыми эфирами; сополимеры малеинового ангидрида с аллилглицидиловым эфиром или винилглицидиловым эфиром этиленгликоля - для введения карбоксильных групп; полимеры эфиров акриловой, метакриловой или малеиновой кислот и их сополимеры с винилацетатом, дивиниловыми эфирами, аллилглицидиловым эфиром или винилглицидиловым эфиром этиленгликоля с последующей обработкой покрытий или пленок водным раствором гидразина - для введения гидразидных групп.
Краткое описание чертежей
Фиг.1 показывает ИК-Фурье спектр исходной смеси ПВА-АГЭ и продукта их реакции. Спектр получен от пленки на ZnSe подложке.
Фиг.2 показывает данные сканирующей электронной микроскопии композиционных покрытий: покрытие на полистироле (1), на стекле (2) и свободная пленка (3).
Фиг.3 показывает ИК-Фурье спектры этилцеллюлозы (1), пленки из композиции этилцеллюлоза-ТЭОС (2) и эпоксисодержащей пленки (3).
Фиг.4 показывает ИК-Фурье спектры пленки из Примера 6 (1) и фминосодержащей пленки (2).
Фиг.5 показывает электрофореграмму продуктов амплификации фрагмента гена белка SIT (720 п.н.) Synedra acus.
Фиг.6 показывает одноцепочечную ДНК фрагмента гена белка SIT (720 н.) Synedra acus, загибридизованную на модифицированной поверхности. Денатурирующий ПААГ, серебряное окрашивание.
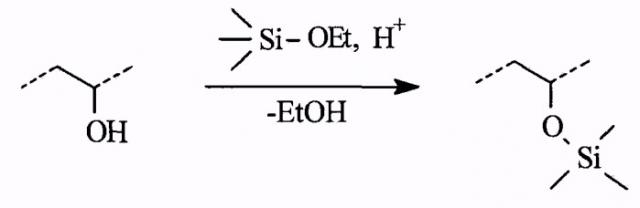
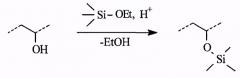
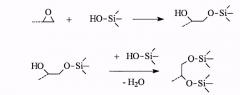
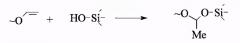
Настоящее изобретение предусматривает получение органо-неорганической композиции, представляющей собой раствор органического полимера (или смеси полимеров) с привитыми олигосилоксановыми цепями. Синтез композиции осуществляется проведением реакций кислотно-катализируемого гидролиза и конденсации алкоксисиланов в присутствии органических полимеров, содержащих функциональные группы, способные реагировать с алкоксисиланами или продуктами их гидролиза, например:
гидроксильная группа:
ацетальная:
эпоксидная:
винилоксидная:
В качестве алкоксисиланов используются тетраэтоксисилан, тетраметоксисилан, алкилэтоксисиланы, например метилтриэтоксисилан или октилтриэтоксисилан. В качестве органического пленкообразующего полимера возможно использование ряда коммерческих полимеров: сополимеры винилацетата и винилового спирта; полиацетали (поливинилформаль, поливинилбутираль, поливинилоктиналь); этилцеллюлоза (Ethocel, © Dow Chemical Company) и другие неполные эфиры целлюлозы, например ацетаты; полиэтиленгликоль, полипропиленгликоль; а также специально синтезированные полимеры и сополимеры на основе винилового спирта, гидроксиэтилметакрилата, аллилглицидилового эфира, виниловых эфиров этиленгликоля и других полигидроксилсодержащих соединений.
Путем подбора условий проведения реакции (соотношение алкоксисилан/полимер, природа растворителя, содержание воды и кислотного катализатора, температура и продолжительность реакции) достигается получение целевых растворов привитых олигосилоксанов, стабильных в течение не менее 7 суток, после чего возможно желирование за счет дальнейшей конденсации силанольных групп в олигосилоксановых фрагментах. Из данных растворов методом полива возможно получение пленочных покрытий на различных поверхностях (стекло, пластики, металл) или свободных пленок при поливе на тефлон или полиэтилен. Существенной особенностью данных покрытий и пленок является наноструктурированная, "холмистая" структура их поверхности (Пример 9), обусловленная конденсацией олигосилоксановых фрагментов и микрофазовым разделением системы в процессе сушки. Наличие в композициях значительных количеств органических полимеров (более 30%), цепи которых сшиты полисилоксановыми наночастицами, обеспечивает достаточную механическую прочность покрытий и пленок.
Получение функционализированных покрытий и свободных пленок на основе рассматриваемых органо-неорганических композиций может осуществляться введением алкоксисиланов и/или специальных полимеров, содержащих соответствующие функциональные группы. В качестве алкоксисиланов возможно использование аминопропилтриэтоксисилана, аминопропилметилдиэтоксисилана, 3-глицидоксипропилтриметоксисилана и других, например, описанных в [патент США № 4378250]. Специальные полимеры, добавляемые для функционализации покрытий, содержат, помимо целевых групп, звенья, способные к связыванию с полисилоксановыми фрагментами органо-неорганической композиции. Некоторые целевые функциональные группы могут играть также роль связывающих, например эпоксигруппы. В качестве функционализирующих полимеров предлагается использовать:
- для введения аминогрупп: продукты конденсации поливиниламина или полиаллиламина с аллилглицидиловым эфиром; сополимеры виниламина, аллиламина или винилового эфира моноэтаноламина с дивиниловыми эфирами (дивиниловый эфир диэтиленгликоля и аналогичные соединения);
- для введения эпоксигрупп: полиаллилглицидиловый эфир; поливинилглицидиловый эфир этиленгликоля; сополимеры аллилглицидилового эфира или винилглицидилового эфира этиленгликоля с дивиниловыми эфирами;
- для введения карбоксильных групп: сополимеры акриловой, метакриловой, малеиновой кислоты или малеинового ангидрида с винилацетатом или дивиниловыми эфирами; сополимеры малеинового ангидрида с аллилглицидиловым эфиром или винилглицидиловым эфиром этиленгликоля;
- для введения гидразидных групп: сополимеры эфиров акриловой, метакриловой или малеиновой кислот с винилацетатом, дивиниловыми эфирами, аллилглицидиловым эфиром или винилглицидиловым эфиром этиленгликоля с последующей обработкой покрытий или пленок водным раствором гидразина.
Добавление функционализирующих компонентов возможно как на стадии синтеза органо-неорганической композиции, так и непосредственно перед ее поливом на поверхность. Получаемые по предлагаемому методу покрытия и пленки обладают высокой поверхностной плотностью целевых групп: до 900 нм-2 в случае аминогрупп и до 300 нм-2 для других групп, что обусловлено нанорельефной, "холмистой" структурой поверхности и расположением функциональных групп на полимерных цепях.
Наилучшие методы выполнения изобретения для функционализированных покрытий представлены в Примерах 1-14. Примеры 15-18 посвящены иммобилизации олигонуклеотидов на модифицированных микробиологических планшетах и их использованию в реакции гибридизации.
Пример 1
Синтез привитого сополимера этилцеллюлозы и тетраэтоксисилана (ТЭОС)
Для синтеза пленкообразующей композиции использована этилцеллюлоза производства The Dow Chemical Company, представляющая собой целлюлозу, в которой часть гидроксильных групп превращена в этоксильные. 0,3 г этилцеллюлозы марки ETHOCEL Std. 20 (содержание O-Et - 48,0-49,5%), растворяли в 5 г этилового спирта (азеотропная смесь, содержащая 4% воды). При перемешивании добавляли 0,3 г тетраэтоксисилана и 0,005 г концентрированной соляной кислоты. Перемешивали на магнитной мешалке при кипячении в течение 2 ч, после чего раствор охлаждали при перемешивании. Аналогичным образом проводили реакцию с другими марками этилцеллюлозы (ETHOCEL Std. 7, 45, 100, ETHOCEL HE 350).
Пример 2
Синтез привитого сополимера поливинилбутираля, тетраэтоксисилана (ТЭОС) и аминопропилтриэтоксисилана
0,216 г поливинилбутираля, содержащего 18 и 2 мас.% остаточных спиртовых и ацетатных звеньев соответственно (Aldrich, #19,097-7), растворяли в 2,96 г этанола, (азеотропная смесь, 4% воды) и смешивали с 0,395 г тетраэтоксисилана и 0,108 г аминопропилтриэтоксисилана. К полученному раствору добавляли 0,1184 г воды и 0,01 г концентрированной соляной кислоты, а также 3 мл n-пентанола. Перемешивали на магнитной мешалке при кипячении в течение 2 ч. Композицию охлаждали при перемешивании.
Пример 3
Синтез привитого сополимера поливинилбутираля, тетраэтоксисилана (ТЭОС) и аминопропилтриэтоксисилана
0,373 г поливинилбутираля, содержащего 18 и 2 мас.% остаточных спиртовых и ацетатных звеньев соответственно (Aldrich, #19,097-7), растворяли в 5,221 г этанола, (азеотропная смесь, 4% воды ), смешивали с 0,279 г тетраэтоксисилана, 0,093 г аминопропилтриэтоксисилана и 0,01 г концентрированной соляной кислоты и перемешивали на магнитной мешалке при кипячении в течение 2 ч. Композицию охлаждали при перемешивании.
Пример 4
Синтез привитого сополимера поливинилбутираля с триэтоксиоктилсиланом
0,194 г поливинилбутираля, содержащего 18 и 2 мас.% остаточных спиртовых и ацетатных звеньев соответственно (Aldrich, #19,097-7), растворяли в 2,524 г этанола, (азеотропная смесь, 4% воды), смешивали с 0,58 г триэтоксиоктилсилана, добавляли 0,02 г 1 М соляной кислоты и перемешивали на магнитной мешалке при кипячении в течение 2 ч, охлаждали при перемешивании.
Пример 5
Синтез привитого сополимера поливинилбутираля, тетраэтоксисилана (ТЭОС) и 3-(диэтоксиметилсилил)пропиламина
0,344 г поливинилбутираля, содержащего 18 и 2 мас.% остаточных спиртовых и ацетатных звеньев соответственно (Aldrich, #19,097-7), растворяли в 4,82 г этанола, (азеотропная смесь, 4% воды), смешивали с 0,344 г ТЭОС и 0,344 г 3-(диэтоксиметилсилил)пропиламина, добавляли 0,02 г 1 М соляной кислоты и перемешивали на магнитной мешалке при кипячении в течение 2 ч, охлаждали при перемешивании.
Пример 6
Синтез привитого сополимера поливинилбутираля и триэтоксиметилсилана
0,47 г поливинилбутираля, содержащего 18 и 2 мас.% остаточных спиртовых и ацетатных звеньев соответственно (Aldrich, #19,097-7), растворяли в 6,699 г этанола, (азеотропная смесь, 4% воды), смешивали с 1,42 г триэтоксиметилсилана, добавляли 0,02 г 1 М соляной кислоты и 0,08 г воды перемешивали на магнитной мешалке при кипячении в течение 2 ч, охлаждали при перемешивании.
Пример 7
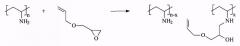
Синтез аддукта поливиниламина (ПВА) и аллилглицидилового эфира (АГЭ)
Полимеризация N-винилформамида
В реакционную колбу помещали 0,0241 г азоизобутиронитрила и 5 г N-винилформамида. Приливали 45 мл дистиллированной воды, продували аргоном в течение 10 мин, выдерживали в термостате 22 ч при 600С. Полимер высаживали в ацетон и затем сушили в вакууме до постоянной массы. Выход 4,545 г (90,9%), молекулярная масса (вискозиметрически): 290000.
Гидролиз поливинилформамида
В реакционную колбу помещали 1,576 г КОН и приливали 17,42 мл дистиллированной воды. Далее в полученный раствор засыпали 1 г ПВФА. Раствор продували аргоном в течение 10 мин, выдерживали в термостате 24 ч при 60°С. Продукт очищали от низкомолекулярных примесей диализом через целлофановую мембрану относительно воды в течение 48 ч. Полученный ПВА высушен лиофильно. Выход 0,59 г (97%).
Конденсация ПВА с АГЭ
0,1 г ПВА растворяли в 3 мл метанола, добавляли 0,05 г АГЭ и кипятили 2 ч. Полученный раствор разбавляли 40 мл метанола. Данные ИК-Фурье спектроскопии (фиг.1) указывают на появление связей вторичных спиртовых групп при реакции ПВА с АГЭ (полоса при 1120 см-1), что связано с протеканием следующей реакции:
Присутствие в полученном аддукте ПВА-АГЭ двойных связей и гидроксильных групп обеспечивает его связывание с полисилоксановыми композициями.
Пример 8
Синтез полиаллилглицидилового эфира
5 г аллилглицидилового эфира нагревали 10 ч с 0,1 г азоизобутиронитрила при 60°С в ампулах, продутых аргоном. Непрореагировавший мономер отгоняли в вакууме, полимер высаживали в петролейный эфир и сушили в вакууме до постоянной массы. Выход 0,55 г (11%).
Пример 9
Функционализация полистирольных микробиологических планшет аминогруппами
Композиции из Примеров 1-4 разбавляли этиловым спиртом в соотношении: 1 г композиции и 7 г спирта. К полученному раствору добавляли амины: раствор аддукта ПВА-АГЭ (Пример 7) или 5% раствор аминопропилтриэтоксисилана (АПТС) в этаноле (см. табл.1). Полученную смесь наносили в ячейки 96-луночного круглодонного планшета по 0,01 мл, сушили в парах растворителя 15-20 ч, затем нагревали 2 ч при 90°С. Поверхностную плотность аминогрупп определяли с помощью 0,01 М водного раствора пикриновой кислоты, который заливали в лунки планшета на 5 мин, затем промывали дистиллированной водой. Содержание пикриновой кислоты, связанной с поверхностными аминогруппами, определяли по поглощению при 364 нм. Полученные результаты (см. табл.1) указывают на возможность получения устойчивых покрытий лунок планшета с поверхностной плотностью аминогрупп до 900 нм-2. Подобные показатели невозможны при расположении аминогрупп на гладкой поверхности и объясняются нанорельефной структурой покрытия (фиг.2).
| Таблица 1Функционализация полистирольных микробиологических планшет аминогруппами | |||
| № | Пленкообразующая композиция (№ Примера), загрузка (г) | Амин, загрузка (г) | Поверхностная плотность аминогрупп, нм-2 |
| 1 | 1; 0,363 | ПВА-АГЭ, 0,043 | 200 |
| 2 | 1; 0,348 | ПВА-АГЭ, 0,079 | 700 |
| 3 | 1; 0,367 | ПВА-АГЭ, 0,165 | 750 |
| 4 | 2; 0,382 | ПВА-АГЭ, 0,032 | 300 |
| 5 | 2; 0,359 | ПВА-АГЭ, 0,068 | 600 |
| 6 | 2; 0,371 | ПВА-АГЭ, 0,158 | 850 |
| 7 | 3; 0,355 | АПТС, 0,043 | 550 |
| 8 | 3; 0,368 | АПТС, 0,083 | 750 |
| 9 | 3; 0,352 | АПТС, 0,162 | 900 |
| 10 | 4; 0,365 | ПВА-АГЭ, 0,035 | 250 |
| 11 | 4; 0,353 | ПВА-АГЭ, 0,080 | 450 |
| 12 | 4; 0,376 | ПВА-АГЭ, 0,161 | 600 |
Пример 10
Функционализация полистирольных микробиологических планшет эпоксидными группами
Композицию из Примера 1 разбавляли этиловым спиртом в соотношении: 1 г композиции и 5 г спирта. К 0,412 г полученного раствора добавляли 0,185 г 4% раствора полиаллилглицидилового эфира (Пример 8) в этаноле. Полученную смесь наносили в ячейки 96-луночного круглодонного планшета по 0,01 мл, сушили в парах растворителя 15-20 часов, затем прогревали 2 ч при 90°С.
Поверхностную плотность эпоксидных групп определяли с помощью 1% водного раствора метиламина, который заливали в исследуемые лунки на 2 ч при 50-55°С, затем промывали поверхность дистиллированной водой. При этом происходила конденсация эпокси- и аминогрупп с образованием вторичных аминогрупп, плотность которых определяли по пикриновой кислоте (Пример 9). Для описанного Примера она составила 200 нм-2.
Аналогичным образом для покрытия использовали композицию из Примера 4, разбавленную этиловым спиртом в соотношении: 1 г композиции и 7 г спирта. К 0,389 г полученного раствора добавляли 0,214 г 4% раствора полиаллилглицидилового эфира (Пример 8) в этаноле. Полученную смесь наносили в ячейки 96-луночного круглодонного планшета по 0,01 мл, сушили в парах растворителя 15-20 ч, затем нагревали 2 ч при 90°С. Поверхностная плотность эпоксигрупп составила 250 нм-2.
Пример 11
Функционализация стеклянных слайдов амино- и эпоксигруппами
Для покрытия использовали покровные стекла для микроскопии, обработанные 5% раствором додецилсульфоната натрия в ультразвуковой бане (20 мин), промытые водно-спиртовой (1:1) смесью и высушенные на воздухе в условиях, исключающих попадание пыли. Для покрытия использовали растворы из Примеров 9 и 10. Стекла покрывали с помощью ракельного ножа ("Doctor Blade"), высушивали и нагревали 1 ч при 100°С. Показатели поверхностной плотности функциональных групп близки к таковым для аналогичных покрытий лунок полистирольных планшет.
Пример 12
Функционализация стеклянных слайдов гидразидными группами
1 г кремнийорганической композиции из Примера 6 разбавляли 4 г 1,2-диметоксиэтана. К 0,366 г полученного раствора добавляли 0,2 мл 0,33% раствора полиметилметакрилата (Aldrich, #18,223-0) в 1,2-диметоксиэтане. Стекла покрывали с помощью ракельного ножа ("Doctor Blade"), высушивали и нагревали 1 ч при 90°С. Далее стекла погружали в 20% водный раствор гидразина, выдерживали 1 ч, промывали водой и сушили при комнатной температуре. Поверхностная плотность гидразидных групп, определенная аналогично аминогруппам (Пример 9), составила 300 нм-2.
Пример 13
Получение эпоксисодержащих пленок
2 г композиции из Примера 4 смешивали с 1 г 20% этанольного раствора полиаллилглицидилового эфира (Пример 8) и наносили на полиэтиленовую поверхность с помощью ракельного ножа ("Doctor Blade") с зазором 1 мм. Пленку сушили 12 ч в парах растворителя и нагревали 1,5 ч при 90°С. Поверхностная плотность эпоксигрупп, определенная аналогично Примеру 10, составила 150 нм-2.
Аналогичным способом получали пленку, используя 1,14 г композиции из Примера 1, смешанной с 0,969 г 20% этанольного раствора полиаллилглицидилового эфира (Пример 8). Плотность эпоксигрупп составила 450 нм-2. Поверхность пленки имеет ярко выраженную рельефную структуру (фиг.2). В ИК-спектре полученной пленки (фиг.3) присутствуют полосы поглощения эпоксигрупп (845 и 1255 см-1) и исчезают полосы силанольных групп (955 и 3040-3600 см-1), что подтверждает связывание полиаллилглицидилового эфира с полисилоксановой композицией благодаря реакциям силанольных и эпоксидных групп.
Пример 14
Получение аминосодержащих пленок
1,9 г композиции из Примера 5 смешивали с 0,2 г 5% раствора аминопропилтриэтоксисилана в пентаноле и наносили на полиэтиленовую поверхность с помощью ракельного ножа ("Doctor Blade") с зазором 1,4 мм. Поверхностная плотность аминогрупп, определенная аналогично Примеру 9, составила 800 нм-2.
Аналогичным способом получали пленку, используя 1 г композиции из Примера 6, смешанной с 3 г ацетона с добавлением 0,6 г раствора аддукта ПВА-АГЭ (Пример 7). Поверхностная плотность аминогрупп 700 нм-2. По данным ИК-спектроскопии полученной пленки (фиг.4) наблюдается существенное уменьшение количества силанольных групп (полосы при 957 и 3050-3600 см-1), что согласуется со связыванием аддукта ПВА-АГЭ с группами Si-OH.
Пример 15
Иммобилизация модифицированных олигонуклеотидов на аминосодержащих подложках
Использовали олигонуклеотид 5'-GTTGACTTGGGCCGTGAGCTGACC, фосфорилированный по 5'-концу, предоставленный фирмой MWG-Biotech AG.
Приготовили раствор для иммобилизации, содержащий 100 мМ EDC (1-этил-3-(3-диметиламинопропил)-карбодиимид) и 100 мМ 1-метилимидазола [Rasmussen H.N., Knudsen J.N., Madsen S.A., Rasmussen S.E. Biotechnol. Int. 1999. 2. 303]. К полученному раствору добавили олигонуклеотид, доведя его концентрацию в растворе до 10 пмоль/мкл. В лунку планшета наносили 100 мкл смеси и инкубировали 15 ч при 45°С. По окончании реакции лунку трижды промыли 100 мМ Tris-HCl (pH 7,5), 150 мМ NaCl и 0,1% Tween-20, инкубировали 5 мин и промыли еще три раза этим же раствором при комнатной температуре. Остаточные аминогруппы на поверхности кэпировали раствором уксусного ангидрида в метаноле. Об эффективности иммобилизации судили по связыванию иммобилизованных олигонуклеотидов с флуоресцентной меткой (Примеры 16 и 17).
Пример 16
Гибридизация меченых олигонуклеотидов с иммобилизованными на подложках олигонуклеотидами
Олигонуклеотид 5'-Flu-GGTCAGCTCACGGCCCAAGTCAAC (Syntol) комплементарен олигонуклеотиду, иммобилизованному на аминных поверхностях (Пример 15). В качестве гибридизационного буфера использовали 5хSSCT (0,75M NaCl, 0,075 M NaCit, pH 7,0). Концентрация олигонуклеотида в буфере составила 10 пмоль/мкл. В лунку планшета наносили 100 мкл раствора и инкубировали 40 мин при 47°С. Затем пустую лунку промыли три раза 0,5 x SSCT, инкубировали 15 мин при 50°С и промыли еще три раза этим же раствором [Lundin B.S., Karlson M.R., Svensson L.A., Hanson L.A., Dahlgren U.I.H., Telemo E. 1999. Clin. Exp. Immunol. 1999. 116. 181]. Также использовали некомплементарный флюоресцентно-меченый олигонуклеотид 5'-Flu-CGCAGCATTCCTTGGAGGCTCATT (Syntol). С этим олигонуклеотидом провели те же манипуляции, что и с комплементарным, для того чтобы оценить степень специфичности гибридизационной реакции.
Пример 17
Оценка эффективности иммобилизации по интенсивности флуоресценции метки, введенной в комплементарный олигонуклеотид
Олигонуклеотид, загибридизованный, как указано в Примере 16, снимали с планшета при помощи 10-минутного инкубирования в 100 мкл 0,2 М NaOH. Затем раствор NaOH нейтрализовали 2 М лимонной кислотой. В полученной таким образом смеси, содержащей снятый Flu-олигонуклеотид, измеряли интенсивность флуоресценции на микроскопе Axiovert200 (Германия) и определяли концентрацию гибридизовавшихся олигонуклеотидов. На основе этих данных вычисляли поверхностную плотность иммобилизованного олигонуклеотида (см. табл.2). Неспецифического связывания некомплементарного олигонуклеотида не наблюдалось, о чем свидетельствует отсутствие флуоресценции у растворов, смытых с соответствующих лунок.
Таким образом, предлагаемый метод модификации поверхностей позволяет достигать плотности иммобилизации олигонуклеотидов в 10 пмоль/мм2.
| Таблица 2Определение плотности иммобилизации олигонуклеотида в лунках аминосодержащих планшетов | ||
| Модифицирующая композиция (№ по табл.1) | Количество гибридизовавшихся олигонуклеотидов, пмоль | Плотность иммобилизации олигонуклеотида в лунке планшета, пмоль/мм2 |
| 3 | 95,2 | 3,8 |
| 5 | 258,8 | 10,3 |
| 8 | 198,5 | 7,9 |
| 12 | 20,3 | 0,8 |
Пример 18
Гибридизация ПЦР-продукта на иммобилизованных олигонуклеотидах
ДНК выделили из диатомеи Synedra acus изотиоционат-гуанидиновым методом [Маниатис Т., Фрич Э., Сэмбрук Дж. 1984. Молекулярное клонирование. М: Мир, 479 с]. Амплификацию фрагмента гена SIT (silicon transporter, Hildebrand M., Volcani B.E., Gassman W., Shcroder J.E., 1997, Nature. 385, 688) длиной 720 п.н. проводили с использованием олигонуклеотидных праймеров: 5'-ATGCTTGATTTCATCAACA и 5'-CAAATACCCGTTGCTTC (Syntol, Москва). Результаты реакции визуализировали электрофорезом в 4% полиакриламидном геле с серебряным окрашиванием (фиг.5).
Гибридизацию ПЦР продукта на поверхностях осуществляли так же, как описано в Примере 16 для олигонуклеотида. Загибридизовавшуюся цепь ДНК отделяли от иммобилизованного на поверхности нуклеотида раствором 0,2 М NaOH и нейтрализовали лимонной кислотой, как описано выше (Пример 17). Наличие одноцепочечной ДНК определяли методом электрофореза в денатурирующем полиакриламидном геле (фиг.6).
1. Способ получения покрытий на поверхности стекла и пластика, а также свободных пленок с повышенной поверхностной плотностью функциональных групп до 900 нм-2 для конструирования био- и химических сенсоров в области генной диагностики, получения генных библиотек, проведения цепной полимеразной реакции на иммобилизованных нуклеиновых кислотах, в качестве носителей в нуклеотидном синтезе, отличающийся тем, что на поверхности наносят органо-неорганические нанокомпозитные материалы на основе композиции, содержащей раствор пленкообразующих органических полимеров с привитыми олигосилоксановыми цепями и алкоксисиланы и/или полимеры, содержащие аминные, гидразидные, эпоксидные или карбоксильные функциональные группы, с последующей сушкой нанесенной на поверхность органо-неорганической композиции.
2. Способ по п.1, отличающийся тем, что используют раствор органического полимера или смеси полимеров с привитыми олигосилоксановыми цепями, способного образовывать пленки и покрытия с "холмистым" нанорельефом, обеспечивающим увеличение эффективной площади поверхности.
3. Способ по п.2, отличающийся тем, что в качестве органических полимеров используют полимеры с функциональными группами, способными взаимодействовать с алкоксисиланами или продуктами их гидролиза, выбранными из группы, состоящей из гидроксильных, ацетальных, эпоксидных, винилоксидных групп, возможно сополимеры винилацетата и винилового спирта; полиацетали (поливинилформаль, поливинилбутираль, поливинилоктиналь); этилцеллюлозу и такие неполные эфиры целлюлозы как ацетаты, нитраты, а также карбоксиметилцеллюлозу; полиэтиленгликоль, полипропиленгликоль; полимеры и сополимеры на основе винилового спирта, гидроксиэтилметакрилата, аллилглицидилового эфира, виниловых эфиров этиленгликоля и диэтиленгликоля.
4. Способ по п.2, отличающийся тем, что прививку олигосилоксановых цепей осуществляют путем неполного гидролиза алкоксисиланов в присутствии органических полимеров, выбираемых из группы, состоящей из сополимеров винилацетата и винилового спирта; полиацеталей (поливинилформаль, поливинилбутираль, поливинилоктиналь); этилцеллюлозы и таких неполных эфиров целлюлозы, как ацетаты и нитраты, а также карбоксиметилцеллюлозы; полиэтиленгликоля, полипропиленгликоля; полимеров и сополимеров на основе винилового спирта, гидроксиэтилметакрилата, аллилглицидилового эфира, виниловых эфиров этиленгликоля и диэтиленгликоля, а в качестве алкоксисиланов используют тетраэтоксисилан, тетраметоксисилан, алкилэтоксисиланы, например метилтриэтоксисилан или октилтриэтоксисилан.
5. Способ по п.1, отличающийся тем, что для получения функционализированных покрытий и пленок в органо-н