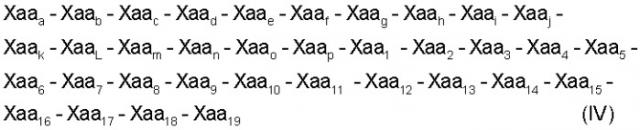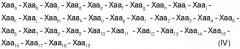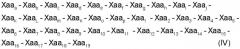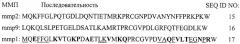Противовозрастные и ранозаживляющие составы
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Предложены пептиды, которые происходят из проферментных форм матриксных металлопротеиназ и являются ингибиторами матриксных металлопротеиназ. Аминокислотная последовательность представлена в описании. Описана композиция для стимулирования развития здоровой кожи, содержащая терапевтически эффективное количество пептидов. Описаны перевязочный материала для ран, способ стимулирования развития здоровой кожи и лосьон для обработки кожи для уменьшения результатов воздействия старения и для стимулирования развития здоровой кожи и лечения ран на основе композиции. Раскрыто применение композиции для изготовления лекарственного средства, способствующего заживлению ран, предотвращению рубцевания, снижению образования морщин, уменьшению результатов воздействия старения или улучшения цвета кожи. Использование изобретения позволяет получить новые противовозрастные и ранозаживляющие агенты. 6 н. и 9 з.п. ф-лы, 24 ил., 6 табл.
Реферат
Область изобретения
Данное изобретение относится к составам, содержащим ингибиторы матриксных металлопротеиназ, которые пригодны для заживления ран и устранения результатов воздействия старения на кожу. Эти ингибиторы представляют собой пептиды, имеющие последовательности, соответствующие вырезаемому участку проферментных форм матриксных металлопротеиназ.
Предшествующий уровень техники
На состояние кожи всегда воздействуют такие факторы, как влажность, ультрафиолетовое излучение, косметические средства, старение, заболевания, стресс и привычки в еде. В результате, могут возникнуть различные кожные проблемы. С возрастом кожа также становится менее упругой, что проявляется в образовании морщин. Старение обычно сопровождается утончением и общей деградацией кожи. По мере естественного старения кожи происходит уменьшение количества клеток и кровеносных сосудов, питающих кожу. Также имеет место уплощение кожно-эпидермального соединения, что приводит к ослаблению его механических свойств. В результате, пожилые люди становятся более восприимчивыми к образованию волдырей при механических травмах или болезненных процессах (см. Oikarinen (1990) "The Aging of Skin: Chronoaging Versus Photoaging", Photodermatal. Photoimmunol. Photomed., Vol.7, pp 3-4).
Кожа содержит сложную сеть волокон эластина, которые ответственны за поддержание ее эластичных свойств. При избыточном воздействии солнечного излучения система эластичных волокон становится гиперпластической, дезорганизованной и, в конечном счете, разрушается. Этот процесс известен как актинический эластоз, который является главной причиной образования морщин, обесцвечивания и рыхлости кожи на открытых участках тела. При формировании новых фибробластов, эндотелиальных клеток и кератиноцитов кожа может восстанавливаться сама. Однако по мере старения кожа постепенно утрачивает эту способность. Поэтому для преждевременно состарившейся кожи требуются агенты, способные ускорять процессы роста и восстановления.
Заживление ран также ускоряется при повышении клеточной пролиферации и миграции некоторых типов клеток. Механизмы, задействованные в процессах заживления ран, часто подразделяются на четыре фазы: гемостаз, воспаление, пролиферация и созревание. Во время воспаления происходит скопление лейкоцитов для борьбы с бактериями, и повышается проницаемость кровеносных сосудов, что приводит к опуханию. Если инфекция не развивается, количество лейкоцитов уменьшается. Лейкоциты заменяются моноцитами. Макрофаги и лимфоциты высвобождают факторы роста (цитокины), а также ряд химических веществ, таких как гистамин, серотонин и простагландины. Эти вещества помогают регулировать процесс заживления ран. В фазе пролиферации возникают новые фибробласты, эндотелиальные клетки и кератиноциты, образуется соединительная ткань, появляются новые кровеносные сосуды и восстанавливается поврежденная ткань. Фибробласты начинают доминировать примерно через неделю, при этом воспаление спадает и прочность ткани вокруг поврежденного участка быстро возрастает. Во время фазы созревания откладывается коллаген, и образуется рубцовая ткань. Эта фаза созревания может продолжаться длительное время, в течение которого восстанавливаются ткани различных типов. Для оптимального восстановления кожи и ассоциированных тканей необходимо достаточное снабжение их различными витаминами и микроэлементами, а также питательными веществами и кислородом.
Хронические раны или безболезненные, незаживающие раны могут возникать по различным причинам, включая инфекции, наличие инородных тел или токсичных раздражающих веществ, ожоги, продолжительное механическое воздействие на кожу и недостаточное кровоснабжение в связи с нарушенной циркуляцией крови. В хронических ранах окружение раны влияет на тканевой гомеостаз таким образом, что либо заживления не происходит, либо оно начинается, но в дальнейшем приостанавливается. Факторами, препятствующими процессам заживления в хронических ранах, являются некроз ткани, дегидратация, отек хронической раны, фиброзное уплотнение и болезни мелких кровеносных сосудов.
Одной из главных причин незаживления хронических ран является действие особого класса протеиназ, называемых матриксными металлопротеиназами (ММП), которые разрушают новое сформированное ложе раны (Vaalamo et al., 1997; Weckroth et al., 1996; DiColandrea et al., 1998; Moses et al., 1996). Обычно защиту ложа раны от разрушения этими матриксными металлопротеиназами выполняют четыре тканевых ингибитора металлопротеиназ (ТИМП 1-4), которые образуют очень специфические ингибиторные комплексы с матриксными металлопротеиназами (Olson et al., 1997; Taylor et al., 1996; Howard et al., 1991). Это значит, что каждый ТИМП ингибирует только определенный подкласс матриксных металлопротеиназ. В хронических ранах наблюдается высокое соотношение матриксной металлопротеиназы к ТИМП, в результате чего большинство матриксных металлопротеиназ не ингибируются (Vaalamo et al., 1996; Saarialho-Kere, 1998). Фактически, при повышенном уровне протеиназ молекулы ТИМП сами могут подвергаться гидролизу. Среди природных тканевых ингибиторов металлопротеиназ нет таких, которые в одиночку были бы способны ингибировать все типы матриксных металлопротеиназ.
Для контроля активности матриксных металлопротеиназ было предложено несколько подходов, включая использование небольших молекул (Levy et al., 1998; Wojtowicz-Praga et al., 1997; Duivenvoorden, et al., 1997), пептидных ингибиторов (Odake et al., 1994) и антител к матриксным металлопротеиназам (Su et al., 1995). Однако идеальное средство для заживления ран и замедления процессов старения должно не только обеспечивать оптимальное ингибирование металлопротеиназ, но и способствовать росту и восстановлению поврежденных тканей.
Краткое изложение изобретения
Настоящее изобретение предоставляет композиции, содержащие пептиды, которые могут использоваться как противовозрастные и ранозаживляющие агенты. Пептиды согласно настоящему изобретению могут не только ингибировать металлопротеиназы, но также стимулировать клеточную пролиферацию и миграцию в некоторых типах клеток, включая фибробласты, эндотелиальные клетки и кератиноциты. В рамках данного изобретения рассматриваются также различные лосьоны топического действия, повязки и композиции, а также способы использования пептидов для замедления процессов старения и для заживления ран.
Представленное изобретение относится, таким образом, к пептидным ингибиторам матриксных металлопротеиназ. Эти пептидные ингибиторы имеют аминокислотные последовательности, идентичные или родственные участку связывания, соединяющему два глобулярных домена матриксных металлопротеиназ. Известно несколько типов матриксных металлопротеиназ и их последовательностей, в частности матриксная металлопротеиназа-1, матриксная металлопротеиназа-2, матриксная металлопротеиназа-3, матриксная металлопротеиназа-4, матриксная металлопротеиназа-5, матриксная металлопротеиназа-6, матриксная металлопротеиназа-7, матриксная металлопротеиназа-8, матриксная металлопротеиназа-9, матриксная металлопротеиназа-10, матриксная металлопротеиназа-11, матриксная металлопротеиназа-12 и матриксная металлопротеиназа-13. Данное изобретение включает в себя ингибиторы, обладающие аминокислотной последовательностью участка связывания какой-либо из матриксных металлопротеиназ. Например, пептидные ингибиторы, заявленные в данном изобретении, могут иметь аминокислотные последовательности, соответствующие любой области примерно с 70 по 120 аминокислоту последовательности матриксной металлопротеиназы-2 (SEQ ID NO: 14) и аналогичным областям всех других матриксных металлопротеиназ.
Настоящее изобретение представляет пептиды, характеризующиеся одной из следующих формул (I), (II), (III):
где
Хаа1, Хаа4 и Хаа6 независимо друг от друга обозначают неполярные аминокислоты;
Хаа2 является основной аминокислотой;
Хаа3 является цистеиноподобной аминокислотой;
Хаа5 является полярной или алифатической аминокислотой;
Хаа7 является кислой аминокислотой,
Хаа8 является алифатической или полярной аминокислотой;
Хаа9 является алифатической, неполярной или основной аминокислотой; и
Хаа10 является полярной, кислой, основной или неполярной аминокислотой;
Хаа11 является полярной или ароматической аминокислотой;
Хаа12 является полярной, основной, алифатической или неполярной аминокислотой;
Хаа13 является ароматической, алифатической, полярной или кислой аминокислотой;
Xaa14 является ароматической, неполярной или полярной аминокислотой;
Хаа15 является неполярной или кислой аминокислотой;
Хаа16 является основной, полярной или неполярной аминокислотой;
Xaa17 является основной, полярной, алифатической, неполярной или кислой аминокислотой;
Хаа18 является неполярной или алифатической аминокислотой;
Хаа19 является основной или алифатической аминокислотой; и
указанный пептид способен ингибировать активность матриксной металлопротеиназы-1, матриксной металлопротеиназы-2, матриксной металлопротеиназы-3, матриксной металлопротеиназы-4, матриксной металлопротеиназы-5, матриксной металлопротеиназы-6, матриксной металлопротеиназы-7, матриксной металлопротеиназы-8 или матриксной металлопротеиназы-9, матриксной металлопротеиназы-10, матриксной металлопротеиназы-11, матриксной металлопротеиназы-12 и матриксной металлопротеиназы-13. В некоторых вариантах осуществления данного изобретения этот пептид может ингибировать активность матриксной металлопротеиназы-2, матриксной металлопротеиназы-3, матриксной металлопротеиназы-7, матриксной металлопротеиназы-8 или матриксной металлопротеиназы-9.
В качестве неполярной аминокислоты может выступать, например, метионин, глицин или пролин. В качестве основной аминокислоты может выступать, в частности, гистидин, лизин, аргинин, 2,3-диаминопропионовая кислота, орнитин, гомоаргинин, ρ-аминофенилаланин или 2,4-диаминомасляная кислота. Цистеиноподобные аминокислоты включают, в частности, цистеин, гомоцистеин, пеницилламин или β-метилцистеин.
К алифатическим аминокислотам относятся, в частности, аланин, валин, лейцин, изолейцин, t-бутилаланин, t-бутилаланин, N-метилизолейцин, норлейцин, N-метилвалин, циклогексилаланин, β-аланин, N-метилглицин или α-аминоизомасляная кислота. К кислым аминокислотам относятся, в частности, аспарагиновая кислота или глутаминовая кислота. К полярным аминокислотам относятся, в частности, аспарагин, глутамин, серин, треонин, тирозин, цитруллин, N-ацетил лизин, метионин сульфоксид или гомосерин, а к неполярным аминокислотам, такие как метионин, глицин или пролин. В рамках данного изобретения к ароматическим аминокислотам относятся, в частности, фенилаланин, тирозин, триптофан, фенилглицин, нафтилаланин, β-2-тиенилаланин, 1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота, 4-хлорофенилаланин, 2-фторфенилаланин, 3-фторфенилаланин, 4-фторфенилаланин, пиридилаланин или 3-бензотиенилаланин.
Настоящее изобретение относится также к пептидам с формулами (IV) (SEQ ID NO: 18):
где:
Xaaa обозначает пролин;
Хааb обозначает глутамин или глутаминовую кислоту;
Хаас обозначает треонин;
Xaad обозначает глицин;
Хааe обозначает аспарагиновую кислоту или глутаминовую кислоту;
Хааf обозначает лейцин;
Xaag обозначает аспарагиновую кислоту;
Хааh обозначает глутамин или серин;
Хааi обозначает аспарагин или аланин;
Xaaj обозначает треонин;
Хааk обозначает изолейцин или лейцин;
ХааL обозначает глутаминовую кислоту или лизин;
Хааm обозначает треонин или аланин;
Хааn обозначает метионин;
Хаао обозначает аргинин;
Хаар обозначает лизин или треонин;
Xaa1 обозначает пролин;
Хаа2 обозначает аргинин;
Хаа3 обозначает цистеин;
Хаа4 обозначает глицин;
Хаа5 обозначает валин или аспарагин
Хаа6 обозначает пролин;
Хаа7 обозначает аспарагиновую кислоту;
Xaa8 обозначает валин или лейцин;
Хаа9 обозначает аланин или глицин;
Хаа10 обозначает аспарагин или аргинин;
Xaa11 обозначает тирозин или фенилаланин;
Xaa12 обозначает аспарагин или глутамин;
Xaa13 обозначает фенилаланин или треонин;
Xaa14 обозначает фенилаланин;
Xaa15 обозначает пролин или глутаминовую кислоту;
Xaa16 обозначает аргинин или глицин;
Xaa17 обозначает лизин или аспарагиновую кислоту;
Xaa18 обозначает пролин или лейцин;
Xaa19 обозначает лизин; и
указанный пептид способен ингибировать активность металлопротеиназы. Примером матриксных металлопротеиназ могут служить матриксная металлопротеиназа-1, матриксная металлопротеиназа-2, матриксная металлопротеиназа-3, матриксная металлопротеиназа-4, матриксная металлопротеиназа-5, матриксная металлопротеиназа-6, матриксная металлопротеиназа-7, матриксная металлопротеиназа-8, матриксная металлопротеиназа-9, матриксная металлопротеиназа-10, матриксная металлопротеиназа-11, матриксная металлопротеиназа-12 и матриксная металлопротеиназа-13. Предпочтительные пептиды ингибируют матриксную металлопротеиназу-2 или матриксную металлопротеиназу-9.
Участки связывания, из которых пептидные ингибиторы согласно настоящему изобретению могут быть получены, имеют, например, аминокислотные последовательности в пределах от около 70 до около 120 положения SEQ ID NO: 14 и аналогичные области других матриксных металлопротеиназ. В некоторых вариантах осуществления данного изобретения пептидные ингибиторы имеют аминокислотные последовательности в пределах от около 77 до около 110 положения SEQ ID NO: 14, и аналогичных областей других матриксных металлопротеиназ. Примеры некоторых пептидных ингибиторов включают ингибиторы, содержащие аминокислотные последовательности SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13.
Пептиды настоящего изобретения могут обладать различным сродством к различным матриксным металлопротеиназам. Например, в одном из вариантов осуществления данного изобретения эти пептидные ингибиторы могут ингибировать матриксную металлопротеиназу-2 со значением ki в пределах примерно от 1,0 мкМ до 500,0 мкМ. В другом варианте осуществления данного изобретения эти пептидные ингибиторы могут ингибировать матриксную металлопротеиназу-2 со значением ki в пределах примерно от 1,0 мкМ до 400,0 мкМ. В еще одном варианте осуществления данного изобретения эти пептидные ингибиторы могут ингибировать матриксную металлопротеиназу-2 со значением ki в пределах примерно от 1,0 мкМ до 50,0 мкМ.
Настоящее изобретение также предоставляет композиции, содержащие терапевтически эффективное количество пептида согласно настоящему изобретению и фармацевтически приемлемый носитель. Составы для обработки ран и кожные лосьоны также рассматриваются в настоящем изобретении.
Объектом данного изобретения является также способ лечения ран или устранения результатов воздействия старения, предусматривающий применение терапевтически эффективного количества пептида, соответствующего одной из следующих формул I, II, III или IV:
(SEQ ID NO: 21)
где:
Xaa1, Xaa4 и Хаа6 независимо друг от друга обозначают неполярные аминокислоты;
Хаа2 является основной аминокислотой;
Хаа3 является цистеиноподобной аминокислотой;
Хаа5 является полярной или алифатической аминокислотой;
Хаа7 является кислой аминокислотой,
Xaa8 является алифатической или полярной аминокислотой;
Хаа9 является алифатической, неполярной или основной аминокислотой; и
Хаа10 является полярной, кислой, основной или неполярной аминокислотой;
Xaa11 является полярной или ароматической аминокислотой;
Xaa12 является полярной, основной, алифатической или неполярной аминокислотой;
Хаа13 является ароматической, алифатической, полярной или кислой аминокислотой;
Xaa14 является ароматической, неполярной или полярной аминокислотой;
Xaa15 является неполярной или кислой аминокислотой;
Xaa16 является основной, полярной или неполярной аминокислотой;
Xaa17 является основной, полярной, алифатической, неполярной или кислой аминокислотой;
Xaa18 является неполярной или алифатической аминокислотой;
Xaa19 является основной или алифатической аминокислотой;
Хааa обозначает пролин;
Хааb обозначает глутамин или глутаминовую кислоту;
Хаас обозначает треонин;
Хааd обозначает глицин;
Хаае обозначает аспарагиновую кислоту или глутаминовую кислоту;
Хааf обозначает лейцин;
Xaag обозначает аспарагиновую кислоту;
Хааh обозначает глутамин или серин;
Хааi обозначает аспарагин или аланин;
Xaaj обозначает треонин;
Xaak обозначает изолейцин или лейцин;
XaaL обозначает глутаминовую кислоту или лизин;
Xaam обозначает треонин или аланин;
Xaan обозначает метионин;
Xaaо обозначает аргинин; и
Хааp обозначает лизин или треонин;
причем указанный пептид способен ингибировать активность матриксной металлопротеиназы.
В качестве неполярной аминокислоты в заявленных в данном изобретении пептидах может выступать, например, метионин, глицин или пролин. В качестве основной аминокислоты может выступать, например, гистидин, лизин, аргинин, 2,3-диаминопропионовая кислота, орнитин, гомоаргинин, ρ-аминофенилаланин и 2,4-диаминомасляная кислота. В качестве цистеиноподобной аминокислоты может выступать, например, цистеин, гомоцистеин, пеницилламин или β-метил цистеин. В качестве алифатической аминокислоты может выступать, например, аланин, валин, лейцин, изолейцин, t-бутилаланин, t-бутилаланин, N-метилизолейцин, норлейцин, N-метилвалин, циклогексилаланин, β-аланин, N-метилглицин или α-аминоизомасляная кислота. В качестве кислой аминокислоты может выступать, например, аспарагиновая кислота или глутаминовая кислота. В качестве полярной аминокислоты может выступать аспарагин, глутамин, серин, треонин, тирозин, цитруллин, N-ацетиллизин, метионин сульфоксид или гомосерин, а в качестве неполярной аминокислоты, такие как метионин, глицин или пролин. В качестве ароматической аминокислоты может выступать фенилаланин, тирозин, триптофан, фенилглицин, нафтилаланин, β-2-тиенилаланин, 1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота, 4-хлорофенилаланин, 2-фторфенилаланин, 3-фторфенилаланин, 4-фторфенилаланин, пиридилаланин или 3-бензотиенилаланин.
В другом варианте осуществления данного изобретения предлагается способ лечения ран или устранения результатов воздействия старения, предусматривающий применение терапевтически эффективного количества пептида, имеющего последовательность SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 или SEQ ID NO: 13.
Описание чертежей
На Фиг.1 приведены согласно CLUSTAL Х (версия 1.8) множественное выравнивание последовательностей вырезаемых связывающих участков выбранных проферментных форм белка ММП. На Фиг.1А показано выравнивание, на котором ярко выделены консервативные остатки, где символ '*' обозначает полную идентичность между последовательностями, символ ':' обозначает положения, для которых степень консервативности составляет 7/9, а символ '.' обозначает положения, для которых степень идентичности составляет более 80% с преимущественно консервативными заменами. На Фиг.1В гетерогенные положения выделены жирным шрифтом.
На Фиг.2 показана структура проферментной формы ММП-1 (Банк данных для белков файл 1FBL.ENT). Область расположения последовательностей SEQ ID NO: 2-10, приведенных в таблице 1, охватывает короткий участок между двумя крупными доменами. При активации фермента этот участок вырезается.
На Фиг.3 показана трехмерная модель матриксной металлопротеиназы-9. Вырезаемый участок, образующий N-конец активной протеиназы, обозначен штриховкой. Два иона цинка изображены в виде сфер. Вырезаемый доменный пептид может связываться с матриксной металлопротеиназой вблизи от места его нормального расположения в проферменте. Это связывание (также рядом с каталитическим цинком) стерически блокирует часть активного участка. Эта блокировка препятствует связыванию с субстратом.
На Фиг.4 приведен график ингибирования активности ММП-9 вырезаемым доменным пептидом 19-mer (SEQ ID NO: 11). ММП-9 смешивался с пептидом 19-mer (SEQ ID NO: 11) перед проведением ФРПЭ анализа. Использовались следующие концентрации пептида 19-mer (SEQ ID NO: 11): 0 мМ (черные кружки), 0.01 мМ (белые кружки), 0.03 мМ (черные квадраты), 0.06 мМ (белые квадраты), 0.125 мМ (черные треугольники), 0.25 мМ (белые треугольники), 0.5 мМ (крестики), 1 мМ (перевернутые черные треугольники), 2 мМ (перевернутые белые треугольники).
На Фиг.5 приведен график ингибирования активности ММП-9 пептидом вырезаемого домена 10-mer (SEQ ID NO: 13). ММП-9 смешивался с пептидом 10-mer (SEQ ID NO: 13) перед проведением ФРПЭ анализа. Использовались следующие концентрации пептида 10-mer (SEQ ID NO: 13): 0 мМ (черные треугольники), 0.25 мМ (белые треугольники), 0.5 мМ (перевернутые белые треугольники), 1.0 мМ (перевернутые черные треугольники), 2.0 мМ (крестики).
На Фиг.6 показано ингибирование активности ММП-9 пептидом вырезаемого домена 9-mer (SEQ ID NO: 12). ММП-9 смешивался с пептидом 9-mer (SEQ ID NO: 12) перед проведением ФРПЭ анализа. Использовались следующие концентрации пептида 9-mer (SEQ ID NO: 12): 0 мМ (черные треугольники), 0.25 мМ (белые треугольники), 0.5 мМ (перевернутые белые треугольники), 1.0 мМ (перевернутые черные треугольники), 2.0 мМ (крестики).
На Фиг.7 показано ингибирование активности ММП-9 пептидом вырезаемого домена 19-mer (SEQ ID NO: 11). ММП-9 смешивался с пептидом 19-mer (SEQ ID NO: 11) перед проведением флуоресцентного анализа коллагена. Использовались следующие концентрации пептида 19-mer (SEQ ID NO: 11): 0 мМ (черные кружки), 0.06 мМ (белые ромбики), 0.1 мМ (белые квадраты), 0.25 мМ (белые кружки), 0.5 мМ (крестики).
На Фиг.8 показано продолжительное ингибирование активности ММП-9 пептидом вырезаемого домена 19-mer (SEQ ID NO: 11). ММП-9 смешивался с пептидом 19-mer (SEQ ID NO: 11) перед проведением флуоресцентного анализа коллагена. Использовались следующие концентрации пептида 19-mer (SEQ ID NO: 11): 0 мМ (черные кружки), 0.06 мМ (белые ромбики), 0.1 мМ (белые квадраты), 0.25 мМ (белые кружки), 0.5 мМ (крестики).
На Фиг.9 показано продолжительное ингибирование активности ММП-9 пептидом вырезаемого домена 10-mer (SEQ ID NO: 13). ММП-9 смешивался с пептидом 10-mer (SEQ ID NO: 13) перед проведением флуоресцентного анализа коллагена. Использовались следующие концентрации пептида 10-mer (SEQ ID NO: 13): 0 мМ (белые кружки), 0.1 мМ (белые ромбики), 0.2 мМ (белые квадраты), 0.4 мМ (крестики).
На Фиг.10 показано продолжительное ингибирование активности ММП-9 пептидом вырезаемого домена 9-mer (SEQ ID NO: 12). ММП-9 смешивался с пептидом 9-mer (SEQ ID NO: 12) перед проведением флуоресцентного анализа коллагена. Использовались следующие концентрации пептида 9-mer (SEQ ID NO: 12): 0 мМ (черные кружки), 0.06 мМ (белые ромбики), 0.1 мМ (белые квадраты), 0.25 мМ (белые кружки), 0.5 мМ (крестики).
На Фиг.11 приведены профили элюирования ВЭЖХ для типичной реакции сплайсинга. Стрелки указывают, что площадь первого пика уменьшается в процессе реакции (пик проферментной формы ММП-9), в то время как площади двух следующих пиков (зрелый ММП-9 и N-концевой продукт расщепления, соответственно) увеличиваются.
На Фиг.12 показано превращение проферментной формы ММП-9 в N-концевой и С-концевой домены под действием стромилизина. Про-ММП-9 реагировала со стромилизином в присутствие пептида 19-mer (SEQ ID NO: 11) в следующих концентрациях: 0 мкМ (черные кружки), 0.5 мкМ (белые квадраты) или 1.0 мкМ (черные квадраты). В указанные моменты времени отбиралась аликвота и подвергалась ВЭЖХ. Площадь пика проферментной формы матриксной металлопротеиназы суммировалась и принималась за 100 процентов для пробы, взятой в нулевой момент времени. Белые кружки обозначают проферментную форму матриксной металлопротеиназы, инкубируемую в буферном растворе, не содержащем стромилизина или пептида 19-mer (SEQ ID NO: 11).
На Фиг.13А приведены данные изотермического титрометрического калориметрического анализа взаимодействия ингибиторного пептида 19-mer (SEQ ID NO: 11) с ферментом ММП-9. Каждый пик обозначает количество тепла, выделившегося после введения и последующей реакции связывания. На Фиг.13В изображена изотерма связывания, полученная путем интегрирования по времени величин пиков для каждой инъекции из Фиг.13А.
На Фиг.14 приведены данные изотермического титрометрический калориметрического анализа взаимодействия ингибиторного пептида 19-mer (SEQ ID NO: 11) с ферментом ММП-2. На Фиг.14А показаны исходные данные изотермического калориметрического анализа для титрования пептида 19-mer (SEQ ID NO: 11) (1 мМ) в растворе, содержащем ММП-2 (20 мкМ), 20 мМ какодилата (рН 6.8) и 10 мМ NaCl при температуре 25°С. Каждый пик обозначает количество тепла, выделившегося после введения и последующей реакции связывания. На Фиг.14В изображена изотерма связывания, полученная путем интегрирования по времени величин пиков для каждой инъекции из Фиг.14А.
На Фиг.15 изображена изотерма поверхностного плазменного резонансного связывания при пропускании раствора, содержащего пептид 19-mer (SEQ ID NO: 11), по поверхности иммобилизованного ММП-9.
На Фиг.16 изображена гистограмма, отображающая процентное соотношение живых клеток по сравнению с положительным контролем на кожной модели после обработки пептидом в двух различных концентрациях. Первый образец, обработанный солевым фосфатным буферным раствором (PBS), служил в качестве положительного контроля для определения степени жизнеспособность клеток, принимаемой за 100%. Второй образец служил в качестве отрицательного контроля, в котором клетки подвергались воздействию 1% Triton-X100, демонстрируя, что данный анализ позволяет регистрировать гибель клеток. Следующие три образца обрабатывались пептидами 9-mer (SEQ ID NO: 12), 10-mer (SEQ ID NO: 13) и 19-mer (SEQ ID NO: 11) в концентрации 500 мкМ. Последние три образца обрабатывались пептидами 9-mer (SEQ ID NO: 12), 10-mer (SEQ ID NO: 13) и 19-mer (SEQ ID NO: 11) в концентрации 2 мМ. Приведенные данные даны для усредненных значений по трем экспериментам.
На Фиг.17 графически отображена динамика заживления ран у диабетических мышей db/db. На графике показано изменение относительной средней площади раны у мышей в зависимости от количества дней, прошедших после ее нанесения при обработке либо обычным солевым раствором (белые кружки) или 20 мкг/мл пептида 19-mer (SEQ ID NO: 11) (черные кружки). Приведенные данные даны для усредненного относительного диаметра раны, полученного по результатам измерения для десяти экспериментальных животных.
На Фиг.18 изображена гистограмма пролиферации нормальных человеческих кожных фибробластов (Clonetics, CC-2509) в присутствие пептида 19-mer (SEQ ID NO: 11) и без него. Клеточный рост определялся по оптической плотности (OD) на длине волны 490 нм для трех различных концентраций пептида. Столбик "19mer6" характеризует рост клеток в присутствие пептида 19-mer (SEQ ID NO: 11) при концентрации 1×10-6 М. Столбик "19mer5" характеризует рост клеток в присутствие пептида 19-mer (SEQ ID NO: 11) при концентрации 1×105 М. Столбик "19mer4" характеризует рост клеток в присутствие пептида 19-mer (SEQ ID NO: 11) при концентрации 1×10-4 М. Контрольные клетки выращивались без добавления пептида.
На Фиг.19 также изображена гистограмма пролиферации нормальных человеческих кератиноцитов в присутствие пептида 19-mer (SEQ ID NO: 11) и без него. Как видно из Фиг.19, добавление пептида 19-mer (SEQ ID NO: 11) приводит к усилению роста кератиноцитов в зависимости от применяемой дозы. Контрольные клетки без добавления пептида 19-mer имели наименьшую клеточную плотность. Клетки, получавшие лишь 1×10-5 М пептида 19-mer (SEQ ID NO: 11, обозначенные "19mer5" на Фиг.19), имели значительно большую клеточную плотность (Р>0.01), чем клетки, не получавшие пептида 19-mer. Клетки, получавшие 1×10-4 М пептида 19-mer (обозначенные "19mer4" на Фиг.19), демонстрировали еще более интенсивный клеточный рост (Р>0.001). Однако клетки, получавшие 1×10-6 М пептида 19-mer (обозначенные "19mer6" на Фиг.19), демонстрировали достаточно слабую клеточную пролиферацию (Р>0.05), что было признано статистически незначимым.
На Фиг.20 изображена 48-луночная хемотаксическая камера (Neuroprobe, Inc.), используемая для измерения миграции нормальных человеческих кожных фибробластов (НЧКФ).
На Фиг.21А и В показана миграция нормальных человеческих кожных фибробластов (НЧКФ). На Фиг.21А изображена мембрана для измерения миграции с 8 мкм порами (выглядящими как кружки) без клеток НЧКФ (300-кратное увеличение). На Фиг.21В изображена та же мембрана после миграции НЧКФ при добавлении препарата положительного контроля (плазматический фибронектин 1.25 мкг/мл). Эта фотография сделана со 300-кратным увеличением. Ядра клеток НЧКФ окрашены в фиолетовый цвет. Некоторые клетки НЧКФ мигрировали через мембрану, в то время как другие застряли в 8 мкм порах.
На Фиг.22 изображена гистограмма, отображающая процентное соотношение мигрирующих нормальных человеческих кожных фибробластов (НЧКФ) по отношению к мигрирующим НЧКФ в экспериментах с положительным контролем (плазматический фибронектин) при различных концентрациях пептида 19-mer (SEQ ID NO: 11). Поскольку некоторые хемотаксические вещества обладают очень узким диапазоном активных концентраций, в начальных экспериментах использовались десятикратные разведения пептида 19-mer. На гистограмме приведены средние значения по трем отдельным экспериментам (данные для концентрации 100 мкг/мл отображают среднее значение по шести экспериментам). Концентрации 1000 и 100 мкг/мл пептида 19-mer (SEQ ID NO: 11) являлись хемотаксическими для фибробластов (55±3% и 46±3% в положительном контроле соответственно). Количество мигрирующих фибробластов при использовании концентраций пептида 19-mer (SEQ ID NO: 11) меньше 100 мкг/мл было лишь примерно в два раза выше, чем в эксперименте с отрицательным контролем и что было признано статистически незначимым.
На Фиг.23 изображена гистограмма, отображающая процентное соотношение мигрирующих нормальных человеческих кожных фибробластов (НЧКФ) по отношению к мигрирующим НЧКФ в экспериментах с положительным контролем (фибронектин) при различных концентрациях пептида 19-mer (SEQ ID NO: 11) и его производных. При концентрации 100 мкг/мл ацетилированный пептид 19-mer (SEQ ID NO: 11) (Ac-19-mer) инициировал миграцию НЧКФ до примерно той же степени, что и неацетилированный пептид 19-mer, но при более высоких концентрациях Ас-19-mer действовал менее эффективно. Пептиды 9-mer (SEQ ID NO: 12) и 10-mer (SEQ ID NO: 13) активизировали миграцию НЧКФ только при концентрации 1000 мкг/мл. Интересно, что пептиды 14-mer TMRKPRCGNPDVAN (SEQ ID NO: 19) и 17-mer TLKAMRKPRCGNPDVAN (SEQ ID NO: 20) не обладают хемотаксической активностью для НЧКФ ни при каких концентрациях (данные не показаны). Начало последовательностей пептидов 14-mer TMRKPRCGNPDVAN (SEQ ID NO: 19) и 17-mer TLKAMRKPRCGNPDVAN (SEQ ID NO: 20), полученных из ферментов матриксных металлопротеиназ, лишь немного смещено к N-концу. Следовательно, аминокислотная последовательность пептида существенна для индукции миграции НЧКФ.
На Фиг.24 изображена гистограмма, свидетельствующая, что добавление пептида 19-mer (SEQ ID NO: 11) приводит к усилению синтеза коллагена в клетках человеческих кожных фибробластов. Контрольные человеческие кожные фибробласты, не получавшие пептида 19-mer (SEQ ID NO: 11), производили лишь небольшое количество коллагена. Напротив, клетки, получавшие лишь 1×10-6 М пептида 19-mer (SEQ ID NO: 11, обозначенные "19mer6" на Фиг.24) или 1×10-5 М пептида 19-mer (SEQ ID NO: 11, обозначенные "19mer5" на Фиг.24), имели значительно большую клеточную плотность (Р>0.001), чем клетки, не получавшие пептида 19-mer.
Подробное описание изобретения
Объектом настоящего изобретения являются ингибиторы матриксных металлопротеиназ, пригодные для противодействия результатам воздействия старения на кожу и для стимулирования процессов заживления ран. В целом, представленные ингибиторы и композиции способствуют заживлению ран, предотвращают рубцевание, улучшают цвет кожи, снижают образование морщин и стимулируют развитие гладкой здоровой кожи.
Матриксные металлопротеиназы синтезируются in vivo в виде неактивных проферментов. Протеолитическое расщепление профермента приводит к активации и образованию зрелой матриксной металлопротеиназы. Отщепляемая пептидная последовательность является лидерной последовательностью профермента длиной около от 100 до 110 аминокислот, которая располагается на аминоконце белка. Согласно данному изобретению, эти лидерные пептиды профермента могут блокировать активный участок матриксных металлопротеиназ и ингибировать активность матриксной металлопротеиназы. Применение лидерных пептидов профермента матриксной металлопротеиназы снижает скорость разрушения внеклеточного матрикса и ускоряет процесс заживления ран.
Большинство стратегий ингибирования заключается в подавлении ферментативной активности матриксных металлопротеиназ с помощью небольших органических молекул. Эти составы зачастую оказываются токсичными для организма и содержат искусственные молекулы, не встречающиеся в природе. Использование природных пептидов для активированных матриксных металлопротеиназ обеспечивает высокую степень контроля за уровнем протеиназной активности, не оказывая токсического побочного действия. В отличие от стратегий ингибирования с использованием небольших молекул пептиды, заявленные в данном изобретении, могут использоваться для ингибирования активации отдельных или всех классов матриксных металлопротеиназ одновременно. Эти пептиды могут непосредственно наноситься на кожу, вводиться в рану, или их можно привязывать или наносить посредством кожных покрытий или перевязочного материала для ран.
Данное изобретение обеспечивает высокую степень контроля за уровнем протеиназной активности для заживления хронических ран и улучшения последствий старения. Например, поскольку при заживлении хронических ран требуется некоторый уровень протеиназной активности (Agren et al., 1999), специалисту в данной области может потребоваться лишь частичное ингибирование протеиназной активности. Регулируя тип и количество применяемого ингибиторного пептида, можно контролировать степень ингибирования матриксной металлопротеиназы.
Пептиды
Согласно настоящему изобретению пептиды, имеющие последовательности, родственные лидерной последовательности проферментной формы матриксной металлопротеиназы в области вырезаемого участка, пригодны для заживления ран и для стимулирования развития здоровой кожи. Эти пептиды ингибируют активность различных типов матриксных металлопротеиназ и способствуют клеточному росту и миграции фибробластов и кератиноцитов.
Положение, по которому отщепляется лидерная последовательность проферментной формы матриксной металлопротеиназы, располагается около 110 аминокислотного положения в аминокислотной последовательности профермента. Пептидные ингибиторы данного изобретения имеют последовательности, родственные любой области внутри профермента в пределах примерно с 70 по 120 аминокислоту. Подобные пептиды ингибируют активность многих типов матриксных металлопротеиназ. Данные пептиды могут также предотвращать активацию проферментной формы матриксных металлопротеиназ, а также ингибировать ферментативную активность зрелых матриксных металлопротеиназ. Пептиды, содержащие последовательности, обладающие более высокой консервативностью среди различных матриксных металлопротеиназ, например последовательности, расположенные ближе к N-концевой области вырезаемого участка, могут использоваться для создания ингибиторов, в целом обладающих эффективностью в отношении широкого спектра матриксных металлопротеиназ. В то же время п