Противоопухолевая, антибактериальная и антивирусная фармацевтическая композиция (ее варианты)
Иллюстрации
Показать всеКомпозиция по первому варианту содержит азотнокислое серебро, гексаметилентетрамин, тиосульфат натрия, альфа-аспарагиновую кислоту или аспарагин, никотиновую кислоту и воду в указанных в формуле изобретения количествах. Композиция по второму варианту содержит азотнокислое серебро, гексаметилентетрамин или имидазол, имидазолсодержащее соединение платины цис-[Pt(NH3)2Im2]Cl3 или цис-[Pt(NH2OH)2Im2]Cl2, альфа-аспарагиновую кислоту или аспарагин, никотиновую кислоту и воду в указанных в формуле изобретения количествах. Композиции по изобретению обладают повышенной противоопухолевой активностью с одновременным антибактериальным и антивирусным воздействием на организм. 2 н.п. ф-лы, 3 ил., 6 табл.
Реферат
Предлагаемая композиция (ее варианты) относится к области медицины и ветеринарии, а именно к веществам с комплексной противоопухолевой, антибактериальной и антивирусной активностью, и может быть использована в фармацевтике при производстве препаратов медицинского и ветеринарного назначения.
Известна противоопухолевая и антибактериальная композиция, включающая соединения серебра, в частности нитрат гексаметилентетрамин серебра и тетрайод-гексаметилентетрамин (Пат. RU 2181050, МПК7 А61K 33/18, А61K 33/38, 2002 г.). Однако известная композиция является достаточно токсичной и, кроме того, обладает плохой растворимостью в воде, вследствие чего не может быть использована для изготовления терапевтических препаратов внутривенного введения.
Известны также противоопухолевые композиции на основе платины (Патент RU 2074861, МПК 6 C07F 15/00, 03.10.1997) и ее соединений, таких как производные дихлорида цис-диаминдиимидазолил платины, проявляющие антипролиферативную и цитостатическую активность (Пат. RU 2114858, МПК6 C07F 15/00, А61K 31/295, 1998 г.). Однако известные композиции имеют также достаточно высокую токсичность и, кроме того, не обладают комплексным воздействием на организм вследствие недостаточно выраженных антибактериальных свойств.
Наиболее близким к заявляемому решению по назначению, совокупности существенных признаков и достигаемому эффекту является цитостатический и антивирусный препарат, который содержит (мас.%): гексаметилентетрамин, или имидазол, или антипирин - 0,007-0,70; азотнокислое серебро - 0,0085-0,85; тиосульфат натрия - 0,0284-2,84; вода или физиологический раствор - до 100% (Пат. RU 2094048, 1997 г.).
Указанное средство в связи с использованием солей серебра в качестве цитостатиков является более прогрессивным противоопухолевым средством, однако существенным недостатком композиции-прототипа является его недостаточно высокая противоопухолевая активность, которая ограничена токсичностью азотнокислого серебра, оказывающего негативное воздействие на живые организмы. Кроме того, данная композиция не решает задачу комплексной терапии, включающей антибактериальное воздействие на организм. Вместе с тем, злокачественные опухоли и лейкозы часто (в большинстве случаев) осложнены бактериальными инфекциями. Это объясняется снижением защитных функций иммунной системы больного организма, в том числе побочным токсическим действием известных химиопрепаратов. Кроме того, в настоящее время антипирин снят с производства в связи с наличием более эффективных компонентов.
Основной задачей, на решение которой направлена заявляемая группа изобретений, является создание фармацевтических композиций, обладающих более высокой по сравнению с известным средством противоопухолевой активностью и одновременным антибактериальным и антивирусным воздействием на организм. Дополнительным техническим результатом заявляемых изобретений является снижение токсического воздействия лекарственных средств на живой организм.
Указанная задача решается тем, что фармацевтическая композиция, содержащая соль серебра, гексаметилентетрамин, тиосульфат натрия и воду в качестве основы, дополнительно содержит альфа-аспарагиновую кислоту или аспарагин и никотиновую кислоту при следующем соотношении компонентов, мас.%:
| азотнокислое серебро | 0,016-1,6 |
| гексаметилентетрамин | 0,03-1,4 |
| тиосульфат натрия | 0,02-5,0 |
| альфа-аспарагиновая кислота или аспарагин | 0,07-0,70 |
| никотиновая кислота | 0,07-0,70 |
| вода | остальное до 100 |
Другим вариантом решения поставленной задачи является дополнительное введение в композицию имидазолсодержащих соединений платины цис-[Pt(NH3)2Im2]Cl2 или цис-[PtNH2(OH)2Im2]Cl2 при следующем количественном содержании, мас.%:
| азотнокислое серебро | 0,016-1,6 |
| гексаметилентетрамин или имидазол | 0,03-1,4 |
| цис-[Pt(NH3)2Im2]Cl2 или цис-[Pt(NH2OH)2Im2]Cl2 | 0,056-5,6 |
| альфа-аспарагиновая кислота или аспарагин | 0,07-0,70 |
| никотиновая кислота | 0,07-0,70 |
| вода | остальное до 100 |
Выполнение заявляемой композиции на основе соединений платины удорожает стоимость препарата, но при этом достигается повышение противоопухолевой активности препарата при одновременном снижении токсичности, что делает композицию более предпочтительной при медицинском применении.
В заявляемой группе изобретений увеличение содержания основного противоопухолевого и бактерицидного компонента - азотнокислого серебра - в пределах 0,016-1,6 не приводит к увеличению общего токсического воздействия композиции за счет включения в нее гексаметилентетрамина, альфа-аспарагиновой кислоты или аспарагина и никотиновой кислоты в заявленных пределах. Перечисленные компоненты по механизму воздействия на живые организмы проявляют себя в качестве синергетических соединений, снижающих токсическое воздействие азотнокислого серебра. В первом варианте заявляемой группы изобретений таким же образом проявляет себя тиосульфат натрия, а во втором варианте - гексаметилентетрамин или имидазол.
Наличие соединений платины во втором варианте группы изобретений также повышает его противоопухолевую активность при одновременном снижении токсичности, что делает композицию более предпочтительной при медицинском применении. Первый вариант композиции предпочтителен при применении в ветеринарии, поскольку он является более дешевым препаратом.
Анализ уровня лекарственных препаратов, проведенный заявителем, позволил установить, что в доступных патентных и медицинских источниках отсутствуют аналоги, характеризующиеся совокупностью признаков, тождественных всем признакам заявляемого вещества. Следовательно, заявляемое изобретение соответствует условию патентоспособности "новизна".
В результате поиска известных решений в данной и смежных областях с целью выявления признаков, совпадающих с отличительными признаками прототипа, не выявлены решения, имеющие признаки, полностью совпадающие с отличительными признаками изобретения. Известность и очевидность влияния заявленных отличительных признаков на достижение указанного технического результата не подтверждена. Это позволяет говорить о соответствии заявленного решения условию патентоспособности "изобретательский уровень".
На Фиг.1 представлены диаграммы, иллюстрирующие зависимость пролиферативной активности злокачественных клеток заявляемой композиции в минимальных количественных пределах компонентов по сравнению с прототипом.
На Фиг.2 представлены диаграммы, иллюстрирующие зависимость пролиферативной активности злокачественных клеток заявляемой композиции в оптимальных количественных пределах компонентов по сравнению с прототипом.
На Фиг.3 представлены диаграммы, иллюстрирующие зависимость пролиферативной активности злокачественных клеток заявляемой композиции в максимальных количественных пределах компонентов по сравнению с прототипом.
Примеры промышленной применимости и эффективности.
При выполнении примеров использовался водный раствор композиции, включающий известные и новые компоненты, при их различных количественных сочетаниях.
В таблице 1 отражены данные по влиянию заявляемой композиции на гибель злокачественных клеток, доказывающие ее противоопухолевую активность. В таблице 2 приведены данные по противоопухолевой активности заявляемой композиции на живых организмах. В таблице 3 отражены данные по антибактериальной активности заявляемой композиции. В таблице 4 приведены данные токсикологических испытаний по первому и второму вариантам заявляемых композиций в сравнении с известным онкологическим средством на основе платины - цисплатином. В таблице 5 приведены сравнительные данные антивирусной активности заявленной композиции по второму варианту. В таблице 6 приведены данные по оценке противоопухолевой активности заявляемой композиции по второму варианту.
Пример 1
0,016 г азотнокислого серебра смешивают с 0,03 г гексаметилентетрамина и 0,02 г тиосульфата натрия, добавляют 0,07 г альфа-аспарагиновой кислоты и 0,07 г никотиновой кислоты, растворенных в необходимом количестве воды. Отмечается мутность полученного раствора. Композицию исследуют на противоопухолевую, антибактериальную и антивирусную активность.
Пример 2
Смешивают 1 г азотнокислого серебра, 0,8 г гексаметилентетрамина и 3 г тиосульфата натрия. Добавляют 0,4 г никотиновой кислоты и 0,4 г альфа-аспарагиновой кислоты или аспарагина, растворенных в необходимом количестве воды. Получают раствор, который исследуют на противоопухолевую, антибактериальную и антивирусную активность.
Пример 3
1,6 г азотнокислого серебра смешивают с 1,4 г гексаметилентетрамина и 5 г тиосульфата натрия, добавляют 0,7 г аспарагина и 0,7 г никотиновой кислоты, растворенных в необходимом количестве воды. Часть реагентов выпадает в осадок. Композицию исследуют на противоопухолевую, антибактериальную и антивирусную активность.
Проведено сравнение цитостатической противоопухолевой активности заявляемой композиции по второму варианту (состав, включающий имидазолсодержащие соединения платины) на опухолевые клетки по включению 3H-тимидина через 24 часа инкубации (количество импульсов в минуту). Измерение радиоактивности проведено на бета-счетчике Mark - III. Оценка цитостатической активности заявляемой композиции проводили на культуре клеток эритролейкоза человека линии К-562 и HUT-102, культивируемых в среде RPMI-1640 (Serva) с 10% эмбриональной телячьей сывороткой (2×105 клеток/мл) и краткосрочной культуре клеток лейкоза Раушера и карциномы Эрлиха по включению Н-тимидина в опухолевые клетки и окраске трипановым синим через 24 часа и 48 часов инкубации.
Пример 4
0,016 г азотнокислого серебра смешивают с 0,03 г гексаметилентетрамина, добавляют 0,056 г цис-[Pt(NH3)2Im2]Cl2, добавляют 0,07 г альфа-аспарагиновой кислоты или аспарагина и 0,07 г никотиновой кислоты, растворенных в необходимом количестве воды. Композицию исследуют на противоопухолевую, антибактериальную и противовирусную активность.
Пример 5
0,016 г азотнокислого серебра смешивают с 0,03 г имидазола, добавляют 0,056 г цис-[Pt(NH3)2Im2]Cl2, 0,07 г альфа-аспарагиновой кислоты или аспарагина и 0,07 г никотиновой кислоты (минимальное количественное содержание компонентов), растворенных в необходимом количестве воды. Композицию исследуют на противоопухолевую, антибактериальную и антивирусную активность.
Пример 6
0,016 г азотнокислого серебра смешивают с 0,07 г гексаметилентетрамина, добавляют 0,0056 г цис-[Pt(NH2OH)2Im2]Cl2, 0,07 г альфа-аспарагиновой кислоты или аспарагина и 0,07 г никотиновой кислоты, растворенных в необходимом количестве воды. Композицию исследуют на противоопухолевую, антибактериальную и антивирусную активность.
Пример 7
1,6 г азотнокислого серебра смешивают с 0,7 г имидазола, добавляют 5,6 г цис-[Pt(NH2OH)2Im2]Cl2 или цис-[Pt(NH3)2Im2]Cl2, 0,07 г альфа-аспарагиновой кислоты или аспарагина и 0,07 г никотиновой кислоты (максимальное количественное содержание компонентов), растворенных в необходимом количестве воды. Отмечается появление осадка и нестабильность раствора. Композицию исследуют на противоопухолевую, антибактериальную и антивирусную активность.
Пример 8
Смешивают 1 г азотнокислого серебра, 0,8 г гексаметилентетрамина и 4 г цис-[Pt(NH2OH)2Im2]Cl2 или цис-[Pt(NH3)2Im2]Cl2, добавляют 0,4 г никотиновой кислоты и 0,4 г альфа-аспарагиновой кислоты или аспарагина (оптимальное количественное содержание компонентов), растворенных в необходимом количестве воды. При оптимальном соотношении компонентов, лежащем в рамках заявленного диапазона, получают устойчивый прозрачный раствор, который исследуют на противоопухолевую и антибактериальную активность.
Пример 9
В композиции по прототипу 0,0085 г азотнокислого серебра смешивают с 0,007 г гексаметилентетрамина (уротропина), добавляют 0,0284 г гидрата тиосульфата натрия. Получают прозрачный раствор, который исследуют на цитостатическую и антивирусную активность.
Пример 10
В композиции по прототипу 0,085 г азотнокислого серебра смешивают с 0,07 г гексаметилентетрамина, добавляют 0,284 г гидрата тиосульфата натрия, растворенного в воде. Получают прозрачную жидкость, которую исследуют на цитостатическую и антивирусную активность.
Пример 11
В композиции по прототипу 0,85 г азотнокислого серебра смешивают с 0,7 г гексаметилентетрамина, добавляют 2,84 г растворенного в воде гидрата тиосульфата натрия. Получают прозрачную жидкость, которую исследуют на цитостатическую и антивирусную активность.
Экспериментальные материалы, подтверждающие существенность заявленных признаков для решения поставленной технической задачи, приведены в таблицах и на графиках фиг.1, фиг.2, фиг.3.
В таблице 1 представлены результаты опытов по влиянию заявляемой композиции на опухолевые клетки, из которых видно, что наиболее выраженное противоопухолевое действие оказала композиция по примеру 2 (практически полное подавление злокачественных клеток). Как следует из сравнительных данных таблицы 1, при нижней границе количественного соотношения компонентов композиция по прототипу оказывает очень малое действие на тестовые клетки К-562 и HUT-102
Более детальное сравнение заявляемой композиции с композицией-прототипом, учитывающее различное противоопухолевое действие при разном количественном соотношении компонентов, подтверждает достижение технического результата при разработке заявленной композиции во всем заявленном интервале количественного содержания компонентов.
В таблице 2 представлены данные по изучению противоопухолевой активности заявляемой композиции на мышах СВА с карциномой Эрлиха (при трехкратном внутрибрюшинном введении в дозе 30 мг/кг). Лечение начинали через 24 часа после перевивки 7×106 опухолевых клеток/мышь. Использование предложенной композиции способствует увеличению продолжительности жизни мышей в 2 раза в сравнении с контролем (при отсутствии лечения).
Таблица 2 характеризует противоопухолевую активность заявляемой композиции in vivo для состава заявляемой композиции по первому варианту. Как следует из данных таблицы 2, продолжительность жизни мышей с карциномой Эрлиха в контроле составила 19,7 дней, при лечении заявленной композицией по варианту 1, для состава по примеру 2 - 53,7 дня. При этом известно (патент RU №2094048), что использование композиции-прототипа увеличивает продолжительность жизни опытных животных с 18,6 дней (контроль) до 41,3 дней (лечение). Следовательно, композиция-прототип увеличивает продолжительность жизни опытных животных в 2,22 раза, в то время как использование заявленной композиции в проведенных при аналогичных условиях опытах увеличивает продолжительность жизни опытных животных в 2,73 раза.
Таким образом, использование предложенной композиции способствует увеличению продолжительности жизни мышей более чем в 2 раза в сравнении с контролем (при отсутствии лечения) и значительно повышает противоопухолевую активность по сравнению с прототипом.
Антибактериальная и антивирусная активность
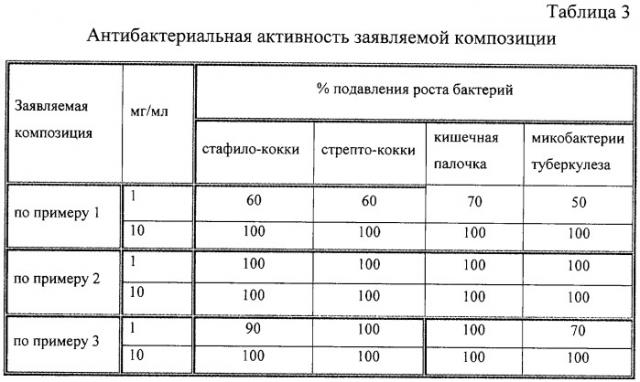
Антибактериальная активность заявляемой композиции определялась методом серийных разведении препаратов в бактериальных культурах в концентрации 1 мг/мл, 10 мг/мл. Препараты цис-[Pt(NH3)2Im2]Cl2 или цис-[Pt(NH2OH)2Im2]Cl2 оказывают аналогичное по направленности действие в рамках поставленной технической задачи. При доказательстве антивирусного действия заявленной композиции использовался как цис-[Pt(NH3)2Im2]Cl2, так и [Pt(NH2OH)2Im2]Cl2. Результаты опытов после 24 ч роста микроорганизмов при 37°С представлены в таблице 3. Из данных таблицы следует, что заявляемая композиция оказывает выраженное цитотоксическое действие на бактериальные клетки, вызывая 100%-ную их гибель при изученных концентрациях (на границе диапазона при оптимальном составе - 90%, при других составах - 50-70%).
Обработка композицией вируса лейкоза Раушера в концентрации 1 мг/мл и 10 мг/мл в течение 4 часов с последующим внутрибрюшинным введением вирусного инокулума мышам BALB/c оказало 100% защитный эффект от летального действия вируса, не вызывая гибели животных.
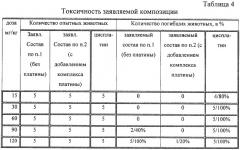
Исследования острой токсичности оптимального состава композиции (примеры 2 и 8) проведены на мышах линии BALB/c при внутрибрюшинном введении водного раствора в интервале от 15 до 120 мг/кг (таблица 4). Наблюдение за животными осуществлялось в течение 30 дней. Для сравнения выбран клинический препарат цисплатин. Токсичность заявляемой композиции заметно ниже, чем токсичность этого известного препарата.
Применение заявленной композиции ингибировало развитие вирусного гемобластоза у подопытных животных: процент гибели подопытных животных составил всего 8,5 процентов (3 из 35), в отличие от контрольной группы нелеченых животных (35 мышей), где наблюдался 100% летальный эффект.
В таблице 5 приведены сравнительные данные антивирусной активности заявленной композиции по второму варианту на примере ингибирования вирусного гемобластоза для заявляемой композиции по составам с минимальным (пример 5), оптимальным (пример 8) и максимальным (пример 7) количественным содержанием компонентов в заявленных интервалах. Как следует из данных таблицы 5, при оптимальном количественном составе компонентов в заявляемой композиции процент гибели животных является минимальным, при этом композиция проявляет антивирусную активность во всем заявленном интервале.
В таблице 6 представлены данные по изучению противоопухолевой активности заявляемой композиции на мышах СВА с мастоцитомой Р-815 (при трехкратном внутрибрюшинном введении композиции в дозе 30 мг/кг). Как видно из таблицы, использование предложенной композиции вызывает 3-кратное увеличение продолжительности жизни подопытных животных в сравнении с контролем (без лечения).
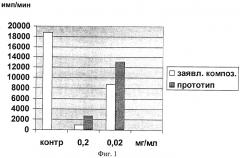
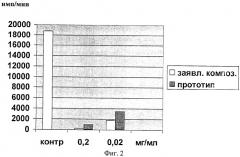
Противоопухолевое цитостатическое действие платиносодержащей композиции по примерам 5, 8 и 7 для минимального, оптимального и максимального количественного содержания компонентов иллюстрируется на Фиг.1, 2, 3 соответственно. Использованы концентрации 0,02 и 0,2 мг/мл для заявляемой композиции и проведено сравнение с воздействием прототипа при тех же концентрациях. На диаграммах показано действие заявляемой композиции на клетки лейкоза Раушера по включению 3H-тимидина через 24 часа инкубации в сравнении с контролем (имп/мин). Контроль, т.е. культивирование злокачественных клеток в тех же условиях без воздействия платиносодержащей композицией, составляет 18750 имп/мин. Из диаграмм видно, что во всем заявленном диапазоне заявляемая композиция (светлые столбцы диаграмм) имеет более выраженный ингибирующий эффект по сравнению с композицией-прототипом (более темные столбцы), что позволяет почти полностью подавить пролиферацию злокачественных клеток. Для всех приводимых составов, указанных в примерах 5, 7, 8, установлен дозозависимый эффект подавления пролиферации злокачественных клеток.
Как следует из диаграмм на фиг.1, при использовании заявляемой композиции (с компонентами в пределах, указанных в примере 5) и композиции по прототипу (с компонентами по примеру 9) цитостатическое действие (в имп/мин) составляет: при концентрации 0,2 мг/мл для заявляемой композиции - 930, для прототипа - 2700; при концентрации 0,02 мг/мл для заявляемой композиции - 8700, для прототипа - 13100.
Из диаграмм фиг.2, в которых приведены сравнительные величины цитостатической активности заявляемой композиции (пример 8) с оптимальным содержанием компонентов и композиции по прототипу в пределах компонентов (пример 10) при концентрации 0,2 мг/мл, для заявляемой композиции цитостатическое действие (имп/мин) составляет 310, для прототипа - 1000; при концентрации 0,02 мг/мл для заявляемой композиции - 1770, для прототипа - 3480.
Из диаграмм фиг.3, в которых приведены сравнительные величины цитостатической активности заявляемой композиции (пример 7) с максимальным содержанием компонентов и композиции по прототипу (пример 11) при концентрации 0,2 мг/мл, для заявляемой композиции цитостатическое действие (имп/мин) при концентрации 0,2 мг/мл составляет 460 (имп/мин), для прототипа - 1150; при концентрации 0,02 мг/мл для заявляемой композиции - 3600, для прототипа - 9000.
Кроме того, проведена специальная серия опытов по курсовому трехкратному введению платиносодержащей композиции (внутрибрюшинно в дозе 30 мг/кг) 35 мышам с лейкозом Раушера через 24 часа после перевивки вирусного инокулума. Применение заявленной платиносодержащей композиции ингибировало развитие гемобластоза у подопытных животных, процент выживания составил 90, в отличие от контрольной группы нелеченых животных (35 мышей), где наблюдался 100% летальный эффект.
Заявляемая композиция (ее варианты) показала свою высокую эффективность и комплексное воздействие на экспериментальных животных и культуры клеток. При этом токсичное воздействие фармацевтической композиции (ее вариантов) является менее выраженным по сравнению с известными средствами.
| Таблица 1Противоопухолевая активность заявляемой композиции in vitro | |||||||||||||
| Погибшие клетки, % | |||||||||||||
| Вид клеток | Заявленная композиция, мг/мл | Прототип, мг/мл | Контроль | ||||||||||
| по примеру 1 | по примеру 2 | по примеру 3 | по примеру 9 | по примеру 10 | по примеру 11 | ||||||||
| 1 | 0,1 | 1 | 0,1 | 1 | 0,1 | 1 | 0,1 | 1 | 0,1 | 1 | 0,1 | - | |
| К-562 | 65 | 30 | 100 | 100 | 100 | 70 | 29 | 15 | 90 | 65 | 85 | 60 | 8 |
| HUT-102 | 50 | 25 | 100 | 95 | 100 | 60 | 24 | 14 | 80 | 55 | 70 | 50 | 7 |
| Таблица 2 | |||||||||||||
| Продолжительности жизни мышей с карциномой Эрлиха (дней) | |||||||||||||
| Заявляемый состав (вариант 1, пример 2) | Прототип | Контроль (мыши без лечения) | |||||||||||
| 53,7±4,9 | 44,2±3,1 | 19,7±1,8 |
| Таблица 5 | |||
| Антивирусная активность заявленной композиции (вариант 2) на примере ингибирования вирусного гемобластоза | |||
| процент гибели подопытных животных | |||
| Заявляемый состав по примеру 5 | Заявляемый состав по примеру 8 | Заявляемый состав по примеру 7 | Контроль (без лечения) |
| 20 | 8,5 | 17,1 | 100 |
| Таблица 6 | |||
| Противоопухолевая активность заявляемой платиносодержащей композиции | |||
| Вид опухоли | Заявляемый состав | Контроль (мыши без лечения) | |
| Мастоцитома р-815 | 63, 3+4,4 | 17,0+1,3 |
Литература
1. Пат. RU 2181050. Противоопухолевая и антибактериальная композиция. МПК7 А61К 33/18, А61К 33/38, 2002 г.
2. Пат. RU 2114858. Производные дихлорида цис-диамминдиимидазолил платины, проявляющие антипролиферативную активность, и способ их получения. МПК6 C07F 15/00, А61К 31/295, 1998 г.
3. Пат. RU 2094048, МПК А61К 33/38. Цитостатический и антивирусный состав. Опубл. 27.10.97 г. Прототип.
1. Противоопухолевая, антибактериальная и антивирусная фармацевтическая композиция, содержащая азотнокислое серебро, гексаметилентетрамин, тиосульфат натрия и воду в качестве основы, отличающаяся тем, что она дополнительно содержит альфа-аспаргиновую кислоту или аспарагин и никотиновую кислоту при следующем соотношении компонентов, мас.%:
| азотнокислое серебро | 0,016-1,6 |
| альфа-аспарагиновая кислота | |
| или аспарагин | 0,07-0,7 |
| никотиновая кислота | 0,07-0,7 |
| гексаметилентетрамин | 0,03-1,4 |
| тиосульфат натрия | 0,02-5:0 |
| вода | остальное до 100 |
2. Противоопухолевая, антибактериальная и антивирусная фармацевтическая композиция, содержащая азотнокислое серебро, гексаметилентетрамин или имидазол и воду в качестве основы, отличающаяся тем, что она дополнительно содержит альфа-аспарагиновую кислоту или аспарагин, никотиновую кислоту и имидазолсодержащие соединения платины цис-[Pt(NH3)2Im2]Cl2 или цис-[Pt(NH2OH)2Im2]Cl2 при следующем соотношении компонентов, мас.%:
| азотнокислое серебро | 0,016-1,6 |
| гексаметилентетрамин или | |
| имидазол | 0,03-1,4 |
| цис-[Pt(NH3)2Im2]Cl2 или | |
| цис-[Pt(NH2OH)2Im2]Cl2 | 0,056-5,6 |
| альфа-аспарагиновая кислота | |
| или аспарагин | 0,07-0,7 |
| никотиновая кислота | 0,07-0,7 |
| вода | остальное до 100 |