Способ получения носителя антигенов на основе липидов из морских макрофитов и тритерпенового гликозида кукумариозида
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к носителям антигенов. Предлагаемый носитель представляет собой липид-сапониновый комплекс, состоящий из смеси тритерпенового гликозида, холестерина и глицерогликолипида. В качестве тритерпеновых гликозидов используют кукумариозид А2-2 (КД), а в качестве глицерогликолипидов используют моногалактозилдиацилглицериды (МГДГ) морских макрофитов. Способ включает смешение растворов холестерина и глицерогликолипида в хлороформе, упаривание смеси досуха под вакуумом, добавление 3 весовых частей 0,4-процентного водного раствора кукумариозида. Затем смесь солюбилизируют и доводят суммарную концентрацию холестерина и глицерогликолипида до 2 мг в 1 мл суспензии фосфатно-солевым буфером при рН 7,2 и озвучивают полученную суспензию ультразвуковым дезинтегратором в течение 5 мин при частоте 20 кГц. Способ обеспечивает получение эффективной адъювантной формы носителя. 5 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к биотехнологии и медицине, а именно иммунологии; предлагается способ получения эффективной адъювантной формы носителя, объединяющей систему доставки антигенов и природных медиаторов на основе липидов из морских гидробионтов.
Создание нового поколения вакцин связано с использованием изолированных антигенов, способных обеспечить высокоспецифический иммунный ответ к бактериальным, вирусным патогенам и опухолевым клеткам.
Адъюванты липидной природы применялись задолго до использования минеральных сорбентов в качестве носителей в вакцинных препаратах. Антигены, иммобилизованные на липидных носителях, обладают высокой иммунологической активностью, а сами носители - биодеградируемостью и отсутствием собственной иммуногенности.
Известно получение липидных носителей в виде эмульсий. В частности, в качестве основного компонента предложено использование растительного галактолипида дигалактозидиацилглицерола (ДГДГ) [пат. RU 2127124, опубл. 10.03.1999 г.], образующего в водно-масляных растворах обратные мицеллы и двухслойные везикулы. Однако масляные адъюванты нередко при подкожном и внутримышечном введении вызывают местные реакции воспалительно-некротического характера, а повышенная вязкость затрудняет их введение. Указанная эмульсия не дает существенного прироста иммуногенности белковых и других антигенов, поскольку сам ДГДГ не обладает иммуноадъювантными свойствами. К другим недостаткам эмульгированных антигенов, ограничивающих их применение, относят нестандартность качества и нестабильность при хранении вакцины в готовом виде в результате расслоения фаз.
Известно использование липосом в качестве везикул для представления антигенов [Allison AG, Gregoriadis G. Liposomes as immunological adjuvants. Nature. 1974. N.252. P.252]. Основным структурообразующим компонентом предлагаемых липосом является ламеллярный фосфатидилхолин. Везикулы липосом могут включать как гидрофобный антигенный материал в липидном бислое, так и гидрофильный во внутренней фазе. Показана способность липосом с встроенным антигеном стимулировать антителообразование, активизировать фагоциты и поглощаться макрофагами в различных органах и тканях организма, обеспечивать доставку лекарственных средств (антигенов) в клетку. Антигены в составе липосомальных препаратов могут рассматриваться как иммуноадъюванты. В отличие от других адъювантов в месте инъекции липосомальных препаратов образования гранулем не происходит и даже наблюдается предотвращение токсических проявлений инкапсулированных лекарственных средств. Недостатками, приводящими к ограничению широкого использования вакцинных препаратов на основе предлагаемых липосом, являются:
- химическая и физическая нестабильность везикул;
- относительно умеренный иммунный ответ;
- неспособность стимулировать клеточный иммунный ответ, обеспечивающий противовирусную и противоопухолевую защиту.
Наиболее близким к заявляемому техническому решению по технической сущности и достигаемому результату являться иммуностимулирующий комплекс (ИСКОМ), представляющий собой липид-сапониновые частицы, которые состоят из смеси растительных тритерпеновых гликозидов Quil A, холестерина и фосфолипидов [пат. RU 2120302, опубл. 20.10.1998 г.] (прототип). Такие комплексы не являются липидными везикулами или липосомами и имеют очень специфическую структуру, подтверждаемую данными электронной микроскопии. ИСКОМы - это коллоидные частицы, состоящие из регулярных субъединиц, имеющих открытую сферическую структуру, которые под микроскопом выглядят как кольца. Присутствие антигена для формирования основной искомовой структуры необязательно. Важную роль в стабилизации ИСКОМ играет структурно-механический фактор, обусловленный образованием прочного гликозид-холестеринового комплекса, который, с одной стороны, ограничивает конформационную подвижность жирнокислотных цепей фосфолипидов, а с другой, очевидно, способствует развитию иммунного ответа. Встроенные Quil А сапонины в составе носителя являются мощными иммуностимуляторами и основными формообразующими компонентами. Эффективность ИСКОМ позволяет на порядок снижать дозу вводимых антигенов, индуцировать существенный противовирусный иммунитет и повышать уровень гуморального иммунного ответа в дозах адъюванта намного меньших, чем в обычных вакцинах.
Основным недостатком ИСКОМ как системы доставки антигенов является токсичность при внутривенном введении препарата, главной причиной которой является относительно высокая гемолитическая активность сапонинов Quil А. Внутримышечное введение указанных сапонинов и ИСКОМ связано с воспалительными и болевыми реакциями у людей. В настоящее время использование Quil А сапонинов в качестве неспецифического иммуностимулятора на человеке ограничивается пероральным введением. Предпринимаемые попытки выделения из Quil А фракции более очищенных сапонинов, характеризующихся низкими цитотоксическими свойствами, приводят к тому, что полученные сапонины или теряют способность образовывать искосомальные структуры, или не обладают иммуностимулирующей активностью.
Задачей заявляемого технического решения является способ получения носителя антигенов, обеспечивающего повышение безопасности (отсутствие токсичности, воспалительных и болевых реакций) и эффективности вакцин.
Поставленная задача решается способом получения носителя на основе липидов из морских гидробионтов, в котором структурообразующей основой липид-сапонинового носителя является нетоксичный комплекс из тритерпенового гликозида кукумарии Cucumaria japonica с холестерином и глицерогликолипидом из морских макрофитов.
Поставленная задача оптимальным образом решается способом получения носителя в виде липид-сапонинового комплекса, в котором в качестве тритерпенового гликозида используют кукумариозид А2-2 из кукумарии Cucumaria japonica (препарат КД), весовое соотношение которого к холестерину постоянно и равно 3:2, а в качестве глицерогликолипида из морских макрофитов используют моногалактозилдиацилглицерид (МГДГ) из морских макрофитов, содержание которого в комплексе может изменяться в интервале от 1 до 10 (в весовом соотношении). Способ включает смешение КД, холестерина и МГДГ, взятых в весовом соотношении 3:2:(1-10) в следующем порядке: смешивают растворы холестерина и МГДГ в хлороформе при весовом соотношении холестерина и МГДГ 2:(1-10), упаривают под вакуумом до удаления хлороформа и добавляют 3 весовые части 0,4-процентного водного раствора кукумариозида, смесь солюбилизируют, после чего доводят суммарную концентрацию липидов (холестерина и МГДГ) до 2 мг в 1 мл суспензии фосфатно-солевым буфером при рН 7,2. Полученную суспензию озвучивают ультразвуковым дезинтегратором в течение 5 минут при частоте 20 кГц.
Заявляемым способом впервые получен носитель антигенов, обладающий высокими иммунологическими характеристиками, который обеспечивает повышение безопасности вакцин и имеет структуру, отличную от структуры известных иммуностимулирующих комплексов. Полученные липид-сапониновые комплексы имеют ультрамикроскопическую тубулярную структуру при диаметре тубул около 40 нм, что подтверждается данными электронной микроскопии (фиг.2, снимки А, Б, В, Г и фиг.3, снимок А). На фиг.2 приведены электронные микрофотографии мицелл носителей антигенов, полученных при изменении количественного содержания МГДГ в системе КД:холестерин:МГДГ; А - (3:2:1); Б - (3:2:4); В - (3:2:6); Г - (3:2:10).
Обнаружено, что комплексы с такой структурой образуются только при использовании всех трех компонентов, принимающих участие в формировании носителя, полученного заявляемым способом, взятых при их оптимальном соотношении, а именно весовое содержание КД:холестерин:МГДГ равно 3:2:(1-10).
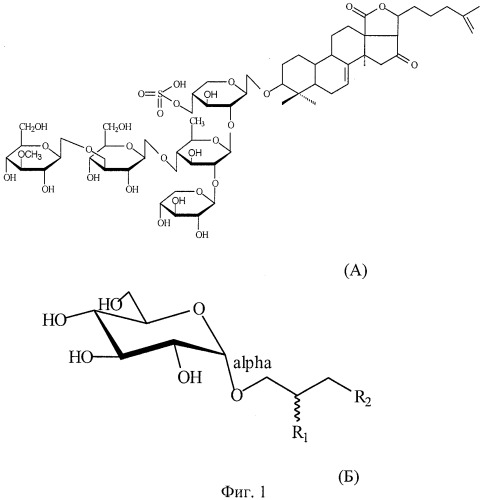
Препарат КД получают из доступного природного сырья, отвара голотурии Cucumaria japonica, который представляет собой сумму тритерпеновых гликозидов, основным компонентом которых является кукумариозид А2-2 (Авилов С.А., Тищенко Л.Я., Стоник В.А. Строение кукумариозида А2-2 - тритерпенового гликозида из голотурии Cucumaria japonica / Химия природ. соедин. 1984. №6. С.799-800). Его структурная формула приведена на фиг.1 (А).
Кукумариозид не проявляет эмбриотоксических и мутагенных свойств и повышает неспецифическую устойчивость к бактериальным и вирусным инфекциям в чрезвычайно низких нетоксичных для организма дозах. Наблюдаемый эффект кукумариозида связывают со стимуляцией фагоцитарной активностью тканевых макрофагов, обеспечивающих неспецифическую защиту организма и опосредующих распознавание антигена иммунной системой, влиянием на уровень пролиферативной активности стволовых клеток, усилением кооперативного взаимодействия иммунокомпетентных клеток (Т- и В-лимфоцитов) в процессе развития специфического иммунного ответа и, вероятно, прямым действием на стадии взаимодействия вирус-клетка.
Таким образом, наличие кукумариозида в составе получаемого заявляемым способом комплекса позволяет увеличить эффективность противовирусных вакцин - повысить их иммуностимулирующую активность в отношении ряда вирусов и исключить гемотоксичность.
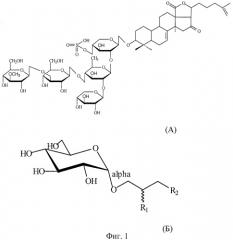
При создании носителей антигенов с целью усиления иммуногенности иммунокомпетентных клеток важен выбор липида. Биологическую активность морских глицерогликолипидов, выбранных для получения носителей антигенов заявляемым способом, обоснованно связывают как со структурой углеводной составляющей, так и с присутствием большого количества полиненасыщенных жирных кислот (ПНЖК). Известно, что гликоглицеролипиды из морских водорослей (макрофитов), относящихся к различным филогенетическим группам, значительно отличаются по жирнокислотному составу и степени ненасыщенности. Состав жирных кислот морских гликолипидов очень разнообразен и специфичен для каждого вида водоросли. Исходя из структурообразующих свойств глицерогликолипидов для формирования ИСКОМ был выбран МГДГ, структурная формула которого приведена на фиг.1 (Б). Используемый в качестве липидного компонента МГДГ из Ulva fenestrata (отдел зеленые водоросли - Chlorophyta), Ahnfeltia tobuchiensis (отдел красные водоросли - Rhodophyta), Laminaria japonica (отдел бурые водоросли - Phaeophyta), Zostera marina (зеленая морская трава - отдел Magnoliophyta) был выделен по методу Sanina N., Goncharova S., Kostetsky E. Fatty acid composition of individual polar lipid classes from marine macrophytes // Phytochemistry. 2004. V.65. №6. P.721-730. Этот липид является самым ненасыщенным гликоглицеролипидом и в зависимости от источника выделения обладает широким спектром жирнокислотного состава. Так, U.fenestrata и Z.marina содержат до 93%, a A.tobuchiensis и L.japonica содержат до 73% омега-3 ПНЖК. Согласно известным данным подобные жирные кислоты обладают иммуномодулирующим действием, оказывая влияние на активацию Т-хелперов 1 и 2 класса, стимуляцию Т-клеточной пролиферации и образование цитокинов, а также обладают избирательной цитотоксичностью в отношении опухолевых клеток, усиливая действие цитотоксических агентов. Из уровня техники известно влияние ненасыщенных жирных кислот, в частности линоленовой и арахидоновой, на состояние мембран клеток иммунной системы, в особенности макрофагов.
Постоянное весовое соотношение КД и холестерина при получении носителя антигенов заявляемым способом, равное 3:2, определяется, с одной стороны, известным из уровня техники фактом. При таком соотношении комплекс не обладает гемолитической активностью и не оказывает токсического действия при внутрибрюшном введении экспериментальным животным. С другой стороны, оптимальность такого весового соотношения КД и холестерина подтверждается экспериментальными данными (примеры 5, 6). На фиг.3 представлены электронные микрофотографии мицелл носителей антигенов, полученных при весовом соотношении КД:холестерин:МГДГ, равном: А - (4:2:3); Б - (4:1:6). Увеличение содержания КД в системе при получении носителя антигенов нерационально, т.к. это не приводит к изменению его тубулярной структуры (пример 5, фиг.3, снимок А). Данные, полученные в примере 6 (фиг.3, снимок Б), показывают, что уменьшение количества холестерина при осуществлении способа приводит к исчезновению тубулярных структур.
Обнаружено также, что количество МГДГ, выделенного из различных морских макрофитов, при получении носителя антигенов заявляемым способом не влияет на его иммунологические свойства и морфологические характеристики, если его весовое соотношение к КД и холестерину изменяется в интервале (1-10), т.е. оптимальным соотношением КД, холестерин и МГДГ является 3:2:(1-10). Примеры 1-4, 8-10 (фиг.2, снимки А-Г) подтверждают, что введение МГДГ в смесь КД и холестерина в указанных соотношениях способствует формированию липид-сапонинового комплекса, обладающего необходимыми адъювантными свойствами природного носителя и имеющего стандартную тубулярную структуру. Увеличение содержания МГДГ нерационально, т.к. при этом не происходит существенного улучшения иммунологических и морфологических характеристик получаемых носителей антигенов.
Уменьшение весового содержания МГДГ в исходной смеси до его полного отсутствия при получении носителя антигенов заявляемым способом приводит к исчезновению видимых под электронным микроскопом структур (пример 7).
Способ включает смешение КД, холестерина и МГДГ, взятых в весовом соотношении 3:2:(1-10) в следующем порядке: смешивают растворы холестерина и МГДГ в хлороформе при весовом соотношении холестерина и МГДГ 2:(1-10), упаривают под вакуумом до удаления хлороформа и добавляют в смесь 3 весовые части 0,4-процентного водного раствора кукумариозида, после чего доводят суммарную концентрацию липидов (холестерина и МГДГ) до 2 мг в 1 мл суспензии фосфатно-солевым буфером при рН 7,2. Указанная концентрация липидов является оптимальной для проведения иммунологических и электронно-микроскопических исследований. Полученную суспензию озвучивают ультразвуковым дезинтегратором SONOPULS Ultraschall-Homogenizatoren HD 2070 (Германия) при частоте 20 кГц, мощность 7 Вт в режиме 7 (0,7 сек работа, 0,3 сек перерыв) в течение 5 минут.
Свойства носителя антигенов, полученного заявляемым способом, не вытекают с очевидностью из уровня техники, что подтверждается известными из литературы данными и результатами экспериментов.
Полученные препараты представляют собой водную суспензию липид-сапониновых комплексов, имеющих ультромикроскопическую тубулярную структуру при диаметре тубул около 40 нм вне зависимости от источника выделения МГДГ из морских макрофитов (примеры 1-4, 8-10).
Подлинность препарата определяется качественным и количественным составом структурных компонентов (кукумариозида, холестерина и МГДГ), являющихся исходными при получении носителя антигенов; его структура подтверждается данными электронной микроскопии (фиг.2, 3). Препарат стабилен при температуре (-4°С) более трех месяцев.
Предлагаемый комплекс при подкожном и внутрибрюшинном введении мышам не вызывает токсических (пример 11), воспалительных, болевых (пример 12) и гемолитических (пример 13) эффектов.
Использование носителей антигенов, полученных заявляемым способом, позволяет:
- исключить воспалительные, болевые, токсические и гемолитические эффекты вакцин;
- повысить иммуногенную активность вакцин и их эффективность в отношении ряда вирусов;
- обеспечить стабильность вакцин при хранении.
Примеры конкретного осуществления изобретения
Исходные компоненты для синтеза липид-сапониновых комплексов заявляемым способом, а именно тритерпеновый гликозид кукумариозид А2-2 из Cucumaria japonica (КД), холестерин и гликоглицеролипид МГДГ из морских макрофитов, берутся в заданном оптимальном весовом соотношении. Растворы холестерина и МГДГ в хлороформе упаривают под вакуумом до удаления хлороформа, добавляют 0,4-процентный водный раствор кукумариозида, солюбилизируют и доводят суммарную концентрацию липидов (холестерин и МГДГ) до 2 мг в 1 мл суспензии фосфатно-солевым буфером при рН 7,2; полученную суспензию озвучивают ультразвуковым дезинтегратором в течение 5 минут при частоте 20 кГц. Полученные препараты носителей антигенов представляют собой водную суспензию, включающую частицы комплекса, имеющего ультрамикроскопическую тубулярную липидную структуру; диаметр тубул - около 40 нм.
Препараты липид-сапониновго комплекса в приведенных примерах 1-6 получали по описанной методике при использовании МГДГ, выделенного из U.fenestrata.
Пример 1. Приготовление препарата комплекса, состоящего из 3 весовых частей КД, двух весовых частей холестерина и одной весовой части МГДГ. 5 мг МГДГ растворяют в 1 мл хлороформа; 5 мг холестерина растворяют в 1 мл хлороформа, а 4 мг КД растворяют в 1 мл дистиллированной воды. Микродозатором отбирают 27 мкл раствора холестерина и 13 мкл раствора МГДГ, упаривают под вакуумом досуха и солюбилизируют остаток раствором КД, объем которого - 500 мкл. В смесь добавляют 500 мкл фосфатного буфера, рН 7,2. Конечная концентрация липидов составляет 2 мг в 1 мл. Суспензию озвучивают 5 минут ультразвуковым дезинтегратором при частоте 20 кГц. Полученный препарат представляет собой водную суспензию, включающую частицы комплекса, имеющего ультрамикроскопическую тубулярную липидную структуру диаметром около 40 нм. На фиг.2 (снимок А) приведена электронная микрофотография полученного липид-сапонинового комплекса (увеличение Х 50000).
Пример 2. Препарат липид-сапонинового комплекса получали по описанной методике при весовом соотношении исходных компонентов 3:2:4. На фиг.2 (снимок Б) приведена электронная микрофотография липид-сапонинового комплекса, полученного в условиях примера 2 (увеличение Х 50000).
Пример 3. Препарат липид-сапонинового комплекса получали по описанной методике при весовом соотношении исходных компонентов 3:2:6. На фиг.2 (снимок В) приведена электронная микрофотография липид-сапонинового комплекса, полученного в условиях примера 3 (увеличение Х 50000).
Пример 4. Препарат липид-сапонинового комплекса получали по описанной методике при весовом соотношении исходных компонентов 3:2:10. На фиг.2 (снимок Г) приведена электронная микрофотография липид-сапонинового комплекса, полученного в условиях примера 4 (увеличение Х 50000).
Пример 5. Препарат липид-сапонинового комплекса получали по описанной методике при весовом соотношении исходных компонентов 4:2:3. На фиг.3 (снимок А) приведена электронная микрофотография липид-сапонинового комплекса, полученного в условиях примера 5 (увеличение Х 50000).
Пример 6. Препарат липид-сапонинового комплекса получали по описанной методике при весовом соотношении исходных компонентов 4:1:6. По данным электронной микроскопии имеет место исчезновение тубулярных структур и появление нитчатых структур. На фиг.3 (снимок Б) приведена электронная микрофотография липид-сапонинового комплекса, полученного в условиях примера 6 (увеличение Х 50000).
Пример 7. Препарат липид-сапониновых комплексов получали по описанной методике на основе кукумариозида и холестерина при их оптимальном весовом соотношении 3:2 (в отсутствии МГДГ). По данным электронной микроскопии кукумариозид и холестерин в отсутствии МГДГ не формируют видимых структур.
Пример 8. Препараты липид-сапонинового комплекса получали по описанной методике при соотношении исходных компонентов, взятых в примере 1, при использовании МГДГ, выделенном из A.tobuchiensis.
Пример 9. Препараты липид-сапонинового комплекса получали по описанной методике при соотношении исходных компонентов, взятых в примере 2, при использовании МГДГ, выделенном из L.japonica.
Пример 10. Препараты липид-сапонинового комплекса получали по описанной методике при соотношении исходных компонентов, взятых в примере 3, при использовании МГДГ, выделенном из Z.marina.
Структура липид-сапониновых комплексов, полученных в примерах 8-10, не отличается от структуры комплексов, полученных в примерах 1-4.
Полученный заявляемым способом носитель антигенов был испытан на группе беспородных мышей (по 10 животных в контрольной и опытной группе) на его безопасность по появлению токсических, воспалительных и болевых реакций и гибели животных. Изучение гемолитического действия липид-сапониновых носителей проводили в условиях in vitro с использованием в качестве тест-системы эритроцитов беспородных мышей.
Пример 11. Однократное внутрибрюшинное введение белым беспородным мышам липид-сапониновых комплексов, приведенных в примерах 1-4, 8-10, из расчета 100 и 200 мкг КД на мышь не вызывают гибели животных и проявления токсических эффектов в течение трех дней наблюдения. Испытываемые дозы КД соответствуют 5 и 10 мг/кг веса. Оптимальная фармацевтическая доза кукумариозида составляет 0,004 - 40 мкг на 1 кг веса.
Пример 12. Однократное подкожное введение липид-сапониновых комплексов, приведенных в примерах 1-4, 8-10, из расчета 100 и 200 мкг КД на мышь не вызывают воспалительных и болевых эффектов у животных в течение трех дней наблюдения.
Пример 13. Липид-сапониновые комплексы, приведенные в примерах 1-4, 8-10, тестировали на гемолитическую активность in vitro. Гепаринизированную кровь, полученную путем декапитации мыши, промывали 2-кратным центрифугированием при 3000 об/мин в течение 15 мин при комнатной температуре в изотоническом растворе хлорида натрия. Из осадка эритроцитов получали 0,5% клеточную суспензию. Исследуемые препараты готовили в фосфатно-солевом буфере, рН 7,4, из расчета 60 мкг кукумариозида на 1 мл липидной суспензии, последовательно разносили по 10 мкл по лункам планшета методом двукратных серийных разведений и добавляли по 90 мкл суспензии эритроцитов. В контрольные лунки добавляли по 10 мкл фосфатно-солевого буфера. Инкубирование проводили в течение 1 и 2 часов в термостате при 37°С. Оценку гемолитической активности исследуемых препаратов производили при визуальном осмотре лунок. В результате опыта определяли минимальную эффективную дозу вещества, вызывающую 100% гемолиз (ЕД100), при котором наблюдается прозрачный раствор «лаковой» крови. Липид-сапониновые комплексы, приведенные в примерах 1-4, 8-10, в дозах до 60 мкг КД в препарате на 1 мл 0,5% клеточной суспензии не проявляли гемолитического эффекта по отношению к эритроцитам белой мыши в течение двух часов наблюдения.
1. Способ получения носителя антигенов в виде липид-сапониновых комплексов, состоящих из смеси тритерпенового гликозида, холестерина и глицерогликолипида, отличающийся тем, что предварительно смешивают растворы холестерина и глицерогликолипида в хлороформе, смесь упаривают досуха под вакуумом, добавляют 3 весовые части 0,4%-ного водного раствора кукумариозида, после чего смесь солюбилизируют и доводят суммарную концентрацию холестерина и глицерогликолипида до 2 мг в 1 мл суспензии фосфатно-солевым буфером при рН 7,2 и озвучивают полученную суспензию ультразвуковым дезинтегратором в течение 5 мин при частоте 20 кГц.
2. Способ по п.1, отличающийся тем, что в качестве глицерогликолипида используют моногалактозилдиацилглицерид (МГДГ) из морских макрофитов.
3. Способ по пп.1 и 2, отличающийся тем, что весовое соотношение холестерина и МГДГ составляет 2:(1-10).
4. Способ по п.1, отличающийся тем, что в качестве тритерпенового гликозида используют кукумариозид А2-2 (КД).
5. Способ по пп.1 и 4, отличающийся тем, что весовое соотношение КД к холестерину постоянно и равно 3:2.
6. Способ по пп.1-5, отличающийся тем, что полученные липид-сапониновые комплексы имеют ультрамикроскопическую тубулярную структуру при диаметре тубул около 40 нм.