Способ биотестирования воды, почвы, биологически активных веществ
Иллюстрации
Показать всеИзобретение относится к области использования микробиологических объектов для контроля загрязнения окружающей среды. Может найти применение в экологическом мониторинге и санитарно-токсикологическом контроле вод, почв, а также в фармакологии при оценке безопасности биологически активных веществ. Способ заключается в регистрации изменчивости характера колониеобразования двух штаммов дрожжей Saccharomyces cerevisae различной плоидности под влиянием среды. Используются гаплоидные и диплоидные штаммы. Фиксируют токсическое действие по летальному показателю, мутагенность по возрастанию количества мутантных форм колоний; определяют индукцию наследуемой клеточной летальности и прогнозируют отдаленную патологию по количеству морфозов и изменению размеров колоний. Способ повышает объективность токсикогенетической оценки за счет использования чувствительных гаплоидных штаммов, специфичных реакций гаплоидов и диплоидов при воздействии слабых доз мутагенов. 2 ил., 1 табл.
Реферат
Изобретение относится к области использования микробиологических объектов для контроля загрязнения окружающей среды. Может найти применение в экологическом мониторинге и санитарно-токсикологическом контроле вод и почв, а также в фармакологии при оценке безопасности биологически активных веществ.
Существует способ оценки общей токсичности воды, в котором проводится экспресс-оценка по регистрации изменения рН при помещении сухих дрожжей S. cerevisae в пробу воды [1]. При этом защелачивание пробы указывает на отсутствие токсикантов. Данный способ не дает гарантии универсальности реакций эукариотических организмов на изучаемую пробу, а также не выявляет наследственной изменчивости и отдаленных последствий воздействия вещества, может использоваться лишь как предварительная оценка токсичности воды.
Известен микробиологический метод для оценки токсичности промстоков по изменению нормы дыхания дрожжевых клеток [2]. Недостатком метода является то, что метод не позволяет оценивать генетические эффекты загрязнителей и отдаленные последствия на клеточное поколение.
Другой метод включает скрининг генетически активных веществ на диплоидных и тетраплоидных дрожжах S. cerevisae, контрастных по цвету [3]. Но данный метод не позволяет получить количественную характеристику мутагенной активности тестируемого вещества, не позволяет определить эффекты последействия на клеточное поколение.
Наиболее близким аналогом заявляемого способа является способ оценки токсичности сточных вод, согласно которому в качестве тест-объекта используют штамм S. cerevisae, фиксируют токсичное действие на него по цитостатическому и летальному показателю, а мутагенное действие - по увеличению количества мутантов [4] (прототип). Цитостатический эффект - задержка роста колоний, - основанный на снижении пролиферативной активности и гибели части клеток в потомстве, явление которое четко демонстрирует дозозависимую (стохастическую) токсичность раствора. Данным способом можно фиксировать мутагенную активность и токсичность, но нельзя определить предмутационные и предлетальные реакции организмов и основанные на этих реакциях отдаленные патологии, поэтому возможно ошибочное отклонение изучаемой пробы как потенциально опасной.
Изобретением решается задача повышения объективности токсикогенетической оценки на дрожжах S. cerevisae и использование в оценке явления нестохастической наследуемой клеточной летальности, которое универсально для всех эукариот и проявляется в широком диапозоне воздействий, начиная с малых концентраций биологически активных факторов среды.
Не существует экспресс-оценки на способность веществ вызывать отдаленную патологию у животных и человека. Обычно отдаленную патологию определяют с использованием лабораторных животных в экспериментах, охватывающих значительный промежуток времени (несколько месяцев). При необходимости проведения экспресс-оценки прогнозирование отдаленной патологии возможно по нестохастическим наследуемым клеточным деталям, наблюдаемым на гаплоидных и диплоидных штаммах дрожжей-сахаромицетов.
Предлагаемый способ включает использование любых коллекционных или интродуцированных из дикой популяции штаммов Saccharomyces cerevisae - гаплоидов и диплоидов, фиксируют токсичное действие по летальному показателю, мутагенность по возрастанию мутантных форм колоний, прогнозируют индукцию отдаленных эффектов вещества по проявлениям нестохастической наследуемой клеточной летальности.
Клетки культур, находящихся в конце логарифмической фазы роста, обрабатываются раствором исследуемого вещества 30-180 мин. Затем проводят посев на полную твердую среду и инкубируют при 30°С. Учет результатов на 4-5-е сутки.
Токсичность определяется в %, по количеству выросших колоний в опыте относительно контроля.
Учет мутаций и морфозов по видоизменению колоний (цвет, форма колоний) ведется на гаплоидном и диплоидном штаммах. Мутации отличают от морфозов по реакции на пассирование. Определяют частоту мутаций и морфозов определенного типа в % относительно всего числа полученных колоний.
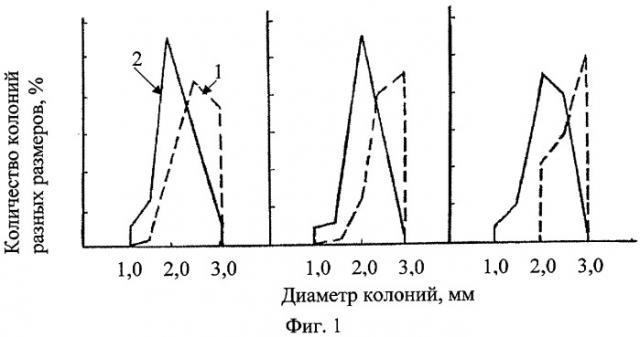
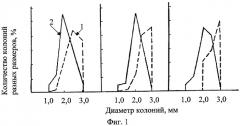
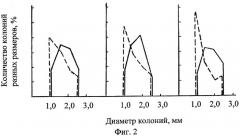
Учет индукции наследуемых клеточных леталей, эффекта стимуляции и ингибирования при колониеобразовании ведут по числу морфозов (бурых, бурых бородавчатых, бородавчатых колоний), и по диаметрам колоний на гаплоидном и диплоидном штаммах. Темноокрашенные колонии свидетельствуют о накоплении в клетках токсичных продуктов (например, фенолов) и летальности в потомстве дрожжевых клеток. Морфозы, как морфофизиологические аномалии колониеобразования, свидетельствуют о способности раствора влиять на генетически детерминированные процессы пространственной организации колоний. Последнее можно экраполировать на активность агента при формировании тканевых процессов у многоклеточных. Сокращение размеров колоний у гаплоидов и увеличение диаметров колоний диплоидов свидетельствует о том, что раствор биологически активен, влияет на интенсивность клеточных делений, хотя концентрация его не достаточна для индукции мутаций у диплоидов и цитостатического эффекта; индуцируется нестохастическая клеточная летальность у гаплоидов. Наследуемая клеточная летальность на диплоидах не фиксируется сокращением размеров колоний при стимулирующем воздействии мутагенного раствора благодаря процессам репопуляции и диплоидспецифичной репарации (т.е. в колониях одновременно происходит гибель клеточного потомства и обновление за счет быстороделящихся клеточных потомков, претерпевших меньшие повреждения). Сокращение размеров колоний диплоидов и абсолютная летальность гаплоидов свидетельствует об особой токсичности раствора как на непосредственно обработанные клетки, так и на клеточное потомство. Измеряют диаметры колоний размером более 1 мм, определяют среднее значение диаметров колоний в опыте и контроле, затем среднее значение диаметров колоний в % к контролю.
В таблице показаны оценочные критерии. На фиг.1, 2 - распределение макроколоний по размерам после обработки сточной водой Оренбургского ГПК - 1, в контроле - 2 у дрожжей-диплоидов (фиг.1) и дрожжей-гаплоидов (фиг.2) (реакция на микроэлементное загрязнение).
| Оценочные критерии | |||
| Токсичность | Мутагенность | Индукция наследуемой клеточной летальности | |
| Гаплоид | летальность относительно контроля, более 10% | мутации по цвету и форме колоний превосходят контроль в 2 раза | сокращение размеров колоний, морфозы, более 10% |
| Диплоид | летальность относительно контроля, более 10% | мутации по цвету и форме колоний в 2 раза | увеличение или сокращение размеров колоний, морфозы, более 10% |
Источники информации
1. Патент РФ №2170258, С1 С12Q 1/02.
2. Патент Великобритании №14267886, G01N 33/00.
3. Авторское свидетельство СССР №648607, С12N 15/00.
4. Авторское свидетельство СССР №1097947, G01N 33/18, G01N 33/00, С12Q 1/00 (прототип).
Способ биотестирования воды, почвы, биологически активных веществ, включающий использование дрожжей Saccharomyces cerevisae, отличающийся тем, что в качестве тест-объектов используют гаплоиды и диплоиды дрожжей, фиксируют токсичное действие по летальному показателю, мутагенность по возрастанию мутантных форм колоний, определяют индукцию наследуемой клеточной летальности и прогнозируют отдаленную патологию по количеству морфозов и изменению размеров колоний.