Способ индивидуального подбора иммунокоррегирующих препаратов у больных папилломатозом гортани
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к отоларингологии. Сущность способа заключается в том, что после проведенной операции по удалению папилломы гортани у больного производят забор периферической крови, получают лейкоцитарную суспензию, суспензию клеток инкубируют с иммунокоррегирующими препаратами в течение 60 мин при 37°С. Затем производят запись кривых люминолзависимой хемилюминесцентной реакции (ХЛ) и рассчитывают индекс стимуляции препарата (ИС). Препаратом выбора считают иммунокоррегирующий препарат, индекс стимуляции которого больше 1,1. Использование способа позволяет выбрать иммунокоррегирующий препарат с оптимальным влиянием на клетки иммунной системы и исключить применение препаратов, вызывающих индивидуальные реакции подавления функциональной активности нейтрофилов. 2 ил., 2 табл.
Реферат
Изобретение относится к медицине, а именно к отоларингологии, и предназначено для индивидуального подбора иммунокоррегирующих препаратов при проведении иммунокоррегирующей терапии у больных папилломатозом гортани.
В основе преодоления опухолевыми клетками иммунологического надзора лежат явления, связанные, с одной стороны, с нарушением в работе иммунной системы (врожденные и приобретенные иммунодефициты, возрастное снижение иммунной реактивности), а с другой - с наличием у злокачественно перерожденных клеток механизмов, блокирующих успешное проявление иммунной реактивности [4, 13].
Среди иммунологических факторов, принимающих участие в защите организма от неоплазм, доминирующая роль принадлежит клеточной форме защиты. Наиболее активными клетками в разрушении опухоли являются CD8 (Т-супрессоры) и CD4 (Т-хелперы) Т-клетки. Если CD8 Т-клетки выполняют прямую киллерную функцию, то CD4 Т-клетки способствуют ее успешной реализации. Помощь со стороны Т-хелперов осуществляется через секретируемые цитокины. Среди них наибольшую роль играет интерферон-γ, который стимулирует макрофаги и увеличивает активность НК клеток (естественных киллеров CD 16) [4, 7, 17].
Состояние иммунодепрессии хорошо известно при онкологических заболеваниях. С этим синдромом связывают механизм опухолевой прогрессии [1].
Однако иммунодепрессия выявляется не только при злокачественных опухолях, но и при доброкачественных - таких как папиллома. Многими исследователями при папилломатозе гортани (ПГ) выявлены нарушения в Т-звене иммунитета, изучены микробиологические и иммунологические аспекты системы антиинфекционной защиты [5, 8, 14].
При папилломатозе угнетение иммунитета обусловлено вирусной инвазией - вирус папилломы человека (ВПЧ) [2, 6, 16].
Нормализация иммунных показателей в этих случаях служит одним из важных факторов в профилактике рецидивов и лечении папиллом гортани.
Основой терапии при папилломатозе гортани остается хирургическое воздействие. С целью улучшения результатов хирургического лечения широкого применения получили иммунотропные препараты.
Однако сложность и множественность механизмов действия иммунокорректоров (ПК) до сих пор не позволяет достаточно глубоко и полно охарактеризовать их роль в развитии иммунных реакций и выработать достаточно обоснованные рекомендации их применения. В связи с этим большое значение приобретает применение индивидуального подхода при проведении иммуномодулирующей терапии. Так, в литературе имеются данные об индивидуальной чувствительности к тому или иному иммунологическому препарату, например, при лечении интерферонами эффективность препаратов в ряде случаев не превышает 50-60% [9, 12, 15]. Однако предложенные на сегодняшний день способы не позволяют объективизировать подбор иммунокорректирующих препаратов и, кроме того, осуществить индивидуальный подбор препарата.
Учитывая это, нами предложена простая и достаточно эффективная методика оценки эффекта лекарственных препаратов на иммунокомпетентные клетки больных папилломатозом гортани, основанная на оценке степени изменения реактивности нейтрофилов периферической крови больного в тесте на люминолзависимую хемилюминесценцию.
Способ осуществляется следующим образом. После проведенной операции по удалению папилломы гортани у больного производили забор периферической крови, затем получали лейкоцитарную суспензию. Для этого 2 мл гепаринизированной крови (25 ЕД/мл) смешивали с 1 мл подогретого до 37°С 3% раствора желатина и инкубировали в термостате при 37°С в течение 30 мин. После оседания эритроцитов слой плазмы, обогащенный лейкоцитами, отбирали в пластиковые пробирки и отмывали 10-кратным объемом фосфатно-солевого буфера (рН 7,4). Затем лейкоциты центрифугированием в течение 10 мин при 1000 об/мин ресуспендировали в растворе Хенкса. После подсчета числа лейкоцитов концентрацию клеток доводили до 106 л/мл. Суспензию клеток инкубировали с иммунокоррегирующими препаратами в течение 60 мин при 37°С. В контрольные кюветы вносили раствор Хэнкса. После инкубации производили запись кривых хемилюминесцентной реакции (ХЛ) с использованием хемилюминометра «Хелюм-111/01» (Россия) в комплексе с компьютером IBM-PC при температуре счетной камеры 37°С. В качестве усилителя свечения использовали люминол (5-амино-2,3-дигидро-1,4-фталазиндион, «Sigma») в концентрации 10-4 М, а в качестве активатора образования активных форм кислорода (АФК) РМА (форбол-12-миристат-13-ацетат, «Sigma») в концентрации 10-6 М [3].
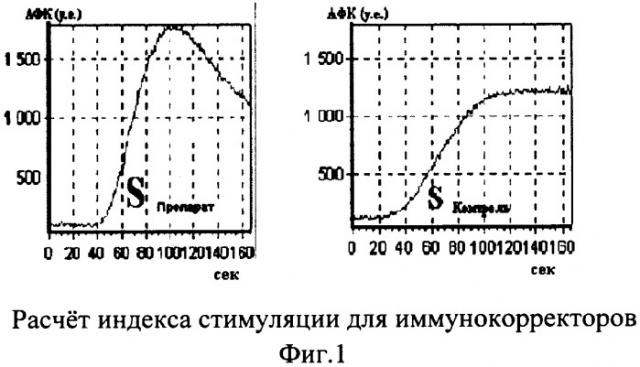
Затем вычисляли суммарную продукцию активных форм кислорода (АФК) как площадь под кривой ХЛ (фиг.1). Рассчитывали индекс стимуляции препарата (ИС) по формуле
ИСпрепарата=Sпрепарат/Sконтроль,
где Sпрепарат - интенсивность ХЛ нейтрофилов в пробе с препаратом,
Sконтроль - интенсивность ХЛ в контрольной пробе.
Препаратом выбора считали иммунокоррегирующий препарат, индекс стимуляции которого был больше 1,1.
Примеры реализации заявленного изобретения
В исследование включена группа, состоящая из 43 больных в возрасте от 18 до 52 лет, из них 34 лица мужского и 9 - женского пола, поступивших на плановое лечение по поводу рецидива папилломатоза гортани.
Всем больным произведено удаление папилломы гортани: у 31 при прямой микроларингоскопии под внутривенным наркозом с использованием инжекционной вентиляции легких, у 12 - при непрямой ларингоскопии под местной аппликационной анестезией 2% раствором дикаина.
Перед назначением терапии проводили анализ по оценке индивидуальной чувствительности к препаратам методом люминолзависимой хемолюминисценции.
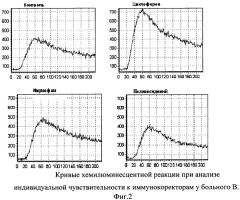
На фиг.2 представлены кривые хемилюминесцентной реакции при анализе индивидуальной чувствительности к иммунокоректорам у больного В.
Иммунологическое исследование крови проводили до и после иммунотерапии. Комплекс лабораторных тестов включал стандартные унифицированные параметры (число лейкоцитов, лейкоцитарная формула), количество Т- и В-лимфоцитов, содержание натуральных киллеров, фагоцитарную активность нейтрофилов. Функциональная активность клеточного звена иммунитета оценивалась по количеству Т-лимфоцитов, экспрессирующих на своей поверхности рецептор к интерлейкину-2 и антигены HLA-DR.
В работе использовали следующие препараты:
- Полиоксидоний (N-оксидированное производное полиэтиленпиперозина с высоким молекулярным весом).
- Имунофан (синтетический гексапептид, представляет собой 32-36 аминокислотные остатки тимопоэтина).
- Циклоферон (низкомолекулярный индуктор интерферона - N-метилглюкаминовая соль карбоксиметилакридона).
Результаты.
При анализе иммунного статуса пациентов папилломой гортани до операции были выявлены следующие закономерности (табл.1): - снижение уровня Т-лимфоцитов, преимущественно за счет Т-хелперов (CD4); - повышение функциональной активности Т-клеточного звена иммунной системы; - сдвиг формулы влево; - снижение фагоцитарной активности нейтрофилов.
Впоследствии все пациенты были разделены на две группы в зависимости от результатов индивидуального подбора ИК: 1-ая группа - пациенты, получавшие ИК, который не являлся препаратом выбора в тесте индивидуального подбора (n=24); 2-ая группа - пациенты, получавшие ИК, который в тесте был определен как препарат выбора (n=19).
Статистическую обработку данных проводили с помощью программы обработки данных "Statistica 6.0." (Statsoft, США, 2002). На первоначальном этапе статистической обработки, используя критерий Колмогорова-Смирнова, было доказано, что данные распределяются согласно закону нормального распределения. Это позволило применить t-критерий Стьюдента.
Был проведен анализ иммунологического статуса обеих групп, результаты которого представлены в таблице 2.
Как видно из представленных результатов, показатели в группе 1 и 2 достоверно не различались между собой до лечения. В течение 14 дней в группе 1 наблюдается повышение уровня Т-хелперов. Снизился уровень СД8- и СД20-лимфоцитов. За это же время в группе 2 отмечается достоверное увеличение уровня Т-лимфоцитов, преимущественно за счет Т-хелперов. Также отмечается достоверное повышение фагоцитарной активности нейтрофилов.
Таким образом исходя из поученных данных по сравнению с первой группой в группе 2 наблюдается достоверно более высокий уровень СД3, СД4 и СД8-лимфоцитов. Происходит нормализация фагоцитарной активности.
В литературе имеются данные, свидетельствующие о том, что функциональная активность нейтрофилов, выделяющих активную форму кислорода (АФК), напрямую зависит от количества СД4-лимфоцитов. Добавление anti-CD4-сыворотки в лейкоцитарную смесь приводит к резкому снижению уровня ХЛ (продукции АФК) нейтрофилами [10, 11]. По-видимому, этим можно объяснить, что ПК, подобранный методом ХЛ, оказывает максимальный стимулирующий эффект именно на субпопуляцию Т-хелперов (табл.2).
Таким образом, этот тест позволяет выбрать ИМ с оптимальным влиянием на клетки иммунной системы и исключить применение препаратов, вызывающих индивидуальные реакции подавления функциональной активности нейтрофилов.
Список литературы
1. Авдеев Г.И., Вядро М.М., Кадагидзе З.Г. Иммунотерапия опухолей. (Итоги науки и техники. Сер. Онкология. Т.14). - М., 1985.
2. Ашуров З.М., Савицкая К.И., Русанова Е.В., Шевцов В.В. и др. Показатели антиинфекционной резистентности у детей, больных респираторным папилломатозом. // Вестник оториноларингологии. 1996. - №4. - с.28-31.
3. Владимиров Ю.А., Шерстнев М.П. Хемилюминисценция клеток животных. // Итоги науки и техники: Биофизика, ВИНИТИ, 1989, Т.24, С.52-99.
4. Галактионов В.Г. Иммунология. Издательство Московского университета. 1998. - стр.350-353.
5. Гаращенко Т.И., Маркова Т.П., Ершов Ф.И., Ильенко Л.И., Современные достижения в лечении ювенильного папилломатоза гортани у детей. Новости оториноларингологии и логопедии. 1997. - №3. - с.62-63.
6. Герайн В., Черешкин Д.Г. Молекулярно-биологические аспекты юношеского респираторного папилломатоза и его комбинированное лечение. // Вести оторинолар. 1996. - №4. - стр.3-8.
7. Клиническая иммунология и аллергология. / Под ред. Л.Йегера. - М., 1986. - Т.2. - С.425-458.
8. Иванченко Г.Ф., Прозоровская К.Н., Григорян С.С., Тарасенкова Н.Н. Исследование интерферонового статуса и применение препаратов интерферона и его индукторов у больных папилломатозом гортани. Вопросы практической фониатрии: (Материалы междунар. симпоз., 27-29 мая 1997 г.). М. 1997. С.83-87.
9. Кольцов В.Д., Онуфриева Е.К., Нурмухаметов Р.Х., Малиновская В.В. и др. Влияние антител к α2- и γ-интерферонам на течение ювенильного респираторного папилломатоза у детей, получающих лечение препаратами α2-интерферона. // Вестник оториноларингологии. - 1997. - №4. - С.13-16.
10. Пухова Я.И., Пухова К.И. Исследование молекулярных механизмов кооперативных взаимодействий при хемилюминисценции иммунокомпетентных клеток в системе цельной крови. // Красноярск, 1993.
11. Пухова Я.И., Соловьева Л.А., Меньшикова Т.Н., Лобанова С.М. и др. Хемилюминисцентный анализ закономерности формирования механизмов иммунного статуса у детей при развитии патологического процесса: системные заболевания и постинфекционно-аллергические состояния. // Иммунология. - 1997. - №4. - С.49-52.
12. Романцев М.Г., Аспель Ю.В. Циклоферон таблетированная форма в клинической практике. // Санкт-Петербург, 2001, С.86-88.
13. Хаитов P.M., Пинегин Б.В. Современные иммуномодуляторы: основные принципы их применения. // Иммунология. 2000. - №5. - стр.4-7.
14. Цветков Э.А., Савенко И.В. Структура иммунологического дефекта при папилломатозе у детей. Вестник оториноларингологии. 1996. - №4. - с.9-11.
15. Чекалина Т.Л. Клинико-иммунологическая оценка эффективности применения Фитомакс-40 в комплексном лечении больных лейкоплакией. Автореф. на соиск... к.м.н. Москва. - 2001. 21 с.
16. В.Антонiв, Т.Антонiв. Папiлломатоз гортанi як облiгатний предрак (iмунологiчнi та вiрусологiчнi аспекти). // медичнi вicтi. VIII конгрес лiкарських товариств 16-20 серпня 2000 року, Львiв, с.100.
17. Caruso С., Modica M.A., Lio D., Cillari E. // Clin. Immunol. Immunopat. - 1987. - Vol.44, №1. - P.160-166.
| Таблица 1Динамика иммунологических показателей до лечения у больных папилломой гортани (n=43) | ||
| Иммунологические показатели | До лечения (М±m) | Здоровые доноры (М±m) |
| Т-лимфоциты (CD3, %) | 56,1±2,3 | 65,9±9,0 |
| Т-хелперы (CD4, %) | 32,7±1,6 | 45,0±9,0 |
| Т-супрессоры (CD8, %) | 20,1±1,3 | 23,0±4,0 |
| В-лимфоциты (CD20, %) | 7,8±0,7 | 10,0±2,0 |
| NK-клетки (CD16, %) | 15,2±1,5 | 13,0±6,0 |
| HLA-DR (%) | 16,9±1,7 | 10,0±5,0 |
| CD25 (%) | 3,8±0,7 | 4,0±2,0 |
| CD71 (%) | 5,7±1,1 | 2,0±2,0 |
| Лейкоциты (ед) | 6822,2±321,7 | 4000-9000 |
| Лимфоциты | 25,6±1,7 | 25-40 |
| Нейтрофилы (с/я) | 55,7±1,7 | 47-72 |
| Нейтрофилы (п/я) | 10,7±0,9 | 1-6 |
| Моноциты | 4,6±0,4 | 1-5 |
| Эозинофилы | 2,6±0,3 | 1-5 |
| Фагоцитарный индекс | 56,2±2,9 | 75,0±5,0 |
| Фагоцитарное число | 3,4±0,1 | 6,0±2,0 |
| Таблица 2Динамика иммунологических показателей в группе 1 и 2 при лечении ПК в течение 14 дней. | ||||
| Иммунологические показатели | Группа 1 до лечения (М±m) | Группа 2 до лечения (М±m) | Группа 1 после лечения (М±m) | Группа 2 после лечения (М±m) |
| Т-лимфоциты (CD3, %) | 61,9±3,0 | 57,8±3,3 | 65,0±2,3 | 68,9±2,5*+ |
| Т-хелперы (CD4, %) | 33,5±1,7 | 31,3±3,1 | 38,1±2,5* | 46,2±2,4*+ |
| Т-супрессоры(CD8, %) | 20,5±1,6 | 16,7±2,2 | 17,4±1,3* | 22,7±2,0*+ |
| В-лимфоциты (CD20, %) | 8,1±1,1 | 7,4±1,1 | 6,2±0,8* | 8,5±1,0 |
| NK-клетки (CD16, %) | 12,5±2,9 | 17,9±2,9 | 10,7±1,4 | 16,7±2,0 |
| HLA-DR (%) | 16,9±2,5 | 17,5±2,1 | 13,1±1,6 | 16,5±1,7 |
| CD25 (%) | 4,8±1,1 | 3,9±0,8 | 4,1±1,2 | 5,7±1,2 |
| CD71 (%) | 5,2±1,2 | 8,5±2,0 | 6,5±1,7 | 9,9±2,8 |
| Лейкоциты (ед) | 6633,3±334,2 | 7038,1±580,4 | 7728,7±626,2 | 7854,5±967,7 |
| Лимфоциты | 24,4±2,6 | 27,2±2,2 | 24,2±1,9 | 24,0±2,0 |
| Нейтрофилы (с/я) | 55,5±2,3 | 56,0±2,8 | 56,3±1,9 | 62,3±2,6 |
| Нейтрофилы (п/я) | 13,2±1,5 | 8,0±0,7 | 11,0±1,4 | 10,0±1,3 |
| Моноциты | 4,0±0,6 | 5,3±0,7 | 4,6±0,8 | 2,6±0,5 |
| Эозинофилы | 3,0±0,6 | 2,4±0,5 | 3,8±0,6 | 2,1±0,6 |
| Фагоцитарный индекс | 56,7±2,9 | 52,7±2,8 | 51,3±3,5 | 61,6±4,2*+ |
| Фагоцитарное число (ед) | 3,6±0,2 | 3,2±0,2 | 3,2±0,2 | 3,6±0,2 |
| * - Достоверное различие по сравнению с исходным уровнем (Р<0,05) | ||||
| + - Достоверное различие по сравнению с группой 1 (р<0,05) |
Способ индивидуального подбора иммунокоррегирующих препаратов при проведении иммунокоррегирующей терапии у больных папилломатозом гортани, отличающийся тем, что после проведенной операции по удалению папилломы гортани у больного производят забор периферической крови, получают лейкоцитарную суспензию, суспензию клеток инкубируют с иммунокоррегирующими препаратами в течение 60 мин при 37°С, затем производят запись кривых люминолзависимой хемилюминесцентной реакции (ХЛ) и рассчитывают индекс стимуляции препарата (ИС) по формуле
ИСпрепарата=Sпрепарат/Sконтроль,
где Sпрепарат - интенсивность ХЛ в пробе с препаратом,
Sконтроль - интенсивность ХЛ в контрольной пробе,
препаратом выбора считают иммунокоррегирующий препарат, индекс стимуляции которого больше 1,1.