Способы и лекарственные формы для контролируемой доставки палиперидона
Иллюстрации
Показать всеИзобретение относится к медицине. Описаны лекарственные формы и способы для обеспечения по существу возрастающей скорости высвобождения палиперидона. Лекарственные формы с замедленным высвобождением обеспечивают терапевтически эффективное среднее устойчивое состояние концентраций палиперидона в плазме при введении один раз в день. Этот режим дозирования один раз в день в результате приводит только к одному пику концентрации палиперидона в плазме, имеющему место в каждый 24-часовой период. Кроме того, пик концентрации палиперидона в плазме происходит в более позднее время после введения дозы и демонстрирует меньшую величину, чем пик концентрации палиперидона в плазме, который достигается после введения палиперидона в лекарственной форме с немедленным высвобождением. 2 н. и 18 з.п. ф-лы, 9 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к контролируемой доставке фармацевтических агентов и к способам, лекарственным формам и устройствам. В частности, данное изобретение направлено на способы, лекарственные формы и устройства для контролируемой доставки палиперидона с пониженным разрушением активного агента.
УРОВЕНЬ ТЕХНИКИ
Данная область насыщена описаниями пероральных лекарственных форм для контролируемого высвобождения фармацевтических агентов. В то время, как может быть известен целый ряд лекарственных форм пролонгированного действия для доставки некоторых лекарственных средств, имеющих короткий период полужизни, не каждое лекарственное средство может быть надлежащим образом доставлено из таких лекарственных форм вследствие растворимости, метаболических процессов, абсорбции и других физических, химических и физиологических параметров, которые могут быть индивидуальными для данного лекарственного средства и способа доставки. Примерами таких лекарственных средств, которые не являются подходящими кандидатами для лекарственных форм с контролируемым высвобождением, являются те лекарственные средства, которые имеют длинный период полужизни, как, например, палиперидон. Также было обнаружено, что палиперидон распадается на значительные количества примесей. Основные продукты деградации включают в себя C-9 кетон, N-оксиды и различные димеры его деструктов.
Палиперидон более полно описан в патенте США № 4804663. Соединение палиперидона отличается от рисперидона и соединений, относящихся к предшествующему уровню техники, описанных в патентах США №№ 4352811 и 4458076, замещением в 1 положении пиперидиновой части молекулы.
Палиперидон практически нерастворим в воде, свободно растворим в метиленхлориде и растворим в метаноле и 0,1н. соляной кислоте. Кроме того, поскольку палиперидон имеет большой период полужизни, около одного дня, он не является типичным кандидатом для продолжительной доставки. Однако побочные эффекты, такие как тревожность, сонливость, головокружение, запор, экстрапирамидные симптомы, могут быть связаны с высокими уровнями концентрации в плазме крови, ограничивая возможность применять однократную суточную дозу немедленного высвобождения.
Были изучены традиционные способы улучшения стабильности, в том числе применение антиоксидантов (сниженные уровни BHT) и включение хелатирующих агентов. Эти традиционные способы для снижения деградации признаны неэффективными.
Ожидается, что побочные эффекты вероятно являются результатом или скорости нарастания, и/или фактических концентраций лекарственного средства в плазме крови, превышающих порог предельно допустимой концентрации (MTC). Однако для получения терапевтического эффекта необходимо, чтобы концентрации поддерживались выше минимальной фармакодинамической концентрации (MPC).
Другой проблемой доставки палиперидона является то, что для введения может требоваться низкий уровень дозировки лекарственного средства в лекарственной форме. Может потребоваться, чтобы лекарственные формы содержали лекарственное средство в интервале от 5 до 20% от всей массы лекарственной формы. Требование низкой дозировки представляет проблемы составления композиций и изготовления лекарственных форм, подходящих для перорального приема, осуществляющих доставку с желаемой скоростью высвобождения в течение продолжительного периода времени.
Осмотические лекарственные формы предшествующего уровня техники упоминают доставку рисперидона из жидкой желатиновой капсулы без упоминания о доставке палиперидона или предпочтительной скорости доставки или определения лекарственной формы в виде твердой капсулы. Опубликованная патентная заявка ALZA Corporation, WO 00/35419.
Другие источники в уровне техники раскрывают доставку рисперидона трансдермальными способами с помощью пластырей без заявления какой-либо скорости высвобождения или желаемого профиля концентрации в плазме. Опубликована патентная заявка Janssen, WO 96/31201. Более того, данные источники не определяют доставку палиперидона, тем более доставку палиперидона посредством перорального контролируемого высвобождения.
Существует также способ, раскрывающий доставку рисперидона и/или палиперидона посредством инъецируемых имплантатов в течение длительного времени, многодневно. Эта область включает в себя опубликованную патентную заявку Alkermes WO 01/34120, и патенты США №№ 5654008; 5650173; 5770231; 6077843; 6368632; 6110923; 5965168; и 5692477, выданные Alkermes. Патенты США, в которых заявлены инъецируемые лекарственные формы для обеспечения почти нулевого порядка высвобождения, включают в себя патенты США №№ 5871778 и 5656299, выданные Yoishitomi Pharmaceutical Industries. Этот способ не раскрывает предпочтительные скорости высвобождения и не предоставляет сведений или мотиваций относительно возрастания скорости высвобождения, тем более такого высвобождения посредством пероральной системы доставки.
В предшествующем уровне техники, по отношению к пероральной доставке, не рассматривается длительное контролируемое высвобождение палиперидона.
Пероральные лекарственные формы с контролируемым высвобождением включают в себя патент США № 5536507, описывающий трехкомпонентный фармацевтический состав, который использует, среди прочего, полимер, чувствительный к рН, и, необязательно, осмотический агент, который будет разбухать в областях с более высоким рН нижней части тонкой кишки и в толстой кишке с высвобождением лекарственного средства в просвет кишечника. Дополнительные компоненты лекарственных форм включают в себя покрытие замедленного высвобождения и энтеросолюбильное покрытие для предоставления лекарственной формы, которая высвобождает незначительное количество, или совсем не высвобождает, лекарственного средства в желудок, сравнительно минимальное количество в тонкую кишку и, по имеющимся сведениям, около 85% или более в толстую кишку. Такая лекарственная форма предназначена для изменения в широких пределах времени высвобождения лекарственного средства после введения, которое может не начинаться в течение 1-3 часов до тех пор, пока лекарственная форма проходит желудок, и дополнительных 3 часов или более для прохождения лекарственной формы в толстую кишку.
Приведенные в качестве примера лекарственные формы палиперидона замедленного высвобождения, способы получения таких форм и способы применения таких лекарственных форм, описанные здесь, направлены на осмотические лекарственные формы для перорального введения.
В дополнение к осмотическим системам, описанным здесь, однако, существует много других известных в данной области подходов к достижению замедленного высвобождения лекарственных средств. Эти различные подходы включают в себя, например, диффузионные системы, такие как устройства с резервуарами и матричные устройства, системы для растворения, такие как инкапсулированные системы для растворения (в том числе, например, «мини пили») и матричные системы растворения, комбинация систем диффузия/растворение и системы ионообменной смолы, описанные в Remington's Pharmaceutical Sciences, 1990 ed., pp. 1682-1685. Лекарственные формы палиперидона, которые действуют в соответствии с приведенными другими подходами, охватываются объемом данного изложения до степени, в которой характеристики высвобождения лекарственного средства и/или характеристики концентрации палиперидона в плазме крови, изложенные здесь и в формуле изобретения, описывают эти лекарственные формы, либо буквально, либо эквивалентно.
Осмотические лекарственные формы в основном используют осмотическое давление для создания движущей силы для всасывания жидкости в образованном отсеке, по меньшей мере в часть, посредством полупроницаемой мембраны, которая допускает свободную диффузию жидкости, но не лекарственного средства или осмотрического агента (агентов), если присутствуют. Основным преимуществом по отношению к осмотическим системам является то, что процесс не зависит от рН и, следовательно, продолжается осмотически определенной скоростью на всем протяжении длительного периода времени прохождения лекарственной формы по желудочно-кишечному тракту и столкновения с различным микроокружением, имеющим существенно различающиеся значения рН. Обзор таких лекарственных форм можно найти у Santus и Baker, «Osmotic drug delivery: a review of the patent literature», Journal of Controlled Release 35 (1995) 1-21, включенный здесь в качестве ссылки в своем полном объеме. В частности, следующие патенты США, принадлежащие правопреемнику данной заявки, ALZA Corporation, направленные на осмотические лекарственные формы, все включены здесь в качестве ссылки в своем полном объеме: №№ 3845770; 3916899; 3995631; 4008719; 4111202; 4160020; 4327725; 4519801; 4578075; 4681583; 5019397 и 5156850.
Устройства, в которых лекарственная композиция доставляется в виде густой суспензии, суспензии или раствора из небольшого выходного отверстия под действием расширяющегося слоя, описаны в патентах США №№ 5633011; 5190765; 5252338; 5620705; 4931285; 5006346; 5024842 и 5160743, которые включены здесь в качестве ссылки. Типичные устройства включают в себя расширяющийся выталкивающий слой и лекарственный слой, окруженный полупроницаемой мембраной. В отдельных случаях лекарственный слой снабжен подслоем для задержки высвобождения лекарственной композиции в окружающую среду применения или для образования нормализованного покрытия в соединении с полупроницаемой мембраной.
Устройства, в которых лекарственная композиция доставляется в сухом виде из большого выходного отверстия под действием расширяющегося слоя, описаны в патентах США №№ 4892778, 4915949 и 4940465. Эти ссылки описывают распределитель для доставки лечебного агента в окружающую среду применения, который включает в себя полупроницаемую оболочку, содержащую слой расширяющегося материала, который выталкивает слой сухого лекарственного средства из отсека, образованного оболочкой. Выходное отверстие в устройстве по существу того же диаметра, что и внутренний диаметр отсека, образованного оболочкой.
Тогда как лекарственные формы, доставляющие лекарственную композицию в окружающую среду применения в сухом виде, могут обеспечивать подходящее высвобождение лекарственного средства с их различной нагруженностью лекарственным веществом на протяжении длительного периода времени, экспозиция лекарственного слоя в окружающую среду применения в результате может приводить к ажитационно-зависимому высвобождению лекарственного средства, что в некоторых обстоятельствах трудно контролировать. Соответственно, может быть полезно высвобождать лекарственное средство в виде густой суспензии или суспензии, которое может быть дозировано путем контроля степени расширения толкающего слоя и размера выходного отверстия в лекарственной форме в соответствии с данным изобретением.
Патент США 5169638 описывает фармацевтический состав в виде порошка с повышаемым контролируемым высвобождением для заполнения капсул, который использует рН-зависимый полимер, образованный из альгиновой кислоты и гидроксипропилметилцеллюлозы для высвобождения фармацевтических агентов с контролируемой скоростью. Кажется, что этот состав капсулы был предназначен для имитации свойств таблетированных составов.
Не представлено описания состава, обеспечивающего характеристики равномерного высвобождения лекарственных форм, содержащих палиперидон и родственные соединения настоящего изобретения.
Патенты США №№ 4892778 и 4940465 описывают распределитель для доставки лечебного агента в окружающую среду применения, которая включает в себя полупроницаемую оболочку, содержащую слой расширяющегося материала, который выталкивает лекарственный слой из отсека, образованного данной оболочкой. Выходное отверстие в устройстве по существу того же диаметра, что и внутренний диаметр отсека, образованного указанной оболочкой.
Патент США № 4915949 описывает распределитель для доставки лечебного агента в окружающую среду применения, который включает в себя полупроницаемую оболочку, содержащую слой расширяющегося материала, который выталкивает лекарственный слой из отсека, образованного указанной оболочкой. Лекарственный слой содержит дискретные мелкие пилюли, диспергированные в носителе. Выходное отверстие в данном устройстве того же диаметра, что и внутренний диаметр отсека, образованного указанной оболочкой.
Патент США № 5126142 описывает устройство для доставки ионофора крупному рогатому скоту, которое включает в себя полупроницаемый корпус, в котором расположены композиция, содержащая ионофор и носитель, и расширяющийся гидрофильный слой, наряду с дополнительным элементом, который придает устройству достаточную плотность для сохранения в рубец-ретикулярной сумке жвачного животного. Ионофор и носитель находятся в сухом виде во время хранения, и композиция изменяется и приобретает несущественное, жидкость-подобное состояние при контакте с жидкой окружающей средой применения. Описан ряд различных выходных структур, в том числе множество отверстий на конце устройства и один выход изменяющегося диаметра для контроля за количеством высвобождаемого лекарственного вещества за единицу времени вследствие диффузии и осмотической подачи.
До настоящего изобретения родственное палиперидону соединение, рисперидон, вводили в обычных формах, таких как таблетка с неконтролируемой доставкой дозы немедленного высвобождения или доставляющая дозу капсула и, обычно, с многочисленными повторяющимися интервалами дозирования на протяжении дня. Указанный продукт маркирован как Risperdal® Janssen Pharmaceutica Products, L.P. Physicians' Desk Reference, Thompson Healthcare, 56th Ed., pp. 1796-1800 (2002).
Способ лечения с помощью Risperdal®, однако, продолжает приводить к достижению начальной высокой дозы рисперидона в плазме крови после введения, с последующим снижением уровня рисперидона в плазме крови. Более того, эти пики максимума и минимума встречаются от двух до трех раз за 24-часовой период вследствие многократного режима дозирования. Временные различия в концентрациях, достигаемых при введении тех или иных доз, связаны с наличием и отсутствием введенного лекарственного средства, что является главным недостатком, связанным с этой ранее существующей лекарственной формой и способом введения.
Обычные лекарственные формы и способы их действия, в том числе точки максимума и минимума доз, обсуждались в Pharmaceutical Sciences, Remington, 18th Ed., pp. 1676-1686 (1990), Mack Publishing Co.; The Pharmaceutical and Clinical Pharmacokinetics, 3rd Ed., pp. 1-28 (1984), Lea и Febreger, Philadelphia; и в патентах США №№ 3598122 и 3598123, оба выданные Zaffaroni.
Лекарственной формой, проявляющей по существу возрастающий профиль скорости высвобождения, является Concerta®, продаваемая McNeil Consumer Healthcare и ALZA Pharmaceuticals. Physicians' Desk Reference, Thompson Healthcare, 56th Ed., pp. 1998-2001 (2002). Продукт Concerta®, предназначенный для введения один раз в день, обеспечивает только, по существу, возрастающую скорость высвобождения в течение примерно 8 часов.
Патентные заявки, относящиеся к Concerta®, включают в себя опубликованную патентную заявку РСТ № WO 99/62496A1. Эта патентная заявка раскрывает по существу возрастающий профиль скорости высвобождения в отношении Concerta® для доставки на протяжении примерно 8 часов для однократного введения в течение дня.
Родственные патентные заявки включают в себя опубликованную патентную заявку РСТ № WO 98/14168; WO 98/23263; WO 98/06380A2 и US 2001/0012847A1.
Другие заявки, относящиеся к обеспечению профиля доставки с повышенной скоростью высвобождения, включают в себя US 2002/0035357A1; WO 01/52819A1 и WO 01/37813A2 и A3.
Остается необходимость в эффективных способах дозирования, лекарственных формах и устройствах, которые дадут возможность обеспечить контролированное высвобождение палиперидона и родственных соединений на протяжении длительного периода времени по существу с повышенной скоростью высвобождения для снижения количества активного вещества, действующего на пациента, в любое конкретное время и увеличить время между дозированием, предпочтительно для получения режима дозирования один раз в день при снижении связанных с этим побочных эффектов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение предназначено для введения один раз в день пероральной лекарственной формы для доставки палиперидона в течение примерно более 22 часов, используя таблетку в форме капсулы. Это приблизительно 22-часовое высвобождение происходит по существу с повышенной скоростью высвобождения из ядра с 90% доставкой, происходящей примерно за 20 часов. Этот новый профиль обеспечивает терапевтическую доставку выше минимальной фармакодинамической концентрации (MPC) при сохранении плазменных уровней ниже MTC и достаточно низких, так что будут снижены побочные эффекты и увеличится толерантность. Такой профиль доставки обеспечивает 24-часовую эффективность без высоких уровней в плазме.
Настоящее изобретение обеспечивает достижение по существу возрастающей скорости высвобождения. Неожиданно было обнаружено, что настоящий профиль наилучшим образом обеспечивает эффективную терапию на протяжении 24 часов при потенциальном снижении отрицательных побочных эффектов, связанных с введением данного лекарственного средства.
Согласно настоящему изобретению достигается медленная, но по существу возрастающая скорость высвобождения, когда лекарственная форма вероятно находится в области ободочной кишки желудочно-кишечного тракта (ЖКТ). Данный профиль ранее не использовался для доставки какого-либо лекарственного средства и разработан для повышения терапевтического индекса палиперидона.
Неожиданно было обнаружено, что описанная возрастающая скорость высвобождения может предназначаться для существенного повышения концентрации лекарственного средства в плазме крови с пиком концентрации, имеющим место позже, чем, примерно, 16 часов после введения. Эта возрастающая концентрация в плазме крови снижает развитие эффекта суточной толерантности.
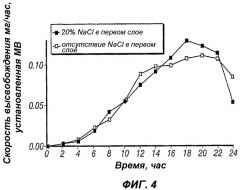
В дальнейшем было неожиданно обнаружено, что добавление осмотического агента, соли, в первый лекарственный слой, но не во второй лекарственный слой, влияет на профиль доставки таким образом, что в результате приводит к значительному повышению скорости высвобождения.
В дальнейшем было неожиданно обнаружено, что установление соотношения концентрации лекарственного средства в первом лекарственном слое и концентрации лекарственного средства во втором лекарственном слое влияет на профиль доставки таким образом, что в результате происходит желаемое значительное повышение скорости высвобождения.
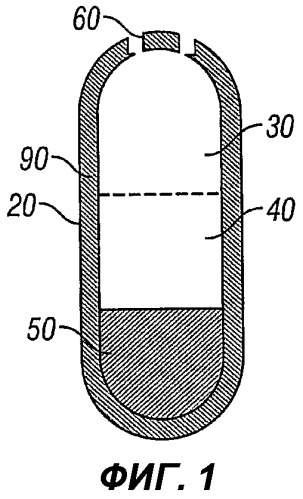
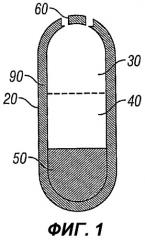
В данной лекарственной форме используют полупроницаемую мембрану, окружающую трехслойное ядро: первый слой называется первым лекарственным слоем и содержит низкое количество лекарственного средства и осмотический агент, такой как соль; средний слой, называемый вторым лекарственным слоем, содержит более высокие количества лекарственного средства, эксципиенты и не содержит соли; и третий слой, называемый выталкивающим слоем, содержит осмотические агенты и не содержит лекарственное средство. По меньшей мере, одно отверстие проделано сквозь мембрану на краю первого лекарственного слоя таблетки, имеющей форму капсулы.
В водном окружении ЖКТ вода поглощается через полупроницаемую мембрану с контролируемой скоростью, определяемой свойствами мембраны и осмоляльностью компонентов, составляющих ядро. Это вызывает разбухание выталкивающего слоя и гидрирование лекарственных слоев с образованием вязких, но деформируемых масс. Выталкивающий слой расширяется по отношению ко второму лекарственному слою, который в свою очередь оказывает давление на гидрированный первый лекарственный слой. Первый лекарственный слой, за которым следует второй лекарственный слой, выходит из системы через отверстие (отверстия) в мембране с той же скоростью, с какой вода впитывалась в ядро. Биологически инертные компоненты таблетки остаются интактными во время прохождения по ЖКТ и элиминируются как оболочка вместе с нерастворимыми компонентами ядра.
Лекарственная форма, включенная в настоящее изобретение, создана как лекарственная форма для введения один раз в день, которая является терапевтически эффективной, обеспечивая повышенную стабильность.
Еще в одном аспекте данное изобретение включает в себя лекарственную форму, содержащую мембрану, которая ограничивает отсек и окружает внутренний защитный подслой, по меньшей мере одно выходное отверстие, образованное в ней, или данная лекарственная форма выполнена с возможностью образования такого отверстия, и, по меньшей мере, часть мембраны является полупроницаемой; расширяющийся слой, расположенный в противоположной части отсека от выходного отверстия и выполненный в подвижной связи с полупроницаемой частью мембраны; первый лекарственный слой, примыкающий к выходному отверстию; и второй лекарственный слой, расположенный в пределах отсека между первым лекарственным слоем и расширяющимся слоем, при этом лекарственные слои содержат соединение, представляющее собой палиперидон или его фармацевтически приемлемую кислотно-аддитивную соль.
Поскольку данное лекарственное средство является относительно нерастворимым, первый лекарственный слой не имеет тенденции смешиваться со вторым лекарственным слоем. В зависимости от относительной вязкости первого лекарственного слоя и второго лекарственного слоя получают различные профили высвобождения. Это является крайне важным для установления оптимальной вязкости для каждого слоя. В настоящем изобретении вязкость модулируют путем добавления соли, хлорида натрия.
Профиль доставки из ядра зависит от массы, состава и толщины каждого из лекарственных слоев.
Соотношение диаметра ядра к длине ядра также является важным фактором. Форма данной системы в виде таблетки в форме капсулы является важным признаком, который вносит вклад в по существу возрастающий профиль высвобождения из ядра.
Данная система доставки предназначена для достижения максимальных концентраций в плазме крови между 14 и 22 часами и, предпочтительно, между 18 и 21 часами после дозирования. Пик концентраций наиболее предпочтительно имеет место приблизительно между 18 и 20 часами.
Настоящее изобретение создано как лекарственная форма для введения один раз в день, которая является терапевтически эффективной, давая меньше побочных эффектов, чем лекарственная форма с немедленным высвобождением, вводимая многократно в течение дня. Настоящее изобретение представляет два ключевых признака: по существу возрастающую доставку, которая оказывает влияние на фармакодинамику и развитие толерантности, и по существу возрастающая доставка обеспечивает концентрацию в плазме, достаточную для фармакологического эффекта. Развитие толерантности связано с седативными эффектами (используя репрезентативное измерение, такое как цифровое наблюдение - digit vigilance).
В одном аспекте данное изобретение включает в себя лекарственную форму с замедленным высвобождением, адаптированную для высвобождения на протяжении длительного периода времени с по существу возрастающей скоростью высвобождения соединения палиперидона.
В другом аспекте данное изобретение включает в себя способ лечения состояния у субъекта, чувствительного к введению палиперидона или его фармацевтически приемлемой кислотно-аддитивной соли, который включает пероральное введение субъекту лекарственной формы, адаптированной к высвобождению данного соединения с по существу возрастающей скоростью высвобождения на протяжении длительного периода времени. Наиболее предпочтительно данную лекарственную форму вводить перорально один раз в день.
Еще в одном аспекте данное изобретение включает в себя лекарственную форму, содержащую мембрану, ограничивающую отсек, которая имеет, по меньшей мере, одно выходное отверстие, образованное в ней, или выполнена с возможность образования данного отверстия, и, по меньшей мере, часть данной мембраны является полупроницаемой; расширяющийся слой, расположенный в противоположной части отсека от выходного отверстия и выполненный в подвижной связи с полупроницаемой частью мембраны; первый лекарственный слой, примыкающий к выходному отверстию; и второй лекарственный слой, расположенный в пределах отсека между первым лекарственным слоем и расширяющимся слоем, при этом лекарственные слои содержат соединение, представляющее собой палиперидон или его фармацевтически приемлемые кислотно-аддитивные соли.
Еще в одном аспекте данное изобретение включает в себя лекарственную форму, содержащую мембрану, ограничивающую отсек, которая имеет, по меньшей мере, одно выходное отверстие, образованное в ней, или выполнена с возможностью образования данного отверстия, и, по меньшей мере, часть мембраны является полупроницаемой; расширяющийся слой, расположенный в противоположной части отсека от выходного отверстия и выполненный в подвижной связи с полупроницаемой частью мембраны; первый лекарственный слой, примыкающий к выходному отверстию; и второй лекарственный слой, расположенный в пределах отсека между первым лекарственным слоем и расширяющимся слоем, при этом лекарственные слои содержат соединение, представляющее собой палиперидон или его фармацевтически приемлемую кислотно-аддитивную соль, и первый лекарственный слой содержит соль, а второй лекарственный слой не содержит соли.
Еще в одном аспекте данное изобретение включает в себя лекарственную форму, содержащую мембрану, ограничивающую отсек, которая имеет, по меньшей мере, одно выходное отверстие, образованное в ней, или выполнена с возможностью образования данного отверстия, и, по меньшей мере, часть мембраны является полупроницаемой; расширяющийся слой, расположенный в противоположной части отсека от выходного отверстия и выполненный в подвижной связи с полупроницаемой частью мембраны; первый лекарственный слой, примыкающий к выходному отверстию; и второй лекарственный слой, расположенный в пределах отсека между первым лекарственным слоем и расширяющимся слоем, при этом лекарственные слои содержат соединение, представляющее собой палиперидон или фармацевтически приемлемую кислотно-аддитивную соль во втором лекарственном слое.
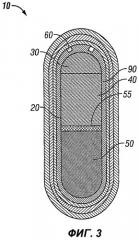
Лекарственная форма может необязательно содержать слой, облегчающий выход ее содержимого, который расположен между мембраной и лекарственными слоями.
В другом аспекте данное изобретение включает в себя способ лечения состояния, чувствительного к введению палиперидона или его фармацевтически приемлемой кислотно-аддитивной соли, который включает введение указанного соединения с обеспечением по существу возрастающей концентрации указанного соединения в плазме. Cmax достигается примерно более чем за 16 часов и, предпочтительно, примерно за 20 часов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 иллюстрирует вариант осуществления настоящего изобретения с двумя отверстиями, до введения субъекту;
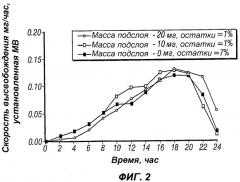
Фиг.2 иллюстрирует модель профиля доставки, обеспечивающего по существу возрастающую скорость высвобождения палиперидона, демонстрируя действие различных типов смазывающих подслоев;
Фиг.3 иллюстрирует вариант осуществления настоящего изобретения до введения субъекту, с необязательным смазывающим подслоем и барьерным слоем;
Фиг.4 иллюстрирует модель профиля доставки, обеспечивающего по существу возрастающую скорость высвобождения палиперидона, демонстрируя действие различных количеств хлорида натрия, содержащихся в первом лекарственном слое;
Фиг.5 иллюстрирует действие соотношения концентраций лекарственных средств между первым лекарственным слоем и вторым лекарственным слоем на скорость высвобождения палиперидона;
Фиг. 6A, 6B, 6C и 6D иллюстрируют влияние массы мембраны на скорость высвобождения палиперидона;
Фиг.7 иллюстрирует возможные пути разрушения палиперидона в стрессовых условиях;
Фиг.8 иллюстрирует сравнение стабильности лекарственной формы с использованием защитного подслоя настоящего изобретения и без него, представленное в виде таблицы;
Фиг. 9A и 9B иллюстрируют графическое сравнение стабильности лекарственной формы с использованием защитного подслоя настоящего изобретения и без него.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение лучше всего понятно со ссылкой на следующие определения, чертежи и описание, представленное здесь в качестве примера.
Определения
Под «лекарственной формой» подразумевают фармацевтическую композицию или устройство, содержащее фармацевтически активный агент, такой как палиперидон или его фармацевтически приемлемую кислотно-аддитивную соль, при этом данная композиция или устройство необязательно содержат неактивные ингредиенты, т.е. фармацевтически приемлемые эксципиенты, такие как суспендирующие агенты, поверхностно-активные вещества, дезинтегранты, связующие вещества, разбавители, смазывающие вещества, стабилизаторы, антиоксиданты, осмотические агенты, красители, пластификаторы, оболочки и подобное, что используют для производства и доставки фармацевтических агентов.
Под «активным агентом», «лекарственным средством» или «соединением» подразумевают агент, лекарственное средство или соединение с характеристиками палиперидона или рисперидона или их фармацевтически приемлемой кислотно-аддитивной соли.
Под «фармацевтически приемлемой кислотно-аддитивной солью» или «фармацевтически приемлемой солью», которые используются здесь взаимозаменяемо, подразумевают соли, в которые анион не вносит существенного вклада в токсичность или в фармацевтическую активность данной соли, и по существу они являются фармакологическими эквивалентами оснований соединения палиперидона. Примеры фармацевтически приемлемых кислот, которые пригодны для образования солей, включают в себя, но не только, соляную, бромисто-водородную, йодисто-водородную, лимонную, уксусную, бензойную, миндальную, фосфорную, азотную, слизевую, изэтионовую, пальмитиновую и другие.
Выражения «выход», «выходное отверстие», «доставляющее отверстие» или «отверстие для доставки лекарственного средства» и другие похожие выражения, которые могут быть здесь использованы, включают в себя элемент конструкции, выбранный из группы, состоящей из проходного отверстия; щели; отверстия и канала. Данное выражение также включает в себя отверстие, образованное или формируемое из вещества или полимера, которое разрушается, растворяется или выщелачивается из наружной оболочки, тем самым образуя выходное отверстие. Данное выражение включает в себя одно или многочисленные проходные отверстия, щели, отверстия, каналы или поры.
«Скорость высвобождения» лекарственного средства относится к количеству лекарственного вещества, высвобождаемого из лекарственной формы за единицу времени, например миллиграмм лекарственного средства, высвобождаемого за час (мг/час). Скорости высвобождения лекарственного средства для лекарственных форм обычно измеряют как in vitro скорость растворения, т.е. количество лекарственного средства, высвобождаемого из лекарственной формы за единицу времени, измеренное в соответствующих условиях и подходящей жидкой среде. Описанные здесь исследования растворения проводили в отношении лекарственных форм, помещенных в металлический змеевик держателей для образцов, присоединенных к прибору USP VII Типа, для определения индекса электролита в водяной бане при постоянной температуре 37°C. Аликвоты растворов с указанной скоростью высвобождения вводили в хроматографическую систему для определения количеств высвобожденного лекарственного средства за время исследуемых интервалов.
Под «исследованием скорости высвобождения» подразумевают стандартизированное исследование для определения скорости высвобождения соединения из лекарственной формы, тестируемой с использованием аппарата USP VII Типа, определяющего прерывистое высвобождение. Понятно, что реактивы эквивалентной степени чистоты могут быть заменены в данном исследовании в соответствии с общепринятыми методиками.
Здесь для ясности и удобства используют условное обозначение для времени введения как ноль часов (t=0 часов) и время после введения в соответствующих единицах времени, например t=30 минут или t=2 часа и т.д.
Как используется здесь, если не оговорено особо, скорость высвобождения лекарственного средства, полученная в определенное время «после введения», относится к in vitro скорости высвобождения лекарственного средства после выполнения соответствующего исследования растворения. Время, в которое высвободился определенный процент лекарственного средства в лекарственной форме, может быть названо значением «Tx», где «x» представляет собой процент высвободившегося лекарственного средства. Например, обычно используемое контрольное измерение для оценки высвобождения лекарственного средства из лекарственной формы представляет собой время, за которое высвобождается 70% или 90% лекарственного средства в пределах лекарственной формы. Такое измерение называют «T70» или «T90» для лекарственной формы.
Под «лекарственной формой немедленного высвобождения» подразумевают лекарственную форму, высвобождающую лекарственное средство по существу полностью за короткий период времени после введения, т.е. главным образом на протяжении от нескольких минут примерно до 1 часа.
Под «лекарственной формой пролонгированного действия» или «лекарственной формой с контролируемым высвобождением» подразумевают лекарственную форму, которая высвобождает лекарственное средство с по существу постоянной предопределенной скоростью в течение многих часов. Лекарственные формы с контролируемым высвобождением в соответствии с настоящим изобретением проявляют значения Т90 по меньшей мере около 18 часов или более и, предпочтительно, около 20 часов или более. Указанные лекарственные формы высвобождают лекарственное средство в течение периодов времени, по меньшей мере, 16 часов, предпочтительно 18 часов или более, более предпочтительно 20 часов или более.
Под «лекарственной формой с замедленным высвобождением» подразумевают лекарственную форму, которая высвобождает лекарственное средство по существу непрерывно в течение многих часов. Лекарственные формы замедленного высвобождения настоящего изобретения высвобождают лекарственное средство на протяжении периодов времени, по меньшей мере, около 16 часов, предпочтительно около 20 часов или более и более предпочтительно около 20 часов или более.
Лекарственные формы в соответствии с настоящим изобретением демонстрируют контролируемые скорости высвобождения палиперидона в течение длительного периода времени.
Под «замедленным высвобождением» подразумевают предопределенное непрерывное высвобождение активного агента в окружающую среду на протяжении длительного периода времени.
Под «постоянной скоростью высвобождения» подразумевают среднечасовую скорость высвобождения из ядра, которая изменяется положительно или отрицательно, но не более чем примерно на 30% и, предпочтительно, не более чем примерно на 25%, наиболее предпочтительно, не более чем примерно на 10%, либо от предыдущей, либо последующей среднечасовой скоростью высвобождения, определенной в аппарате USP VII Типа прерывистого высвобождения, где кумулятивное высвобождение составляет от 25 до 75%.
Под «длительным периодом времени» подразумевают непрерывный период времени, по меньшей мере, примерно 8 часов, предпочтительно 10-14 часов или более и более предпочтительно 16 часов или более. Например, осмотические лекарственные формы, описываемые здесь в качестве примера, главным образом начинают высвобождение палиперидона примерно за один час после введения и постоянной скоростью высвобождения, определенной выше, продолжается в течение длительного периода времени, примерно от 25% по меньшей мере, примерно до 75% и, предпочтительно, по меньшей мере, примерно 85% лекарственного средства высвобождается из лекарственной формы. Высвобождение палиперидона продолжается после этого в течение еще нескольких часов, хотя скорость высвобождения в основном отчасти замедлена по сравнению с постоянной скоростью высво